甲基强的松龙对大鼠急性脊髓损伤后c-fos基因表达的影响
作者:赵忠球 王秋桂 胡松林
单位:(咸宁医学院神经组化研究室,咸宁 437100)
关键词:脊髓损伤;甲基强的松龙;c-fos基因
咸宁医学院学报000103 摘 要 目的:探讨甲基强的松龙对脊髓损伤后c-fos基因表达的影响。方法:采用Allens法制成大鼠脊髓损伤模型,动物随机分三组:假手术组、手术组、术后给药组(术后5min腹腔注射甲基强的松龙30mg/kg,假手术组和手术组给等量生理盐水以对照)。分3个时间点(术后1小时、2小时、4小时)进行c-fos免疫细胞化学法染色。结果:损伤后FOS样免疫反应神经元主要分布在后角Ⅰ、Ⅱ层,手术组FOS样神经元与假手术组比较明显增多,而用药组较之手术组明显减少(P<0.001)。结论:脊髓损伤后脊髓c-fos基因表达显著增多,甲基强的松龙能抑制损伤后c-fos基因表达。
, 百拇医药 中图分类号 R651.2 Q786 文献标识码 A
文章编号 1008-0635(2000)01-0007-04
Effect of Methylprednisolone on c-fos Expression after Acute Spinal Cord Injury in Rats
ZHAO Zhongqiu,WAN Qiugui,HU Songlin
(Neural histochemistry study room,Xianning Medical College.Xian ning 437100)
ABSTRACT Objective To explore the effect of methylpredniosolone (MP) on c-fos expression after acute spinal cord injury (ASCI) in rats.Methods The ASCI-model of rats was established with Allen′s way.Rats were randomly divided into three groups:sham-operated group,operated group and drug-treated group.The animals of treated group were given a single dose of MP (30mg/kg) 5 minutes after injury,while other two groups were given isometric saline as control. At three different times (1h,2h and 4h later) c-fos immunocyto-chemistry was done.Results Following ASCI,most of FOS-like immunoreactive (FOS-LI) neurons were observed in lamina Ⅰ and Ⅱ.The FOS-LI neurons in operated group were significantly increased as compared with sham-operated group,while the FOS-LI neurons in drug-treated group were markedly lower than those in operated group.Conclusion C-fos gene expression in rat spinal cord can be markedly enhanced by injury,and MP may play a role in inhibition of c-fos gene expression during injury.
, 百拇医药
KEY WORDS Methyprednisolone;Spinal cord injury;c-fos gene
脊髓损伤(spinal cord injury,SCI) 是临床常见病且致残率高,已经认识到,SCI很少为横断,而是在原发损伤后一系列进行性改变导致了不可逆的结构改变[1]。90年代以来,美国两次大规模多中心临床研究结果证实,早期(伤后8小时内)大剂量甲基强的松龙(methylprednisolone,MP) 可使SCI患者达到更好的恢复,美国国立急性脊髓损伤研究分(NASCIS) 已将MP列为其它药物研究中必须予以比较的药物[2]。c-fos 与神经元发育、分化、再生修复等密切相关,病理情况下基因表达与调控可能与疾病发生发展有关,尽管其表达的生理学、行为学意义仍存在很大争议,但IEG特别是c-fos 作为神经元活动的标志已被广泛地接受[3,4]。脊髓损伤后c-fos 的表达以及用药后的变化国内外少有报道。急性SCI后使用MP已成为临床常规,MP治疗急性SCI后早期c-fos表达的变化是如何的呢?本文试图观察这些方面的变化,为脊髓损伤与修复研究提供形态学依据。
, http://www.100md.com
1 材料与方法
1.1材料
成年健康Wistar大鼠72只,雌雄不拘,重量200~300g,尽量一致。咸宁医学院动物室提供。
1.2 方法
1.2.1 动物模型
参照Allens重量垂直打击法建立SCI模型[5]:3%戊巴比妥钠30mg/kg 腹腔注射麻醉后,取后背正中切口,将T13~L1椎板小心轻柔切除,不留骨突以免打击时触抵重物,保留硬脊膜,用重2.5g自制砝码在玻璃细导管引导下从20cm高处自由落体运动打击脊髓造成SCI模型。致伤能量2.5×20g.cm。
1.2.2 动物分组
, http://www.100md.com
动物均在安静、无强光刺激、室温下饲养24小时以上。随机分为三组,每组24只,即①假手术组,②手术组,③治疗组。方法为:①组动物只暴露不给予打击,③组动物打击后5分钟MPSS 30mg/kg腹腔注射,①②组则相应给予生理盐水以对照。
1.2.3 实验步骤
各组均在三个时间点(术后1h、2h、4h),3%戊巴比妥钠60mg/kg腹腔注射深麻醉后,经升主动脉快速灌注生理盐水(37℃,100ml/只),继之灌注4%多聚甲醛(4℃,400~600ml/只),先快后慢1~2小时,注毕取T13~L1节段脊髓标本,在4%多聚甲醛中后固定2~4小时,转入30%蔗糖4℃过夜至下沉,恒冷箱连续切片,片厚16μm,每5片取一片。
1.3 c-fos免疫细胞化学方法及图像分析
①切片入0.01M PBS (PH 7.4) 漂洗,5分钟×2。②切片入甲醇-3%H2O2(4:1)液,37℃,45分钟,0.01M PBS漂洗,2分钟×3。③ 0.25% TritonX-100处理切片,37℃,30分钟,0.01M PBS 漂洗,5分钟×2。④ 3%血清白蛋白处理切片,37℃,30分钟,0.01M PBS漂洗,5分钟×2。⑤ 正常羊血清封闭液,37℃,20分钟,甩去多余血清。⑥滴加I抗(鼠抗IgG,1:100)4℃过夜(8~12小时),0.01M PBS漂洗,2分钟×3。⑦滴加生物素化山羊抗鼠IgG,37℃,1小时,0.01M PBS漂洗,2分钟×3。⑧滴加试剂SABC,37℃,1小时,0.01M PBS漂洗,5分钟×4。⑨DAB显色:使用DAB显色试剂盒,室温下显色,镜下控制时间(2分钟~7分钟),蒸馏水洗涤。⑩脱水、透明、封片,观察,照像。B11对照实验:用PBS或正常羊血清代替Ⅰ抗进行阴性对照或替代对照。B12FOS 阳性细胞密度和强度分析:细胞密度以0.01mm2内标记细胞数表示(10×10方格测试系统,显微镜下计数),标记强度以光密度值(optical density,OD值)表示。用图像分析仪测得各视野FOS阳性细胞OD值,同时测定同一张切片上前角视野内OD值作为背景(因为该区域内无阳性细胞)。FOS阳性细胞OD值减去背景OD值得到校正OD值(COD值)。每张切片测灰质10个视野范围(10×10倍),每个动物测4~5张切片,取平均值。
, http://www.100md.com
1.3 统计学处理
计量资料用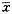 ±s表示,各时间点间比较用配对t检验,两组间比较用非配对t检验,多组间比较采用方差分析和Neuman-Keuls 检验,P<0.05为显著性标准。
±s表示,各时间点间比较用配对t检验,两组间比较用非配对t检验,多组间比较采用方差分析和Neuman-Keuls 检验,P<0.05为显著性标准。
2 结 果
FOS免疫反应(FOS—IR) 阳性神经元的胞核染成棕褐色,大小不等,多为圆形或椭圆形,较大的细胞可见核仁透亮区。FOS—IR细胞多见于后角Ⅰ、Ⅱ,尤其是内侧部,部分FOS—IR细胞分布于后角深层及中央管周围。见图1、2。
假手术组未见或偶见少量阳性细胞,SCI后阳性细胞数目大量增加,且以2小时最高,用药后阳性细胞数目仍较假手术组高,且2小时最高,但其与手术组相比,各时间点阳性数目均减少。见图3、4。
, 百拇医药
图1 手术组术后2小时c-fos表达×400
图2 手术组术后2小时c-fos表达(后角深层)×400
各组FOS标记细胞的计量比较。标记细胞密度(no/0.01mm2)和标记强度(COD值)手术组高于假手术组,治疗组低于手术组,差异有显著性(P<0.001);各组FOS标记细胞密度和标记强度1小时、4小时均低于2小时(除手术组2小时和4小时FOS标记细胞光密度值无显著差异P>0.05),差异有显著性(P<0.001)。见表1、2。
图3 治疗组术后2小时c-fos表达×100
, 百拇医药
图4 治疗组术后2小时c-fos表达×100
表1 SCI后大鼠脊髓内FOS标记细胞密度(no/0.01mm2)的比较(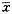 ±s,n=24)
±s,n=24)
1h
2h
4h
假手术组
2.01±0.95*
6.49±2.01
5.43±0.32*
, http://www.100md.com
手术组
18.72±1.15△*
28.31±0.62△
24.21±0.51△*
治疗组
15.69±0.68△△*
24.70±0.54△△
21.10±0.31△△*
与假手术组比较△P<0.001,与手术组比较△△P<0.001,与同组2h比较*P<0.001表2 SCI后大鼠脊髓内FOS标记细胞校正光密度值(COD值)比较(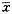 ±s,n=24)
±s,n=24)
, 百拇医药
1h
2h
4h
假手术组
0.17±0.03*
2.76±0.10
2.32±0.08*
手术组
6.15±0.21△*
12.49±0.35△
12.47±0.26△
, 百拇医药
治疗组
5.57±0.22△△*
8.93±0.25△△
7.49±0.21△△*
与假手术组比较△P<0.001,与手术组比较△△P<0.001,与同组2h比较*P<0.0013 讨 论
c-fos原癌基因是一种快速、一过性表达的基因,当中枢神经元受到物理、化学等各种刺激后,激活受体和第二信使,诱导c-fos在胞浆中转录合成mRNA,再翻译成原癌基因蛋白FOS,FOS蛋白进入胞核中与目的基因结合,激活目的基因的表达而对刺激作出反应。深入研究发现,导致c-fos表达差异的重要因素是第二信使,包括二脂酰甘油(DG)依赖的蛋白激酶C(PKC)、环磷酸腺苷(cAMP)和钙离子/钙调蛋白(Ca2+/CaM)[6]。由于FOS 蛋白仅在和受刺激的神经元有功能联系的神经元中表达,用免疫细胞化学方法容易显示,因此FOS表达可作为一种较好的研究神经系统功能和结构相结合的手段[3,4]。
, 百拇医药
国内外有关c-fos在脊髓内表达多以外周伤害性刺激为手段,借以探讨脊髓内伤害性信息传递的神经机制。如陶元祥等以大鼠足趾部注射甲醛[7],张怡泓等以鞘内注射SP受体拮抗剂[8],Tomosoda S.等用胫神经切断后后爪皮下注射甲醛[9],Thomas R[10]静脉注射抗惊厥药分别报道了脊髓内c-fos在不同时相的表达分布情况。因刺激性质和强度、脊髓水平、操作者主观因素等不同,结果有所不同。但有两点是肯定的:①FOS阳性神经元在后角浅层内侧部最密集,其次是后角深层。②FOS表达为快速一过性。本实验采用WD法直接机械刺激脊髓,造成脊髓轻度损伤后FOS表达,特点与上述特点是一致的。确切机制及意义尚待进一步研究补充阐明。
MPSS治疗SCI最早被肯定的可能药理作用机制即为抗脂质过氧化,减轻损伤区缺血,减轻水肿,提高Na+-K+-ATP酶活性,减少Ca2+超载以及对前列腺素的影响[8]。本实验结果还提示MPSS对c-fos表达是抑制性的,可能原因:①糖皮质激素受体(GR)与配体结合后,抑制通过PKC所调控的c-fos基因表达。②抑制Ca2+内流。③抑制兴奋性氨基酸受体的激活使损伤后c-fos基因异常表达受到抑制,进而保护了神经细胞,这也可能是MPSS治疗SCI机理之一。
, http://www.100md.com
参考文献
1,Charles HT,Michael GF.Review of the secondary injury theory of acute spinal Cord trauma with emphasis on vascular mechanisms.J Neurosurg,1991;75:15
2,Michael BB,Mary JS,WIlliam FCJ et al.Methylprednisolone or nalosone treatment after acute spinal cord injury:1-gear follow-up data.J Neurosurg,1992;76:23
3,Elizabeth B.Expression of c-fos-like portein as a marker for neuronal activity following noxious stimulation in the rat.J Comp Neurol,1990;296:517
, 百拇医药
4,徐智策,将星红.快反应基因在神经科学研究中的进展与动态.生理科学进展,1997;28(1):49
5,Jewell Lo.The pathophysiologica response to spinal cord injury.J Neurosurg,1974;40Jan:5
6,朱和明,朱长庚.第三信使的诱导及其分子机制.神经解剖学杂志,1996;12(1):75
7,陶元祥,魏锋,赵志奇.大鼠脊髓背角内FOS和NDP阳性神经元的分布与联系.神经解剖学杂志,1997;13(3):225
8,张怡泓,杨鲲,李云庆,等.大鼠外周注射SP受体拮抗剂对脊髓内伤害性刺激引起的c-fos基因表达的影响.神经解剖学杂志,1997;13(2):152
, http://www.100md.com 9,Tomosada S,Hiroyuki I,Seiji M,et al.Changes in c-fos induction in dorsal following tibial neurotomy.Brain Res,1994;642:348
10,Thomas RT,Jose MCL,Jan S,et al.Anticonvulsants suppress c-fos protein expression in Spinal cord neurons following noxious therma stimulation.Exp Neurol,1995;132:271
(收稿:1999-05-26), 百拇医药
单位:(咸宁医学院神经组化研究室,咸宁 437100)
关键词:脊髓损伤;甲基强的松龙;c-fos基因
咸宁医学院学报000103 摘 要 目的:探讨甲基强的松龙对脊髓损伤后c-fos基因表达的影响。方法:采用Allens法制成大鼠脊髓损伤模型,动物随机分三组:假手术组、手术组、术后给药组(术后5min腹腔注射甲基强的松龙30mg/kg,假手术组和手术组给等量生理盐水以对照)。分3个时间点(术后1小时、2小时、4小时)进行c-fos免疫细胞化学法染色。结果:损伤后FOS样免疫反应神经元主要分布在后角Ⅰ、Ⅱ层,手术组FOS样神经元与假手术组比较明显增多,而用药组较之手术组明显减少(P<0.001)。结论:脊髓损伤后脊髓c-fos基因表达显著增多,甲基强的松龙能抑制损伤后c-fos基因表达。
, 百拇医药 中图分类号 R651.2 Q786 文献标识码 A
文章编号 1008-0635(2000)01-0007-04
Effect of Methylprednisolone on c-fos Expression after Acute Spinal Cord Injury in Rats
ZHAO Zhongqiu,WAN Qiugui,HU Songlin
(Neural histochemistry study room,Xianning Medical College.Xian ning 437100)
ABSTRACT Objective To explore the effect of methylpredniosolone (MP) on c-fos expression after acute spinal cord injury (ASCI) in rats.Methods The ASCI-model of rats was established with Allen′s way.Rats were randomly divided into three groups:sham-operated group,operated group and drug-treated group.The animals of treated group were given a single dose of MP (30mg/kg) 5 minutes after injury,while other two groups were given isometric saline as control. At three different times (1h,2h and 4h later) c-fos immunocyto-chemistry was done.Results Following ASCI,most of FOS-like immunoreactive (FOS-LI) neurons were observed in lamina Ⅰ and Ⅱ.The FOS-LI neurons in operated group were significantly increased as compared with sham-operated group,while the FOS-LI neurons in drug-treated group were markedly lower than those in operated group.Conclusion C-fos gene expression in rat spinal cord can be markedly enhanced by injury,and MP may play a role in inhibition of c-fos gene expression during injury.
, 百拇医药
KEY WORDS Methyprednisolone;Spinal cord injury;c-fos gene
脊髓损伤(spinal cord injury,SCI) 是临床常见病且致残率高,已经认识到,SCI很少为横断,而是在原发损伤后一系列进行性改变导致了不可逆的结构改变[1]。90年代以来,美国两次大规模多中心临床研究结果证实,早期(伤后8小时内)大剂量甲基强的松龙(methylprednisolone,MP) 可使SCI患者达到更好的恢复,美国国立急性脊髓损伤研究分(NASCIS) 已将MP列为其它药物研究中必须予以比较的药物[2]。c-fos 与神经元发育、分化、再生修复等密切相关,病理情况下基因表达与调控可能与疾病发生发展有关,尽管其表达的生理学、行为学意义仍存在很大争议,但IEG特别是c-fos 作为神经元活动的标志已被广泛地接受[3,4]。脊髓损伤后c-fos 的表达以及用药后的变化国内外少有报道。急性SCI后使用MP已成为临床常规,MP治疗急性SCI后早期c-fos表达的变化是如何的呢?本文试图观察这些方面的变化,为脊髓损伤与修复研究提供形态学依据。
, http://www.100md.com
1 材料与方法
1.1材料
成年健康Wistar大鼠72只,雌雄不拘,重量200~300g,尽量一致。咸宁医学院动物室提供。
1.2 方法
1.2.1 动物模型
参照Allens重量垂直打击法建立SCI模型[5]:3%戊巴比妥钠30mg/kg 腹腔注射麻醉后,取后背正中切口,将T13~L1椎板小心轻柔切除,不留骨突以免打击时触抵重物,保留硬脊膜,用重2.5g自制砝码在玻璃细导管引导下从20cm高处自由落体运动打击脊髓造成SCI模型。致伤能量2.5×20g.cm。
1.2.2 动物分组
, http://www.100md.com
动物均在安静、无强光刺激、室温下饲养24小时以上。随机分为三组,每组24只,即①假手术组,②手术组,③治疗组。方法为:①组动物只暴露不给予打击,③组动物打击后5分钟MPSS 30mg/kg腹腔注射,①②组则相应给予生理盐水以对照。
1.2.3 实验步骤
各组均在三个时间点(术后1h、2h、4h),3%戊巴比妥钠60mg/kg腹腔注射深麻醉后,经升主动脉快速灌注生理盐水(37℃,100ml/只),继之灌注4%多聚甲醛(4℃,400~600ml/只),先快后慢1~2小时,注毕取T13~L1节段脊髓标本,在4%多聚甲醛中后固定2~4小时,转入30%蔗糖4℃过夜至下沉,恒冷箱连续切片,片厚16μm,每5片取一片。
1.3 c-fos免疫细胞化学方法及图像分析
①切片入0.01M PBS (PH 7.4) 漂洗,5分钟×2。②切片入甲醇-3%H2O2(4:1)液,37℃,45分钟,0.01M PBS漂洗,2分钟×3。③ 0.25% TritonX-100处理切片,37℃,30分钟,0.01M PBS 漂洗,5分钟×2。④ 3%血清白蛋白处理切片,37℃,30分钟,0.01M PBS漂洗,5分钟×2。⑤ 正常羊血清封闭液,37℃,20分钟,甩去多余血清。⑥滴加I抗(鼠抗IgG,1:100)4℃过夜(8~12小时),0.01M PBS漂洗,2分钟×3。⑦滴加生物素化山羊抗鼠IgG,37℃,1小时,0.01M PBS漂洗,2分钟×3。⑧滴加试剂SABC,37℃,1小时,0.01M PBS漂洗,5分钟×4。⑨DAB显色:使用DAB显色试剂盒,室温下显色,镜下控制时间(2分钟~7分钟),蒸馏水洗涤。⑩脱水、透明、封片,观察,照像。B11对照实验:用PBS或正常羊血清代替Ⅰ抗进行阴性对照或替代对照。B12FOS 阳性细胞密度和强度分析:细胞密度以0.01mm2内标记细胞数表示(10×10方格测试系统,显微镜下计数),标记强度以光密度值(optical density,OD值)表示。用图像分析仪测得各视野FOS阳性细胞OD值,同时测定同一张切片上前角视野内OD值作为背景(因为该区域内无阳性细胞)。FOS阳性细胞OD值减去背景OD值得到校正OD值(COD值)。每张切片测灰质10个视野范围(10×10倍),每个动物测4~5张切片,取平均值。
, http://www.100md.com
1.3 统计学处理
计量资料用
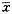 ±s表示,各时间点间比较用配对t检验,两组间比较用非配对t检验,多组间比较采用方差分析和Neuman-Keuls 检验,P<0.05为显著性标准。
±s表示,各时间点间比较用配对t检验,两组间比较用非配对t检验,多组间比较采用方差分析和Neuman-Keuls 检验,P<0.05为显著性标准。2 结 果
FOS免疫反应(FOS—IR) 阳性神经元的胞核染成棕褐色,大小不等,多为圆形或椭圆形,较大的细胞可见核仁透亮区。FOS—IR细胞多见于后角Ⅰ、Ⅱ,尤其是内侧部,部分FOS—IR细胞分布于后角深层及中央管周围。见图1、2。
假手术组未见或偶见少量阳性细胞,SCI后阳性细胞数目大量增加,且以2小时最高,用药后阳性细胞数目仍较假手术组高,且2小时最高,但其与手术组相比,各时间点阳性数目均减少。见图3、4。

, 百拇医药
图1 手术组术后2小时c-fos表达×400

图2 手术组术后2小时c-fos表达(后角深层)×400
各组FOS标记细胞的计量比较。标记细胞密度(no/0.01mm2)和标记强度(COD值)手术组高于假手术组,治疗组低于手术组,差异有显著性(P<0.001);各组FOS标记细胞密度和标记强度1小时、4小时均低于2小时(除手术组2小时和4小时FOS标记细胞光密度值无显著差异P>0.05),差异有显著性(P<0.001)。见表1、2。

图3 治疗组术后2小时c-fos表达×100

, 百拇医药
图4 治疗组术后2小时c-fos表达×100
表1 SCI后大鼠脊髓内FOS标记细胞密度(no/0.01mm2)的比较(
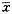 ±s,n=24)
±s,n=24)1h
2h
4h
假手术组
2.01±0.95*
6.49±2.01
5.43±0.32*
, http://www.100md.com
手术组
18.72±1.15△*
28.31±0.62△
24.21±0.51△*
治疗组
15.69±0.68△△*
24.70±0.54△△
21.10±0.31△△*
与假手术组比较△P<0.001,与手术组比较△△P<0.001,与同组2h比较*P<0.001表2 SCI后大鼠脊髓内FOS标记细胞校正光密度值(COD值)比较(
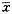 ±s,n=24)
±s,n=24), 百拇医药
1h
2h
4h
假手术组
0.17±0.03*
2.76±0.10
2.32±0.08*
手术组
6.15±0.21△*
12.49±0.35△
12.47±0.26△
, 百拇医药
治疗组
5.57±0.22△△*
8.93±0.25△△
7.49±0.21△△*
与假手术组比较△P<0.001,与手术组比较△△P<0.001,与同组2h比较*P<0.0013 讨 论
c-fos原癌基因是一种快速、一过性表达的基因,当中枢神经元受到物理、化学等各种刺激后,激活受体和第二信使,诱导c-fos在胞浆中转录合成mRNA,再翻译成原癌基因蛋白FOS,FOS蛋白进入胞核中与目的基因结合,激活目的基因的表达而对刺激作出反应。深入研究发现,导致c-fos表达差异的重要因素是第二信使,包括二脂酰甘油(DG)依赖的蛋白激酶C(PKC)、环磷酸腺苷(cAMP)和钙离子/钙调蛋白(Ca2+/CaM)[6]。由于FOS 蛋白仅在和受刺激的神经元有功能联系的神经元中表达,用免疫细胞化学方法容易显示,因此FOS表达可作为一种较好的研究神经系统功能和结构相结合的手段[3,4]。
, 百拇医药
国内外有关c-fos在脊髓内表达多以外周伤害性刺激为手段,借以探讨脊髓内伤害性信息传递的神经机制。如陶元祥等以大鼠足趾部注射甲醛[7],张怡泓等以鞘内注射SP受体拮抗剂[8],Tomosoda S.等用胫神经切断后后爪皮下注射甲醛[9],Thomas R[10]静脉注射抗惊厥药分别报道了脊髓内c-fos在不同时相的表达分布情况。因刺激性质和强度、脊髓水平、操作者主观因素等不同,结果有所不同。但有两点是肯定的:①FOS阳性神经元在后角浅层内侧部最密集,其次是后角深层。②FOS表达为快速一过性。本实验采用WD法直接机械刺激脊髓,造成脊髓轻度损伤后FOS表达,特点与上述特点是一致的。确切机制及意义尚待进一步研究补充阐明。
MPSS治疗SCI最早被肯定的可能药理作用机制即为抗脂质过氧化,减轻损伤区缺血,减轻水肿,提高Na+-K+-ATP酶活性,减少Ca2+超载以及对前列腺素的影响[8]。本实验结果还提示MPSS对c-fos表达是抑制性的,可能原因:①糖皮质激素受体(GR)与配体结合后,抑制通过PKC所调控的c-fos基因表达。②抑制Ca2+内流。③抑制兴奋性氨基酸受体的激活使损伤后c-fos基因异常表达受到抑制,进而保护了神经细胞,这也可能是MPSS治疗SCI机理之一。
, http://www.100md.com
参考文献
1,Charles HT,Michael GF.Review of the secondary injury theory of acute spinal Cord trauma with emphasis on vascular mechanisms.J Neurosurg,1991;75:15
2,Michael BB,Mary JS,WIlliam FCJ et al.Methylprednisolone or nalosone treatment after acute spinal cord injury:1-gear follow-up data.J Neurosurg,1992;76:23
3,Elizabeth B.Expression of c-fos-like portein as a marker for neuronal activity following noxious stimulation in the rat.J Comp Neurol,1990;296:517
, 百拇医药
4,徐智策,将星红.快反应基因在神经科学研究中的进展与动态.生理科学进展,1997;28(1):49
5,Jewell Lo.The pathophysiologica response to spinal cord injury.J Neurosurg,1974;40Jan:5
6,朱和明,朱长庚.第三信使的诱导及其分子机制.神经解剖学杂志,1996;12(1):75
7,陶元祥,魏锋,赵志奇.大鼠脊髓背角内FOS和NDP阳性神经元的分布与联系.神经解剖学杂志,1997;13(3):225
8,张怡泓,杨鲲,李云庆,等.大鼠外周注射SP受体拮抗剂对脊髓内伤害性刺激引起的c-fos基因表达的影响.神经解剖学杂志,1997;13(2):152
, http://www.100md.com 9,Tomosada S,Hiroyuki I,Seiji M,et al.Changes in c-fos induction in dorsal following tibial neurotomy.Brain Res,1994;642:348
10,Thomas RT,Jose MCL,Jan S,et al.Anticonvulsants suppress c-fos protein expression in Spinal cord neurons following noxious therma stimulation.Exp Neurol,1995;132:271
(收稿:1999-05-26), 百拇医药