肥厚型心肌病的分子遗传学与治疗进展
作者:Lameh Fananapazir, MD, FRCP
单位:
关键词:
美国医学会杂志中文版000205 Advances in Molecular Genetics and Management of
Hypertrophic Cardiomyopathy
病例介绍
患者女,28岁。13年前在一次家庭普查中诊断患有梗阻性肥厚型心肌病(HCM)。患者最初采用阿替洛尔和维拉帕米治疗胸痛,但几年后主诉疼痛加重且呼吸困难。体检发现心尖搏动明显,心前区有2/6收缩期杂音。12导联心电图示窦性心律79/min,PR间期205毫秒,QRS电轴正常,且左室(LV)肥厚伴继发性ST-T改变。超声心动图示室间隔19 mm(正常 ≤11 mm);左室游离壁15 mm(正常<11 mm);左房52 mm(正常<40 mm);二尖瓣没有收缩期前向运动,但在乳头肌水平与LV各壁相触;轻度二尖瓣返流;休息时LV压力阶差85 mm Hg。心脏磁共振成像证实LV肥厚,以左心腔中部最明显,并发现LV心尖部室壁瘤。心导管检查心腔压力如下:右房平均4 mm Hg;右室36/4 mm Hg;肺动脉30/14 mm Hg;平均肺动脉毛细血管楔压19 mm Hg;LV 190/20 mm Hg;主动脉100/50 mm Hg。因此,LV腔内压力阶差在室腔中部测定值为90 mm Hg。心输出量是4.7 L/min。LV造影证实为室腔中部梗阻型HCM。遗传学研究发现患者之家族性HCM为心肌的肌球蛋白轻链149位缬氨酸突变为蛋氨酸而引起的。
, 百拇医药
该例患者安装了双腔起搏器(DDD)以解除严重的LV腔内梗阻。DDD起搏期间,患者临床症状改善,随访5年,心导管测定血流动力学参数如下:右房平均压2 mm Hg;右室32/8 mm Hg;肺动脉压24/12 mm Hg;平均肺动脉毛细血管楔压9 mm Hg;LV 150/10 mm Hg;主动脉105/50 mm Hg;(LV阶差45 mm Hg)。心输出量4.2 L/min。起搏器按心房需求方式设置,压力如下:右房平均压2 mm Hg;右室26/6 mm Hg;肺动脉26/14 mm Hg;平均肺动脉毛细血管楔压13 mm Hg;LV155/10 mm Hg;主动脉85/48 mm Hg(LV阶差20 mm Hg)。心输出量4.3 L/min。DDD起搏在不影响充盈压和心输出量的情况下明显缓解了LV梗阻。长期起搏同样引起血流动力学变化,即使在DDD起搏暂时中断时这种变化也很明显。
讨论
10年来人们对HCM病理生理和治疗的认识有了很大进步。肥厚型心肌病是一种常染色体显性遗传病。本病的特征为患者LV壁肥厚,但没有其他可引起心肌体积增加的因素。据估计一般人群发病率0.1%~0.2%,但这一数值可能比实际发病率偏低,因为许多患者没有临床症状而未被诊断1。心肌肥厚常常伴随LV流出道的血流动力学梗阻,LV充盈和舒张异常(舒张功能不全)以及运动诱发的心肌灌注不良2,3。患者常有严重症状,易发生房性、室性心率失常以及猝死4。
, 百拇医药
临床和遗传的多样性
HCM的显著特征是表型的多样性2。即使是在同一家族,LV肥厚的严重程度和分布特征,LV腔内梗阻状况,LV收缩和舒张障碍和心肌缺血以及猝死的危险性亦可能有明显差异。有几个特有的心脏形态学特征已被确定2。在不对称性室间隔肥厚时,病变主要累及前间壁;在特发性肥厚性主动脉瓣下狭窄类型中,近端间隔肥厚造成了LV流出道梗阻;心尖型HCM主要影响心尖部;中央型HCM,肥厚主要位于乳头肌水平,近端LV和远端室壁瘤之间由一狭窄通道相连(图1)。
图1 特异遗传缺陷引起的肥厚型心肌病的罕见左心室形态
A.由肌球蛋白基本轻链的Met149Val突变引起的室腔中部梗阻性肥厚型心肌病(HCM)患者的左心室(LV)造影。B.由肌球蛋白调节轻链的Glu22Lys突变引起的室腔中部梗阻性HCM患者的左心室造影。上述两病例,乳头肌水平大块LV心肌的肥厚已使LV腔缩小为一狭窄通道连接着近端的LV腔和远端的室壁瘤。心房和心室的起搏导程也清晰可见。C.一例具有β-肌球蛋白Leu908Val突变的HCM患者的左心室造影,室腔中部心肌的肥厚已引起几乎全部的腔内梗阻,严重阻碍了远端室壁瘤的充盈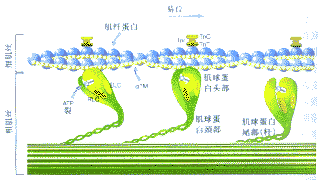
, 百拇医药
图2 肌小节收缩蛋白
肌小节是由粗细肌丝构成的收缩蛋白组成的。粗肌丝由β-肌球蛋白重链(Myosin)、基本轻链(ELC)和调节轻链(RLC)构成。细肌丝由几种蛋白构成,包括肌纤蛋白(Actin)、原肌球蛋白(αTm)、肌钙蛋白C(TnC)、肌钙蛋白I(TnI)和肌钙蛋白T(TnT)。肌球蛋白有三个功能区:头、颈和尾(或杆)。肌球蛋白头部有一三磷酸腺苷结合袋(ATP Cleft),和一肌纤蛋白结合点,肌球蛋白通过颈部的伸展与肌纤蛋白发生作用,其尾部用来固定分子。ATP水解为环磷腺苷和磷酸(肌球蛋白头部的ATP酶激活)释放的能量使肌球蛋白与肌纤蛋白相接。肌球蛋白与一分子ATP结合后使其与肌纤蛋白解离。肥厚型心肌病时,肌小节突变可影响到收缩和舒张过程的不同阶段,并且干扰了肌球蛋白分子运动的正常功能
肥厚型心肌病还存在明显的基因型(等位基因和不等位基因)多样性。目前已证实HCM是由7个编码收缩蛋白的基因突变引起的,这些收缩蛋白构成了重复排列的肌节单位(图2和表1)5-9。可能只有不足50%的HCM患者是由这些基因致病的,一些非肌节基因可能也会引起HCM。另外,染色体的7q3位点也可能与伴有预激综合征的HCM发病有关10。
, 百拇医药
遗传缺陷的临床表现
尽管相同基因突变所致HCM的亲属之间常有显著不同的临床表现,但是仍有几项研究显示HCM的表型主要由遗传缺陷决定。
基因特异性心脏形态学:某些基因突变常可引起特定的心脏形态学改变。例如,罕见的中央型HCM,主要与肌球蛋白的基本调节轻链突变有密切关系8。某些具有这种突变的患者,肥厚的乳头肌占据了LV心尖部,并表现为心尖肥厚型心肌病。因此,某些心尖型HCM可能为中央型HCM的早期阶段。
突变特异性外显率与自然病史:突变类型也决定了疾病的外显率(HCM病例数/突变例数×100%)和预后(表1)。大多数β-肌球蛋白突变表现为疾病几乎完全外显并且猝死率高。只有少数β-肌球蛋白突变疾病外显率低,且预后较好11-13。这些家族的HCM表型可持续1代或几代12,13。相反,有些遗传缺陷虽然仅表现为较轻的LV肥厚,但预后却很差6,11。
, 百拇医药
猝死的突变特异性病原学:猝死的机制可能和突变类型有关。例如,国立卫生研究院对Arg403Gln β-肌球蛋白突变导致HCM的家族进行研究显示,患者的晕厥前兆、晕厥以及猝死与心肌缺血有密切关系13。维拉帕米和β-阻滞剂可有效治疗运动诱发的心肌灌注异常。有些家 表1 肥厚型心肌病(HCM)的基因多变性族,遗传缺陷不仅引起HCM,而且还可导致其他心脏异常,例如预激综合征或传导阻滞。 基因(在染色体的位置)
已明确突变的举例
突变数
突变(在分子中的位置)
临床联系*
心脏肌钙蛋白T(TNN2)[1q32]
11…
, 百拇医药
外显率低,轻型,但预后差
基本轻链(MYL3)[3p21.2-p21.3]
2
Met149Val
中央型HCM,外显率高,预后差
Arg154His
中央型HCM
肌球结合蛋白C(MYBPC3)[11p11.2]
21
大多数突变导致了短链蛋白
外显率低,轻型,发病晚,预后好
, 百拇医药
调节轻链(MYL2)[12q23-q24.3]
4
Glu22Ly
中央型HCM
β-肌球蛋白重链(MYH7)[14q11.2-q13]
>50
Thr124lle(核苷酸结合区)
Thr162Cys(核苷酸结合区)
Phe244Leu(核苷酸结合区)
Arg249Gln
预后差
, 百拇医药
Gly256Glu(ATP区的外端)
外显率低,预后较好
Arg403Gln(肌球-肌纤蛋白接口)
外显率高,预后差
Arg453Cys(ATP区的外端)
预后差
Va1606Met(50-kd交叉点)
外显率高,大多数家族预后差
Arg719Trp(ELC结合点)
外显率高,预后适中
Arg663His(肌球-肌纤蛋白接口)
, 百拇医药
Gly716Arg
预后差
Arg719Gln(ELC粘接口)
预后差
Arg741Gln(ELC粘接口)
Lys847Glu(在杆上)
预后良好
Arg870His(在杆上)
外显率高,预后较好
Leu908Val(在杆上)
外显率低,中央型HCM,预后较好
, http://www.100md.com
α-原肌球蛋白(TPM1)[15q22]
4
Asp175Asn
表型多变,预后较好
Glu180Gly
轻度左室肥厚,预后不清楚
Ala63Val
轻度左室肥厚,心衰,预后差
Lys70Thr
轻度左室肥厚,心衰,预后差
心脏肌钙蛋白-I(TNN13)[19p13.2-q13.2]
, 百拇医药
6……
* LV指左心室;省略号表示缺乏资料 突变特异性功能异常:所有β-肌球蛋白突变都发生在分子头部或头-杆连接处的不同功能区(表1)。也就是说突变对分子运动功能具有不同的影响(表2)14。
已经证实某些突变可在骨骼肌表达15。为此,人们可以利用取自不同突变所致HCM患者的单根骨骼肌纤维,对其机械性能差异(等长运动张力、张力-刚性比率、无负荷最大缩短速率和肌力)进行研究16,纤维刚性是与紧密连接的横桥数成比例的。张力-刚性比率可用作正常肌纤维每个横桥的张力指标。最大无负荷缩短速率则可对纤维运动期间横桥环的生理速率进行定量。骨骼肌功能损害的性质和严重程度随肌纤维内含β-肌球蛋白的突变表达种类的不同而有所不同,这种差异可能会影响HCM的严重程度与外显率。
表2 肥厚型心肌病(HCM)猝死危险增高的临床指证
, 百拇医药
与不良预后有关的遗传缺陷
有晕厥或心脏停搏史
年轻患者
心肌缺血,尤其是有意识受损和/或运动诱发低
血压的年轻患者
疾病进展到左室壁变薄和射血分数下降
电生理研究可诱发持续性室性心律失常
有意识受损,动态Holter监测期间出现阵发性
室性心动过速
肌动力试验是另一种从分子水平研究突变所致肌力功能异常的理想手段。在此项试验中,需借助抗β-肌球蛋白C-端特异抗体将肌球蛋白末端与一个覆盖结构连接,而肌球蛋白的头端则游离于荧光标记的易位肌纤蛋白中15,17。预期基因突变将会影响肌球蛋白与肌纤蛋白的易位速率。研究发现,某些突变确实可抑制荧光标记的肌纤蛋白的速率,而另一些基因突变则可使之加快8,17。因此,动力试验可为肌小节突变对分子运动有特异影响提供进一步的证据。
, 百拇医药
突变特异性骨骼肌病:某些肌小节基因,如β-肌球蛋白重链、肌球蛋白轻链和α-原肌球蛋白既可在心肌又可在骨骼肌表达。基因突变在骨骼肌表达时可发生特异性骨骼肌肌病8,18。对β-肌球蛋白突变所致HCM患者的比目鱼肌进行活检标本显微镜检证实,其骨骼肌病与中枢核疾病相似,主要表现为I型“慢”纤维占优势,且许多I型纤维的中心部缺乏线粒体17。由肌球蛋白轻链引起的心肌肥厚也与特殊骨骼肌病有关,最明显的是线粒体性肌病的粗红纤维模型特性。
心肌肥厚是一种代偿机制
虽然HCM时LV收缩力呈增强趋势,但越来越多的证据表明心肌肥厚是针对LV收缩功能减退而发生的一种代偿性反应。该症的主要病变是肌小节蛋白机能异常,至少这些患者有明确的遗传缺陷6。能动性的不正常和单-浅慢骨骼肌纤维机制支持这个假说。磁共振成像研究进一步证实HCM存在LV壁收缩不良的部位19。
, http://www.100md.com
这样,与引起后负荷增加的一些病理状态(如高血压)不同,HCM时收缩功能受损的心肌会误将正常的血压辩认为负荷过重。并且,由于LV内心肌肥厚与收缩功能受损的分布并不均衡,LV收缩力的节段性差异亦可成为维持LV肥厚的一种刺激。需氧增多以及心肌内血管分布异常所致心肌缺血可引起心肌重构。
HCM时左室壁增厚可使心室张力降低并使LV收缩功能在中短期内亢进。但远期则可发生心肌细胞坏死、纤维化、心肌细胞能量耗竭以及舒张功能异常,并导致心力衰竭。因此,LV收缩力亢进是一种假象:HCM时LV射血分数增高反映了LV室壁过度增厚和心室容量减少所致室壁张力降低。
诱导心脏病逆转的理论策略
LVH的临床表现多种多样(即使相同的基因突变亦如是),且其表现与肌小节无直接联系,这反映了调节因素的重要性11-13。人们已对数种涉及心脏肥厚发生与维持的机制进行了研究。
, 百拇医药
血管紧张素转换酶(ACE)基因位于染色体17q23,在intron16具有插入型(I)/缺失型(D)多形性20。D等位基因与血浆ACE活性增高有关,可能是由于它紧密联接着调节ACE基因的另一个重要位点。研究显示DD表型与猝死危险性增加和HCM更严重的LV肥厚有关21。然而,进入这些研究的HCM患者是由不同遗传缺陷引起的,而且大多数为高外显突变。我们对许多HCM家族做了估价以了解ACE基因是否能改变心脏病表型的表达,这些家族的HCM是由β-肌球蛋白突变引起的,疾病的外显率低。结果表明,D等位基因与循环激素的变化和心脏肾素-血管紧张素活性有关,后者是造成心脏不同肥厚的原因22。ACE抑制剂和血管紧张素受体拮抗剂在改善非梗阻型HCM的LV肥厚、心肌缺血和LV收缩功能不良中的作用正在研究之中。
大多数肥厚性刺激引起细胞内Ca2+增加。有人提出肌小节突变也会增加细胞内Ca2+ 23。细胞内Ca2+和钙调蛋白的增加可激活神经钙蛋白(Ca2+-钙调蛋白依赖型蛋白磷酸脂酶)。神经钙蛋白激活后可使NF-AT3(激活T细胞的核心因子)去磷酸化,后者是转录因子家族成员之一24。经脱磷酸NF-AT3转移至细胞核,在该部位与GATA4(一种心脏锌指转录因子)紧密结合,从而引发心脏蛋白的转录。在心肌病转基因动物模型研究中,心肌肥厚与肌小节功能不良有关(HCM由原肌球蛋白、肌球蛋白和胎儿原肌球蛋白引起),用神经钙蛋白抑制剂(环孢霉素或藤霉素)治疗可防止心脏病的进展25。
, 百拇医药
然而,肾素-血管紧张素系统或神经钙蛋白抑制剂对HCM的患者有效性仍需进一步研究证实。
猝死的机制和危险性评价
人们在完善危险分级和阐明猝死机制上不断努力,因为这有助于治疗3,4,26。有一项研究评价了几个调查报告,包括一个对155例HCM患者进行危险分级的电生理(EP)方案3,4。此前,在少数临床表现各异HCM患者应用不同EP方案进行的研究,曾使人们对EP研究在HCM的价值产生疑问。
研究发现约2/3的患者窦房结功能异常,20%的患者AV结传导延迟或加速,30%的患者希-蒲氏传导系统异常。最常诱发的心律失常是心房折返性心动过速和心房纤颤。采用标准化程序刺激方案可在43%的患者诱发持续性室性心动过速(VT)。其中大约75%为多形性VT,约25%为单形性。重要的是,持续VT的诱发与心脏停搏和晕厥史关系密切。这些在猝死高危患者获得的发现促使人们进行了一项前瞻性研究。该研究在230例患者对有关血流动力学和EP异常的治疗策略进行了评估26。作者还利用多变量logistic回归分析研究了临床、Holter、血液动力学和EP参数与继发性心脏事件(猝死、植入除颤器放电、心脏停搏、晕厥)的关系。该研究,164例患者因心脏停搏、晕厥或晕厥前兆就诊,66例没有意识受损症状,动态ECG监测显示115例患者有非持续性VT。有二个变量可独立预测继发性心脏事件(猝死、晕厥和植入除颤器放电):(1)心脏停搏或晕厥史;(2)EP研究中至少3个期前刺激诱发了VT。EP研究期间可诱发VT者,在第1年和第5年,未发生心脏事件患者所占百分比(均值[SD])分别为94%(3%)和48%(21%),而未能诱发VT的患者则分别为100%和92%(6%)。较弱的EP刺激方案(≤2额外刺激)同样可鉴别无意识障碍的高危猝死患者。然而这只能代表少数无症状患者。相反,非持续性VT(24~48小时Holter记录中25%的患者出现)只能在具有晕厥前兆、晕厥和心脏停搏患者预测预后。
, http://www.100md.com
这些结果表明了EP研究在评价HCM患者继发性心脏事件危险性高低方面的价值。这些危险性评估研究表明,所有有意识障碍的HCM患者都应进行以下实验:(1)48小时Holter监测;(2)运动铊闪烁成像(以鉴别可逆性心肌缺血);(3)进行心导管和EP研究,判定有无LV梗阻和心律失常,并对观察到之心律失常对血流动力学影响作出评价(表2和表3)。与此相反,对无症状的HCM患者,这些研究只适用于对危险分级具有特殊需求的患者,例如飞行员或运动员以及有猝死家族史或预激综合征的患者。
心律失常的治疗
HCM患者的猝死大多为室性心律失常所致。安全有效地控制这些患者的心律失常是非常必要的。Ⅰ型和 Ⅱ型抗心律失常药并不能降低HCM患者的病死率。胺碘酮治疗可使有症状的HCM患者猝死率增高27,它仅对30%的病例可抑制持续性VT的发生,使50%患者更易诱发VT(致心律失常作用),并可使一些患者发生传导阻滞。
, 百拇医药
植入型除颤器对易发生室颤的HCM患者是一种安全有效的方法。下述病例可考虑除颤器治疗:(1)心脏停搏存活者;(2)有晕厥或晕厥前兆,而且EP研究可诱发持续性VT的非梗阻型HCM患者;(3)无意识受损症状但在EP研究中易诱发持续VT(≤2个期前刺激)的患者;(4)经适当药物治疗仍反复发生晕厥的年轻心肌缺血患者28-30。 有一项研究显示28,在上述危险评估方案的基础上植入除颤器,3年内除颤器适时、成功放电者为20%。
梗阻型HCM的治疗
约1/3的HCM患者发生LV流出道梗阻,无症状的成年患者可能无需冶疗。然而,梗阻是决定临床预后的重要因素,受累患者常诉胸部不适、心悸气短以及与运动或姿势相关的轻度头晕或晕厥。这些症状首先应用维拉帕米或β-阻滞剂治疗。药物难以控制症状的严重病例可行LV肌切开和切除术或二尖瓣置换术。然而,这些大手术常伴有较高的死亡率与并发症发生率。
, 百拇医药
有几个研究中心证实DDD起博也可降低LV流出道梗阻并改善这些患者的症状31,32。 实际上,RV起搏可改变LV的收缩模式,从而使收缩期LV流出道扩大,使低LV流出道血流速度降低。继之,这将减少收缩期的前向运动,进一步降低LV流出道的梗阻和二尖瓣返流。长期起搏还可改变心肌电生理和血流动力学特性。这些变化在起搏暂时中断时是明显的。DDD起搏的长期效果是令人鼓舞的。
表3 肥厚型心肌病患者调查表* 研究项目
意义
局限性
建议对象
ECG
确定HCM诊断、疾病严重性、LV梗阻以及其他相关异常
, 百拇医药
没有足够心脏表现的患者不能诊断肥厚型心肌病
HCM患者的家庭成员以及有晕厥/晕厥前兆表现的年轻患者
磁共振成像
能准确显示局部室壁的厚度、功能和LV质量
只限于一些中心医院
轻度LVH患者或ECHO正常但ECG异常的患者
心导管血管造影
准确评估LV流出道的阶段差、LV充盈压和心输出量
有创检查
有症状的患者,部分评估其危险性,从而排除冠心病
, http://www.100md.com
踏车运动实验最大氧摄取量
客观地确定运动的限度,辅助诊断运动诱发的心肌缺血和低血压,从而有助于确定猝死高危患者
没有
部分评估患者的危险性和治疗效果
动态ECG监测
常可发现房性和室性心律失常
对治疗的指导性差,VT不能用来预测无症状患者的预后
心脏停搏、晕厥前兆和心悸的评估
电生理研究
为窦房结和希-蒲传导性疾病的诊断提供依据,可明确附属通道的存在,确定易发生房性和室性心律失常以及猝死的患者
, http://www.100md.com
有创检查
部分估价危险性,尤其是表现有晕厥、晕厥前兆和心悸的非梗阻性HCM患者以及无症状的危险患者,如运动员和WPW患者
运动负荷铊闪烁成像
显示可逆性心肌灌注异常、肺吸收增加
具有放射性,对无症状的成年人意义不清楚
非常适于有运动诱发晕厥的年轻患者
遗传学研究
可明确疾病基因,确定特异突变蛋白的自然史、外显率和临床前诊断
只明确<50%患者的突变,几乎没有突变的自然史被确立
, http://www.100md.com
已知突变的家庭成员的确定,寻找有多个家庭成员患病的致病基因
*LHV:左室肥厚;VT:室性心动过速;ECHO:超声心动图;LV:左心室;ECG:心电图;WPW:预激综合征
中央梗阻型HCM的治疗比常见的LV流出道梗阻型HCM更为困难。该型HCM患者进展快,发生室性心律失常和猝死的危险性较高。有关心脏手术以及DDD起搏对此类患者作用的报道很少。
最后,采用经皮室间隔消融术代替心脏外科手术的研究尚在进行之中33-37。该法通过血管成形术导管把酒精灌入左前降支冠脉的一或几个间隔支,其目的是使造成LV流出道梗阻的近端间隔部分坏死或变薄。初步研究显示该法可使LV压力阶差下降70%,临床症状和运动耐力都明显改善。患者一般对经皮室间隔消融术具有很好的耐受性。然而,这种方法可合并院内传导异常和需要植入起博器的传导阻滞,可发生室性心律失常和死亡。它的长期效果还不清楚。经皮室间隔消融术的潜在副作用可能包括迟发性心律失常和LV功能不全,尽管这些合并症还未见报道。
, 百拇医药
所有这些方法都不能预防猝死。它们的主要目的是缓解症状并改善运动耐力。这些方法并不相互排斥。因此,DDD起博无效的患者可行心脏手术治疗。同样,已进行了心脏手术治疗的HCM患者,如果还有梗阻症状,亦可成功地运用DDD起博治疗。
结论
出现LV肥厚而无其他原因可循时常可诊断肥厚型心肌病。然而,人们越来越认识到这个术语包含了许多不同的、具有特定表型的遗传病。有些病例,病变可同时累及骨骼肌和心脏。其基因型也常决定其外显率、严重性和LV肥厚的分布及预后。危险性评估研究可使我们进一步认识晕厥和猝死的潜在机制。许多新奇的治疗方法尚在评价之中,它们可能有助于缓解症状和改善预后。
张清芬 译 宋光耀 郭艺芳 校
JAMA,1999;281:1746~1752, 百拇医药
单位:
关键词:
美国医学会杂志中文版000205 Advances in Molecular Genetics and Management of
Hypertrophic Cardiomyopathy
病例介绍
患者女,28岁。13年前在一次家庭普查中诊断患有梗阻性肥厚型心肌病(HCM)。患者最初采用阿替洛尔和维拉帕米治疗胸痛,但几年后主诉疼痛加重且呼吸困难。体检发现心尖搏动明显,心前区有2/6收缩期杂音。12导联心电图示窦性心律79/min,PR间期205毫秒,QRS电轴正常,且左室(LV)肥厚伴继发性ST-T改变。超声心动图示室间隔19 mm(正常 ≤11 mm);左室游离壁15 mm(正常<11 mm);左房52 mm(正常<40 mm);二尖瓣没有收缩期前向运动,但在乳头肌水平与LV各壁相触;轻度二尖瓣返流;休息时LV压力阶差85 mm Hg。心脏磁共振成像证实LV肥厚,以左心腔中部最明显,并发现LV心尖部室壁瘤。心导管检查心腔压力如下:右房平均4 mm Hg;右室36/4 mm Hg;肺动脉30/14 mm Hg;平均肺动脉毛细血管楔压19 mm Hg;LV 190/20 mm Hg;主动脉100/50 mm Hg。因此,LV腔内压力阶差在室腔中部测定值为90 mm Hg。心输出量是4.7 L/min。LV造影证实为室腔中部梗阻型HCM。遗传学研究发现患者之家族性HCM为心肌的肌球蛋白轻链149位缬氨酸突变为蛋氨酸而引起的。
, 百拇医药
该例患者安装了双腔起搏器(DDD)以解除严重的LV腔内梗阻。DDD起搏期间,患者临床症状改善,随访5年,心导管测定血流动力学参数如下:右房平均压2 mm Hg;右室32/8 mm Hg;肺动脉压24/12 mm Hg;平均肺动脉毛细血管楔压9 mm Hg;LV 150/10 mm Hg;主动脉105/50 mm Hg;(LV阶差45 mm Hg)。心输出量4.2 L/min。起搏器按心房需求方式设置,压力如下:右房平均压2 mm Hg;右室26/6 mm Hg;肺动脉26/14 mm Hg;平均肺动脉毛细血管楔压13 mm Hg;LV155/10 mm Hg;主动脉85/48 mm Hg(LV阶差20 mm Hg)。心输出量4.3 L/min。DDD起搏在不影响充盈压和心输出量的情况下明显缓解了LV梗阻。长期起搏同样引起血流动力学变化,即使在DDD起搏暂时中断时这种变化也很明显。
讨论
10年来人们对HCM病理生理和治疗的认识有了很大进步。肥厚型心肌病是一种常染色体显性遗传病。本病的特征为患者LV壁肥厚,但没有其他可引起心肌体积增加的因素。据估计一般人群发病率0.1%~0.2%,但这一数值可能比实际发病率偏低,因为许多患者没有临床症状而未被诊断1。心肌肥厚常常伴随LV流出道的血流动力学梗阻,LV充盈和舒张异常(舒张功能不全)以及运动诱发的心肌灌注不良2,3。患者常有严重症状,易发生房性、室性心率失常以及猝死4。
, 百拇医药
临床和遗传的多样性
HCM的显著特征是表型的多样性2。即使是在同一家族,LV肥厚的严重程度和分布特征,LV腔内梗阻状况,LV收缩和舒张障碍和心肌缺血以及猝死的危险性亦可能有明显差异。有几个特有的心脏形态学特征已被确定2。在不对称性室间隔肥厚时,病变主要累及前间壁;在特发性肥厚性主动脉瓣下狭窄类型中,近端间隔肥厚造成了LV流出道梗阻;心尖型HCM主要影响心尖部;中央型HCM,肥厚主要位于乳头肌水平,近端LV和远端室壁瘤之间由一狭窄通道相连(图1)。

图1 特异遗传缺陷引起的肥厚型心肌病的罕见左心室形态
A.由肌球蛋白基本轻链的Met149Val突变引起的室腔中部梗阻性肥厚型心肌病(HCM)患者的左心室(LV)造影。B.由肌球蛋白调节轻链的Glu22Lys突变引起的室腔中部梗阻性HCM患者的左心室造影。上述两病例,乳头肌水平大块LV心肌的肥厚已使LV腔缩小为一狭窄通道连接着近端的LV腔和远端的室壁瘤。心房和心室的起搏导程也清晰可见。C.一例具有β-肌球蛋白Leu908Val突变的HCM患者的左心室造影,室腔中部心肌的肥厚已引起几乎全部的腔内梗阻,严重阻碍了远端室壁瘤的充盈

, 百拇医药
图2 肌小节收缩蛋白
肌小节是由粗细肌丝构成的收缩蛋白组成的。粗肌丝由β-肌球蛋白重链(Myosin)、基本轻链(ELC)和调节轻链(RLC)构成。细肌丝由几种蛋白构成,包括肌纤蛋白(Actin)、原肌球蛋白(αTm)、肌钙蛋白C(TnC)、肌钙蛋白I(TnI)和肌钙蛋白T(TnT)。肌球蛋白有三个功能区:头、颈和尾(或杆)。肌球蛋白头部有一三磷酸腺苷结合袋(ATP Cleft),和一肌纤蛋白结合点,肌球蛋白通过颈部的伸展与肌纤蛋白发生作用,其尾部用来固定分子。ATP水解为环磷腺苷和磷酸(肌球蛋白头部的ATP酶激活)释放的能量使肌球蛋白与肌纤蛋白相接。肌球蛋白与一分子ATP结合后使其与肌纤蛋白解离。肥厚型心肌病时,肌小节突变可影响到收缩和舒张过程的不同阶段,并且干扰了肌球蛋白分子运动的正常功能
肥厚型心肌病还存在明显的基因型(等位基因和不等位基因)多样性。目前已证实HCM是由7个编码收缩蛋白的基因突变引起的,这些收缩蛋白构成了重复排列的肌节单位(图2和表1)5-9。可能只有不足50%的HCM患者是由这些基因致病的,一些非肌节基因可能也会引起HCM。另外,染色体的7q3位点也可能与伴有预激综合征的HCM发病有关10。
, 百拇医药
遗传缺陷的临床表现
尽管相同基因突变所致HCM的亲属之间常有显著不同的临床表现,但是仍有几项研究显示HCM的表型主要由遗传缺陷决定。
基因特异性心脏形态学:某些基因突变常可引起特定的心脏形态学改变。例如,罕见的中央型HCM,主要与肌球蛋白的基本调节轻链突变有密切关系8。某些具有这种突变的患者,肥厚的乳头肌占据了LV心尖部,并表现为心尖肥厚型心肌病。因此,某些心尖型HCM可能为中央型HCM的早期阶段。
突变特异性外显率与自然病史:突变类型也决定了疾病的外显率(HCM病例数/突变例数×100%)和预后(表1)。大多数β-肌球蛋白突变表现为疾病几乎完全外显并且猝死率高。只有少数β-肌球蛋白突变疾病外显率低,且预后较好11-13。这些家族的HCM表型可持续1代或几代12,13。相反,有些遗传缺陷虽然仅表现为较轻的LV肥厚,但预后却很差6,11。
, 百拇医药
猝死的突变特异性病原学:猝死的机制可能和突变类型有关。例如,国立卫生研究院对Arg403Gln β-肌球蛋白突变导致HCM的家族进行研究显示,患者的晕厥前兆、晕厥以及猝死与心肌缺血有密切关系13。维拉帕米和β-阻滞剂可有效治疗运动诱发的心肌灌注异常。有些家 表1 肥厚型心肌病(HCM)的基因多变性族,遗传缺陷不仅引起HCM,而且还可导致其他心脏异常,例如预激综合征或传导阻滞。 基因(在染色体的位置)
已明确突变的举例
突变数
突变(在分子中的位置)
临床联系*
心脏肌钙蛋白T(TNN2)[1q32]
11…
, 百拇医药
外显率低,轻型,但预后差
基本轻链(MYL3)[3p21.2-p21.3]
2
Met149Val
中央型HCM,外显率高,预后差
Arg154His
中央型HCM
肌球结合蛋白C(MYBPC3)[11p11.2]
21
大多数突变导致了短链蛋白
外显率低,轻型,发病晚,预后好
, 百拇医药
调节轻链(MYL2)[12q23-q24.3]
4
Glu22Ly
中央型HCM
β-肌球蛋白重链(MYH7)[14q11.2-q13]
>50
Thr124lle(核苷酸结合区)
Thr162Cys(核苷酸结合区)
Phe244Leu(核苷酸结合区)
Arg249Gln
预后差
, 百拇医药
Gly256Glu(ATP区的外端)
外显率低,预后较好
Arg403Gln(肌球-肌纤蛋白接口)
外显率高,预后差
Arg453Cys(ATP区的外端)
预后差
Va1606Met(50-kd交叉点)
外显率高,大多数家族预后差
Arg719Trp(ELC结合点)
外显率高,预后适中
Arg663His(肌球-肌纤蛋白接口)
, 百拇医药
Gly716Arg
预后差
Arg719Gln(ELC粘接口)
预后差
Arg741Gln(ELC粘接口)
Lys847Glu(在杆上)
预后良好
Arg870His(在杆上)
外显率高,预后较好
Leu908Val(在杆上)
外显率低,中央型HCM,预后较好
, http://www.100md.com
α-原肌球蛋白(TPM1)[15q22]
4
Asp175Asn
表型多变,预后较好
Glu180Gly
轻度左室肥厚,预后不清楚
Ala63Val
轻度左室肥厚,心衰,预后差
Lys70Thr
轻度左室肥厚,心衰,预后差
心脏肌钙蛋白-I(TNN13)[19p13.2-q13.2]
, 百拇医药
6……
* LV指左心室;省略号表示缺乏资料 突变特异性功能异常:所有β-肌球蛋白突变都发生在分子头部或头-杆连接处的不同功能区(表1)。也就是说突变对分子运动功能具有不同的影响(表2)14。
已经证实某些突变可在骨骼肌表达15。为此,人们可以利用取自不同突变所致HCM患者的单根骨骼肌纤维,对其机械性能差异(等长运动张力、张力-刚性比率、无负荷最大缩短速率和肌力)进行研究16,纤维刚性是与紧密连接的横桥数成比例的。张力-刚性比率可用作正常肌纤维每个横桥的张力指标。最大无负荷缩短速率则可对纤维运动期间横桥环的生理速率进行定量。骨骼肌功能损害的性质和严重程度随肌纤维内含β-肌球蛋白的突变表达种类的不同而有所不同,这种差异可能会影响HCM的严重程度与外显率。
表2 肥厚型心肌病(HCM)猝死危险增高的临床指证
, 百拇医药
与不良预后有关的遗传缺陷
有晕厥或心脏停搏史
年轻患者
心肌缺血,尤其是有意识受损和/或运动诱发低
血压的年轻患者
疾病进展到左室壁变薄和射血分数下降
电生理研究可诱发持续性室性心律失常
有意识受损,动态Holter监测期间出现阵发性
室性心动过速
肌动力试验是另一种从分子水平研究突变所致肌力功能异常的理想手段。在此项试验中,需借助抗β-肌球蛋白C-端特异抗体将肌球蛋白末端与一个覆盖结构连接,而肌球蛋白的头端则游离于荧光标记的易位肌纤蛋白中15,17。预期基因突变将会影响肌球蛋白与肌纤蛋白的易位速率。研究发现,某些突变确实可抑制荧光标记的肌纤蛋白的速率,而另一些基因突变则可使之加快8,17。因此,动力试验可为肌小节突变对分子运动有特异影响提供进一步的证据。
, 百拇医药
突变特异性骨骼肌病:某些肌小节基因,如β-肌球蛋白重链、肌球蛋白轻链和α-原肌球蛋白既可在心肌又可在骨骼肌表达。基因突变在骨骼肌表达时可发生特异性骨骼肌肌病8,18。对β-肌球蛋白突变所致HCM患者的比目鱼肌进行活检标本显微镜检证实,其骨骼肌病与中枢核疾病相似,主要表现为I型“慢”纤维占优势,且许多I型纤维的中心部缺乏线粒体17。由肌球蛋白轻链引起的心肌肥厚也与特殊骨骼肌病有关,最明显的是线粒体性肌病的粗红纤维模型特性。
心肌肥厚是一种代偿机制
虽然HCM时LV收缩力呈增强趋势,但越来越多的证据表明心肌肥厚是针对LV收缩功能减退而发生的一种代偿性反应。该症的主要病变是肌小节蛋白机能异常,至少这些患者有明确的遗传缺陷6。能动性的不正常和单-浅慢骨骼肌纤维机制支持这个假说。磁共振成像研究进一步证实HCM存在LV壁收缩不良的部位19。
, http://www.100md.com
这样,与引起后负荷增加的一些病理状态(如高血压)不同,HCM时收缩功能受损的心肌会误将正常的血压辩认为负荷过重。并且,由于LV内心肌肥厚与收缩功能受损的分布并不均衡,LV收缩力的节段性差异亦可成为维持LV肥厚的一种刺激。需氧增多以及心肌内血管分布异常所致心肌缺血可引起心肌重构。
HCM时左室壁增厚可使心室张力降低并使LV收缩功能在中短期内亢进。但远期则可发生心肌细胞坏死、纤维化、心肌细胞能量耗竭以及舒张功能异常,并导致心力衰竭。因此,LV收缩力亢进是一种假象:HCM时LV射血分数增高反映了LV室壁过度增厚和心室容量减少所致室壁张力降低。
诱导心脏病逆转的理论策略
LVH的临床表现多种多样(即使相同的基因突变亦如是),且其表现与肌小节无直接联系,这反映了调节因素的重要性11-13。人们已对数种涉及心脏肥厚发生与维持的机制进行了研究。
, 百拇医药
血管紧张素转换酶(ACE)基因位于染色体17q23,在intron16具有插入型(I)/缺失型(D)多形性20。D等位基因与血浆ACE活性增高有关,可能是由于它紧密联接着调节ACE基因的另一个重要位点。研究显示DD表型与猝死危险性增加和HCM更严重的LV肥厚有关21。然而,进入这些研究的HCM患者是由不同遗传缺陷引起的,而且大多数为高外显突变。我们对许多HCM家族做了估价以了解ACE基因是否能改变心脏病表型的表达,这些家族的HCM是由β-肌球蛋白突变引起的,疾病的外显率低。结果表明,D等位基因与循环激素的变化和心脏肾素-血管紧张素活性有关,后者是造成心脏不同肥厚的原因22。ACE抑制剂和血管紧张素受体拮抗剂在改善非梗阻型HCM的LV肥厚、心肌缺血和LV收缩功能不良中的作用正在研究之中。
大多数肥厚性刺激引起细胞内Ca2+增加。有人提出肌小节突变也会增加细胞内Ca2+ 23。细胞内Ca2+和钙调蛋白的增加可激活神经钙蛋白(Ca2+-钙调蛋白依赖型蛋白磷酸脂酶)。神经钙蛋白激活后可使NF-AT3(激活T细胞的核心因子)去磷酸化,后者是转录因子家族成员之一24。经脱磷酸NF-AT3转移至细胞核,在该部位与GATA4(一种心脏锌指转录因子)紧密结合,从而引发心脏蛋白的转录。在心肌病转基因动物模型研究中,心肌肥厚与肌小节功能不良有关(HCM由原肌球蛋白、肌球蛋白和胎儿原肌球蛋白引起),用神经钙蛋白抑制剂(环孢霉素或藤霉素)治疗可防止心脏病的进展25。
, 百拇医药
然而,肾素-血管紧张素系统或神经钙蛋白抑制剂对HCM的患者有效性仍需进一步研究证实。
猝死的机制和危险性评价
人们在完善危险分级和阐明猝死机制上不断努力,因为这有助于治疗3,4,26。有一项研究评价了几个调查报告,包括一个对155例HCM患者进行危险分级的电生理(EP)方案3,4。此前,在少数临床表现各异HCM患者应用不同EP方案进行的研究,曾使人们对EP研究在HCM的价值产生疑问。
研究发现约2/3的患者窦房结功能异常,20%的患者AV结传导延迟或加速,30%的患者希-蒲氏传导系统异常。最常诱发的心律失常是心房折返性心动过速和心房纤颤。采用标准化程序刺激方案可在43%的患者诱发持续性室性心动过速(VT)。其中大约75%为多形性VT,约25%为单形性。重要的是,持续VT的诱发与心脏停搏和晕厥史关系密切。这些在猝死高危患者获得的发现促使人们进行了一项前瞻性研究。该研究在230例患者对有关血流动力学和EP异常的治疗策略进行了评估26。作者还利用多变量logistic回归分析研究了临床、Holter、血液动力学和EP参数与继发性心脏事件(猝死、植入除颤器放电、心脏停搏、晕厥)的关系。该研究,164例患者因心脏停搏、晕厥或晕厥前兆就诊,66例没有意识受损症状,动态ECG监测显示115例患者有非持续性VT。有二个变量可独立预测继发性心脏事件(猝死、晕厥和植入除颤器放电):(1)心脏停搏或晕厥史;(2)EP研究中至少3个期前刺激诱发了VT。EP研究期间可诱发VT者,在第1年和第5年,未发生心脏事件患者所占百分比(均值[SD])分别为94%(3%)和48%(21%),而未能诱发VT的患者则分别为100%和92%(6%)。较弱的EP刺激方案(≤2额外刺激)同样可鉴别无意识障碍的高危猝死患者。然而这只能代表少数无症状患者。相反,非持续性VT(24~48小时Holter记录中25%的患者出现)只能在具有晕厥前兆、晕厥和心脏停搏患者预测预后。
, http://www.100md.com
这些结果表明了EP研究在评价HCM患者继发性心脏事件危险性高低方面的价值。这些危险性评估研究表明,所有有意识障碍的HCM患者都应进行以下实验:(1)48小时Holter监测;(2)运动铊闪烁成像(以鉴别可逆性心肌缺血);(3)进行心导管和EP研究,判定有无LV梗阻和心律失常,并对观察到之心律失常对血流动力学影响作出评价(表2和表3)。与此相反,对无症状的HCM患者,这些研究只适用于对危险分级具有特殊需求的患者,例如飞行员或运动员以及有猝死家族史或预激综合征的患者。
心律失常的治疗
HCM患者的猝死大多为室性心律失常所致。安全有效地控制这些患者的心律失常是非常必要的。Ⅰ型和 Ⅱ型抗心律失常药并不能降低HCM患者的病死率。胺碘酮治疗可使有症状的HCM患者猝死率增高27,它仅对30%的病例可抑制持续性VT的发生,使50%患者更易诱发VT(致心律失常作用),并可使一些患者发生传导阻滞。
, 百拇医药
植入型除颤器对易发生室颤的HCM患者是一种安全有效的方法。下述病例可考虑除颤器治疗:(1)心脏停搏存活者;(2)有晕厥或晕厥前兆,而且EP研究可诱发持续性VT的非梗阻型HCM患者;(3)无意识受损症状但在EP研究中易诱发持续VT(≤2个期前刺激)的患者;(4)经适当药物治疗仍反复发生晕厥的年轻心肌缺血患者28-30。 有一项研究显示28,在上述危险评估方案的基础上植入除颤器,3年内除颤器适时、成功放电者为20%。
梗阻型HCM的治疗
约1/3的HCM患者发生LV流出道梗阻,无症状的成年患者可能无需冶疗。然而,梗阻是决定临床预后的重要因素,受累患者常诉胸部不适、心悸气短以及与运动或姿势相关的轻度头晕或晕厥。这些症状首先应用维拉帕米或β-阻滞剂治疗。药物难以控制症状的严重病例可行LV肌切开和切除术或二尖瓣置换术。然而,这些大手术常伴有较高的死亡率与并发症发生率。
, 百拇医药
有几个研究中心证实DDD起博也可降低LV流出道梗阻并改善这些患者的症状31,32。 实际上,RV起搏可改变LV的收缩模式,从而使收缩期LV流出道扩大,使低LV流出道血流速度降低。继之,这将减少收缩期的前向运动,进一步降低LV流出道的梗阻和二尖瓣返流。长期起搏还可改变心肌电生理和血流动力学特性。这些变化在起搏暂时中断时是明显的。DDD起搏的长期效果是令人鼓舞的。
表3 肥厚型心肌病患者调查表* 研究项目
意义
局限性
建议对象
ECG
确定HCM诊断、疾病严重性、LV梗阻以及其他相关异常
, 百拇医药
没有足够心脏表现的患者不能诊断肥厚型心肌病
HCM患者的家庭成员以及有晕厥/晕厥前兆表现的年轻患者
磁共振成像
能准确显示局部室壁的厚度、功能和LV质量
只限于一些中心医院
轻度LVH患者或ECHO正常但ECG异常的患者
心导管血管造影
准确评估LV流出道的阶段差、LV充盈压和心输出量
有创检查
有症状的患者,部分评估其危险性,从而排除冠心病
, http://www.100md.com
踏车运动实验最大氧摄取量
客观地确定运动的限度,辅助诊断运动诱发的心肌缺血和低血压,从而有助于确定猝死高危患者
没有
部分评估患者的危险性和治疗效果
动态ECG监测
常可发现房性和室性心律失常
对治疗的指导性差,VT不能用来预测无症状患者的预后
心脏停搏、晕厥前兆和心悸的评估
电生理研究
为窦房结和希-蒲传导性疾病的诊断提供依据,可明确附属通道的存在,确定易发生房性和室性心律失常以及猝死的患者
, http://www.100md.com
有创检查
部分估价危险性,尤其是表现有晕厥、晕厥前兆和心悸的非梗阻性HCM患者以及无症状的危险患者,如运动员和WPW患者
运动负荷铊闪烁成像
显示可逆性心肌灌注异常、肺吸收增加
具有放射性,对无症状的成年人意义不清楚
非常适于有运动诱发晕厥的年轻患者
遗传学研究
可明确疾病基因,确定特异突变蛋白的自然史、外显率和临床前诊断
只明确<50%患者的突变,几乎没有突变的自然史被确立
, http://www.100md.com
已知突变的家庭成员的确定,寻找有多个家庭成员患病的致病基因
*LHV:左室肥厚;VT:室性心动过速;ECHO:超声心动图;LV:左心室;ECG:心电图;WPW:预激综合征
中央梗阻型HCM的治疗比常见的LV流出道梗阻型HCM更为困难。该型HCM患者进展快,发生室性心律失常和猝死的危险性较高。有关心脏手术以及DDD起搏对此类患者作用的报道很少。
最后,采用经皮室间隔消融术代替心脏外科手术的研究尚在进行之中33-37。该法通过血管成形术导管把酒精灌入左前降支冠脉的一或几个间隔支,其目的是使造成LV流出道梗阻的近端间隔部分坏死或变薄。初步研究显示该法可使LV压力阶差下降70%,临床症状和运动耐力都明显改善。患者一般对经皮室间隔消融术具有很好的耐受性。然而,这种方法可合并院内传导异常和需要植入起博器的传导阻滞,可发生室性心律失常和死亡。它的长期效果还不清楚。经皮室间隔消融术的潜在副作用可能包括迟发性心律失常和LV功能不全,尽管这些合并症还未见报道。
, 百拇医药
所有这些方法都不能预防猝死。它们的主要目的是缓解症状并改善运动耐力。这些方法并不相互排斥。因此,DDD起博无效的患者可行心脏手术治疗。同样,已进行了心脏手术治疗的HCM患者,如果还有梗阻症状,亦可成功地运用DDD起博治疗。
结论
出现LV肥厚而无其他原因可循时常可诊断肥厚型心肌病。然而,人们越来越认识到这个术语包含了许多不同的、具有特定表型的遗传病。有些病例,病变可同时累及骨骼肌和心脏。其基因型也常决定其外显率、严重性和LV肥厚的分布及预后。危险性评估研究可使我们进一步认识晕厥和猝死的潜在机制。许多新奇的治疗方法尚在评价之中,它们可能有助于缓解症状和改善预后。
张清芬 译 宋光耀 郭艺芳 校
JAMA,1999;281:1746~1752, 百拇医药