重组睫状神经营养因子对大鼠反应性胶质化的影响
作者:林江凯 蔡文琴 范明
单位:林江凯(第三军医大学基础医学部组织学与胚胎学教研室,重庆400038);蔡文琴(第三军医大学基础医学部组织学与胚胎学教研室,重庆400038);范明(军事医学科 学院基础所,北京100850)
关键词:睫状神经营养因子;胶质化;脑损伤;胶质 纤维酸性蛋白
第三军医大学学报000217
提要 目的:探讨睫状神经营养因子(CNTF)对反应性胶 质化的影响。方法:应用大鼠脑顶叶刺伤模型,将动物分为3组。对照组:刺伤后即原位注射生理盐水 10μl;小剂量组:刺伤后即原位注射0.1g/L CNTF 1μg;大剂量组:刺伤后即原位注射1g/L CNTF 10μg,分别于伤后 1、2、7周灌注活杀大鼠,胶质纤维酸性蛋白(GFAP)免疫 组织化学染色。结果:对照组1周时伤道及附近GFAP染 色增强,星形胶质细胞数目和突起数及突起长度增加,胞体增大,胞浆丰富;2周时,上述变化仍明显 ,开始形成胶质瘢痕;7周时有较明显的胶质瘢痕形成;给予CNTF各时间点上述变化均较对照组明显,大剂量组胶质变化较小剂量组更显著。结论:CNTF具有 促进胶质化形成的作用。
, http://www.100md.com
中图法分类号 R394.2;R745.02 文献标识码A
文章编号:1000-5404(2000)02-0156-04
Effects of recombinant ciliary neurotrophic factor on reactive gliosis in rats
LIN Jiang-kai,CAI Wen-qin, FAN Ming
(Department of Histology and Embryology, Third Military Medical University,Chongqing 400038)
Abstract Objective: To investigate the effects of recombinant ciliary neurotrophic factor (CNTF) on gliosis. Methods: After the model of brain stab wound in parietal lobe was established in rats, the animals were randomized into the control group, 1 μg group and 10 μg group. The rats in the control group were injected with 10 μ l normal saline and those in 1ug and 10 μg groups were injected with CNTF at 1 μg/10 μ l and 10 μg/10 μ l respectively. Then the rats were sacrificed in 1,2 and 7 weeks following the injury for immunohistochemistry of GFAP. Results: The hypertrophy and hyperplasia of GFAP(+) glial cells in and around the wound were more significant and lasted longer in 1 μ g and 10 μg groups than in the control. The formation of glial scar began at the 2nd week. Furthermore, gliosis was more remarkable in 10 μg group than in 1 μg group. Conclusion: CNTF can enhance the formation of gliosis.
, 百拇医药
Key words CNTF; gliosis; brain injury; GFAP
胶质化表现为胶质细胞的增生和肥大。如果刺激持 续存在或刺激有足够强度,一定时期以后,胶质化 组织演变成致密的胶质瘢痕,从而阻碍神经元的神 经元的再生[1]。睫状神经营养因子(Ciliary neurotrophic factor,CNTF)是从E8鸡眼分离出的一种特异蛋白,因能维 持培养的睫状节神经细胞的存活而命名,有广泛的 生理作用[2]。一些研究表明CNTF可促进脊髓和周围神经 损伤后轴索生长。CNTF为25×103u的多肽,存在于中枢神 经系统的星形胶质细胞和周围神经系统的雪旺氏细 胞,在神经系统的分布不均,在嗅球、视神经和脑 干较丰富,与白血病抑制因子(Leukemia inhibitory factor,LIF) 属同一家族,共享两个信号转导β成份gp130和LIFR-β受体,其特异性受体即配体结合α-成份为跨膜亚单位CNTFR-α[3]。有关CNTF与胶质化关系的研究 的相关报道较少。
, http://www.100md.com
1 材料和方法
1.1 动物模型与分组
健康Wistar大鼠27只,体重140~160g,雌雄不拘,随机分 为对照组、小剂量组和大剂量组,每组9只。腹腔注 射3%戊巴比妥钠30mg/kg麻醉,固定于江湾立体定位仪上。左顶头皮切口,直径2mm牙科钻钻孔,坐标为前囟后4mm,矢状线旁2.5mm,穿刺针垂直刺入4mm,留针30s后 拔除,立即伤道内注入生理盐水或CNTF(军事医学科 学院范明提供)。其中对照组注入生理盐水10μl,小剂量组注入0.1g/LCNTF1μg,大剂量组注入1g/LCNTF10μg。 注射时间为5min,缓慢拔针。拔针后严密缝合头皮。上述操作均严格无菌。
1.2免疫组织化学检测
按蔡文琴方法[4]进行。SP-9002试剂盒购自中山公司 。分别于伤后1、2、7周灌注(先0.9%生理盐水250ml,后 Zamboni's液200ml)活杀大鼠,取脑,后固定6h修块。2d内 冰冻切片,厚30μm,0.01mol/LPBS漂洗5min×3次,3%H2O215min, 0.01mol/LPBS漂洗5min×3次,置1%牛血清白蛋白与Triton37℃ 孵育30min,1∶100anti-GFAP(重庆医科大学)37℃孵育3h,0.01 mol/LPBS漂洗10min×3次,1∶100二抗37℃孵育2h,0.01mol/LPBS漂 洗5min×3次,1∶100三抗37℃孵育1h,0.01mol/LPBS漂洗5min×3次 。0.05%DAB/0.05mol/LTris-HCl/0.05%H2O2显色,60°C烘烤5h,100% 乙醇10min×2次,二甲苯透明,DPX封片。
, 百拇医药
1.3 图像分析
920GTIGER图像分析仪分析单位面积胶质纤维酸性蛋白(Glial fibrillary acidic protein,GFAP)阳性细胞积分光密度(Integral opticdensity,IOD)。
1.4 统计学方法
数据以 ±s表示,利用Excel行两样本均数的t检验, P<0.05和P<0.01代表相差显著和相差非常显著。
±s表示,利用Excel行两样本均数的t检验, P<0.05和P<0.01代表相差显著和相差非常显著。
2 结果
对照组1周时伤道及附近染色增强,星形胶质细胞 数目和突起数及突起长度增加,胞体增大,胞浆丰富;2周时,上述变化仍明显,胶质突起开始交织成 网状,逐渐形成胶质瘢痕;7周时有较明显的胶质瘢痕。给予CNTF后,各时间点上述变化均较对照组明显,大剂量组胶质变化较小剂量组更显著,且伤侧胶质化持续存在,时间延长,并影响到对侧大脑半球,见表1、图1~4。
, http://www.100md.com
表1 各组GFAP积分光密度比较
Tab1 Comparison of IOD among groups
1st week
2nd week
Control
68.3±22.2
109.9±8.1
Small dosage
146.7±17.2*
181.0±33.3**
, http://www.100md.com
Large dosage
338.7±55.9*★
368.0±90.6**★
*:P<0.05,**:P<0.01 vs control;★:P<0.05 vs snall dosage

图1 大剂量组第1周时伤侧皮质GFAP表现(S-P×400)
Fig1 GFAP staining around injured cortex of large dosage group at 1st week(S-P×400)

, 百拇医药
图2 小剂量组第1周时伤侧皮质GFAP表现(S-P×200)
Fig2 GFAP staining around injured cortex of small dosage group at 1st week(S-P×200)

图3 大剂量组第2周时伤侧皮质GFAP表现(S-P×400)
Fig3 GFAP staining in injured cortex of large dosage group at 2nd week(S-P×400)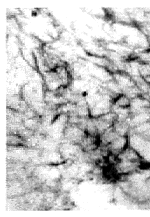

, http://www.100md.com
图4 对照组第2周时伤侧皮质GFAP表现(S-P×200)
Fig4 GFAP staining in injured corex of control group at 2nd week(S-P×200)
3 讨论
本实验模型为破坏性损伤,刺激强烈,实验结果显 示较广泛的胶质化和胶质瘢痕形成。在此模型基础 上局部给予重组CNTF,发现胶质化明显增强,即GFAP免疫组化染色时,伤道附近星形胶质细胞数目增加,细胞胞体增大,突起变粗大且延长,免疫染色加深 。这与以前报道的结论一致[5]。CNTF为神经营养因子,具有神经营养作用。但在胶质化过程中,我们的实 验表明它也具有促进胶质化的作用,表现为典型的 星形胶质细胞肥大和增生,后期形成胶质瘢痕。
CNTF促进胶质细胞肥大。胶质化本身是神经系统对于 外来刺激的防御性反应,在没有任何伤害时,即单 纯的神经元活动增强足以引起星形胶质细胞肿胀。脑损伤时胶质细胞肿大是其早期的突出表现,增大 的细胞常持续数天到数周。一些细胞因子可能参与了这一过程。由于胶质细胞表现为内向的钾通道,细胞外钾浓度增加引起钾内流入星形胶质细胞导致 细胞内渗透性升高和细胞肿胀。损伤后神经元不能 维持其膜电位,导致钾积聚在细胞外。另外损伤的 神经元大量释放兴奋性氨基酸谷氨酸,星形胶质细胞摄取谷氨酸,谷氨酸激活胶质代谢营养性的谷氨 酸受体从而增加钾、钠、氯流入星形胶质细胞,星形胶质细胞肿胀。离子共转运子(Cotransporter)和交换 子(Exchanger)的激活,也可导致胶质肿胀。随肿胀时间的延长,星形细胞为适应损害而增加其功能,表现为细胞肥大[6]。
, 百拇医药
CNTF促进胶质细胞增生。体外实验已发现CNTF能增强无营养因子支持的非成熟及成熟少突胶质细胞的生存 ,还增强O-2A祖细胞GFAP表达。CNTF作为前炎性因子激活 静息星形胶质细胞变为反应性星形胶质细胞,从而 引起星形胶质细胞的增生性反应[3]。CNTF不是由健康细 胞所分泌,CNTFmRNA在正常大鼠中枢神经系统水平很低 ,对正常的发育、生存并非必需。一旦损伤发生, 可能存在于健康细胞内的CNTF序列作为损伤信号释放 ,刺激邻近的胶质细胞,保护神经元[7]。
CNTF促进胶质化的可能途径。本实验给予外源性的 CNTF,其作用途径可能为外源性的CNTF与CNTF特异性受体 CNTFR-α结合,激活核内多种信号转导通路,引起基 因的表达[6]。CNTF引起胶质化可能通过两条途径,一是间接途径,即通过刺激小胶质细胞和星形胶质细胞 释放可溶性因子作用于临近的细胞群,这些因子如IL-1、TNF-α、IL-6、TGF-β等引起胶质化;二是直接途径,即结合未成熟胶质细胞表面受体直接调节GFAP的 合成[8]。
, http://www.100md.com
局部给予CNTF影响对侧大脑半球。本实验还发现伤灶 局部给予CNTF后星形胶质细胞肥大的时间延长,而且 在对侧大脑半球区域如新皮质、海马、基底节的星 形胶质细胞肥大,GFAP染色加深。其原因可能是:① 注射入伤道的重组CNTF自蛛网膜下腔或脑室系统影响 到对侧半球;②脑水肿和胶质细胞的分布的差别;③Kahn[8]认为,星形胶质细胞通过缝隙连接的细胞间 通讯。GFAP阳性细胞形成的紧密网络可能涉及到通过 缝隙连接(Gapjunction)的离子和代谢联接,通过这种 方式一侧半球的反应性星形胶质细胞与远离损伤脑 区的未成熟星形胶质细胞通讯;④还有一可能的解 释是神经元而不是胶质通讯网络发送了越过大脑半 球的信号。
Levison[7]利用免疫组化发现GFAP、vimentin、GST(谷胱肝肽-S-转移酶)Yp、S-100等蛋白和OX-42在48h升高。且增生的细胞增加了2倍,作者根据以上胶质细胞基因表达 和细胞增生结果认为CNTF从多方面诱导胶质化。OX-42是小胶质细胞的标志分子,其数量增加可能是CNTF对小胶质细胞的趋化作用。中间丝GFAP和波形蛋白作为主 要的细胞骨架蛋白显著上调,导致胶质瘢痕的形成 [7]。在CNTF的表达环节或作用途径上的适当介入,是否有望减轻脑损伤后的胶质化反应和胶质瘢痕形成尚 需进一步的研究。
, 百拇医药
作者简介:林江凯(1964.4),男,湖北省浠水县人,博 士,主治医师,讲师,主要从事神经胶质与神经再生方面的研究, 发表论文15篇。电话:(023)68752229
参考文献
[1]Ridet J L, S K Malhotra, A Privat, et al. Reactive astrocytes: cellular and molecular cues to biological function[J]. TINS,1997,20(12);570- 577.
[2]Hibi M, Nakajima K,Hirano-T. IL-6 cytokine family and signal transduction: A model of the cytokine system[J]. J Mol Med,1996,74(1): 1-12.
, 百拇医药
[3]Frostick S P, Frcs D M, Yin Q I. Schwann cells, neurotrophic factors, and peripheral nerve regeneration[J]. Microsurgery, 1998,18(7):397- 405.
[4]蔡文琴,王伯沄.实用免疫组织化学与核酸分子杂交技术[M].成都.四川科学技术出版社,1994,119-130.
[5]Winter C G, Saotome Y, Levison S W, et al. A role for ciliary neurotrophic factor as an inducer of reactive gliosis, the glial response to central nervous system injury[J]. Proc Natl Acad Sci USA,1995,92(13):5 865-5 869.
, 百拇医药
[6]Hudgins S N, Levison S W. Ciliary neurotrophic factor stimulates astroglial hypertrophy in vivo and vitro[J]. Exp Neurol,1998,150:171-182.
[7]Levison S W, Ducceschi M H, Young G M, et al. Acute expo-sure to CNTF in vivo i nduces multiple components of reactive gliosis[J]. Exp Neurol,1996,141(2):256-268.
[8]Kahn M A, Ellison J A, Speight G J, et al. CNTF regulation of astrogliosis and the activation of microglia in the developing rat central nervous system[J]. Brain Res,1995,685(1-2):55-56.
收稿日期:1999-09-29;修回日期:1999-12-22, 百拇医药
单位:林江凯(第三军医大学基础医学部组织学与胚胎学教研室,重庆400038);蔡文琴(第三军医大学基础医学部组织学与胚胎学教研室,重庆400038);范明(军事医学科 学院基础所,北京100850)
关键词:睫状神经营养因子;胶质化;脑损伤;胶质 纤维酸性蛋白
第三军医大学学报000217
提要 目的:探讨睫状神经营养因子(CNTF)对反应性胶 质化的影响。方法:应用大鼠脑顶叶刺伤模型,将动物分为3组。对照组:刺伤后即原位注射生理盐水 10μl;小剂量组:刺伤后即原位注射0.1g/L CNTF 1μg;大剂量组:刺伤后即原位注射1g/L CNTF 10μg,分别于伤后 1、2、7周灌注活杀大鼠,胶质纤维酸性蛋白(GFAP)免疫 组织化学染色。结果:对照组1周时伤道及附近GFAP染 色增强,星形胶质细胞数目和突起数及突起长度增加,胞体增大,胞浆丰富;2周时,上述变化仍明显 ,开始形成胶质瘢痕;7周时有较明显的胶质瘢痕形成;给予CNTF各时间点上述变化均较对照组明显,大剂量组胶质变化较小剂量组更显著。结论:CNTF具有 促进胶质化形成的作用。
, http://www.100md.com
中图法分类号 R394.2;R745.02 文献标识码A
文章编号:1000-5404(2000)02-0156-04
Effects of recombinant ciliary neurotrophic factor on reactive gliosis in rats
LIN Jiang-kai,CAI Wen-qin, FAN Ming
(Department of Histology and Embryology, Third Military Medical University,Chongqing 400038)
Abstract Objective: To investigate the effects of recombinant ciliary neurotrophic factor (CNTF) on gliosis. Methods: After the model of brain stab wound in parietal lobe was established in rats, the animals were randomized into the control group, 1 μg group and 10 μg group. The rats in the control group were injected with 10 μ l normal saline and those in 1ug and 10 μg groups were injected with CNTF at 1 μg/10 μ l and 10 μg/10 μ l respectively. Then the rats were sacrificed in 1,2 and 7 weeks following the injury for immunohistochemistry of GFAP. Results: The hypertrophy and hyperplasia of GFAP(+) glial cells in and around the wound were more significant and lasted longer in 1 μ g and 10 μg groups than in the control. The formation of glial scar began at the 2nd week. Furthermore, gliosis was more remarkable in 10 μg group than in 1 μg group. Conclusion: CNTF can enhance the formation of gliosis.
, 百拇医药
Key words CNTF; gliosis; brain injury; GFAP
胶质化表现为胶质细胞的增生和肥大。如果刺激持 续存在或刺激有足够强度,一定时期以后,胶质化 组织演变成致密的胶质瘢痕,从而阻碍神经元的神 经元的再生[1]。睫状神经营养因子(Ciliary neurotrophic factor,CNTF)是从E8鸡眼分离出的一种特异蛋白,因能维 持培养的睫状节神经细胞的存活而命名,有广泛的 生理作用[2]。一些研究表明CNTF可促进脊髓和周围神经 损伤后轴索生长。CNTF为25×103u的多肽,存在于中枢神 经系统的星形胶质细胞和周围神经系统的雪旺氏细 胞,在神经系统的分布不均,在嗅球、视神经和脑 干较丰富,与白血病抑制因子(Leukemia inhibitory factor,LIF) 属同一家族,共享两个信号转导β成份gp130和LIFR-β受体,其特异性受体即配体结合α-成份为跨膜亚单位CNTFR-α[3]。有关CNTF与胶质化关系的研究 的相关报道较少。
, http://www.100md.com
1 材料和方法
1.1 动物模型与分组
健康Wistar大鼠27只,体重140~160g,雌雄不拘,随机分 为对照组、小剂量组和大剂量组,每组9只。腹腔注 射3%戊巴比妥钠30mg/kg麻醉,固定于江湾立体定位仪上。左顶头皮切口,直径2mm牙科钻钻孔,坐标为前囟后4mm,矢状线旁2.5mm,穿刺针垂直刺入4mm,留针30s后 拔除,立即伤道内注入生理盐水或CNTF(军事医学科 学院范明提供)。其中对照组注入生理盐水10μl,小剂量组注入0.1g/LCNTF1μg,大剂量组注入1g/LCNTF10μg。 注射时间为5min,缓慢拔针。拔针后严密缝合头皮。上述操作均严格无菌。
1.2免疫组织化学检测
按蔡文琴方法[4]进行。SP-9002试剂盒购自中山公司 。分别于伤后1、2、7周灌注(先0.9%生理盐水250ml,后 Zamboni's液200ml)活杀大鼠,取脑,后固定6h修块。2d内 冰冻切片,厚30μm,0.01mol/LPBS漂洗5min×3次,3%H2O215min, 0.01mol/LPBS漂洗5min×3次,置1%牛血清白蛋白与Triton37℃ 孵育30min,1∶100anti-GFAP(重庆医科大学)37℃孵育3h,0.01 mol/LPBS漂洗10min×3次,1∶100二抗37℃孵育2h,0.01mol/LPBS漂 洗5min×3次,1∶100三抗37℃孵育1h,0.01mol/LPBS漂洗5min×3次 。0.05%DAB/0.05mol/LTris-HCl/0.05%H2O2显色,60°C烘烤5h,100% 乙醇10min×2次,二甲苯透明,DPX封片。
, 百拇医药
1.3 图像分析
920GTIGER图像分析仪分析单位面积胶质纤维酸性蛋白(Glial fibrillary acidic protein,GFAP)阳性细胞积分光密度(Integral opticdensity,IOD)。
1.4 统计学方法
数据以
 ±s表示,利用Excel行两样本均数的t检验, P<0.05和P<0.01代表相差显著和相差非常显著。
±s表示,利用Excel行两样本均数的t检验, P<0.05和P<0.01代表相差显著和相差非常显著。2 结果
对照组1周时伤道及附近染色增强,星形胶质细胞 数目和突起数及突起长度增加,胞体增大,胞浆丰富;2周时,上述变化仍明显,胶质突起开始交织成 网状,逐渐形成胶质瘢痕;7周时有较明显的胶质瘢痕。给予CNTF后,各时间点上述变化均较对照组明显,大剂量组胶质变化较小剂量组更显著,且伤侧胶质化持续存在,时间延长,并影响到对侧大脑半球,见表1、图1~4。
, http://www.100md.com
表1 各组GFAP积分光密度比较
Tab1 Comparison of IOD among groups
1st week
2nd week
Control
68.3±22.2
109.9±8.1
Small dosage
146.7±17.2*
181.0±33.3**
, http://www.100md.com
Large dosage
338.7±55.9*★
368.0±90.6**★
*:P<0.05,**:P<0.01 vs control;★:P<0.05 vs snall dosage


图1 大剂量组第1周时伤侧皮质GFAP表现(S-P×400)
Fig1 GFAP staining around injured cortex of large dosage group at 1st week(S-P×400)


, 百拇医药
图2 小剂量组第1周时伤侧皮质GFAP表现(S-P×200)
Fig2 GFAP staining around injured cortex of small dosage group at 1st week(S-P×200)


图3 大剂量组第2周时伤侧皮质GFAP表现(S-P×400)
Fig3 GFAP staining in injured cortex of large dosage group at 2nd week(S-P×400)


, http://www.100md.com
图4 对照组第2周时伤侧皮质GFAP表现(S-P×200)
Fig4 GFAP staining in injured corex of control group at 2nd week(S-P×200)
3 讨论
本实验模型为破坏性损伤,刺激强烈,实验结果显 示较广泛的胶质化和胶质瘢痕形成。在此模型基础 上局部给予重组CNTF,发现胶质化明显增强,即GFAP免疫组化染色时,伤道附近星形胶质细胞数目增加,细胞胞体增大,突起变粗大且延长,免疫染色加深 。这与以前报道的结论一致[5]。CNTF为神经营养因子,具有神经营养作用。但在胶质化过程中,我们的实 验表明它也具有促进胶质化的作用,表现为典型的 星形胶质细胞肥大和增生,后期形成胶质瘢痕。
CNTF促进胶质细胞肥大。胶质化本身是神经系统对于 外来刺激的防御性反应,在没有任何伤害时,即单 纯的神经元活动增强足以引起星形胶质细胞肿胀。脑损伤时胶质细胞肿大是其早期的突出表现,增大 的细胞常持续数天到数周。一些细胞因子可能参与了这一过程。由于胶质细胞表现为内向的钾通道,细胞外钾浓度增加引起钾内流入星形胶质细胞导致 细胞内渗透性升高和细胞肿胀。损伤后神经元不能 维持其膜电位,导致钾积聚在细胞外。另外损伤的 神经元大量释放兴奋性氨基酸谷氨酸,星形胶质细胞摄取谷氨酸,谷氨酸激活胶质代谢营养性的谷氨 酸受体从而增加钾、钠、氯流入星形胶质细胞,星形胶质细胞肿胀。离子共转运子(Cotransporter)和交换 子(Exchanger)的激活,也可导致胶质肿胀。随肿胀时间的延长,星形细胞为适应损害而增加其功能,表现为细胞肥大[6]。
, 百拇医药
CNTF促进胶质细胞增生。体外实验已发现CNTF能增强无营养因子支持的非成熟及成熟少突胶质细胞的生存 ,还增强O-2A祖细胞GFAP表达。CNTF作为前炎性因子激活 静息星形胶质细胞变为反应性星形胶质细胞,从而 引起星形胶质细胞的增生性反应[3]。CNTF不是由健康细 胞所分泌,CNTFmRNA在正常大鼠中枢神经系统水平很低 ,对正常的发育、生存并非必需。一旦损伤发生, 可能存在于健康细胞内的CNTF序列作为损伤信号释放 ,刺激邻近的胶质细胞,保护神经元[7]。
CNTF促进胶质化的可能途径。本实验给予外源性的 CNTF,其作用途径可能为外源性的CNTF与CNTF特异性受体 CNTFR-α结合,激活核内多种信号转导通路,引起基 因的表达[6]。CNTF引起胶质化可能通过两条途径,一是间接途径,即通过刺激小胶质细胞和星形胶质细胞 释放可溶性因子作用于临近的细胞群,这些因子如IL-1、TNF-α、IL-6、TGF-β等引起胶质化;二是直接途径,即结合未成熟胶质细胞表面受体直接调节GFAP的 合成[8]。
, http://www.100md.com
局部给予CNTF影响对侧大脑半球。本实验还发现伤灶 局部给予CNTF后星形胶质细胞肥大的时间延长,而且 在对侧大脑半球区域如新皮质、海马、基底节的星 形胶质细胞肥大,GFAP染色加深。其原因可能是:① 注射入伤道的重组CNTF自蛛网膜下腔或脑室系统影响 到对侧半球;②脑水肿和胶质细胞的分布的差别;③Kahn[8]认为,星形胶质细胞通过缝隙连接的细胞间 通讯。GFAP阳性细胞形成的紧密网络可能涉及到通过 缝隙连接(Gapjunction)的离子和代谢联接,通过这种 方式一侧半球的反应性星形胶质细胞与远离损伤脑 区的未成熟星形胶质细胞通讯;④还有一可能的解 释是神经元而不是胶质通讯网络发送了越过大脑半 球的信号。
Levison[7]利用免疫组化发现GFAP、vimentin、GST(谷胱肝肽-S-转移酶)Yp、S-100等蛋白和OX-42在48h升高。且增生的细胞增加了2倍,作者根据以上胶质细胞基因表达 和细胞增生结果认为CNTF从多方面诱导胶质化。OX-42是小胶质细胞的标志分子,其数量增加可能是CNTF对小胶质细胞的趋化作用。中间丝GFAP和波形蛋白作为主 要的细胞骨架蛋白显著上调,导致胶质瘢痕的形成 [7]。在CNTF的表达环节或作用途径上的适当介入,是否有望减轻脑损伤后的胶质化反应和胶质瘢痕形成尚 需进一步的研究。
, 百拇医药
作者简介:林江凯(1964.4),男,湖北省浠水县人,博 士,主治医师,讲师,主要从事神经胶质与神经再生方面的研究, 发表论文15篇。电话:(023)68752229
参考文献
[1]Ridet J L, S K Malhotra, A Privat, et al. Reactive astrocytes: cellular and molecular cues to biological function[J]. TINS,1997,20(12);570- 577.
[2]Hibi M, Nakajima K,Hirano-T. IL-6 cytokine family and signal transduction: A model of the cytokine system[J]. J Mol Med,1996,74(1): 1-12.
, 百拇医药
[3]Frostick S P, Frcs D M, Yin Q I. Schwann cells, neurotrophic factors, and peripheral nerve regeneration[J]. Microsurgery, 1998,18(7):397- 405.
[4]蔡文琴,王伯沄.实用免疫组织化学与核酸分子杂交技术[M].成都.四川科学技术出版社,1994,119-130.
[5]Winter C G, Saotome Y, Levison S W, et al. A role for ciliary neurotrophic factor as an inducer of reactive gliosis, the glial response to central nervous system injury[J]. Proc Natl Acad Sci USA,1995,92(13):5 865-5 869.
, 百拇医药
[6]Hudgins S N, Levison S W. Ciliary neurotrophic factor stimulates astroglial hypertrophy in vivo and vitro[J]. Exp Neurol,1998,150:171-182.
[7]Levison S W, Ducceschi M H, Young G M, et al. Acute expo-sure to CNTF in vivo i nduces multiple components of reactive gliosis[J]. Exp Neurol,1996,141(2):256-268.
[8]Kahn M A, Ellison J A, Speight G J, et al. CNTF regulation of astrogliosis and the activation of microglia in the developing rat central nervous system[J]. Brain Res,1995,685(1-2):55-56.
收稿日期:1999-09-29;修回日期:1999-12-22, 百拇医药