大鼠局部脑缺血后NADPH-d神经元的变化
作者:史树贵 邵淑琴
单位:史树贵(第三军医大学附属西南 医院神经内科,重庆400038);邵淑琴(第三军医大学附属西南 医院神经内科,重庆400038);陈康宁(第三军医大学附属西南 医院神经内科,重庆400038)
关键词:脑缺血;一氧化氮;一氧化氮合酶;NADPH黄递 酶;大鼠
第三军医大学学报000206
提要 目的:观察缺血性脑损害中一氧化氮合酶(NOS)神经元的变化规律,探讨一氧化氮(NO)参与缺血性脑损 害的机制。方法:采用组织化学染色方法观察大鼠 局灶性脑缺血后尼克酰胺腺啶呤二核苷酸磷酸黄递 酶(NADPH-d)阳性神经元的变化规律。结果:大鼠局灶性 脑缺血后NADPH-d阳性神经元明显增加,缺血2h后出现形 态学改变,且以细胞皱缩、胞浆致密为主要死亡方 式。结论:NADPH-d阳性神经元对缺血性损害相对耐受,细胞凋亡可能为其主要死亡方式。
, http://www.100md.com
中图法分类号R743.31 文献标识码A
文章编号:1000-5404(2000)02-0119-04
Changes of NADPHd neurons after focal cerebral ischemia in rats
SHI Shu-gui, SHAO Shu-qin, CHEN Kang-nin
(Department of Neurology, Southwest Hospital, Third Military Medical University, Chongqing 400038)
Abstract Objective: To investigate the changes of NOS-positive neurons following focal cerebral ischemia. Methods: Focal cerebral ischemia was induced in adult Wistar rats with occlusion of right middle cerebral artery. NADPH-diaphorase histochemistry was used to observe the changes of NOS-positive neurons. Results: After ischemia, the number of NOS-positive neurons in the foci was significantly increased and the neurons began to present morphological changes in 2 h after the ischemia. Conclusion: NOS-positive cells are relatively tolerate to ischemic damage and apoptosis is the major manner of their death.
, 百拇医药
Key words cerebral ischemia; NO; rat
一氧化氮(Nitricoxide,NO)是具有广泛生物活性的生物介质,由一氧化氮合酶(Nitric oxide synthase,NOS)催化L-精氨酸氧化生成,参与调节神经元传递、血管扩张和免疫 系统中细胞之间的相互作用。NOS由神经元性NOS(nNOS)、内皮性NOS(eNOS)、诱生性NOS(iNOS)3种存在方式,其表达生成 的NO在神经系统中发挥不同作用。全脑和局部脑缺血 后NOS活性增加并参与缺血性脑损伤已被公认[1,2],但 表达NOS的神经元对缺血性损伤的反应如何,目前少有 文献报道。本研究通过观察大鼠局部脑缺血后尼克 酰胺腺嘌呤二核苷酸磷酸黄递酶(Nicotinamide adenine dinucleotide phosphate-diaphorase,NADPH-d)阳性神经元形态学改变,对此 进行了研究。现报告如下:
1 材料与方法
, 百拇医药
1.1 动物模型及分组
雄性Wistar大鼠,体重280~300g,右侧大脑中动脉闭塞脑缺血模型和入组标准均按我们既往的方法进行[3],设假手术组(分离大鼠右侧颈总、颈内及颈外动脉,结扎颈外动脉并剪断,自颈外动脉残端放入线栓5mm,不堵塞大脑中动脉起始部)、缺血30min、2h、6h、24h、4 d组。
1.2 NADPH-d组化染色
动物经4%多聚甲醛灌注固定,取脑,20%蔗糖浸泡 过夜,冰冻切片厚20μm,0.1mol/LPBS漂洗,0.3%TritonX-100的 PBS孵育后取出加入含0.1mg/mlNBT和1.0mg/mlNADPH-d的作用液 中,37℃孵育45min,终止染色。
1.3 常规病理切片
脑组织灌注固定后石蜡包埋,切片厚7μm,HE染色。
, 百拇医药
2 结果
对照组:缺血对侧及假手术组均可见少量NADPH-d阳 性神经元,这些神经元随机分布于皮层区,可见一 些神经元的突触末梢与血管壁紧密相连。NADPH-d神经 元为非锥体的双极或多极神经元,胞膜平滑,带有 较长的突起,连续性好;由于NOS主要在胞浆表达,因 此可见中心淡染区或透亮区,见图1。在海马,NADPH-d阳性神经元为一些较小的中间神经元,有多个突起 ,主要位于齿状回颗粒细胞层的内带,在纹状体区 为大的多极细胞,其密度超过皮层的阳性细胞。



图1 假手术组,皮层区NADPH-d神经元胞膜光滑,中心有淡染区,突起连续性好(×200)
, http://www.100md.com
Fig1 NADPH-d positive neurons with smooth cytomembrane,central light staining and consecutive processes in the cortex of control(×200)
缺血30min:缺血区NADPH-d阳性神经元表达明显增多, 细胞形态变化不明显,HE染色可见细胞轻度水肿,血 管周隙改变不明显。
缺血2h:病灶区NADPH-d阳性细胞皱缩,胞浆浓缩致 密,部分细胞中心淡染区消失,胞膜失去其平滑的 外形而变得隆凸不平,神经突起断裂、卷曲、螺旋 状改变,突触小体扩张,碎裂,上述变化主要发生 于纹状体外侧及前额叶皮层,海马神经元无明显受 累。HE染色可见细胞水肿加重,血管周围间隙增大。
缺血6h:病灶中心NADPH-d阳性神经元明显致密,绝 大多数神经元突起断裂,部分突起球形肿胀,神经 末梢呈雾状,病灶周边区神经元胞浆轻度致密,突 起断裂,见图2;HE染色示病灶中心重度水肿,血管周 围间隙明显增大,其中可见白细胞浸润、红细胞漏 出。



, http://www.100md.com
图2 缺血6h,病灶中心NADPH-d阳性神经元胞浆凝集,胞膜隆凸,突起卷曲断裂(×200)
Fig2 Post-ischemia 6h:NADPH-d positive cells with knobby perikaryon,prominent cytomembrane and twist fragment dendrites(×200)
缺血24h:NADPH-d阳性神经元胞浆进一步致密,突起 断裂甚至完全消失,个别视野可见NADPH-d阳性神经元 正在解体,见图3。HE染色可见病灶中心坏死,细胞结构模糊不清。



, 百拇医药
图3 缺血24h,NADPH-d阳性细胞胞浆进一步致密,突起消失,其中可见细胞正在解体(×400)
Fig3 Post-ischemia 24h:NADPH-d positive cells with more densed perikaryon and without processes,cells are vanishing(×400)
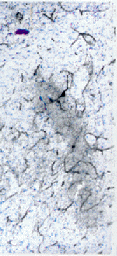
缺血4d:病灶中心明显坏死,在病灶周边区域可见 胶质细胞反应性增生,毛细血管扩张,内皮细胞、小胶质细胞均可见NADPH-d阳性反应,见图4。


, http://www.100md.com
图4 缺血4d,病灶周围NADPH-d阳性细胞胞浆致密,突起卷曲断裂,血管壁染色大量增加(×100)
Fig4 Post-ischemia 4d:NADPH-d positive cells with cornpacted perikaryon and twist fragment dendrites,heavy staining for uessel wall around ischemic center(×100)
3 讨论
3.1 NO参与缺血性神经元死亡
全脑和局部脑缺血NOS表达和NO生成增加已有许多文 献报道,nNOS表达所生成的NO激活NMDA受体从而引起兴奋 毒性,是导致缺血早期细胞死亡的主要原因,eNOS表 达产生的NO通过增加rCBF而减轻缺血性脑损害,具有脑 保护作用;iNOS表达生成的NO引起迟发性细胞死亡[4]。 此外,我们早期的研究还发现,NOS表达与脑缺血后细 胞凋亡密切相关[3]。各种NOS的抑制剂或供体目前已被 用于治疗缺血性中风患者。但是,NOS阳性神经元对缺 血的反应直接影响到上述药物的应用。例如,表达 nNOS和iNOS的神经元所生成的NO具有细胞毒性作用,但这 种作用将持续多久,其本身是否受损及以何种方式 死亡;eNOS表达具有脑保护作用,但表达eNOS的细胞本 身可能因缺血性损害而死亡等,目前未见系统报道[5]。由于NOS与NADPH-d活性在CNS中100%共存,且NADPH-d组 织化学方法能清楚显示细胞形态,因此,我们采用 NADPH-d组织化学方法代表中枢神经系统中NOS活性具有 良好的可行性。
, http://www.100md.com
3.2 NADPH-d阳性神经元对缺血的耐受性
脑缺血后NOS表达上调,生成NO大量增加,由于NO脂溶 性极强,因此迅速扩散到临近细胞,通过激活NMDA受 体产生兴奋毒性使细胞死亡,但NOS神经元本身对缺血 性损害具有耐受性。NO在损伤临近细胞之前为什么不 损伤NOS自身细胞,以及NOS神经元的耐受性能持续多久,目前尚不明了。本研究发现,大鼠局部脑缺血后 NADPH-d神经元除数量上增加外,在形态学上随着缺血 时间延长发生了改变,主要表现为胞浆逐渐致密, 胞膜逐渐失去其平滑的外形而变得凸凹不平,随着 缺血进一步加重,胞浆进一步致密、细胞突起断裂 、解体,最终整个细胞皱缩消失。这些细胞的死亡 高峰在缺血后24h为甚,在病灶中心和周边区均可见 。说明NOS神经元对缺血易损,这种易损性迟发于细胞 坏死,因为缺血6h时病灶中心已有细胞坏死,但NADPH-d阳性细胞形态学上仅表现为细胞皱缩,突起卷曲断 裂。说明NOS神经元对缺血性损伤的耐受性是相对的, 可能属于迟发性神经元死亡(DND)。
, 百拇医药
文献报道脑缺血后细胞死亡有坏死和凋亡2种方式 。我们以前的研究中亦发现相似的现象,其中细胞 坏死的主要表现为早期细胞肿胀,逐渐出现胞膜破 裂,整个细胞溶解,坏死,最终被吞噬细胞吞噬; 细胞凋亡的主要表现为:胞浆致密,皱缩,逐渐消 失即细胞容积的逐渐缩小,辅以其它生化指标或药 理学指标如DNA梯等[6]。但我们观察局部脑缺血后30min至 4d,均未发现有NADPH-d阳性细胞的水肿、破裂等现象 ,相反,所有NADPH-d阳性细胞均以逐渐皱缩最终消失 。说明NOS阳性细胞的死亡方式有其独特性,尽管目前 细胞凋亡的标准尚不统一,但我们推测NADPH-d阳性细 胞的死亡方式是以细胞凋亡为主。Lei等[7]在观察局部 注射海人酸(Kainic acid)对NOS表达的影响时亦发现了相似 的现象。局部脑缺血与脑组织中局部注射海人酸的 损伤方式不同,但NADPH-d细胞的形态学改变具有惊人 的相似之处,NADPH-d细胞的上述死亡是否为各种损伤 方式的最后共同表现尚需进一步研究。细胞坏死早 期细胞肿胀的主要原因为缺血缺氧致细胞膜通透性 增加引起细胞内钠水潴留所致。NOS阳性神经元在缺血 时不发生细胞肿胀,说明这些细胞内不存在钠、水 潴留现象,也即这些细胞在缺血缺氧早期膜的通透 性不增加,这可能是NOS神经元对兴奋毒性相对耐受的 主要原因。
, 百拇医药
NOS阳性神经元对缺血耐受的原因可能有:①NOS细胞 本身对缺血缺氧不敏感,其细胞膜对Ca2+超载所致的 兴奋毒性具有抵抗能力;②NOS神经元细胞膜上不存在 NMDA受体;③由于NOS表达产生NO引发一系列继发事件导 致细胞产生耐受能力。线粒体中Mn-SOD是nNOS神经元对 毒性损伤具有选择性抵抗力的主要原因,但研究发 现线粒体Mn-SOD为NO毒性产物ONOO-攻击的主要对象[8], 可能需在ONOO-使Mn-SOD完全失活后方可启动NOS细胞的 自身伤害。NOS细胞与非NOS细胞在线粒体Mn-SOD含量上是 否存在差异目前未见报道。
基金项目:国家自然科学基金资助项目(39670269)
作者简介:史树贵(1968.11),男,云南省陆良县人,硕士,主治医师,主要从事脑血管疾病及局限性肌张力障碍方面的研究,发表论文10篇。电话:(023)68753786
, 百拇医药 参考文献
[1]Matsui T, Nagafuji T, Kumanishi T, et al. Role of nitric oxide in pathogenesis underlying ischemia cerebral damage[J]. Cell Mol Neurobiol, 1999, 19(1):177-189.
[2]Strijbos P J. Nitric oxide in cerebral ischemic neurodegeneration and excitotoxicity[J]. Crit Rev Neurobiol,1998,12(3):223-243.
[3]史树贵,邵淑琴,陈康宁.大鼠局灶性脑缺血后一氧化氮与细胞凋亡关系的研究[J].第三军医大学学报,1999,21(4):249-252.
, 百拇医药
[4]Amer F S, Dawson T M, Dawson V L. Nitric oxide synthase in models of focal ischemia[J]. Stroke,1997, 28(6):1283-1288.
[5]Rosenblum W I. A review of vasomotor responses on the surface of the mouse brain: The necessary prelude to studies using genetically manipulated mice[J]. Microcirculation, 1998, 5(2-3):129-138.
[6]Hockenbery D. Defining apoptosis [comment][see comments][J]. Am J Pathol, 1995, 146(1):16-19.
, http://www.100md.com
[7]Lei D L, Yang D L, Liu H M. Local injection of kainic acid causes widespread degeneration of NADPH-d neurons and induction of NADPH-d in neurons, endothelial cells and reactive astrocytes[J]. Brain Res, 1996,730(1):199-206.
[8]MacMillan Crow L A, Crow J P, Kerby J D, et al. Nitration and inactivation of manganese superoxide dismutase in chronic injection of human renal allografts[J]. Proc Natl Acad Sci USA,1996,93(21):11 853-11 858.
收稿日期:1999-05-25;修回日期:1999-12-28, http://www.100md.com
单位:史树贵(第三军医大学附属西南 医院神经内科,重庆400038);邵淑琴(第三军医大学附属西南 医院神经内科,重庆400038);陈康宁(第三军医大学附属西南 医院神经内科,重庆400038)
关键词:脑缺血;一氧化氮;一氧化氮合酶;NADPH黄递 酶;大鼠
第三军医大学学报000206
提要 目的:观察缺血性脑损害中一氧化氮合酶(NOS)神经元的变化规律,探讨一氧化氮(NO)参与缺血性脑损 害的机制。方法:采用组织化学染色方法观察大鼠 局灶性脑缺血后尼克酰胺腺啶呤二核苷酸磷酸黄递 酶(NADPH-d)阳性神经元的变化规律。结果:大鼠局灶性 脑缺血后NADPH-d阳性神经元明显增加,缺血2h后出现形 态学改变,且以细胞皱缩、胞浆致密为主要死亡方 式。结论:NADPH-d阳性神经元对缺血性损害相对耐受,细胞凋亡可能为其主要死亡方式。
, http://www.100md.com
中图法分类号R743.31 文献标识码A
文章编号:1000-5404(2000)02-0119-04
Changes of NADPHd neurons after focal cerebral ischemia in rats
SHI Shu-gui, SHAO Shu-qin, CHEN Kang-nin
(Department of Neurology, Southwest Hospital, Third Military Medical University, Chongqing 400038)
Abstract Objective: To investigate the changes of NOS-positive neurons following focal cerebral ischemia. Methods: Focal cerebral ischemia was induced in adult Wistar rats with occlusion of right middle cerebral artery. NADPH-diaphorase histochemistry was used to observe the changes of NOS-positive neurons. Results: After ischemia, the number of NOS-positive neurons in the foci was significantly increased and the neurons began to present morphological changes in 2 h after the ischemia. Conclusion: NOS-positive cells are relatively tolerate to ischemic damage and apoptosis is the major manner of their death.
, 百拇医药
Key words cerebral ischemia; NO; rat
一氧化氮(Nitricoxide,NO)是具有广泛生物活性的生物介质,由一氧化氮合酶(Nitric oxide synthase,NOS)催化L-精氨酸氧化生成,参与调节神经元传递、血管扩张和免疫 系统中细胞之间的相互作用。NOS由神经元性NOS(nNOS)、内皮性NOS(eNOS)、诱生性NOS(iNOS)3种存在方式,其表达生成 的NO在神经系统中发挥不同作用。全脑和局部脑缺血 后NOS活性增加并参与缺血性脑损伤已被公认[1,2],但 表达NOS的神经元对缺血性损伤的反应如何,目前少有 文献报道。本研究通过观察大鼠局部脑缺血后尼克 酰胺腺嘌呤二核苷酸磷酸黄递酶(Nicotinamide adenine dinucleotide phosphate-diaphorase,NADPH-d)阳性神经元形态学改变,对此 进行了研究。现报告如下:
1 材料与方法
, 百拇医药
1.1 动物模型及分组
雄性Wistar大鼠,体重280~300g,右侧大脑中动脉闭塞脑缺血模型和入组标准均按我们既往的方法进行[3],设假手术组(分离大鼠右侧颈总、颈内及颈外动脉,结扎颈外动脉并剪断,自颈外动脉残端放入线栓5mm,不堵塞大脑中动脉起始部)、缺血30min、2h、6h、24h、4 d组。
1.2 NADPH-d组化染色
动物经4%多聚甲醛灌注固定,取脑,20%蔗糖浸泡 过夜,冰冻切片厚20μm,0.1mol/LPBS漂洗,0.3%TritonX-100的 PBS孵育后取出加入含0.1mg/mlNBT和1.0mg/mlNADPH-d的作用液 中,37℃孵育45min,终止染色。
1.3 常规病理切片
脑组织灌注固定后石蜡包埋,切片厚7μm,HE染色。
, 百拇医药
2 结果
对照组:缺血对侧及假手术组均可见少量NADPH-d阳 性神经元,这些神经元随机分布于皮层区,可见一 些神经元的突触末梢与血管壁紧密相连。NADPH-d神经 元为非锥体的双极或多极神经元,胞膜平滑,带有 较长的突起,连续性好;由于NOS主要在胞浆表达,因 此可见中心淡染区或透亮区,见图1。在海马,NADPH-d阳性神经元为一些较小的中间神经元,有多个突起 ,主要位于齿状回颗粒细胞层的内带,在纹状体区 为大的多极细胞,其密度超过皮层的阳性细胞。




图1 假手术组,皮层区NADPH-d神经元胞膜光滑,中心有淡染区,突起连续性好(×200)
, http://www.100md.com
Fig1 NADPH-d positive neurons with smooth cytomembrane,central light staining and consecutive processes in the cortex of control(×200)
缺血30min:缺血区NADPH-d阳性神经元表达明显增多, 细胞形态变化不明显,HE染色可见细胞轻度水肿,血 管周隙改变不明显。
缺血2h:病灶区NADPH-d阳性细胞皱缩,胞浆浓缩致 密,部分细胞中心淡染区消失,胞膜失去其平滑的 外形而变得隆凸不平,神经突起断裂、卷曲、螺旋 状改变,突触小体扩张,碎裂,上述变化主要发生 于纹状体外侧及前额叶皮层,海马神经元无明显受 累。HE染色可见细胞水肿加重,血管周围间隙增大。
缺血6h:病灶中心NADPH-d阳性神经元明显致密,绝 大多数神经元突起断裂,部分突起球形肿胀,神经 末梢呈雾状,病灶周边区神经元胞浆轻度致密,突 起断裂,见图2;HE染色示病灶中心重度水肿,血管周 围间隙明显增大,其中可见白细胞浸润、红细胞漏 出。




, http://www.100md.com
图2 缺血6h,病灶中心NADPH-d阳性神经元胞浆凝集,胞膜隆凸,突起卷曲断裂(×200)
Fig2 Post-ischemia 6h:NADPH-d positive cells with knobby perikaryon,prominent cytomembrane and twist fragment dendrites(×200)
缺血24h:NADPH-d阳性神经元胞浆进一步致密,突起 断裂甚至完全消失,个别视野可见NADPH-d阳性神经元 正在解体,见图3。HE染色可见病灶中心坏死,细胞结构模糊不清。




, 百拇医药
图3 缺血24h,NADPH-d阳性细胞胞浆进一步致密,突起消失,其中可见细胞正在解体(×400)
Fig3 Post-ischemia 24h:NADPH-d positive cells with more densed perikaryon and without processes,cells are vanishing(×400)
缺血4d:病灶中心明显坏死,在病灶周边区域可见 胶质细胞反应性增生,毛细血管扩张,内皮细胞、小胶质细胞均可见NADPH-d阳性反应,见图4。




, http://www.100md.com
图4 缺血4d,病灶周围NADPH-d阳性细胞胞浆致密,突起卷曲断裂,血管壁染色大量增加(×100)
Fig4 Post-ischemia 4d:NADPH-d positive cells with cornpacted perikaryon and twist fragment dendrites,heavy staining for uessel wall around ischemic center(×100)
3 讨论
3.1 NO参与缺血性神经元死亡
全脑和局部脑缺血NOS表达和NO生成增加已有许多文 献报道,nNOS表达所生成的NO激活NMDA受体从而引起兴奋 毒性,是导致缺血早期细胞死亡的主要原因,eNOS表 达产生的NO通过增加rCBF而减轻缺血性脑损害,具有脑 保护作用;iNOS表达生成的NO引起迟发性细胞死亡[4]。 此外,我们早期的研究还发现,NOS表达与脑缺血后细 胞凋亡密切相关[3]。各种NOS的抑制剂或供体目前已被 用于治疗缺血性中风患者。但是,NOS阳性神经元对缺 血的反应直接影响到上述药物的应用。例如,表达 nNOS和iNOS的神经元所生成的NO具有细胞毒性作用,但这 种作用将持续多久,其本身是否受损及以何种方式 死亡;eNOS表达具有脑保护作用,但表达eNOS的细胞本 身可能因缺血性损害而死亡等,目前未见系统报道[5]。由于NOS与NADPH-d活性在CNS中100%共存,且NADPH-d组 织化学方法能清楚显示细胞形态,因此,我们采用 NADPH-d组织化学方法代表中枢神经系统中NOS活性具有 良好的可行性。
, http://www.100md.com
3.2 NADPH-d阳性神经元对缺血的耐受性
脑缺血后NOS表达上调,生成NO大量增加,由于NO脂溶 性极强,因此迅速扩散到临近细胞,通过激活NMDA受 体产生兴奋毒性使细胞死亡,但NOS神经元本身对缺血 性损害具有耐受性。NO在损伤临近细胞之前为什么不 损伤NOS自身细胞,以及NOS神经元的耐受性能持续多久,目前尚不明了。本研究发现,大鼠局部脑缺血后 NADPH-d神经元除数量上增加外,在形态学上随着缺血 时间延长发生了改变,主要表现为胞浆逐渐致密, 胞膜逐渐失去其平滑的外形而变得凸凹不平,随着 缺血进一步加重,胞浆进一步致密、细胞突起断裂 、解体,最终整个细胞皱缩消失。这些细胞的死亡 高峰在缺血后24h为甚,在病灶中心和周边区均可见 。说明NOS神经元对缺血易损,这种易损性迟发于细胞 坏死,因为缺血6h时病灶中心已有细胞坏死,但NADPH-d阳性细胞形态学上仅表现为细胞皱缩,突起卷曲断 裂。说明NOS神经元对缺血性损伤的耐受性是相对的, 可能属于迟发性神经元死亡(DND)。
, 百拇医药
文献报道脑缺血后细胞死亡有坏死和凋亡2种方式 。我们以前的研究中亦发现相似的现象,其中细胞 坏死的主要表现为早期细胞肿胀,逐渐出现胞膜破 裂,整个细胞溶解,坏死,最终被吞噬细胞吞噬; 细胞凋亡的主要表现为:胞浆致密,皱缩,逐渐消 失即细胞容积的逐渐缩小,辅以其它生化指标或药 理学指标如DNA梯等[6]。但我们观察局部脑缺血后30min至 4d,均未发现有NADPH-d阳性细胞的水肿、破裂等现象 ,相反,所有NADPH-d阳性细胞均以逐渐皱缩最终消失 。说明NOS阳性细胞的死亡方式有其独特性,尽管目前 细胞凋亡的标准尚不统一,但我们推测NADPH-d阳性细 胞的死亡方式是以细胞凋亡为主。Lei等[7]在观察局部 注射海人酸(Kainic acid)对NOS表达的影响时亦发现了相似 的现象。局部脑缺血与脑组织中局部注射海人酸的 损伤方式不同,但NADPH-d细胞的形态学改变具有惊人 的相似之处,NADPH-d细胞的上述死亡是否为各种损伤 方式的最后共同表现尚需进一步研究。细胞坏死早 期细胞肿胀的主要原因为缺血缺氧致细胞膜通透性 增加引起细胞内钠水潴留所致。NOS阳性神经元在缺血 时不发生细胞肿胀,说明这些细胞内不存在钠、水 潴留现象,也即这些细胞在缺血缺氧早期膜的通透 性不增加,这可能是NOS神经元对兴奋毒性相对耐受的 主要原因。
, 百拇医药
NOS阳性神经元对缺血耐受的原因可能有:①NOS细胞 本身对缺血缺氧不敏感,其细胞膜对Ca2+超载所致的 兴奋毒性具有抵抗能力;②NOS神经元细胞膜上不存在 NMDA受体;③由于NOS表达产生NO引发一系列继发事件导 致细胞产生耐受能力。线粒体中Mn-SOD是nNOS神经元对 毒性损伤具有选择性抵抗力的主要原因,但研究发 现线粒体Mn-SOD为NO毒性产物ONOO-攻击的主要对象[8], 可能需在ONOO-使Mn-SOD完全失活后方可启动NOS细胞的 自身伤害。NOS细胞与非NOS细胞在线粒体Mn-SOD含量上是 否存在差异目前未见报道。
基金项目:国家自然科学基金资助项目(39670269)
作者简介:史树贵(1968.11),男,云南省陆良县人,硕士,主治医师,主要从事脑血管疾病及局限性肌张力障碍方面的研究,发表论文10篇。电话:(023)68753786
, 百拇医药 参考文献
[1]Matsui T, Nagafuji T, Kumanishi T, et al. Role of nitric oxide in pathogenesis underlying ischemia cerebral damage[J]. Cell Mol Neurobiol, 1999, 19(1):177-189.
[2]Strijbos P J. Nitric oxide in cerebral ischemic neurodegeneration and excitotoxicity[J]. Crit Rev Neurobiol,1998,12(3):223-243.
[3]史树贵,邵淑琴,陈康宁.大鼠局灶性脑缺血后一氧化氮与细胞凋亡关系的研究[J].第三军医大学学报,1999,21(4):249-252.
, 百拇医药
[4]Amer F S, Dawson T M, Dawson V L. Nitric oxide synthase in models of focal ischemia[J]. Stroke,1997, 28(6):1283-1288.
[5]Rosenblum W I. A review of vasomotor responses on the surface of the mouse brain: The necessary prelude to studies using genetically manipulated mice[J]. Microcirculation, 1998, 5(2-3):129-138.
[6]Hockenbery D. Defining apoptosis [comment][see comments][J]. Am J Pathol, 1995, 146(1):16-19.
, http://www.100md.com
[7]Lei D L, Yang D L, Liu H M. Local injection of kainic acid causes widespread degeneration of NADPH-d neurons and induction of NADPH-d in neurons, endothelial cells and reactive astrocytes[J]. Brain Res, 1996,730(1):199-206.
[8]MacMillan Crow L A, Crow J P, Kerby J D, et al. Nitration and inactivation of manganese superoxide dismutase in chronic injection of human renal allografts[J]. Proc Natl Acad Sci USA,1996,93(21):11 853-11 858.
收稿日期:1999-05-25;修回日期:1999-12-28, http://www.100md.com