弓形虫速殖子细胞质游离钙浓度的测定
作者:林京 胡建石 林建银
单位:福建医科大学分子医学教研室,福州 350004
关键词:刚地弓形虫;细胞质游离钙;荧光光度测定法
福建医科大学学报000208 摘要:目的 研究弓形虫与宿主细胞之间相互作用的钙通道机制。方法 以急性期感染小鼠腹水收集的RH株刚地弓形虫速殖子为材料,采用荧光染料Fura-2与细胞质游离钙结合,通过荧光分光光度计技术和Super Ion Probe Software计算机软件测定弓形虫速殖子细胞质游离钙浓度([Ca2+]i)。结果 正常弓形虫速殖子[Ca2+]i为(205.02±18.6)nmol/L,符合文献报道的静息状态下真核细胞[Ca2+]i浓度范围。结论 本方法简便、易行,相对费用低,适用于国内实验室。
中图分类号:R382.5;R392.11;R446.61 文献标识码:A
, 百拇医药
文章编号:1000-2235(2000)02-0120-03
Determination of Cytosolic Free Calcium Concentration in Toxoplasma Gondii Tachyzoite
LIN Jing,HU Jian-shi,LIN Jian-yin
(Department of Molecular Medicine,Fujian Medical University,Fuzhou 350004,China)
ABSTRACT:Objective To further study the mechanism of Ca2+ channels in interaction between both toxoplasma and host cell.Methods Toxoplasma gondii tachyzoites of the RH strain collected from the peritoneal fluid in mice 3 days after infection,using a fluorescence dye(Fura-2) to bind cytoplasmic free Ca2+.Cytoplasmic free calcium concentration([Ca2+]i) in toxoplasma gondii tachyzoite was determined by spectrofluorophotometer and Super Ion Probe Software computer software.Results The cytoplasmic free[Ca2+]i in nomal toxoplasma gondii tachyzoite were(205.02±18.6)nmol/L,concentration which are in the range observed in many studies with resting eukaryotic cells.Conclusion This method for measurement of Ca2+ is simple,applicable and less expensive.
, 百拇医药
KEY WORDS:Toxoplasma gondii;cytosolic free calcium;spectrofluorophotometer
弓形虫是先天性致畸的重要生物因素,被列为胎儿感染致畸TORCH综合征的主要病原体[1]。免疫缺陷患者并发弓形虫感染,后果更为严重[2]。最近Pezzella等研究发现弓形虫速殖子内一定的钙水平对虫体侵入宿主细胞十分重要。钙除了调节虫体侵入过程的粘附、运动、分泌外,还调节虫体生长和分裂所需的微管的聚合和解聚,胞内核苷酸代谢,激活蛋白激酶、Ca2+/Mg2+ATP酶、磷脂酶A2等[3]。为了深入了解弓形虫与宿主细胞之间相互作用的钙通道机制,笔者建立应用Fura-2测定弓形虫速殖子细胞质游离钙浓度([Ca2+]i)的方法。
1 材料与方法
, 百拇医药
1.1 主要仪器和试剂 RF-5301 PC双波长荧光分光光度计(日本岛津公司)。 MILLI-Q plus离子交换纯水器(美国Millipore公司)。 Fura-2/AM, Ethylene Glycol-bis(β-aminoethyl Ether)N,N,N',N'-Tetraacetic Acid(EGTA),HEPES均购自美国Sigma公司。 albumin bovine (上海吉泰科技有限公司), Triton X-100(美国Sinc-American.Biotechnology 公司)。
1.2 寄生虫 RH株刚地弓形虫引自福建省卫生防疫站疫源科。
1.3 动物 雌性昆明小白鼠,体重18~22 g(购自福建医科大学实验动物中心,合格证号:闽实动质准第14号)。
1.4 弓形虫速殖子悬液的制备 RH株刚地弓形虫速殖子悬液腹腔感染小鼠,3天后无菌常规收集腹水,经5 μm滤器过滤[4],滤液离心洗涤后,将沉淀物悬浮于含10%小牛血清的RPMI 1640细胞培养液,置CO2培养箱(95%空气,5%CO2,37℃)。
, 百拇医药
1.5 Fura-2/AM负载 选用新鲜速殖子悬液,倒置显微镜下观察虫体透明,呈香蕉形或半月形,运动活跃,能作螺旋式转动,用锥虫蓝拒染试验检测虫体存活率,要求虫体存活率大于95%。该速殖子悬液用37℃平衡盐溶液BSS[5] (每升含NaCl 135 mmol,KCl 4.5 mmol,CaCl2 1.5 mmol,MgCl2 0.5 mmol,葡萄糖5.6 mmol,Hepes 10 mmol,pH 7.4)洗涤2次。将108速殖子悬浮于含Fura-2/AM 2.5 μmol/L,BSA 0.2%的BSS 1 ml中,37℃下温浴80 min,并不断振荡。
1.6 去除胞外Fura-2/AM 用冷BSS洗涤虫体2次,去除胞外游离的Fura-2/AM。将虫体悬浮在冷BSS 2 ml中,置4℃冰箱,待测前37℃水浴复温7 min。
1.7 荧光光谱检验 用RF-5301 PC双波长荧光分光光度计进行37℃恒温测定,并不断搅拌使速殖子悬液分布均匀。进入Super Ion Probe Software 软件进行参数设置:激发光栅3 nm ,发射光栅5 nm,扫描速度(nm/min)100,响应时间0.5 s,激发光扫描范围(300~450 nm),发射光扫描范围(400~600 nm)。首先进行荧光光谱特征检验,包括Fura-2/AM标准液(2.5 μmol/L Fura-2/AM纯水溶液)扫描,其最大激发光波长(λex)和最大发射光波长(λem)分别为380和490 nm,加入终浓度为1~6 mmol/L Ca2+,上述λex、λem应无明显改变。Fura-2/AM负载液的荧光光谱特征基本相同。速殖子悬液扫描λex和λem分别为340和490 nm,而340 nm处荧光强度相应380 nm处荧光强度增强。如果上述光谱检验合格(图1),即可正式测定。
, 百拇医药
图1 荧光光谱扫描
A.激发光扫描;B.发射光扫描.…:Fura-2/AM标准液;-.-:Fura-2/AM负载液;-:速殖子悬液.
扫描结果由Super Ion Probe Software软件自动分析,计算[Ca2+]i。依据公式:[Ca2+]i=Kd.(R-Rmin)/(Rmax-R).Ff2/Fb2,其中平衡常数Kd为Fura-2与Ca2+结合反应的解离平衡常数,37℃时其值为224 nmol/L;R为荧光强度比值,(R=F340/F380);校正参数Rmax是胞内Fura-2全部为Ca2+饱和时的荧光比值,采用Triton X-100(0.05~0.1%)破坏细胞膜,胞外Ca2+内流,使胞内的Fura-2被Ca2+饱和。Rmin为Fura-2完全未结合Ca2+时的荧光比值,通过向介质中加入过量的EGTA(10 mmol/L)将细胞内外游离Ca2+螯合;Ff2与Fb2分别为Ca2+游离与Ca2+饱和时380 nm荧光强度。自身荧光以未孵育Fura-2/AM的细胞依法同测,计算[Ca2+]i时减去。Super Ion Probe Software软件自动分析荧光强度扫描图及比率图。
, 百拇医药
2 结 果
连续测定340,380 nm波长激发光交替激发时,490 nm发射新的荧光强度F(图2),同时记录荧光强度比值R(R=F340/F380)(图3)。
刚地弓形虫速殖子胞内[Ca2+]i为(205.02±18.6)nmol/L (n=15),符合文献报道的静息状态下真核细胞内游离钙浓度范围[6]。
3 讨 论
Fura-2作为第二代Ca2+荧光探针,具有荧光强度高、Ca2+选择性强、自身荧光弱、双激发光波长等优点,是目前使用最广泛的荧光探针。荧光染料Fura-2/AM在适宜条件下载入细胞,随后被细胞质的非特异性酯酶水解成Fura-2,Fura-2与细胞质游离Ca2+结合后即可被特定波长的紫外光激发产生荧光,其发射光强度与[Ca2+]i之间存在一定函数关系[6],据此可测定[Ca2+]i 。Fura-2较Quin-2产生和吸收荧光量大5倍,因而亮30倍。本室采用双波长荧光分光光度计可发挥Fura-2双激发波长的优点,它同时测340和380 nm两个波长激发的荧光强度,因而测定结果更准确可靠。刚地弓形虫速殖子[Ca2+]i仅见个别资料[7],应用Fura-2 测定细胞内游离钙浓度的方法已有许多报道[8,9],但是弓形虫速殖子的生物学特性与细胞截然不同,所以测定条件有很大区别,通过多次实验,发现以下因素可影响弓形虫速殖子细胞质[Ca2+]i浓度测定。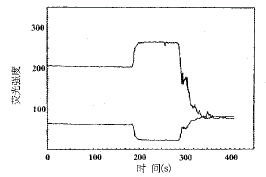
, 百拇医药
图2 弓形虫速殖子[Ca2+]i测定的荧光强度扫描
静息水平时为F340,F380;待稳定后,加入Triton,F340上升,而F380下降;继而加入EGTA,则使F340迅速下降而F380上升,重叠交叉.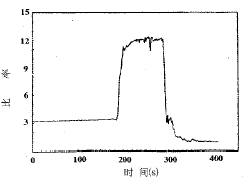
图3 弓形虫速殖子[Ca2+]i测定的比率图
静息水平时R(R=F340/F380);待稳定后加入Triton,得到Rmax;继而加入EGTA得到Rmin。依据公式计算[Ca2+]i=214.832 nmol.
3.1 弓形虫速殖子悬液 由于死亡虫体胞内酯酶外漏,胞外降解Fura-2/AM,使Fura-2与胞外Ca2+结合而影响[Ca2+]i测定。因此控制每个样本速殖子数108个,存活率至少大于95%。本室采用新鲜腹水收集的速殖子,或将其悬浮在含10%小牛血清的RPMI 1640细胞培养液中置37℃ CO2培养箱,20 h内均可用。
, 百拇医药
3.2 洗涤 洗涤过程中离心转速高,时间长,次数多易造成虫体损伤、死亡。反之,虫体丢失多,胞外游离Fura-2/AM洗不干净。本室摸索出离心转速2000 r/min,离心时间7 min,Fura-2/AM负载前后各洗涤2次,能有效洗去死亡虫体碎片及胞外游离Fura-2/AM,保证虫体数及存活率。
3.3 pH值 荧光素发光的最有利条件是其离子化状态。pH值可影响指示剂的离子化程度,pH值的变化只有在生理范围内对Fura-2的荧光谱影响较小,因此严格控制pH的范围在7.4±0.5。
3.4 温度 为保证速殖子功能正常,应在37℃下恒温测定。但37℃下荧光染料易扩散外漏,为控制由于室温高而引起的染料外漏,Fura-2/AM负载后的速殖子用冷BSS(可加入0.2%BSA)洗涤,洗涤后置4℃冰箱,扫描测定前每个样本37℃统一复温7 min。
3.5 水质 普通蒸馏水因其所含重金属离子可致荧光淬灭,故不适于此实验。将双蒸水用离子交换纯水器过柱后,可满足要求。
, http://www.100md.com
3.6 光分解效应 为了减少光分解效应的影响,一方面要控制每个样品测定的全过程的时间(不宜超过10 min);另一方面轻轻搅拌悬液,使新的细胞不断进入激发光照射的区域。
3.7 防止微生物污染 速殖子腹水抽取按无菌操作;所有缓冲液和试剂应临时配制;玻璃仪器按细胞培养要求处理,这样还可以防止Ca2+从玻璃仪器中解离出来而影响检测结果。
综上所述,本室建立了适合于弓形虫速殖子细胞质游离钙浓度的测定方法,为深入研究弓形虫与宿主细胞之间相互作用的钙通道机制提供了基本资料和实验方法。
基金项目:福建省自然科学基金资助项目(C96036)
作者简介:林 京(1971~),女,助教,硕士研究生.
参考文献:
, 百拇医药
[1]严仁英.实用优生学[M].北京:人民卫生出版社,1986.273.
[2]于恩庶.弓形虫病学[M].福州:福建科技出版社,1992.125.
[3]Pezzella N,Bouchot A,Bonhomme A,et al.Involvement of calcium and calmodulin in Toxoplasma gondii tachyzoite invasion[J].Eur J Cell Bio,1997,74:92.
[4]孙 新,Cozon G,Gandilhon F,et al.刚地弓形虫细胞培养的研究II.RH株速殖子细胞培养上清对成囊株速殖子侵入细胞的影响[J].中国寄生虫病防治杂志,1995,8:111.
[5]叶庆林,Wagner M,Smythe S,et al.Tsh和Catbachol对甲状腺细胞内游离钙的动员作用[J].福建医学院学报,1991,25(3):183.
, 百拇医药
[6]Grynkiewicz G,Poenie M,Tsien RY.A new generation of Ca2+ indicators with greatly improved fluorescence properties[J].J Biol Chem,1985,260:3440.
[7]Moreno SNJ,Zhong L.Acidocalcisomes in toxoplasma gondii tachyzoites[J].Biochem J,1996,313:655.
[8]Toborek M,Blanc EM,Kaiser S,et al.Linoleic acid potentiates TNF-mediated oxidative stress,disruption of calcium homeostasis,and apoptosis of cultured vascular endothelial cells[J].J Lipid Res,1997,38:2155.
[9]Clementi E,Sciorati C,Riccio M,et al.Nitric oxide action on growth factor-elicited signals[J].J Biol Chem,1995,270:22277.
收稿日期:1999-12-27, 百拇医药
单位:福建医科大学分子医学教研室,福州 350004
关键词:刚地弓形虫;细胞质游离钙;荧光光度测定法
福建医科大学学报000208 摘要:目的 研究弓形虫与宿主细胞之间相互作用的钙通道机制。方法 以急性期感染小鼠腹水收集的RH株刚地弓形虫速殖子为材料,采用荧光染料Fura-2与细胞质游离钙结合,通过荧光分光光度计技术和Super Ion Probe Software计算机软件测定弓形虫速殖子细胞质游离钙浓度([Ca2+]i)。结果 正常弓形虫速殖子[Ca2+]i为(205.02±18.6)nmol/L,符合文献报道的静息状态下真核细胞[Ca2+]i浓度范围。结论 本方法简便、易行,相对费用低,适用于国内实验室。
中图分类号:R382.5;R392.11;R446.61 文献标识码:A
, 百拇医药
文章编号:1000-2235(2000)02-0120-03
Determination of Cytosolic Free Calcium Concentration in Toxoplasma Gondii Tachyzoite
LIN Jing,HU Jian-shi,LIN Jian-yin
(Department of Molecular Medicine,Fujian Medical University,Fuzhou 350004,China)
ABSTRACT:Objective To further study the mechanism of Ca2+ channels in interaction between both toxoplasma and host cell.Methods Toxoplasma gondii tachyzoites of the RH strain collected from the peritoneal fluid in mice 3 days after infection,using a fluorescence dye(Fura-2) to bind cytoplasmic free Ca2+.Cytoplasmic free calcium concentration([Ca2+]i) in toxoplasma gondii tachyzoite was determined by spectrofluorophotometer and Super Ion Probe Software computer software.Results The cytoplasmic free[Ca2+]i in nomal toxoplasma gondii tachyzoite were(205.02±18.6)nmol/L,concentration which are in the range observed in many studies with resting eukaryotic cells.Conclusion This method for measurement of Ca2+ is simple,applicable and less expensive.
, 百拇医药
KEY WORDS:Toxoplasma gondii;cytosolic free calcium;spectrofluorophotometer
弓形虫是先天性致畸的重要生物因素,被列为胎儿感染致畸TORCH综合征的主要病原体[1]。免疫缺陷患者并发弓形虫感染,后果更为严重[2]。最近Pezzella等研究发现弓形虫速殖子内一定的钙水平对虫体侵入宿主细胞十分重要。钙除了调节虫体侵入过程的粘附、运动、分泌外,还调节虫体生长和分裂所需的微管的聚合和解聚,胞内核苷酸代谢,激活蛋白激酶、Ca2+/Mg2+ATP酶、磷脂酶A2等[3]。为了深入了解弓形虫与宿主细胞之间相互作用的钙通道机制,笔者建立应用Fura-2测定弓形虫速殖子细胞质游离钙浓度([Ca2+]i)的方法。
1 材料与方法
, 百拇医药
1.1 主要仪器和试剂 RF-5301 PC双波长荧光分光光度计(日本岛津公司)。 MILLI-Q plus离子交换纯水器(美国Millipore公司)。 Fura-2/AM, Ethylene Glycol-bis(β-aminoethyl Ether)N,N,N',N'-Tetraacetic Acid(EGTA),HEPES均购自美国Sigma公司。 albumin bovine (上海吉泰科技有限公司), Triton X-100(美国Sinc-American.Biotechnology 公司)。
1.2 寄生虫 RH株刚地弓形虫引自福建省卫生防疫站疫源科。
1.3 动物 雌性昆明小白鼠,体重18~22 g(购自福建医科大学实验动物中心,合格证号:闽实动质准第14号)。
1.4 弓形虫速殖子悬液的制备 RH株刚地弓形虫速殖子悬液腹腔感染小鼠,3天后无菌常规收集腹水,经5 μm滤器过滤[4],滤液离心洗涤后,将沉淀物悬浮于含10%小牛血清的RPMI 1640细胞培养液,置CO2培养箱(95%空气,5%CO2,37℃)。
, 百拇医药
1.5 Fura-2/AM负载 选用新鲜速殖子悬液,倒置显微镜下观察虫体透明,呈香蕉形或半月形,运动活跃,能作螺旋式转动,用锥虫蓝拒染试验检测虫体存活率,要求虫体存活率大于95%。该速殖子悬液用37℃平衡盐溶液BSS[5] (每升含NaCl 135 mmol,KCl 4.5 mmol,CaCl2 1.5 mmol,MgCl2 0.5 mmol,葡萄糖5.6 mmol,Hepes 10 mmol,pH 7.4)洗涤2次。将108速殖子悬浮于含Fura-2/AM 2.5 μmol/L,BSA 0.2%的BSS 1 ml中,37℃下温浴80 min,并不断振荡。
1.6 去除胞外Fura-2/AM 用冷BSS洗涤虫体2次,去除胞外游离的Fura-2/AM。将虫体悬浮在冷BSS 2 ml中,置4℃冰箱,待测前37℃水浴复温7 min。
1.7 荧光光谱检验 用RF-5301 PC双波长荧光分光光度计进行37℃恒温测定,并不断搅拌使速殖子悬液分布均匀。进入Super Ion Probe Software 软件进行参数设置:激发光栅3 nm ,发射光栅5 nm,扫描速度(nm/min)100,响应时间0.5 s,激发光扫描范围(300~450 nm),发射光扫描范围(400~600 nm)。首先进行荧光光谱特征检验,包括Fura-2/AM标准液(2.5 μmol/L Fura-2/AM纯水溶液)扫描,其最大激发光波长(λex)和最大发射光波长(λem)分别为380和490 nm,加入终浓度为1~6 mmol/L Ca2+,上述λex、λem应无明显改变。Fura-2/AM负载液的荧光光谱特征基本相同。速殖子悬液扫描λex和λem分别为340和490 nm,而340 nm处荧光强度相应380 nm处荧光强度增强。如果上述光谱检验合格(图1),即可正式测定。

, 百拇医药
图1 荧光光谱扫描
A.激发光扫描;B.发射光扫描.…:Fura-2/AM标准液;-.-:Fura-2/AM负载液;-:速殖子悬液.
扫描结果由Super Ion Probe Software软件自动分析,计算[Ca2+]i。依据公式:[Ca2+]i=Kd.(R-Rmin)/(Rmax-R).Ff2/Fb2,其中平衡常数Kd为Fura-2与Ca2+结合反应的解离平衡常数,37℃时其值为224 nmol/L;R为荧光强度比值,(R=F340/F380);校正参数Rmax是胞内Fura-2全部为Ca2+饱和时的荧光比值,采用Triton X-100(0.05~0.1%)破坏细胞膜,胞外Ca2+内流,使胞内的Fura-2被Ca2+饱和。Rmin为Fura-2完全未结合Ca2+时的荧光比值,通过向介质中加入过量的EGTA(10 mmol/L)将细胞内外游离Ca2+螯合;Ff2与Fb2分别为Ca2+游离与Ca2+饱和时380 nm荧光强度。自身荧光以未孵育Fura-2/AM的细胞依法同测,计算[Ca2+]i时减去。Super Ion Probe Software软件自动分析荧光强度扫描图及比率图。
, 百拇医药
2 结 果
连续测定340,380 nm波长激发光交替激发时,490 nm发射新的荧光强度F(图2),同时记录荧光强度比值R(R=F340/F380)(图3)。
刚地弓形虫速殖子胞内[Ca2+]i为(205.02±18.6)nmol/L (n=15),符合文献报道的静息状态下真核细胞内游离钙浓度范围[6]。
3 讨 论
Fura-2作为第二代Ca2+荧光探针,具有荧光强度高、Ca2+选择性强、自身荧光弱、双激发光波长等优点,是目前使用最广泛的荧光探针。荧光染料Fura-2/AM在适宜条件下载入细胞,随后被细胞质的非特异性酯酶水解成Fura-2,Fura-2与细胞质游离Ca2+结合后即可被特定波长的紫外光激发产生荧光,其发射光强度与[Ca2+]i之间存在一定函数关系[6],据此可测定[Ca2+]i 。Fura-2较Quin-2产生和吸收荧光量大5倍,因而亮30倍。本室采用双波长荧光分光光度计可发挥Fura-2双激发波长的优点,它同时测340和380 nm两个波长激发的荧光强度,因而测定结果更准确可靠。刚地弓形虫速殖子[Ca2+]i仅见个别资料[7],应用Fura-2 测定细胞内游离钙浓度的方法已有许多报道[8,9],但是弓形虫速殖子的生物学特性与细胞截然不同,所以测定条件有很大区别,通过多次实验,发现以下因素可影响弓形虫速殖子细胞质[Ca2+]i浓度测定。

, 百拇医药
图2 弓形虫速殖子[Ca2+]i测定的荧光强度扫描
静息水平时为F340,F380;待稳定后,加入Triton,F340上升,而F380下降;继而加入EGTA,则使F340迅速下降而F380上升,重叠交叉.

图3 弓形虫速殖子[Ca2+]i测定的比率图
静息水平时R(R=F340/F380);待稳定后加入Triton,得到Rmax;继而加入EGTA得到Rmin。依据公式计算[Ca2+]i=214.832 nmol.
3.1 弓形虫速殖子悬液 由于死亡虫体胞内酯酶外漏,胞外降解Fura-2/AM,使Fura-2与胞外Ca2+结合而影响[Ca2+]i测定。因此控制每个样本速殖子数108个,存活率至少大于95%。本室采用新鲜腹水收集的速殖子,或将其悬浮在含10%小牛血清的RPMI 1640细胞培养液中置37℃ CO2培养箱,20 h内均可用。
, 百拇医药
3.2 洗涤 洗涤过程中离心转速高,时间长,次数多易造成虫体损伤、死亡。反之,虫体丢失多,胞外游离Fura-2/AM洗不干净。本室摸索出离心转速2000 r/min,离心时间7 min,Fura-2/AM负载前后各洗涤2次,能有效洗去死亡虫体碎片及胞外游离Fura-2/AM,保证虫体数及存活率。
3.3 pH值 荧光素发光的最有利条件是其离子化状态。pH值可影响指示剂的离子化程度,pH值的变化只有在生理范围内对Fura-2的荧光谱影响较小,因此严格控制pH的范围在7.4±0.5。
3.4 温度 为保证速殖子功能正常,应在37℃下恒温测定。但37℃下荧光染料易扩散外漏,为控制由于室温高而引起的染料外漏,Fura-2/AM负载后的速殖子用冷BSS(可加入0.2%BSA)洗涤,洗涤后置4℃冰箱,扫描测定前每个样本37℃统一复温7 min。
3.5 水质 普通蒸馏水因其所含重金属离子可致荧光淬灭,故不适于此实验。将双蒸水用离子交换纯水器过柱后,可满足要求。
, http://www.100md.com
3.6 光分解效应 为了减少光分解效应的影响,一方面要控制每个样品测定的全过程的时间(不宜超过10 min);另一方面轻轻搅拌悬液,使新的细胞不断进入激发光照射的区域。
3.7 防止微生物污染 速殖子腹水抽取按无菌操作;所有缓冲液和试剂应临时配制;玻璃仪器按细胞培养要求处理,这样还可以防止Ca2+从玻璃仪器中解离出来而影响检测结果。
综上所述,本室建立了适合于弓形虫速殖子细胞质游离钙浓度的测定方法,为深入研究弓形虫与宿主细胞之间相互作用的钙通道机制提供了基本资料和实验方法。
基金项目:福建省自然科学基金资助项目(C96036)
作者简介:林 京(1971~),女,助教,硕士研究生.
参考文献:
, 百拇医药
[1]严仁英.实用优生学[M].北京:人民卫生出版社,1986.273.
[2]于恩庶.弓形虫病学[M].福州:福建科技出版社,1992.125.
[3]Pezzella N,Bouchot A,Bonhomme A,et al.Involvement of calcium and calmodulin in Toxoplasma gondii tachyzoite invasion[J].Eur J Cell Bio,1997,74:92.
[4]孙 新,Cozon G,Gandilhon F,et al.刚地弓形虫细胞培养的研究II.RH株速殖子细胞培养上清对成囊株速殖子侵入细胞的影响[J].中国寄生虫病防治杂志,1995,8:111.
[5]叶庆林,Wagner M,Smythe S,et al.Tsh和Catbachol对甲状腺细胞内游离钙的动员作用[J].福建医学院学报,1991,25(3):183.
, 百拇医药
[6]Grynkiewicz G,Poenie M,Tsien RY.A new generation of Ca2+ indicators with greatly improved fluorescence properties[J].J Biol Chem,1985,260:3440.
[7]Moreno SNJ,Zhong L.Acidocalcisomes in toxoplasma gondii tachyzoites[J].Biochem J,1996,313:655.
[8]Toborek M,Blanc EM,Kaiser S,et al.Linoleic acid potentiates TNF-mediated oxidative stress,disruption of calcium homeostasis,and apoptosis of cultured vascular endothelial cells[J].J Lipid Res,1997,38:2155.
[9]Clementi E,Sciorati C,Riccio M,et al.Nitric oxide action on growth factor-elicited signals[J].J Biol Chem,1995,270:22277.
收稿日期:1999-12-27, 百拇医药