盐酸乙哌立松颗粒剂人体生物利用度研究
作者:郭瑞臣 王本杰 张文东 李朝武 李智立
单位:郭瑞臣 王本杰 张文东 李朝武(山东医科大学附属医院,济南 250012);李智立(中国兵器工业第53研究所,济南 250031)
关键词:盐酸乙哌立松颗粒剂;妙纳片;生物利用度;生物等效性;GC-MS;托哌酮
中国临床药理学与治疗学000212
目的 比较盐酸乙哌立松颗粒剂与国外同类产品(妙纳片)的生物等效性。方法 10名志愿者单剂双交叉一次口服盐酸乙哌立松颗粒剂或妙纳片150 mg,肘静脉采血,以托哌酮为内标,采用GC-MS法测定各志愿者经时血浓度,计算主要药代动力学参数,并进行制剂间、个体间、阶段间双单侧t检验和(1-2α)置信区间分析。结果 两制剂血药浓度-时间数据经3p87药代动力学计算程序拟合,符合二室模型,实验制剂和参比制剂AUC0-8分别为(17.9±1.2) 和(18.6±1.6)ng.h.ml-1,AUC0-∞分别为(19.1±1.2)和(20.2±1.6)ng.h.ml-1,Cmax分别为(5.2±0.5)和(5.4±0.5) ng.ml-1,Tpeak分别为(1.05±0.18)和(1.08±0.23)h,t1/2(α)分别为(0.78±0.13)和(0.82±0.15)h,t1/2(β)分别为(1.8±0.3)和(1.8±0.3)h。盐酸乙哌立松颗粒剂相对生物利用度为(105±5)%。结论 盐酸乙哌立松颗粒剂与妙纳片药代动力学参数剂型间、个体间、阶段间无显著性差异(P>0.05),两制剂具有生物等效性。
, http://www.100md.com
中图分类号 R972.4
Relative bioavalability of hydrochloride
eperisone granule in healthy volunteers
GUO Rui-Chen
(Affiliated Hospital of Shandong Medical University, Jinan, 250012)
WANG Ben-Jie
(Affiliated Hospital of Shandong Medical University, Jinan, 250012)
, 百拇医药 ZHANG Wen-Dong
(Affiliated Hospital of Shandong Medical University, Jinan, 250012)
LI Chao-Wu
(Affiliated Hospital of Shandong Medical University, Jinan, 250012)
LI Zhi-Li
(Institute 53 of China's Ordnance Industry, Jinan, 250031)
Aim The relative bioavalability of hydrochloride eperisone granule in 10 healthy volunteers was studied. Methods The time-plasma concentrations of hydrochloride eperisone granule, as test drug, and myonal, as reference drug, were determined by GC-MS, with tolperisone senuing as internal standard.The pharmacokinetic parameters of both reference and test drug were calculated and analyzed with two-one side test and confidential interval test. Results The results showed that the AUC0-8, AUC0-∞, Cmax, Tpeak, t1/2(α) and t1/2(β) were (17.9±1.3)ng.h.ml-1 and(18.6±1.6)ng.h.ml-1, (19.1±1.2)ng.h.ml-1 and (20.2±1.6)ng.h.ml-1, (5.2±0.5)ng.ml-1 and (5.4±0.5) ng.ml-1, (1.05±0.18)h and (1.08±0.23)h, (0.78± 0.13)h and ( 0.82±0.14)h,( 1.8±0.3)h and (1.8±0.3)h, respectively. The relative bioavalability of test drug was (105± 5)%. Conclusion It can be concluded that the test and reference are bioequivalented between individuals, preparations and periods.
, 百拇医药
Key words eperisone hydrochloride; myonal;bioavalability; bioequivalence; GC-MS;tolperisong
盐酸乙哌立松(eperisone hydrochloride)是一种兼具扩张血管、抑制疼痛放射的中枢性肌肉松弛药。口服吸收较快,多次给药未见明显蓄积。常规剂量(50~100 mg)不良反应发生率约为2.4%,主要为恶心、便秘、胃痛、腹泻等消化道症状及失眠、头疼、眩晕、乏力等,但一般较轻微。对肩周炎、颈椎病、腰背痛以及多种原因引起的痉挛性麻痹具有较好疗效。与片剂相比,盐酸乙哌立松颗粒剂具有服用方便、吸收较好的特点。本实验以托哌酮(tol- perisong)为内标,采用GC-MS方法测定不同时间血中盐酸乙哌立松浓度,计算参比制剂和实验制剂主要药代动力学参数,并进行参比制剂和实验制剂个体间、阶段间、剂型间生物等效性分析,为其临床应用提供实验依据。
1 材料和方法
, 百拇医药
1.1 仪器 800型离心沉淀器,上海手术机械厂;80-2型离心沉淀器,上海手术机械厂;HANGPING FA1104 电子天平,上海天平仪器厂;SK-1型快速混匀器,江苏医疗仪器厂;HW-8 B型超级微量恒温器,上海浦江分析仪器厂;美国瓦里安(Varian)气相
色谱仪与TSQ-70质谱检测器。
1.2 药品试剂 参比制剂妙纳片(50mg/片),由日本株式会社生产,沈阳卫材制药有限公司分装,批号980301。 实验制剂盐酸乙哌立松颗粒剂(50 mg/包),批号990403、 盐酸乙哌立松标准品及托哌酮由中国科学院药物研究所提供。
乙醚由国营山东单县有机化工厂生产,批号961125; 甲醇由济南鲁康化学工业有限公司生产,批号960828; 盐酸由淄博化学试剂厂生产,批号981125,含量(36~38)%; 碳酸氢钠由天津市天河化学试剂厂生产,批号990106。所有均为分析纯。
, 百拇医药
1.3 研究对象 志愿者10名,男性,年龄(22.2±0.42)岁,身高(1.76±0.07)m,体重(67±7) kg。心电图检查正常,血、尿常规及肝功能等实验室检查正常,无家族遗传病史。所有志愿者均书面告知实验目的、方法、可能发生的危险以及相应权益,并签署知情同书。
志愿者于实验前1 wk内以及实验期间禁服任何药物,忌烟、酒等,实验前1 d晚10时后绝对禁食, 次日晨7:00空腹服药,2 h后进食标准低脂肪低蛋白早餐。
1.4 实验设计 实验采用单剂双交叉设计,10名志愿者随机分为A、B 两组,第1阶段A组服用盐酸乙哌立松颗粒剂(50 mg/包×3),B组服用妙纳片(50 mg/片×3),分别于服药前和服药后0.5,1.0,1.5,2.0,2.5,3.0,4.0,5.0,6.0, 8.0 h 抽取肘静脉血3 ml,离心,血清-20 ℃保存。1 wk后两组交换服药。取血时间、样本处理及保存方法同第1阶段。
, 百拇医药
1.5 实验方法
1.5.1 样本提取 取样本血清1 ml,加入100 μl内标溶液(0.5 μg.ml-1)、1 ml饱和碳酸氢钠溶液和4 ml乙醚,混匀,振摇,离心。取乙醚层加入1 ml 0.1 mol.L-1盐酸,混匀,振摇,离心。乙醚层40 ℃水浴蒸干,残渣用甲醇溶解。
1.5.2 色谱条件 瓦里安(Varian)气相色谱仪与TSQ-70质谱检测器相连组成所需仪器。以托哌酮为内标, 氦气为通气流。质子检测器为电子轰击选择性离子监测(SIM)模式,电子能量为70 ev, 离子加速电压为35 V,衬硅毛细管柱(10 m× 0.33 mmI.D, 0.50 μm厚)。初始炉温为50 ℃,保持50 s,然后以20 ℃/min速度升至170 ℃,并保持6 min,再以30 ℃/min的速度升至200 ℃,保持7.5 min。接口温度200 ℃,汽化室温度220 ℃。柱前压11 psi,无分流进样。 样品和内标的质谱由电子轰击模式捕获,样品在m/z 98用SIM分析。
, http://www.100md.com
上述色谱条件下,内标和盐酸乙哌立松保留时间分别为8.13 min和9.13 min。盐酸乙哌立松质谱图如图1所示。空白血清、样本血清及含内标和盐酸乙哌立松血清经提取后色谱图如图2所示。
图1 盐酸乙哌立松(上)和内标(下)质谱图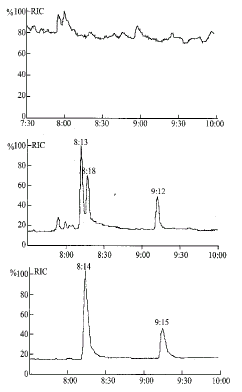
图2 空白血清(上)、志愿者血清(中)及含内标(IS)和盐酸乙哌立松(EPRI)血清(下)经提取后色谱图
1.6 方法确认
1.6.1 标准曲线 取空白血清和浓度为40.0 ng.ml-1的工作液配成含乙哌立松0.2,0.5,0.75,1,1.25,2.5,5,10和40 ng.ml-1的标准液,以盐酸乙哌立松及内标峰面积比对浓度值在低浓度范围(0.2~2.5 ng.ml-1)和高浓度范围(2.5 ~ 40 ng.ml-1)进行线性回归分析,评价其线性关系。
, http://www.100md.com
将盐酸乙哌立松与内标之峰面积代入低浓度范围标准曲线(Y=0.01283 X± 0.0006035,r= 0.9987),如超出该浓度范围,则改用高浓度范围曲线 (Y= 0.013874 X± 0.005907, r = 0.9995),计算待测样品盐酸乙哌立松浓度。
1.6.2 回收率 取空白血清,加入0.5,1.0,5.0 ng·ml-1的盐酸乙哌立松标准品,按前述样本处理方法,测定含量,计算回收率,分别为77.6±1.5,73.9±0.8和 79.2±1.6。
1.6.3 精密度 配浓度为0.5,1.0和5.0 ng.ml-1质控样本,并分为每份1.0 ml贮于-20 ℃备用。同一浓度的质控样本每天测定3次,日内变异系数分别为0.4±0.8,3.962 ±0.007和0.02± 0.08。 测试期间连续测定0.5,1.0和5.0 ng.ml-1 血样3 d,日间变异系数分别为0.4±0.7,3.952±0.005和0.01±0.06。
, 百拇医药
1.7 数据处理
1.7.1 药代动力学参数计算 血药浓度-时间数据经3p97实用药代动力学程序处理,得两制剂的主要药代动力学参数,根据下式计算实验制剂的相对生物利用度。
生物利用度(F)=实验制剂AUC0-∞/ 参比制剂AUC0-∞×100%
1.7.2 生物等效性评价 利用3p97实用药代动力学程序,对两制剂的药代动力学参数进行生物等效性分析。
2 结果
2.1 各志愿者实验制剂和参比制剂经时血药浓度 见表1。
表1 各志愿者实验制剂和参比制剂经时血药浓度均值 采血时间/h
, http://www.100md.com
实验制剂
参比制剂
血药浓度
RSD/%
血药浓度
RSD/%
0.5
2.05±0.18
8.77
1.97±0.22
11.29
1.0
5.0±0.3
, 百拇医药
5.96
4.9±0.4
8.95
1.5
6.2±0.4
6.54
6.1±0.3
5.53
2.0
4.7±0.6
13.33
4.6±0.5
10.60
, 百拇医药
2.5
3.8±0.6
17.28
3.7±0.4
10.72
3.0
3.0±0.6
20.01
2.9±0.4
15.80
4.0
2.16±0.27
12.45
, 百拇医药
2.1±0.2
10.36
5.0
1.43±0.25
17.32
1.31±0.12
9.46
6.0
0.93±0.10
11.23
0.85±0.04
5.07
, 百拇医药 8.0
0.51±0.08
13.08
0.44±0.07
15.97
表2 10名志愿者实验制剂和参比制剂药代动力学参数均值 参数
实验制剂
参比制剂
均制
RSD%
均值
RSD%
, 百拇医药
t1/2(a)
0.96±0.28
29.16
0.86±0.23
26.66
t1/2(β)
1.8±0.3
18.07
1.8±0.3
17.15
Tpeak
1.08±0.23
, 百拇医药
21.07
1.05±0.18
17.03
Cmax
5.4±0.5
9.09
5.2±0.5
9.31
AUC0~8
18.6±1.6
8.41
17.9±1.3
, 百拇医药
7.01
AUC0~∞
20.2±1.6
8.08
19.1±1.2
6.44
F
105±5
4.59
2.2 各志愿者实验制剂和参比制剂经时血药浓度-时间曲线 志愿者经时血药浓度均值经3p97实用药代动力学程序拟合符合二室模型。实验制剂和参比制剂经时血药浓度均值实测曲线如图3所示。表3 10名志愿者实验制剂和参比制剂药代动力学参数方差分析及双单侧t检验结果
, 百拇医药
t1/2(a)/h
t1/2(β)/h
t1/2(ka)/h
Tpeak/h
Cmax/ng.ml-1
AUC/ng.h.ml-1
0~8
0~∞
, 百拇医药
个体间F
0.21582
0.41218
0.20885
0.08239
0.27957
0.70617
0.37765
剂型间F
0.70880
0.68950
0.41338
, http://www.100md.com
0.75194
0.23707
0.02084
0.00926
阶段间F
0.77245
0.25716
0.08554
0.98529
0.73237
0.63569
0.81727
, 百拇医药
t1(≥1.86)
2.035
3.113
4.106
3.67
7.676
19.280
17.951
t2(≥1.86)
1.261
3.942
2.383
, 百拇医药
3.017
5.120
13.540
11.135
90%CI*
90.8~118
86.4~109.2
90.8~100.5
89.6~116.0
98.1~111.0
93.4~114.5
95.5~115.3
, 百拇医药
*CI:confidential interval(置信区间);F:各项变异的方差分析计算的F值,均为P>0.05
图3 10名志愿者口服受试制剂(T)和参比制剂(R)血药浓度均值-时间曲线
2.3 各志愿者实验制剂和参比制剂药代动力学参数 各志愿者实验制剂和参比制剂血药浓度-时间数据经3p97实用药代动力学程序处理,得主要药代动力学参数如表2所示。
2.4 生物等效性评价 两制剂药代动力学参数(t1/2(α)、t1/2(β)、Tpeak、Cmax、AUC)方差分析无显著性差异(P>0.05),双单侧 t 检验和(1-2α)置信区间分析提示两制剂为生物等效制剂,结果如表3所示。
, 百拇医药
3 讨论
本实验以托哌酮为内标,采用GC-MS法测定健康志愿者单剂口服盐酸乙哌粒松颗粒剂和妙纳片剂后的乙哌粒松血浓度,样本制备过程简单,方法灵敏度及精密度高,重现性好,完全达到人体生物利用度实验要求。
本实验所得主要药代动力学参数与国外相关文献报道基本一致,实验制剂盐酸乙哌立松颗粒剂相对生物利用度(F)为105.47%。反映药物吸收速度的指标Tpeak和Cmax,反映药物消除速度的指标t1/2(β),反映药物全身吸收量的指标AUC经方差分析、双单侧t检验和(1-2α)置信区间分析,两种制剂剂型间、个体间、阶段间不存在显著性差异(P>0.05), t1和 t2大于1.860同时成立,接受生物等效的假设。证明实验制剂盐酸乙哌立松颗粒剂与参比制剂妙纳片为生物等效制剂。国产盐酸乙哌粒松颗粒剂可代替进口妙纳片剂。
, 百拇医药
郭瑞臣,男,43岁,山东医科大学临床药理研究所副主任、主任药师、教授、硕士研究生导师,研究方向为临床药学和临床药理学。
参考文献
1,Fumio T,Kasunik O,Yamazak I,et al. A sensitive determination of eperisone in plasma by GC/MS.J Mass Spectrom Soc Jpn,1993;41(4):335
2,Tomio T, masukatsu H, Tetsuo O. Determination of eperisone in human plasma by gas chromatographymass spectrometry. J Chromatography, 1992;584:261
2000-03-12 收稿,2000-04-10 修回, 百拇医药
单位:郭瑞臣 王本杰 张文东 李朝武(山东医科大学附属医院,济南 250012);李智立(中国兵器工业第53研究所,济南 250031)
关键词:盐酸乙哌立松颗粒剂;妙纳片;生物利用度;生物等效性;GC-MS;托哌酮
中国临床药理学与治疗学000212
目的 比较盐酸乙哌立松颗粒剂与国外同类产品(妙纳片)的生物等效性。方法 10名志愿者单剂双交叉一次口服盐酸乙哌立松颗粒剂或妙纳片150 mg,肘静脉采血,以托哌酮为内标,采用GC-MS法测定各志愿者经时血浓度,计算主要药代动力学参数,并进行制剂间、个体间、阶段间双单侧t检验和(1-2α)置信区间分析。结果 两制剂血药浓度-时间数据经3p87药代动力学计算程序拟合,符合二室模型,实验制剂和参比制剂AUC0-8分别为(17.9±1.2) 和(18.6±1.6)ng.h.ml-1,AUC0-∞分别为(19.1±1.2)和(20.2±1.6)ng.h.ml-1,Cmax分别为(5.2±0.5)和(5.4±0.5) ng.ml-1,Tpeak分别为(1.05±0.18)和(1.08±0.23)h,t1/2(α)分别为(0.78±0.13)和(0.82±0.15)h,t1/2(β)分别为(1.8±0.3)和(1.8±0.3)h。盐酸乙哌立松颗粒剂相对生物利用度为(105±5)%。结论 盐酸乙哌立松颗粒剂与妙纳片药代动力学参数剂型间、个体间、阶段间无显著性差异(P>0.05),两制剂具有生物等效性。
, http://www.100md.com
中图分类号 R972.4
Relative bioavalability of hydrochloride
eperisone granule in healthy volunteers
GUO Rui-Chen
(Affiliated Hospital of Shandong Medical University, Jinan, 250012)
WANG Ben-Jie
(Affiliated Hospital of Shandong Medical University, Jinan, 250012)
, 百拇医药 ZHANG Wen-Dong
(Affiliated Hospital of Shandong Medical University, Jinan, 250012)
LI Chao-Wu
(Affiliated Hospital of Shandong Medical University, Jinan, 250012)
LI Zhi-Li
(Institute 53 of China's Ordnance Industry, Jinan, 250031)
Aim The relative bioavalability of hydrochloride eperisone granule in 10 healthy volunteers was studied. Methods The time-plasma concentrations of hydrochloride eperisone granule, as test drug, and myonal, as reference drug, were determined by GC-MS, with tolperisone senuing as internal standard.The pharmacokinetic parameters of both reference and test drug were calculated and analyzed with two-one side test and confidential interval test. Results The results showed that the AUC0-8, AUC0-∞, Cmax, Tpeak, t1/2(α) and t1/2(β) were (17.9±1.3)ng.h.ml-1 and(18.6±1.6)ng.h.ml-1, (19.1±1.2)ng.h.ml-1 and (20.2±1.6)ng.h.ml-1, (5.2±0.5)ng.ml-1 and (5.4±0.5) ng.ml-1, (1.05±0.18)h and (1.08±0.23)h, (0.78± 0.13)h and ( 0.82±0.14)h,( 1.8±0.3)h and (1.8±0.3)h, respectively. The relative bioavalability of test drug was (105± 5)%. Conclusion It can be concluded that the test and reference are bioequivalented between individuals, preparations and periods.
, 百拇医药
Key words eperisone hydrochloride; myonal;bioavalability; bioequivalence; GC-MS;tolperisong
盐酸乙哌立松(eperisone hydrochloride)是一种兼具扩张血管、抑制疼痛放射的中枢性肌肉松弛药。口服吸收较快,多次给药未见明显蓄积。常规剂量(50~100 mg)不良反应发生率约为2.4%,主要为恶心、便秘、胃痛、腹泻等消化道症状及失眠、头疼、眩晕、乏力等,但一般较轻微。对肩周炎、颈椎病、腰背痛以及多种原因引起的痉挛性麻痹具有较好疗效。与片剂相比,盐酸乙哌立松颗粒剂具有服用方便、吸收较好的特点。本实验以托哌酮(tol- perisong)为内标,采用GC-MS方法测定不同时间血中盐酸乙哌立松浓度,计算参比制剂和实验制剂主要药代动力学参数,并进行参比制剂和实验制剂个体间、阶段间、剂型间生物等效性分析,为其临床应用提供实验依据。
1 材料和方法
, 百拇医药
1.1 仪器 800型离心沉淀器,上海手术机械厂;80-2型离心沉淀器,上海手术机械厂;HANGPING FA1104 电子天平,上海天平仪器厂;SK-1型快速混匀器,江苏医疗仪器厂;HW-8 B型超级微量恒温器,上海浦江分析仪器厂;美国瓦里安(Varian)气相
色谱仪与TSQ-70质谱检测器。
1.2 药品试剂 参比制剂妙纳片(50mg/片),由日本株式会社生产,沈阳卫材制药有限公司分装,批号980301。 实验制剂盐酸乙哌立松颗粒剂(50 mg/包),批号990403、 盐酸乙哌立松标准品及托哌酮由中国科学院药物研究所提供。
乙醚由国营山东单县有机化工厂生产,批号961125; 甲醇由济南鲁康化学工业有限公司生产,批号960828; 盐酸由淄博化学试剂厂生产,批号981125,含量(36~38)%; 碳酸氢钠由天津市天河化学试剂厂生产,批号990106。所有均为分析纯。
, 百拇医药
1.3 研究对象 志愿者10名,男性,年龄(22.2±0.42)岁,身高(1.76±0.07)m,体重(67±7) kg。心电图检查正常,血、尿常规及肝功能等实验室检查正常,无家族遗传病史。所有志愿者均书面告知实验目的、方法、可能发生的危险以及相应权益,并签署知情同书。
志愿者于实验前1 wk内以及实验期间禁服任何药物,忌烟、酒等,实验前1 d晚10时后绝对禁食, 次日晨7:00空腹服药,2 h后进食标准低脂肪低蛋白早餐。
1.4 实验设计 实验采用单剂双交叉设计,10名志愿者随机分为A、B 两组,第1阶段A组服用盐酸乙哌立松颗粒剂(50 mg/包×3),B组服用妙纳片(50 mg/片×3),分别于服药前和服药后0.5,1.0,1.5,2.0,2.5,3.0,4.0,5.0,6.0, 8.0 h 抽取肘静脉血3 ml,离心,血清-20 ℃保存。1 wk后两组交换服药。取血时间、样本处理及保存方法同第1阶段。
, 百拇医药
1.5 实验方法
1.5.1 样本提取 取样本血清1 ml,加入100 μl内标溶液(0.5 μg.ml-1)、1 ml饱和碳酸氢钠溶液和4 ml乙醚,混匀,振摇,离心。取乙醚层加入1 ml 0.1 mol.L-1盐酸,混匀,振摇,离心。乙醚层40 ℃水浴蒸干,残渣用甲醇溶解。
1.5.2 色谱条件 瓦里安(Varian)气相色谱仪与TSQ-70质谱检测器相连组成所需仪器。以托哌酮为内标, 氦气为通气流。质子检测器为电子轰击选择性离子监测(SIM)模式,电子能量为70 ev, 离子加速电压为35 V,衬硅毛细管柱(10 m× 0.33 mmI.D, 0.50 μm厚)。初始炉温为50 ℃,保持50 s,然后以20 ℃/min速度升至170 ℃,并保持6 min,再以30 ℃/min的速度升至200 ℃,保持7.5 min。接口温度200 ℃,汽化室温度220 ℃。柱前压11 psi,无分流进样。 样品和内标的质谱由电子轰击模式捕获,样品在m/z 98用SIM分析。
, http://www.100md.com
上述色谱条件下,内标和盐酸乙哌立松保留时间分别为8.13 min和9.13 min。盐酸乙哌立松质谱图如图1所示。空白血清、样本血清及含内标和盐酸乙哌立松血清经提取后色谱图如图2所示。

图1 盐酸乙哌立松(上)和内标(下)质谱图

图2 空白血清(上)、志愿者血清(中)及含内标(IS)和盐酸乙哌立松(EPRI)血清(下)经提取后色谱图
1.6 方法确认
1.6.1 标准曲线 取空白血清和浓度为40.0 ng.ml-1的工作液配成含乙哌立松0.2,0.5,0.75,1,1.25,2.5,5,10和40 ng.ml-1的标准液,以盐酸乙哌立松及内标峰面积比对浓度值在低浓度范围(0.2~2.5 ng.ml-1)和高浓度范围(2.5 ~ 40 ng.ml-1)进行线性回归分析,评价其线性关系。
, http://www.100md.com
将盐酸乙哌立松与内标之峰面积代入低浓度范围标准曲线(Y=0.01283 X± 0.0006035,r= 0.9987),如超出该浓度范围,则改用高浓度范围曲线 (Y= 0.013874 X± 0.005907, r = 0.9995),计算待测样品盐酸乙哌立松浓度。
1.6.2 回收率 取空白血清,加入0.5,1.0,5.0 ng·ml-1的盐酸乙哌立松标准品,按前述样本处理方法,测定含量,计算回收率,分别为77.6±1.5,73.9±0.8和 79.2±1.6。
1.6.3 精密度 配浓度为0.5,1.0和5.0 ng.ml-1质控样本,并分为每份1.0 ml贮于-20 ℃备用。同一浓度的质控样本每天测定3次,日内变异系数分别为0.4±0.8,3.962 ±0.007和0.02± 0.08。 测试期间连续测定0.5,1.0和5.0 ng.ml-1 血样3 d,日间变异系数分别为0.4±0.7,3.952±0.005和0.01±0.06。
, 百拇医药
1.7 数据处理
1.7.1 药代动力学参数计算 血药浓度-时间数据经3p97实用药代动力学程序处理,得两制剂的主要药代动力学参数,根据下式计算实验制剂的相对生物利用度。
生物利用度(F)=实验制剂AUC0-∞/ 参比制剂AUC0-∞×100%
1.7.2 生物等效性评价 利用3p97实用药代动力学程序,对两制剂的药代动力学参数进行生物等效性分析。
2 结果
2.1 各志愿者实验制剂和参比制剂经时血药浓度 见表1。
表1 各志愿者实验制剂和参比制剂经时血药浓度均值 采血时间/h
, http://www.100md.com
实验制剂
参比制剂
血药浓度
RSD/%
血药浓度
RSD/%
0.5
2.05±0.18
8.77
1.97±0.22
11.29
1.0
5.0±0.3
, 百拇医药
5.96
4.9±0.4
8.95
1.5
6.2±0.4
6.54
6.1±0.3
5.53
2.0
4.7±0.6
13.33
4.6±0.5
10.60
, 百拇医药
2.5
3.8±0.6
17.28
3.7±0.4
10.72
3.0
3.0±0.6
20.01
2.9±0.4
15.80
4.0
2.16±0.27
12.45
, 百拇医药
2.1±0.2
10.36
5.0
1.43±0.25
17.32
1.31±0.12
9.46
6.0
0.93±0.10
11.23
0.85±0.04
5.07
, 百拇医药 8.0
0.51±0.08
13.08
0.44±0.07
15.97
表2 10名志愿者实验制剂和参比制剂药代动力学参数均值 参数
实验制剂
参比制剂
均制
RSD%
均值
RSD%
, 百拇医药
t1/2(a)
0.96±0.28
29.16
0.86±0.23
26.66
t1/2(β)
1.8±0.3
18.07
1.8±0.3
17.15
Tpeak
1.08±0.23
, 百拇医药
21.07
1.05±0.18
17.03
Cmax
5.4±0.5
9.09
5.2±0.5
9.31
AUC0~8
18.6±1.6
8.41
17.9±1.3
, 百拇医药
7.01
AUC0~∞
20.2±1.6
8.08
19.1±1.2
6.44
F
105±5
4.59
2.2 各志愿者实验制剂和参比制剂经时血药浓度-时间曲线 志愿者经时血药浓度均值经3p97实用药代动力学程序拟合符合二室模型。实验制剂和参比制剂经时血药浓度均值实测曲线如图3所示。表3 10名志愿者实验制剂和参比制剂药代动力学参数方差分析及双单侧t检验结果
, 百拇医药
t1/2(a)/h
t1/2(β)/h
t1/2(ka)/h
Tpeak/h
Cmax/ng.ml-1
AUC/ng.h.ml-1
0~8
0~∞
, 百拇医药
个体间F
0.21582
0.41218
0.20885
0.08239
0.27957
0.70617
0.37765
剂型间F
0.70880
0.68950
0.41338
, http://www.100md.com
0.75194
0.23707
0.02084
0.00926
阶段间F
0.77245
0.25716
0.08554
0.98529
0.73237
0.63569
0.81727
, 百拇医药
t1(≥1.86)
2.035
3.113
4.106
3.67
7.676
19.280
17.951
t2(≥1.86)
1.261
3.942
2.383
, 百拇医药
3.017
5.120
13.540
11.135
90%CI*
90.8~118
86.4~109.2
90.8~100.5
89.6~116.0
98.1~111.0
93.4~114.5
95.5~115.3
, 百拇医药
*CI:confidential interval(置信区间);F:各项变异的方差分析计算的F值,均为P>0.05

图3 10名志愿者口服受试制剂(T)和参比制剂(R)血药浓度均值-时间曲线
2.3 各志愿者实验制剂和参比制剂药代动力学参数 各志愿者实验制剂和参比制剂血药浓度-时间数据经3p97实用药代动力学程序处理,得主要药代动力学参数如表2所示。
2.4 生物等效性评价 两制剂药代动力学参数(t1/2(α)、t1/2(β)、Tpeak、Cmax、AUC)方差分析无显著性差异(P>0.05),双单侧 t 检验和(1-2α)置信区间分析提示两制剂为生物等效制剂,结果如表3所示。
, 百拇医药
3 讨论
本实验以托哌酮为内标,采用GC-MS法测定健康志愿者单剂口服盐酸乙哌粒松颗粒剂和妙纳片剂后的乙哌粒松血浓度,样本制备过程简单,方法灵敏度及精密度高,重现性好,完全达到人体生物利用度实验要求。
本实验所得主要药代动力学参数与国外相关文献报道基本一致,实验制剂盐酸乙哌立松颗粒剂相对生物利用度(F)为105.47%。反映药物吸收速度的指标Tpeak和Cmax,反映药物消除速度的指标t1/2(β),反映药物全身吸收量的指标AUC经方差分析、双单侧t检验和(1-2α)置信区间分析,两种制剂剂型间、个体间、阶段间不存在显著性差异(P>0.05), t1和 t2大于1.860同时成立,接受生物等效的假设。证明实验制剂盐酸乙哌立松颗粒剂与参比制剂妙纳片为生物等效制剂。国产盐酸乙哌粒松颗粒剂可代替进口妙纳片剂。
, 百拇医药
郭瑞臣,男,43岁,山东医科大学临床药理研究所副主任、主任药师、教授、硕士研究生导师,研究方向为临床药学和临床药理学。
参考文献
1,Fumio T,Kasunik O,Yamazak I,et al. A sensitive determination of eperisone in plasma by GC/MS.J Mass Spectrom Soc Jpn,1993;41(4):335
2,Tomio T, masukatsu H, Tetsuo O. Determination of eperisone in human plasma by gas chromatographymass spectrometry. J Chromatography, 1992;584:261
2000-03-12 收稿,2000-04-10 修回, 百拇医药