口服单剂量西沙必利片剂的人体相对生物利用度
作者:代宗顺 侯淑贤 刘奕明 陈彬
单位:代宗顺 侯淑贤 刘奕明(同济医科大学临床药理研究所,武汉 430030);陈彬(鞍山市中心医院药剂科,鞍山 114001)
关键词:西沙必利;相对生物利用度;高效液相色谱法
沈阳药科大学学报000204 摘 要:健康志愿者8名,随机交叉单次口服西安杨森制药有限公司(简称西安杨森)生产的参比普瑞博思片剂(简称R)和广西田丰制药有限公司(简称广西田丰)研制的试验西沙必利片剂(简称T).用高效液相色谱法测定血药浓度.结果求得R和T的Cmax为(85.21±21.22)ng/mL和(78.02±28.20)ng/mL,Tmax为(0.97±0.45)h和(1.06±0.42)h;AUC(0-n)为(802.57±177.4)ng/mL.h和(820.39±245.10)ng/mL.h.广西田丰西沙必利片剂的人体相对生物利用度为(100.0±14.7)%.两种制剂的AUC(0-n)和Cmax经统计分析,均无显著性差异.
, 百拇医药
分类号:R912
Relative Bioavailability of the Cisapride Tablets in a Human Body after Administration of a Single Oral Dose
Dai Zongshun Hou Shuxian Liu Yiming Chen Bin
(Tongji Medical University,Wuhan 430030)
Abstract:The relative bioavailability of the two cisapride tablets,which were respectively produced by Yangsen(R)and Tianfeng(T)Pharmaceutical Companies,was studied in 8 healthy volunteers after their taking orally a single dose(20 mg) according to a randomized crossover design.The blood concentrations were determined by HPLC.The main parameters were as follows:Cmax(85.21±21.2)ng/mL and (78.02±28.20)ng/mL;Tmax(0.97±0.45)h and(1.06±0.42)h; AUC(0-n)(802.57±177.14)ng/mL。h and (820.39±245.10)ng/mL。h.The relative bioavailability of Tianfeng′s product was (100.0±14.7)%.The result of the statistical analysis showed that both preparations were bioequivalent.
, 百拇医药
Key words:cisapride;relative bioavailability;HPLC▲
西沙必利(cisapride)是第三代胃肠动力药,临床广泛用于治疗返流性食管炎、消化不良、胃轻瘫、便秘、假性肠梗阻.由于其不具有抗多巴胺作用,而是通过对5-HT不同受体的多重作用来实现其促力作用,所以副作用小,且发生率仅约2.5%〔1〕.西沙必利的相对生物利用度国内尚未见报道.作者采用HPLC法对广西田丰生产的西沙必利片相对生物利用度进行研究.
1 实验材料与方法
1.1 药品与试剂
试验药品:西沙必利片剂(T),广西田丰制药有限公司生产,每片10 mg,批号:980118;标示量=102.0%.
参比药品:普瑞博思片剂(R),西安杨森制药有限公司生产,每片10 mg,批号,9707104.批准文号:[96]卫药准字J-16(2)号;标示量=100.5%.
, 百拇医药
试剂:甲醇、异丙醇、正庚烷等均为分析纯.
1.2 仪器与色谱条件
日本岛津LC-1型高效液相色谱仪;SPC-1型检测器;固定相:WYG-C18 5 μm不锈钢柱(4.6×150)mm;流动相:甲醇-水(V∶V=50∶50);流速:0.8 mL/min,检测波长:276 nm.
1.3 血样品的采集
8名健康男性志愿者,年龄19~22岁,体重49~70 kg.受试者均经过临床体检和实验室检查,心、肝、肾正常.受试前一周未服任何药物,受试期间禁烟酒〔2〕.采用随机交叉试验法,在禁食12 h后,先后口服(间隔2周)单剂量试验药(T)和参比药(R)各20 mg,200 mL温开水送服.服药前取空白血,服用T或R后分别于0.25、0.5、0.75、1.0、2.0、4.0、8.0、12.0、24.0和34.0 h取静脉血5 mL,离心(30 000 r/min,10 min),取血浆,保存于-20℃备测.
, 百拇医药
1.4 血样品的测定
1.4.1 血样品的处理
取1.0 mL血清,加入5 mL正庚烷-异丙醇(V∶V=95∶5)充分混匀,振摇15 min后,离心(10 000 r/min,10 min),提取液于恒温水浴上氮气吹干,残渣用100 μL流动相定容,取50 μL进行HPLC分析测定.
1.4.2 标准曲线的制备
配制含西沙必利0、5.5、11.0、22.0、33.0、55.0 ng/mL浓度的血浆标准液.如上法处理后测定.测定时,若发现超出标准曲线范围,将样品稀释后重测,以后者结果为准.
2 结果
2.1 色谱行为
, http://www.100md.com
在实验测试条件下,西沙必利和其它杂质色谱峰分离良好,详见图1.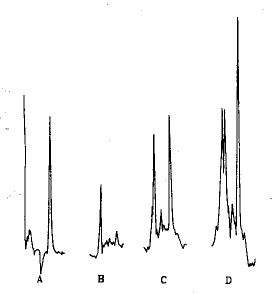
Fig.1 Chromatography by HPLC
A—Cisapride;B—Blank plasma;C—The blank plasma mixed with cisapried;D—The plasma sample of cisapride
2.2 方法学研究
在5.5~55 ng/mL浓度范围内,以浓度(ng/mL)对峰高(UV)作直线回归,西沙必利线性关系良好,直线方程为C=0.995+0.003 4H,C为西沙必利的浓度(ng/mL);H为峰高(UV);r=0.998 9(n=5).按信噪比(S/N)=2计,最小检测浓度为1 ng/mL.方法的日内变异系数(RSD)为(4.9±1.7)%(n=3),日间变异系数(RSD)为(4.8±2.1)%(n=3).11.0 ng/mL、33.0 ng/mL和55.0 ng/mL的回收率分别为(76.4±7.5)%、(99.5±5.0)%和(99.4±4.0)%,平均回收率为(91.8±5.8)%.
, 百拇医药
2.3 相对生物利用度研究
正常人分别口服单剂量西沙必利片剂和普瑞博思片剂后,测得不同时间血药浓度,见表1、2.西沙必利片剂和普瑞博思片剂的血药浓度数据采用北京计算中心编制的3P97程序处理,输入原始血药浓度时间数据,用非房室模型估算药代动力学参数(梯形法估算AUC、Cmax和Tmax均为实测值),生物利用度主要参数见表3.
Tab.1 The plasma concentrations of the tested cisapride Time/h
Plasma concentration/ng。mL-1
1
2
, 百拇医药
3
4
5
6
7
8 ±s
±s
0.25
37.5
24.5
26.6
16.1
43.9
, 百拇医药
4.3
43.6
14.5
26.38±
14.47
0.50
102.7
58.7
51.9
30.6
85.3
10.2
85.1
, http://www.100md.com
41.5
58.25±
31.22
0.75
95.5
63.5
64.3
51.0
104.0
14.0
94.4
57.6
68.04±
, http://www.100md.com
29.51
1.00
97.5
66.5
67.3
62.4
113.8
20.0
113.3
60.7
75.19±
31.62
2.00
, 百拇医药
86.2
60.2
42.3
59.8
88.6
37.5
107.0
59.0
67.58±
24.13
4.00
58.6
48.6
, 百拇医药
42.3
28.0
85.3
25.9
104.6
35.4
53.59±
28.13
8.00
36.7
30.7
39.6
16.6
, 百拇医药
51.4
25.4
54.5
21.2
34.51±
13.68
12.0
21.7
21.7
27.6
14.7
27.6
13.6
, 百拇医药
32.8
16.1
21.98±
6.95
24.0
8.0
10.0
16.0
10.2
8.1
13.5
11.6
10.9
, http://www.100md.com
11.04±
2.69
34.0
3.3
7.3
8.8
5.8
5.5
10.4
9.9
9.6
7.58±
2.53
, http://www.100md.com
Tab.2 The plasma concentrations of the reference cisapride Time/h
Plasma concentration/ng。mL-1
1
2
3
4
5
6
7
8 ±s
±s
, 百拇医药
0.25
21.0
12.9
26.8
20.1
36.0
6.8
26.8
34.9
23.16±
10.12
0.50
48.8
, 百拇医药
33.1
54.0
40.8
115.4
8.2
54.0
51.6
50.74±
30.30
0.75
70.7
77.1
94.8
, http://www.100md.com
55.0
87.4
29.9
94.8
106.9
77.08±
25.01
1.00
63.6
58.1
95.1
67.7
88.1
, 百拇医药
43.5
95.1
52.0
70.40±
20.00
2.00
56.2
56.5
91.0
57.3
51.6
53.7
91.0
, http://www.100md.com
40.9
62.28±
18.48
4.00
45.6
40.1
55.6
32.1
42.3
30.3
55.6
27.8
41.18±
, 百拇医药
10.81
8.00
30.3
26.0
35.3
23.5
25.5
25.0
35.3
11.2
26.51±
7.71
12.0
, 百拇医药
21.4
22.5
26.8
17.2
22.5
19.8
26.8
27.0
23.00±
3.62
24.0
14.1
14.3
, http://www.100md.com
18.7
12.1
19.7
7.0
18.7
12.1
14.59±
4.31
34.0
12.0
13.7
15.5
8.7
, 百拇医药
8.7
3.0
15.5
8.7
10.68±
4.31
Tab.3 The main bioavailability parameters of the tested tablet-reference tablet AUC0-34/ng。(mL。h)-1
Tmax/h
Cmax/ng。mL-1
, http://www.100md.com
Ke/h-1
T1/2/h
F/%
R
T
R
T
R
T
R
T
R
T
, http://www.100md.com
x 802.57
820.39
0.97
1.06
85.21
78.02
0.040
0.059
20.76
14.49
100.0
, http://www.100md.com
s 177.14
245.10
0.45
0.42
21.22
28.20
0.021
0.026
7.75
7.41
14.7
P>0.05 西沙必利片剂的人体相对生物利用度按下式求算: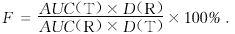
, 百拇医药
根据西沙必利片剂和普瑞博思片剂的AUC、Tmax、Cmax、Ke和T1/2Ke进行方差分析和双单侧t检验,结果表明两种制剂在统计学上无显著性差异,并具生物等效性.
3 结论
作者实验建立的HPLC检测血浆中西沙必利含量的方法简便易行.药物最小检测浓度为1 ng/mL,血浆药物平均回收率为(91.8±5.8)%,日间和日内RSD值均未超过10%,符合药物动力学研究技术要求,证实该法灵敏、稳定、重现性好,可用于西沙必利血药浓度和相对生物利用度的测定.
8名志愿者口服20 mg试验片(T)和参比片(R)后,达峰时间(Tmax)分别为(1.06±0.42)h和(0.97±0.45)h,峰浓度(Cmax)分别为(78.02±28.20)ng/mL和(85.21±21.22)ng/mL,表明该品口服后吸收迅速.实验测得试验片的相对生物利用度为(100.0±14.7)%,两种片剂的生物利用度主要参数经统计学处理无显著性差异(P>0.05),表明两片剂具有生物等效性.■
参考文献:
[1]陈克威.新型胃肠动力药—西沙必利.中国医院药学杂志,1995,15(8):378
[2]中华人民共和国卫生部药政局.新药(西药)临床研究指导原则汇编:药物制剂人体生物利用度指导原则.北京:人民卫生出版社,1993.163
收稿日期:1999-05-16, 百拇医药
单位:代宗顺 侯淑贤 刘奕明(同济医科大学临床药理研究所,武汉 430030);陈彬(鞍山市中心医院药剂科,鞍山 114001)
关键词:西沙必利;相对生物利用度;高效液相色谱法
沈阳药科大学学报000204 摘 要:健康志愿者8名,随机交叉单次口服西安杨森制药有限公司(简称西安杨森)生产的参比普瑞博思片剂(简称R)和广西田丰制药有限公司(简称广西田丰)研制的试验西沙必利片剂(简称T).用高效液相色谱法测定血药浓度.结果求得R和T的Cmax为(85.21±21.22)ng/mL和(78.02±28.20)ng/mL,Tmax为(0.97±0.45)h和(1.06±0.42)h;AUC(0-n)为(802.57±177.4)ng/mL.h和(820.39±245.10)ng/mL.h.广西田丰西沙必利片剂的人体相对生物利用度为(100.0±14.7)%.两种制剂的AUC(0-n)和Cmax经统计分析,均无显著性差异.
, 百拇医药
分类号:R912
Relative Bioavailability of the Cisapride Tablets in a Human Body after Administration of a Single Oral Dose
Dai Zongshun Hou Shuxian Liu Yiming Chen Bin
(Tongji Medical University,Wuhan 430030)
Abstract:The relative bioavailability of the two cisapride tablets,which were respectively produced by Yangsen(R)and Tianfeng(T)Pharmaceutical Companies,was studied in 8 healthy volunteers after their taking orally a single dose(20 mg) according to a randomized crossover design.The blood concentrations were determined by HPLC.The main parameters were as follows:Cmax(85.21±21.2)ng/mL and (78.02±28.20)ng/mL;Tmax(0.97±0.45)h and(1.06±0.42)h; AUC(0-n)(802.57±177.14)ng/mL。h and (820.39±245.10)ng/mL。h.The relative bioavailability of Tianfeng′s product was (100.0±14.7)%.The result of the statistical analysis showed that both preparations were bioequivalent.
, 百拇医药
Key words:cisapride;relative bioavailability;HPLC▲
西沙必利(cisapride)是第三代胃肠动力药,临床广泛用于治疗返流性食管炎、消化不良、胃轻瘫、便秘、假性肠梗阻.由于其不具有抗多巴胺作用,而是通过对5-HT不同受体的多重作用来实现其促力作用,所以副作用小,且发生率仅约2.5%〔1〕.西沙必利的相对生物利用度国内尚未见报道.作者采用HPLC法对广西田丰生产的西沙必利片相对生物利用度进行研究.
1 实验材料与方法
1.1 药品与试剂
试验药品:西沙必利片剂(T),广西田丰制药有限公司生产,每片10 mg,批号:980118;标示量=102.0%.
参比药品:普瑞博思片剂(R),西安杨森制药有限公司生产,每片10 mg,批号,9707104.批准文号:[96]卫药准字J-16(2)号;标示量=100.5%.
, 百拇医药
试剂:甲醇、异丙醇、正庚烷等均为分析纯.
1.2 仪器与色谱条件
日本岛津LC-1型高效液相色谱仪;SPC-1型检测器;固定相:WYG-C18 5 μm不锈钢柱(4.6×150)mm;流动相:甲醇-水(V∶V=50∶50);流速:0.8 mL/min,检测波长:276 nm.
1.3 血样品的采集
8名健康男性志愿者,年龄19~22岁,体重49~70 kg.受试者均经过临床体检和实验室检查,心、肝、肾正常.受试前一周未服任何药物,受试期间禁烟酒〔2〕.采用随机交叉试验法,在禁食12 h后,先后口服(间隔2周)单剂量试验药(T)和参比药(R)各20 mg,200 mL温开水送服.服药前取空白血,服用T或R后分别于0.25、0.5、0.75、1.0、2.0、4.0、8.0、12.0、24.0和34.0 h取静脉血5 mL,离心(30 000 r/min,10 min),取血浆,保存于-20℃备测.
, 百拇医药
1.4 血样品的测定
1.4.1 血样品的处理
取1.0 mL血清,加入5 mL正庚烷-异丙醇(V∶V=95∶5)充分混匀,振摇15 min后,离心(10 000 r/min,10 min),提取液于恒温水浴上氮气吹干,残渣用100 μL流动相定容,取50 μL进行HPLC分析测定.
1.4.2 标准曲线的制备
配制含西沙必利0、5.5、11.0、22.0、33.0、55.0 ng/mL浓度的血浆标准液.如上法处理后测定.测定时,若发现超出标准曲线范围,将样品稀释后重测,以后者结果为准.
2 结果
2.1 色谱行为
, http://www.100md.com
在实验测试条件下,西沙必利和其它杂质色谱峰分离良好,详见图1.

Fig.1 Chromatography by HPLC
A—Cisapride;B—Blank plasma;C—The blank plasma mixed with cisapried;D—The plasma sample of cisapride
2.2 方法学研究
在5.5~55 ng/mL浓度范围内,以浓度(ng/mL)对峰高(UV)作直线回归,西沙必利线性关系良好,直线方程为C=0.995+0.003 4H,C为西沙必利的浓度(ng/mL);H为峰高(UV);r=0.998 9(n=5).按信噪比(S/N)=2计,最小检测浓度为1 ng/mL.方法的日内变异系数(RSD)为(4.9±1.7)%(n=3),日间变异系数(RSD)为(4.8±2.1)%(n=3).11.0 ng/mL、33.0 ng/mL和55.0 ng/mL的回收率分别为(76.4±7.5)%、(99.5±5.0)%和(99.4±4.0)%,平均回收率为(91.8±5.8)%.
, 百拇医药
2.3 相对生物利用度研究
正常人分别口服单剂量西沙必利片剂和普瑞博思片剂后,测得不同时间血药浓度,见表1、2.西沙必利片剂和普瑞博思片剂的血药浓度数据采用北京计算中心编制的3P97程序处理,输入原始血药浓度时间数据,用非房室模型估算药代动力学参数(梯形法估算AUC、Cmax和Tmax均为实测值),生物利用度主要参数见表3.
Tab.1 The plasma concentrations of the tested cisapride Time/h
Plasma concentration/ng。mL-1
1
2
, 百拇医药
3
4
5
6
7
8
 ±s
±s0.25
37.5
24.5
26.6
16.1
43.9
, 百拇医药
4.3
43.6
14.5
26.38±
14.47
0.50
102.7
58.7
51.9
30.6
85.3
10.2
85.1
, http://www.100md.com
41.5
58.25±
31.22
0.75
95.5
63.5
64.3
51.0
104.0
14.0
94.4
57.6
68.04±
, http://www.100md.com
29.51
1.00
97.5
66.5
67.3
62.4
113.8
20.0
113.3
60.7
75.19±
31.62
2.00
, 百拇医药
86.2
60.2
42.3
59.8
88.6
37.5
107.0
59.0
67.58±
24.13
4.00
58.6
48.6
, 百拇医药
42.3
28.0
85.3
25.9
104.6
35.4
53.59±
28.13
8.00
36.7
30.7
39.6
16.6
, 百拇医药
51.4
25.4
54.5
21.2
34.51±
13.68
12.0
21.7
21.7
27.6
14.7
27.6
13.6
, 百拇医药
32.8
16.1
21.98±
6.95
24.0
8.0
10.0
16.0
10.2
8.1
13.5
11.6
10.9
, http://www.100md.com
11.04±
2.69
34.0
3.3
7.3
8.8
5.8
5.5
10.4
9.9
9.6
7.58±
2.53
, http://www.100md.com
Tab.2 The plasma concentrations of the reference cisapride Time/h
Plasma concentration/ng。mL-1
1
2
3
4
5
6
7
8
 ±s
±s, 百拇医药
0.25
21.0
12.9
26.8
20.1
36.0
6.8
26.8
34.9
23.16±
10.12
0.50
48.8
, 百拇医药
33.1
54.0
40.8
115.4
8.2
54.0
51.6
50.74±
30.30
0.75
70.7
77.1
94.8
, http://www.100md.com
55.0
87.4
29.9
94.8
106.9
77.08±
25.01
1.00
63.6
58.1
95.1
67.7
88.1
, 百拇医药
43.5
95.1
52.0
70.40±
20.00
2.00
56.2
56.5
91.0
57.3
51.6
53.7
91.0
, http://www.100md.com
40.9
62.28±
18.48
4.00
45.6
40.1
55.6
32.1
42.3
30.3
55.6
27.8
41.18±
, 百拇医药
10.81
8.00
30.3
26.0
35.3
23.5
25.5
25.0
35.3
11.2
26.51±
7.71
12.0
, 百拇医药
21.4
22.5
26.8
17.2
22.5
19.8
26.8
27.0
23.00±
3.62
24.0
14.1
14.3
, http://www.100md.com
18.7
12.1
19.7
7.0
18.7
12.1
14.59±
4.31
34.0
12.0
13.7
15.5
8.7
, 百拇医药
8.7
3.0
15.5
8.7
10.68±
4.31
Tab.3 The main bioavailability parameters of the tested tablet-reference tablet AUC0-34/ng。(mL。h)-1
Tmax/h
Cmax/ng。mL-1
, http://www.100md.com
Ke/h-1
T1/2/h
F/%
R
T
R
T
R
T
R
T
R
T
, http://www.100md.com
x 802.57
820.39
0.97
1.06
85.21
78.02
0.040
0.059
20.76
14.49
100.0
, http://www.100md.com
s 177.14
245.10
0.45
0.42
21.22
28.20
0.021
0.026
7.75
7.41
14.7
P>0.05 西沙必利片剂的人体相对生物利用度按下式求算:
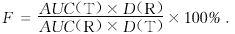
, 百拇医药
根据西沙必利片剂和普瑞博思片剂的AUC、Tmax、Cmax、Ke和T1/2Ke进行方差分析和双单侧t检验,结果表明两种制剂在统计学上无显著性差异,并具生物等效性.
3 结论
作者实验建立的HPLC检测血浆中西沙必利含量的方法简便易行.药物最小检测浓度为1 ng/mL,血浆药物平均回收率为(91.8±5.8)%,日间和日内RSD值均未超过10%,符合药物动力学研究技术要求,证实该法灵敏、稳定、重现性好,可用于西沙必利血药浓度和相对生物利用度的测定.
8名志愿者口服20 mg试验片(T)和参比片(R)后,达峰时间(Tmax)分别为(1.06±0.42)h和(0.97±0.45)h,峰浓度(Cmax)分别为(78.02±28.20)ng/mL和(85.21±21.22)ng/mL,表明该品口服后吸收迅速.实验测得试验片的相对生物利用度为(100.0±14.7)%,两种片剂的生物利用度主要参数经统计学处理无显著性差异(P>0.05),表明两片剂具有生物等效性.■
参考文献:
[1]陈克威.新型胃肠动力药—西沙必利.中国医院药学杂志,1995,15(8):378
[2]中华人民共和国卫生部药政局.新药(西药)临床研究指导原则汇编:药物制剂人体生物利用度指导原则.北京:人民卫生出版社,1993.163
收稿日期:1999-05-16, 百拇医药