大鼠颌下腺血管内皮生长因子cDNA的转移及表达
作者:张从纪 李慧增 杨军 黄庆愿 孙远 史文进
单位:张从纪(第三军医大学:附属西南医院口腔科);李慧增(第三军医大学:附属西南医院口腔科);杨军(第三军医大学:附属西南医院口腔科);黄庆愿(第三军医大学:高原军事医学系高原医学研究室、病理生理学教研室;重庆400038)
关键词:颌下腺;血管内皮生长因子;基因治疗
第三军医大学学报000220
提要 目的:探讨以颌下腺为靶器官,进行血管内皮 生长因子(VEGF)基因治疗后,颌下腺中VEGF含量变化 。方法:构建了VEGF基因表达的真核细胞表达载体, 以阳离子脂质体为介质,向大鼠颌下腺转染外源性 的VEGF基因,应用RT-PCR技术观察VEGF基因的表达,ELISA方法检测颌下腺中VEGF的含量变化。结果:转pBKCMV-VEGF121基因后第1天,大鼠颌下腺内VEGF的表达及涎液中VEGF的含 量即开始增高,术后2~3d达到高峰,之后逐渐下降 ,但高水平表达持续5d左右,与同期对照组相比,二 者差别显著。结论:以颌下腺为靶器官,阳离子脂 质体为载体进行VEGF基因转染,可使外源基因在颌下 腺内稳定持续表达,改变了涎液中细胞因子的含量 ,为临床上促进口内伤口的愈合提供了新的途径和 依据。
, 百拇医药
中图法分类号R392.2;R781.7 文献标识码A
文章编号:1000-5404(2000)02-0166-04
Expression of vascular endothelial growth factor transferred into salivary
glands in rats
ZHANG Cong-ji, LI Hui-zeng, YANG Jun, HUANG Qing-yuan, SUN Yuan, SHI Wen-jin
(Department of Stomatology, Southwest Hospital, Third Military Medical University, Chongqing 400038)
, 百拇医药
Abstract Objective: To study the feasibility of using vascular endothelial growth factor (VEGF) gene therapy for salivary glands and observe the changes in content of VEGF in spittle. Methods: VEGF cDNA was cloned into eukaryotic expression vector pBKCMV and the VEGF gene was transferred into rat maxillary glands mediated by lipotect AMINE. The expression of VEGF gene was investigated by RT-PCR and the content of VEGF in spittle was observed by ELISA. Results: The expression of VEGF gene and the content of VEGF were significantly higher in the experimental group than in the control. It reached its peak from the 2nd to 3rd d after treatment and remained high for 5 d. Conclusion: After being mediated by lipotect AMINE, the VEGF gene can express steadily and constantly. The content of VEGF in spittle becomes higher. It provides a new way for promoting oral wound healing in clinical practice.
, 百拇医药
Key words salivary gland; vascular endothelial growth factor; gene therapy
口腔粘膜的损伤是口腔科的常见病症。与其它组织相比,具有明显的愈合快的特点,目前认为这与涎 液对维持口腔内环境的稳定性有关[1]。随着分子生物学的发展及对细胞因子认识的深入,将细胞因子直 接作为促进创伤愈合的药物已用于实验及临床,并取得一定的疗效,但也存在有费用高和药物持续时 间短的缺点[2]。本研究应用基因工程技术,将血管再 生相关因子:血管内皮生长因子(Vascular endothelial growth factor,VEGF)的DNA转染到颌下腺中,增强其在颌下腺中的表达,提高涎液中VEGF的含量,为进一步促进口内创 伤愈合的临床治疗提供基础。
1 材料与方法
1.1 动物与手术
, 百拇医药
Wistar大鼠48只,由本校动物所提供,体重200~220g,雌 雄不拘,分为实验组(24只),和对照组(24只)。 以2%戊巴比妥钠(30mg/kg)麻醉,在颈部中央沿身体长轴方向切开皮肤、皮下组织,暴露颌下腺囊膜, 用6号针在直视下注入DNA-脂质体复合物,对照组动 物,以等量的空白脂质体注射。分层缝合伤口,术 后常规换药。各组动物分别于术前和术后1、2、3、4、 5、7d,在麻醉下用消毒的1cm×1cm×1cm的聚乙烯醇( Polyvinylalcohol,PVA)海绵收集口腔涎液,取出后离心,取上清,-70°C保存。之后,分离和切取颌下腺,液氮 中保存[3]。
1.2 VEGF真核表达质粒的构建与扩增
以EcoRⅠ和SalⅠ双酶切pUC19-VEGF121载体,(本校黄庆愿 博士提供)0.8%琼脂糖凝胶电泳分离回收全长大鼠 VEGF121cDNA片段,与同样酶切的pBKCMV(Stratagene公司产品)连接 ,构建成真核表达载体pBKCMV-VEGF121,其中目的基因可 编码121个氨基酸的VEGF121,含有信号肽序列,其上游有 巨细胞病毒启动子(CMV)及其增强子,酶切鉴定正确后,碱裂解法大量制备,纯化后,存-20℃备用[4]。
, 百拇医药
1.3 质粒注射液的制备
将保存的pBKCMV-VEGF121质粒DNA溶入含5%等渗葡萄糖PBS中 ,配制成1g/L浓度。再加入到LipofectinAMINE(GIBCOBRL)中,脂 质体与质粒DNA溶液的体积比为10∶1,静置30min。每只 颌下腺注入0.5ml的脂质体-DNA复合物。
1.4 颌下腺中VEGFmRNA的含量
采用RT-PCR法检测颌下腺中VEGFmRNA的含量[5]。
RNA的提取:从液氮中取出各标本组织100mg,用总RNA提 取试剂盒(美国Promega公司)提取组织总RNA,经紫外分 光光度计测定总RNA浓度和纯度,计算样品总RNA浓度。 定量RNA并调成1μg/μl。
, 百拇医药 1.4.1 逆转录 在20μl的反应体系中加入RNA2μl,5×buffer4 μl,DTT(Promega)0.5μl,dNTPs(25mmol/L)0.5μl(Promega),Rnasin(Promega) 0.5μl,Moloney鼠白血病病毒(M-MLV)逆转录酶(200U/μl)1μl, 寡(dT)12~18引物2μl,加水至20μl,混匀,37℃作用60min, 95℃作用5min,灭活逆转录酶,立即冰浴冷却。
1.4.2 PCR反应 将逆转录产物进行扩增[4]。VEGF正义引物5′-TTGCTGCTCTACCTCCAC-3′,反义引物5′-AATGCTTTCTCCGCTCTG-3′,内参照β-肌动蛋白(β-actin)5′端引物序列为5′-AAGGTGACCCAGAT-CATGTTTGAG-3′,3′端引物序列为 5′-AGGAGGAGCAATGATCTTGATCTT-3′。20μl的反应体系中加入:10×buffer2μl,25mmol/Lmcl21.6μl,25mmol/LdNTPs1.5μl,β-actin引物 各0.4μl,VEGF引物各0.4μl,2U/μlTag酶0.4μl,反转录产 物1.5μl,加去离子水至20μl。将反应管置于PCR仪(美国 Perkin-Elmer9600型)上,94℃30s,55°C1min,72°C1min,共30个 循环。最后72°C延伸7min。
, http://www.100md.com
1.4.3 电泳及定量分析 8μlPCR产物经1.2%的普通琼脂糖 凝胶电泳后,溴化乙啶染色,电泳完毕后在紫外灯 下观察照相,密度扫描分析PCR产物带。将VEGF与β-actin比值作为VEGF表达水平的参数,对VEGFPCR产物相对定量。
1.5 涎液中VEGF含量
涎液中VEGF含量采用ELISA试剂盒(R&Dsystems,Minneapolis,MN) 检测,测定标本时先解冻,10000×g离心10min,去除杂质。按试剂盒说明书进行操作,以微量滴定板读数 仪测定450nm的光密度,进行定量检测,结果以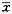 ±s表 示。所有检测的OD值减去标准VEGF含量为0的平均OD值, 以VEGF的含量对其OD数的log值制图,求得标准曲线,据 此取得各标本中VEGF的含量。
±s表 示。所有检测的OD值减去标准VEGF含量为0的平均OD值, 以VEGF的含量对其OD数的log值制图,求得标准曲线,据 此取得各标本中VEGF的含量。
2 结果
, 百拇医药
2.1 pBKCMV-VEGF121表达质粒载体的酶切鉴定
pUC19-VEGF121载体及pBKCMV经EcoRⅠ和SalⅠ双酶切后分别回 收499bp的目的基因片段和4.5kb的载体片段,两者经T4DNA连 接酶作用,构建成pUC19-VEGF121质粒,进一步酶切鉴定 ,见图1、2,可见片段大小与理论值相符,证明载体 构建正确。
图1 pUC19-VEGF121酶切鉴定
Fig1 Identification of pUC19-VEGF121 by digest enzyme
M:Marker(λDNAHindⅢ);A:pUC19-VEGF121;B:pUC19-VEGF121digestedbyEcoRⅠandSalⅠ;C:VEGF121DNA
, http://www.100md.com
图2 pBKCMV-VEGF121酶切鉴定
Fig2 Identification of pBKCMV-VEGF121 by digest enzyme
M:Marker(λDNA Hind Ⅲ);A:pBKCMV-VEGF121;B:pBKCMV-VEGF121 digested by EcoR Ⅰ and Sal Ⅰ;C:VEGF121 DNA
2.2 VEGF基因的表达
由于β-actin几乎存在于所有细胞中,并且含量相对 稳定,VEGF的基因表达程度以VEGFmRNA相对于β-actinmRNA取 得。大鼠颌下腺VEGF基因转染前后腺体中VEGFmRNA含量见 表1。
, http://www.100md.com
表1 大鼠颌下腺VEGF基因转染前后腺体中VEGF mRNA含量
Tab1 Content of VEGF mRNA in submaxillary gland before and after VEGF gene transfection
Pre-operation
Post-operation(d)
1
2
3
4
5
7
, http://www.100md.com
Gene therapy
0.531±0.061*
0.732±0.032*
1.372±0.2**##
1.14±0.11**##
0.875±0.21*#
0.716±0.3*#
0.731±0.22*#
Control
, 百拇医药
0.524±0.121*
0.726±0.1*
0.686±0.12
0.574±0.34
0.533±0.2
0.590±0.11
0.552±0.2
*:P<0.05,**:P<0.01 vs pre-operation;#P<0.05,##P<0.01 vs control
2.3 颌下腺转染VEGF基因后涎液中VEGF的水平变化见表2
, 百拇医药
表2 大鼠涎液中VEGF的含量(pg/ml)
Tab1 Content of VEGF in rat spittle(pg/ml)
Pre-operation
Post-operation(d)
1
2
3
4
5
7
Gene therapy
, 百拇医药
66.0±29.6
167.25±45.2*
214.48±66.7**#
201.03±47.8**##
177.46±42.3**##
128.45±25.4*#
130.12±50.4*#
Control
74.5±36.3
135.44±51.1*
, 百拇医药
122.98±67.0*
80.67±44.5
92.35±34.4
88.79±52.2
75.68±40.8
*:P<0.05,**:P<0.01 vs pre-operation;#P<0.05,##P<0.01 vs control
3 讨论
VEGF是近年来新发现的一种特异性促进血管内皮细胞 增殖的有丝分裂原,它在血管发生,维持血管内皮 完整性和通透性,以及在胚胎发育,肿瘤的生成和 生长,炎症和创伤愈合等方面均有重要意义[5]。 Taichman等[1]发现涎液中也存在有VEGF,并初步证实VEGF单独 或和涎液中其它因子协同作用,保护口腔粘膜[1,4], VEGF的这些特性表明,VEGF在创伤愈合过程中具有重要 作用,将VEGF用于促进伤口的愈合研究也日益受到关 注。
, 百拇医药
以创伤组织为靶器官进行基因转移,在治疗过程中 难免在接近伤口的区域产生新的物理、化学、生物 等因素的刺激,并诱导免疫功能改变等一系列反应 ,在促伤口愈合的同时,也增加了新的负面影响。 而以涎腺为靶器官进行口内创伤的治疗,可以克服 上述缺陷,更为安全,可行,便利[6,7]。
本研究中采用的LipofectAMINE系多聚阳离子脂质体,具 有较多的正电荷,增强了与DNA及靶细胞的亲合能力, 并使其能在形成较多复合体颗粒的前题下携带较多 的DNA分子进入靶细胞,因此较其它阳离子脂质体具有 更理想的转染效率[8]。另外,为进一步提高VEGF基因的 转染率,本实验将原核的VEGF表达质粒改建为以CMV为启 动子的真核表达质粒-pBKCMV-VEGF121,全长约5.0kb,其中 位于EcoRⅠ和SalⅠ位点间为499bp的VEGFcDNA序列,故用EcoRⅠ和SalⅠ双酶切pBKCMV-VEGF121表达质粒可得约4.5kb和0.5kb2个 片段,本实验的酶切结果与之相符,表明质粒及VEGF基 因插入正确。
, 百拇医药
由实验结果可见,大鼠颌下腺经外源性VEGF基因转染 后,于术后第1天,即表现出VEGFmRNA含量的升高,提示 VEGF合成的增加,于术后2~3d达到高峰,并在高水平 表达持续一周的时间,与术前及对照组相比,差异 显著。说明外源性的VEGF已成功转染到颌下腺体内, 并得以正常表达。同样涎液中的VEGF含量的动态变化 也得以再次证实,涎液中VEGF含量的变化与VEGFmRNA的含 量变化基本相符。
另外,对照组虽然未进行VEGF基因的转染,但其术后 1~2d内颌下腺中VEGFmRNA水平及涎液中VEGF含量均有所升 高,且差异显著,这是由于本实验在大鼠进行基因 转染的当天,即又进行口内创伤模型的制备,在外 伤的刺激下,使涎腺合成和分泌VEGF的量有所增加,这与文献报道相一致[1,9]。但这并未影响到作为对 照组与基因转染组的对比,从结果可见,二者的差 异仍然显著。
VEGF是主要的血管再生刺激因子,调节血管生长,促进创伤愈合过程中肉芽组织的生成[4],在体外实验中 已得到证实,然而在体内实验中,由于给药方式的 不同,疗效差异很大。创伤愈合需要在各阶段细胞 因子的持续刺激下完成[10],在伤口中直接给予重组 的细胞因子治疗,存在有给药不便,药物半衰期短 等不利因素,难以达到持续作用的效果。基因治疗 无疑是克服上述缺陷的首选方法,本实验结果表明 ,通过以颌下腺为靶器官进行细胞因子的基因转移 ,可使涎液中该因子的含量明显提高,并持续5d左右 的时间,足以达到伤口愈合所需时间。
, 百拇医药
总之,颌下腺是进行基因转染的理想的靶器官,利 用其内分泌腺和外分泌腺的特点,可以将促进创伤 愈合的细胞生长因子等,通过基因工程技术,将其 DNA转染入腺体内,使外源基因得以表达,从而改变口 腔及上消化道的内环境,为临床上进行口内组织损 伤的治疗提供了新的途径和依据。
作者简介:张从纪(1968.2),男,河北省永年县人,硕 士,住院医师,主要从事颌面部创伤及修复方面的研究,发表论文7篇。电话:(023)68754135
作者单位:孙远(第三军医大学:附属西南医院口腔科;)
史文进(第三军医大学:附属西南医院口腔科;)
参考文献
[1]Taichman N S, Cruchley A T, Fletcher L M, et al .Vascular endothelial growth factor in normal human salivary glands and saliva: a possible role in the maintenance of mucosal homeostasis [J]. Laboratory Investigation,1998,78(7): 869-875.
, 百拇医药
[2]Winn D M, Diehl S R, Horowitz A M, et al. Scientific progress in understanding oral and pharyngeal cancers[J]. J Am Dent Assoc,1998,129(6):713-718.
[3]Nissen N N, Polverini P J, Koch A E, et al. Vascular en-dothelial growth factor mediates angiogenic activity during the proliferative phase of wound healing[J]. Am J Pathol,1998,152 (6): 1 445-1 452.
[4]Ilan N, Mahooti S, Madri J A. Distinct signal transduction pathways are utilized during the tube f ormation and survival phases of in vitro angiogenesis[J]. J Cell Sci,1998,111 (Pt 24): 3 621- 3 631.
, 百拇医药
[5]Gille J,Khalik M,Konig V,et al . Hepatocyte growth factor/ scatter factor (HGF/SF) induces vascular permeability factor (VPF/VEGF) expression by cultured keratinocytes[J]. J Invest Dermatol,1998,111(6): 1 160-1 175.
[6]He X,Goldsmith C M,Marmary Y, et al. Systemic action of human growth hormone following adenovirus-mediated gene trans-fer to rat submandibular glands[J]. Gene Ther,1998,5(4): 537-541.
[7]O'Connell B C,Lillibridge C D,Ambudkar I,et al .Somatic gene transfer to salivary glands[J]. Ann N Y Acad Sci,1998,842(2):171- 180.
, http://www.100md.com
[8]Kagami H, Atkinson J C, Michalek S M, et al .Repetieive adenovirus administration to the parotid gland: Role of immuno logical barriers and induction of oral tolerance[J]. Hum Gene Ther,1998,9(3):305-313.
[9]Yasushi F,Kenneth W . Akt mediates cytoprotection of endothe-lial cells by vascular endothelial growth factor in an anchorage-dependent manner[J]. J Biol Chem, 1999, 274(23): 16 349-16 354.
[10]Oxford G O, Nguyen K H, Alford C E, et al. Elevated salivary EGF levels stimulated by periodontal surgery[J]. J Periodontol,1998, 69(4):479-484.
收稿日期:1999-10-06;修回日期:1999-12-22, 百拇医药
单位:张从纪(第三军医大学:附属西南医院口腔科);李慧增(第三军医大学:附属西南医院口腔科);杨军(第三军医大学:附属西南医院口腔科);黄庆愿(第三军医大学:高原军事医学系高原医学研究室、病理生理学教研室;重庆400038)
关键词:颌下腺;血管内皮生长因子;基因治疗
第三军医大学学报000220
提要 目的:探讨以颌下腺为靶器官,进行血管内皮 生长因子(VEGF)基因治疗后,颌下腺中VEGF含量变化 。方法:构建了VEGF基因表达的真核细胞表达载体, 以阳离子脂质体为介质,向大鼠颌下腺转染外源性 的VEGF基因,应用RT-PCR技术观察VEGF基因的表达,ELISA方法检测颌下腺中VEGF的含量变化。结果:转pBKCMV-VEGF121基因后第1天,大鼠颌下腺内VEGF的表达及涎液中VEGF的含 量即开始增高,术后2~3d达到高峰,之后逐渐下降 ,但高水平表达持续5d左右,与同期对照组相比,二 者差别显著。结论:以颌下腺为靶器官,阳离子脂 质体为载体进行VEGF基因转染,可使外源基因在颌下 腺内稳定持续表达,改变了涎液中细胞因子的含量 ,为临床上促进口内伤口的愈合提供了新的途径和 依据。
, 百拇医药
中图法分类号R392.2;R781.7 文献标识码A
文章编号:1000-5404(2000)02-0166-04
Expression of vascular endothelial growth factor transferred into salivary
glands in rats
ZHANG Cong-ji, LI Hui-zeng, YANG Jun, HUANG Qing-yuan, SUN Yuan, SHI Wen-jin
(Department of Stomatology, Southwest Hospital, Third Military Medical University, Chongqing 400038)
, 百拇医药
Abstract Objective: To study the feasibility of using vascular endothelial growth factor (VEGF) gene therapy for salivary glands and observe the changes in content of VEGF in spittle. Methods: VEGF cDNA was cloned into eukaryotic expression vector pBKCMV and the VEGF gene was transferred into rat maxillary glands mediated by lipotect AMINE. The expression of VEGF gene was investigated by RT-PCR and the content of VEGF in spittle was observed by ELISA. Results: The expression of VEGF gene and the content of VEGF were significantly higher in the experimental group than in the control. It reached its peak from the 2nd to 3rd d after treatment and remained high for 5 d. Conclusion: After being mediated by lipotect AMINE, the VEGF gene can express steadily and constantly. The content of VEGF in spittle becomes higher. It provides a new way for promoting oral wound healing in clinical practice.
, 百拇医药
Key words salivary gland; vascular endothelial growth factor; gene therapy
口腔粘膜的损伤是口腔科的常见病症。与其它组织相比,具有明显的愈合快的特点,目前认为这与涎 液对维持口腔内环境的稳定性有关[1]。随着分子生物学的发展及对细胞因子认识的深入,将细胞因子直 接作为促进创伤愈合的药物已用于实验及临床,并取得一定的疗效,但也存在有费用高和药物持续时 间短的缺点[2]。本研究应用基因工程技术,将血管再 生相关因子:血管内皮生长因子(Vascular endothelial growth factor,VEGF)的DNA转染到颌下腺中,增强其在颌下腺中的表达,提高涎液中VEGF的含量,为进一步促进口内创 伤愈合的临床治疗提供基础。
1 材料与方法
1.1 动物与手术
, 百拇医药
Wistar大鼠48只,由本校动物所提供,体重200~220g,雌 雄不拘,分为实验组(24只),和对照组(24只)。 以2%戊巴比妥钠(30mg/kg)麻醉,在颈部中央沿身体长轴方向切开皮肤、皮下组织,暴露颌下腺囊膜, 用6号针在直视下注入DNA-脂质体复合物,对照组动 物,以等量的空白脂质体注射。分层缝合伤口,术 后常规换药。各组动物分别于术前和术后1、2、3、4、 5、7d,在麻醉下用消毒的1cm×1cm×1cm的聚乙烯醇( Polyvinylalcohol,PVA)海绵收集口腔涎液,取出后离心,取上清,-70°C保存。之后,分离和切取颌下腺,液氮 中保存[3]。
1.2 VEGF真核表达质粒的构建与扩增
以EcoRⅠ和SalⅠ双酶切pUC19-VEGF121载体,(本校黄庆愿 博士提供)0.8%琼脂糖凝胶电泳分离回收全长大鼠 VEGF121cDNA片段,与同样酶切的pBKCMV(Stratagene公司产品)连接 ,构建成真核表达载体pBKCMV-VEGF121,其中目的基因可 编码121个氨基酸的VEGF121,含有信号肽序列,其上游有 巨细胞病毒启动子(CMV)及其增强子,酶切鉴定正确后,碱裂解法大量制备,纯化后,存-20℃备用[4]。
, 百拇医药
1.3 质粒注射液的制备
将保存的pBKCMV-VEGF121质粒DNA溶入含5%等渗葡萄糖PBS中 ,配制成1g/L浓度。再加入到LipofectinAMINE(GIBCOBRL)中,脂 质体与质粒DNA溶液的体积比为10∶1,静置30min。每只 颌下腺注入0.5ml的脂质体-DNA复合物。
1.4 颌下腺中VEGFmRNA的含量
采用RT-PCR法检测颌下腺中VEGFmRNA的含量[5]。
RNA的提取:从液氮中取出各标本组织100mg,用总RNA提 取试剂盒(美国Promega公司)提取组织总RNA,经紫外分 光光度计测定总RNA浓度和纯度,计算样品总RNA浓度。 定量RNA并调成1μg/μl。
, 百拇医药 1.4.1 逆转录 在20μl的反应体系中加入RNA2μl,5×buffer4 μl,DTT(Promega)0.5μl,dNTPs(25mmol/L)0.5μl(Promega),Rnasin(Promega) 0.5μl,Moloney鼠白血病病毒(M-MLV)逆转录酶(200U/μl)1μl, 寡(dT)12~18引物2μl,加水至20μl,混匀,37℃作用60min, 95℃作用5min,灭活逆转录酶,立即冰浴冷却。
1.4.2 PCR反应 将逆转录产物进行扩增[4]。VEGF正义引物5′-TTGCTGCTCTACCTCCAC-3′,反义引物5′-AATGCTTTCTCCGCTCTG-3′,内参照β-肌动蛋白(β-actin)5′端引物序列为5′-AAGGTGACCCAGAT-CATGTTTGAG-3′,3′端引物序列为 5′-AGGAGGAGCAATGATCTTGATCTT-3′。20μl的反应体系中加入:10×buffer2μl,25mmol/Lmcl21.6μl,25mmol/LdNTPs1.5μl,β-actin引物 各0.4μl,VEGF引物各0.4μl,2U/μlTag酶0.4μl,反转录产 物1.5μl,加去离子水至20μl。将反应管置于PCR仪(美国 Perkin-Elmer9600型)上,94℃30s,55°C1min,72°C1min,共30个 循环。最后72°C延伸7min。
, http://www.100md.com
1.4.3 电泳及定量分析 8μlPCR产物经1.2%的普通琼脂糖 凝胶电泳后,溴化乙啶染色,电泳完毕后在紫外灯 下观察照相,密度扫描分析PCR产物带。将VEGF与β-actin比值作为VEGF表达水平的参数,对VEGFPCR产物相对定量。
1.5 涎液中VEGF含量
涎液中VEGF含量采用ELISA试剂盒(R&Dsystems,Minneapolis,MN) 检测,测定标本时先解冻,10000×g离心10min,去除杂质。按试剂盒说明书进行操作,以微量滴定板读数 仪测定450nm的光密度,进行定量检测,结果以
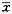 ±s表 示。所有检测的OD值减去标准VEGF含量为0的平均OD值, 以VEGF的含量对其OD数的log值制图,求得标准曲线,据 此取得各标本中VEGF的含量。
±s表 示。所有检测的OD值减去标准VEGF含量为0的平均OD值, 以VEGF的含量对其OD数的log值制图,求得标准曲线,据 此取得各标本中VEGF的含量。2 结果
, 百拇医药
2.1 pBKCMV-VEGF121表达质粒载体的酶切鉴定
pUC19-VEGF121载体及pBKCMV经EcoRⅠ和SalⅠ双酶切后分别回 收499bp的目的基因片段和4.5kb的载体片段,两者经T4DNA连 接酶作用,构建成pUC19-VEGF121质粒,进一步酶切鉴定 ,见图1、2,可见片段大小与理论值相符,证明载体 构建正确。

图1 pUC19-VEGF121酶切鉴定
Fig1 Identification of pUC19-VEGF121 by digest enzyme
M:Marker(λDNAHindⅢ);A:pUC19-VEGF121;B:pUC19-VEGF121digestedbyEcoRⅠandSalⅠ;C:VEGF121DNA

, http://www.100md.com
图2 pBKCMV-VEGF121酶切鉴定
Fig2 Identification of pBKCMV-VEGF121 by digest enzyme
M:Marker(λDNA Hind Ⅲ);A:pBKCMV-VEGF121;B:pBKCMV-VEGF121 digested by EcoR Ⅰ and Sal Ⅰ;C:VEGF121 DNA
2.2 VEGF基因的表达
由于β-actin几乎存在于所有细胞中,并且含量相对 稳定,VEGF的基因表达程度以VEGFmRNA相对于β-actinmRNA取 得。大鼠颌下腺VEGF基因转染前后腺体中VEGFmRNA含量见 表1。
, http://www.100md.com
表1 大鼠颌下腺VEGF基因转染前后腺体中VEGF mRNA含量
Tab1 Content of VEGF mRNA in submaxillary gland before and after VEGF gene transfection
Pre-operation
Post-operation(d)
1
2
3
4
5
7
, http://www.100md.com
Gene therapy
0.531±0.061*
0.732±0.032*
1.372±0.2**##
1.14±0.11**##
0.875±0.21*#
0.716±0.3*#
0.731±0.22*#
Control
, 百拇医药
0.524±0.121*
0.726±0.1*
0.686±0.12
0.574±0.34
0.533±0.2
0.590±0.11
0.552±0.2
*:P<0.05,**:P<0.01 vs pre-operation;#P<0.05,##P<0.01 vs control
2.3 颌下腺转染VEGF基因后涎液中VEGF的水平变化见表2
, 百拇医药
表2 大鼠涎液中VEGF的含量(pg/ml)
Tab1 Content of VEGF in rat spittle(pg/ml)
Pre-operation
Post-operation(d)
1
2
3
4
5
7
Gene therapy
, 百拇医药
66.0±29.6
167.25±45.2*
214.48±66.7**#
201.03±47.8**##
177.46±42.3**##
128.45±25.4*#
130.12±50.4*#
Control
74.5±36.3
135.44±51.1*
, 百拇医药
122.98±67.0*
80.67±44.5
92.35±34.4
88.79±52.2
75.68±40.8
*:P<0.05,**:P<0.01 vs pre-operation;#P<0.05,##P<0.01 vs control
3 讨论
VEGF是近年来新发现的一种特异性促进血管内皮细胞 增殖的有丝分裂原,它在血管发生,维持血管内皮 完整性和通透性,以及在胚胎发育,肿瘤的生成和 生长,炎症和创伤愈合等方面均有重要意义[5]。 Taichman等[1]发现涎液中也存在有VEGF,并初步证实VEGF单独 或和涎液中其它因子协同作用,保护口腔粘膜[1,4], VEGF的这些特性表明,VEGF在创伤愈合过程中具有重要 作用,将VEGF用于促进伤口的愈合研究也日益受到关 注。
, 百拇医药
以创伤组织为靶器官进行基因转移,在治疗过程中 难免在接近伤口的区域产生新的物理、化学、生物 等因素的刺激,并诱导免疫功能改变等一系列反应 ,在促伤口愈合的同时,也增加了新的负面影响。 而以涎腺为靶器官进行口内创伤的治疗,可以克服 上述缺陷,更为安全,可行,便利[6,7]。
本研究中采用的LipofectAMINE系多聚阳离子脂质体,具 有较多的正电荷,增强了与DNA及靶细胞的亲合能力, 并使其能在形成较多复合体颗粒的前题下携带较多 的DNA分子进入靶细胞,因此较其它阳离子脂质体具有 更理想的转染效率[8]。另外,为进一步提高VEGF基因的 转染率,本实验将原核的VEGF表达质粒改建为以CMV为启 动子的真核表达质粒-pBKCMV-VEGF121,全长约5.0kb,其中 位于EcoRⅠ和SalⅠ位点间为499bp的VEGFcDNA序列,故用EcoRⅠ和SalⅠ双酶切pBKCMV-VEGF121表达质粒可得约4.5kb和0.5kb2个 片段,本实验的酶切结果与之相符,表明质粒及VEGF基 因插入正确。
, 百拇医药
由实验结果可见,大鼠颌下腺经外源性VEGF基因转染 后,于术后第1天,即表现出VEGFmRNA含量的升高,提示 VEGF合成的增加,于术后2~3d达到高峰,并在高水平 表达持续一周的时间,与术前及对照组相比,差异 显著。说明外源性的VEGF已成功转染到颌下腺体内, 并得以正常表达。同样涎液中的VEGF含量的动态变化 也得以再次证实,涎液中VEGF含量的变化与VEGFmRNA的含 量变化基本相符。
另外,对照组虽然未进行VEGF基因的转染,但其术后 1~2d内颌下腺中VEGFmRNA水平及涎液中VEGF含量均有所升 高,且差异显著,这是由于本实验在大鼠进行基因 转染的当天,即又进行口内创伤模型的制备,在外 伤的刺激下,使涎腺合成和分泌VEGF的量有所增加,这与文献报道相一致[1,9]。但这并未影响到作为对 照组与基因转染组的对比,从结果可见,二者的差 异仍然显著。
VEGF是主要的血管再生刺激因子,调节血管生长,促进创伤愈合过程中肉芽组织的生成[4],在体外实验中 已得到证实,然而在体内实验中,由于给药方式的 不同,疗效差异很大。创伤愈合需要在各阶段细胞 因子的持续刺激下完成[10],在伤口中直接给予重组 的细胞因子治疗,存在有给药不便,药物半衰期短 等不利因素,难以达到持续作用的效果。基因治疗 无疑是克服上述缺陷的首选方法,本实验结果表明 ,通过以颌下腺为靶器官进行细胞因子的基因转移 ,可使涎液中该因子的含量明显提高,并持续5d左右 的时间,足以达到伤口愈合所需时间。
, 百拇医药
总之,颌下腺是进行基因转染的理想的靶器官,利 用其内分泌腺和外分泌腺的特点,可以将促进创伤 愈合的细胞生长因子等,通过基因工程技术,将其 DNA转染入腺体内,使外源基因得以表达,从而改变口 腔及上消化道的内环境,为临床上进行口内组织损 伤的治疗提供了新的途径和依据。
作者简介:张从纪(1968.2),男,河北省永年县人,硕 士,住院医师,主要从事颌面部创伤及修复方面的研究,发表论文7篇。电话:(023)68754135
作者单位:孙远(第三军医大学:附属西南医院口腔科;)
史文进(第三军医大学:附属西南医院口腔科;)
参考文献
[1]Taichman N S, Cruchley A T, Fletcher L M, et al .Vascular endothelial growth factor in normal human salivary glands and saliva: a possible role in the maintenance of mucosal homeostasis [J]. Laboratory Investigation,1998,78(7): 869-875.
, 百拇医药
[2]Winn D M, Diehl S R, Horowitz A M, et al. Scientific progress in understanding oral and pharyngeal cancers[J]. J Am Dent Assoc,1998,129(6):713-718.
[3]Nissen N N, Polverini P J, Koch A E, et al. Vascular en-dothelial growth factor mediates angiogenic activity during the proliferative phase of wound healing[J]. Am J Pathol,1998,152 (6): 1 445-1 452.
[4]Ilan N, Mahooti S, Madri J A. Distinct signal transduction pathways are utilized during the tube f ormation and survival phases of in vitro angiogenesis[J]. J Cell Sci,1998,111 (Pt 24): 3 621- 3 631.
, 百拇医药
[5]Gille J,Khalik M,Konig V,et al . Hepatocyte growth factor/ scatter factor (HGF/SF) induces vascular permeability factor (VPF/VEGF) expression by cultured keratinocytes[J]. J Invest Dermatol,1998,111(6): 1 160-1 175.
[6]He X,Goldsmith C M,Marmary Y, et al. Systemic action of human growth hormone following adenovirus-mediated gene trans-fer to rat submandibular glands[J]. Gene Ther,1998,5(4): 537-541.
[7]O'Connell B C,Lillibridge C D,Ambudkar I,et al .Somatic gene transfer to salivary glands[J]. Ann N Y Acad Sci,1998,842(2):171- 180.
, http://www.100md.com
[8]Kagami H, Atkinson J C, Michalek S M, et al .Repetieive adenovirus administration to the parotid gland: Role of immuno logical barriers and induction of oral tolerance[J]. Hum Gene Ther,1998,9(3):305-313.
[9]Yasushi F,Kenneth W . Akt mediates cytoprotection of endothe-lial cells by vascular endothelial growth factor in an anchorage-dependent manner[J]. J Biol Chem, 1999, 274(23): 16 349-16 354.
[10]Oxford G O, Nguyen K H, Alford C E, et al. Elevated salivary EGF levels stimulated by periodontal surgery[J]. J Periodontol,1998, 69(4):479-484.
收稿日期:1999-10-06;修回日期:1999-12-22, 百拇医药