rhGM-CSF和rhG-CSF对急性白血病骨髓CFU-F形成的影响
作者:徐运孝 卢汉波 张广森
单位:徐运孝(第二附属医院血液内科 长沙 410011);卢汉波(第二附属医院血液内科 长沙 410011);张广森(第二附属医院血液内科 长沙 410011)
关键词:白血病;淋巴细胞性;急性;粒-单核细胞集落刺激因子;集落形成单位测定;细胞;培养的
湖南医科大学学报000233[摘要] 应用人骨髓CFU-F体外培养技术,观察rhGM-CSF 和rhG-CSF对急性白血病骨髓CFU-F生成的影响。结果表明,上二者对CFU-F的形成均有明 显促进作用及协同效应,且rhGM-CSF的作用大于rhG-CSF。提示二者可能通过这种促进作 用和改善骨髓微环境而更有效地发挥造血调节机能。
[中图分类号] R773.71 [文献标识码] A [文章编号] 1000-5625(2000)02-0185-03
, 百拇医药
Effects of rhGM-CSF and rhG-CSF on growth of CFU-F derived
from acute leukemia(AL) patient bone marrow in vitro
XU Yun-xiao, LU Han-bo, ZHANG Guang-sen
Department of Haematological Research, The Second Affiliated Hospital, Hu nan Medical University(Changsha 410011)
[Abstract] By using the cultural method of CFU-F derived from bone marrow in the patient with acute leukemia in vitro, we dissected the effe cts of rhGM-CSF and rhG-CSF on growth of CFU-F derived from AL patient bone marrow. The results showed that rhGM-CSF and rhG-CSF enhanced the number of co lonies of CFU-F and its proliferation activity. Both factors had a synergy on t he above effects. The effects of rhGM-CSF on CFU-F were significantly greater than that of rhG-CSF. The deta indicate that rhGM-CSF and rhG-CSF might regul ate hemopoiesis more effectively by stimulating the growth of fibroblast and imp roving bone marrow microenvironment.
, 百拇医药
[Key words] leukemia,lymphocytic,acute; granulocyte-macroph age colony-stimulating factor; colony forming units assay; cells,cultured
重组人粒-巨噬细胞集落刺激因子(rhGM-CSF)和重组人 粒细胞集落刺激因子(rhG-CSF)是目前临床上研究较多和使用广泛的造血正调控细胞因子, 能刺激造血干细胞增殖、分化,增加中性粒细胞,促进巨噬细胞生长[1]。成纤维 细胞是骨髓造血微环境基质细胞中的一种主要成分,体外培养能贴壁生长形成成纤维细胞集 落(CFU-F),后者能产生多种造血调控因子。通过对CFU-F集落数量及增殖能力的分析,推 测造血微环境的改变及其对造血调节作用的影响。本实验将一定浓度的rhGM-CSF和rhG-CS F加入骨髓CFU-F培养体系中,观察它们对该体系形成的影响,探索其对骨髓造血微环境可 能的作用机制,从而为临床应用提供理论依据。
, 百拇医药
1 材料与方法
1.1 病例来源和试剂 根据细胞形态学、免疫学、细胞化学诊断及FAB分型 标准进行诊断分型。骨髓均取自非缓解期患者。急性淋巴细胞性白血病(ALL)14例,男6例, 女8例,中位年龄33(18~35)岁;急性非淋巴细胞性白血病(ANLL)17例,男8例,女9例,中 位年龄34(20~64)岁。rhG-CSF(商品名惠尔血)由麒麟(中国)有限公司赠送;rhGM-CSF(商 品名生白能)系美国产品,先灵雅葆雅厂赛格公司赠送;RPMI-1640培养液系美国GIBC产品 ;淋巴细胞分离液为上海生化试剂二厂产品。另有37℃恒温条件培养箱和倒置显微镜。
b 每一病例骨髓分4组培养体系,即rhGM-CSF组(20ng.ml -1)、rhG-CSF组(10ng.ml-1)、rhGM-CSF+rhG-CSF组(剂量分别同前)和对照 组(不加rhGM-CSF和rhG-CSF)。CFU-F体外培养方法参照文献方法[2]加以改进 。100ml培养皿中装入RPMI1640培养液10ml,含有核细胞1×107个,青霉素、 链霉 素各100μ.ml-1,20%小牛血清。7% CO2 37℃培养,至第14d作瑞氏姬姆萨染 色。成纤维细胞胞浆呈泡沫状,浅蓝色,核成细网状,紫红色,有2~3个清楚的核仁;巨噬 细胞呈星状形;内皮细胞呈扁平圆形或椭圆形。碱性磷酸酶染色,成纤维细胞阳性,巨噬细 胞及内皮细胞阴性。同时作vWF∶Ag测定进行鉴别。在倒置显微镜下计数CFU-F集落数量及 大小(以增殖能力表示),≥20个成纤维细胞为一个CFU-F集落,并以10个成纤维细胞数为等 差所组成的集落数进行百分累积统计。
, 百拇医药
1.3 统计学处理 结果用平均值加减标准差(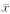 ±s)表示;显著 性用t检验和秩和检验
±s)表示;显著 性用t检验和秩和检验
2 结 果
2.1 rhGM-CSF和rhG-CSF剂量依赖曲线 取急性粒细胞性白血病(M2)和 急性淋巴细胞性白血病(L2)各1例于培养体系中分别加入2~100mg.ml-1浓度的r hGM-CSF和rhG-CSF,每种浓度配备相同的两瓶培养体系,取其平均值分别作剂量依赖曲线 。rhGM-CSF和rhG-CSF浓度分别在20~40mg.ml-1和10~20mg.kg-1时C FU-F生长最好,超过该二浓度时集落数无明显增加。据此,实验中分别取20mg.kg- 1和10mg.kg-1浓度。剂量依赖曲线见图1。
, 百拇医药
2.2 rhGM-CSF和rhG-CSF对CFU-F集落数量的影响 附表示:rhGM-CSF 对ALL和ANLL患者骨髓CFU-F集落数量形成均有明显促进作用,且rhGM-CSF的作用大于rhG -CSF,即加入rhGM-CSF的ALL和ANLL组中CFU-F集落数均显著高于加入rhG-CSF(P<0. 05,P<0.01),二者合用时的作用均 大于它们单一使用时的作用。在4个组别 中,ALL和ANLL之间的CFU-F集落数均无显著差异 (P>0.05)。
附表 rhGM-CSF和rhG-CSF对CFU-F集落数影响的比较(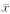 ±s) 分组
±s) 分组
例数
CFU-F集落数①
rhGM-
, 百拇医药
CSF组
rhG-
CSF组
rhGM-CSF组
+rhG-CSF组
对照组
ALL
14
74.8±29.4 ②④
64.1±28.3③
92.5±30.4⑥
53.4±23.8
, 百拇医药
ANLL
17
70.5±27.0②⑤
59.7±19.5 ③
89.7±31.8⑥
48.8±16.8
①在4个组别中,ALL与ANLL之间比较均为P>0.05;②与对 照组比P<0 .01;③与对照组比P<0.05;④与rhG-CSF组比P<0.05; ⑤与rhG-CSF组比P <0.01;⑥与任一单用组相比P<0.012.3 rhGM-CSF和rhG-CSF对CFU-F增殖能力的影响 rhGM-CSF和rhG-C SF分别对ALL和ANLL CFU-F的增殖能力均有明显促进作用(P<0.01和P<0.05),而rh GM-CSF与rhG-CSF之间差异无显著性,亦无协同作用。但在对照组中ALL骨髓CFU-F增殖能 力明显高于ANLL,两者差异有显著性(P<0.05,图2)。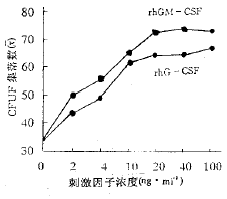
, http://www.100md.com
图1 rhGM-CSF和rhG-CSF剂量依赖曲线
Fig.1 The dose-depentent curve of r hGM-CSF and rhG-CSF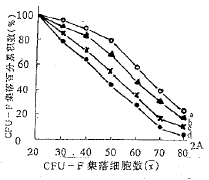
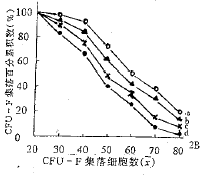
图2 CFU-F集落百分累积数比较
a ALL实验组;b ALL对照组;c ANLL实验组;d ANLL对照组;a vs b P<0.01; c vs d及b vs d均为P<0.05
Fig.2 The analysis of cumulative percenta ge of CFU-F colonies
, 百拇医药
3 讨 论
rhGM-CSF和rhG-CSF对粒细胞、巨噬细胞及巨核细胞作用及其机能已得到证实[1, 3],但它们对人骨髓成纤维细胞的作用国内报道尚少。本文结果表明,rhGM-CSF和rhG -CSF也能通过促进骨髓CFU-F形成而发挥造血调节效应。观察剂量依赖曲线,发现它们在 培养体系中达到一定浓度后,集落数不再明显增多,表明对某种因子敏感的克隆形成细胞数 量是有限的[4],或细胞因子在达到一定浓度时便能充分发挥其生物学活性。这 一浓度与有关报道及临床常用剂量致人体内所能具有的有效血清浓度相 近。故认 为该浓度对于指导临床应用可作为一种借鉴。
人骨髓造血微环境基质细胞主要是成纤维细胞,它参与骨髓血窦外壁支架的组成,具有支持 调节造血及转移造血微环境等多种重要机能。已有证据表明基质细胞集落能支持造血干细胞 群CD+34/CD38-增殖、分化和生长[5]。急性白血病与病人体内 某种体液因子 有关,且这种体液因子很可能来源于病人骨髓白血病细胞。在ALL和ANLL患者对照组中,两 者CFU-F集落数无明显差异,而ALL患者骨髓CFU-F增殖能力明显高于ANLL。这种差异与ALL 和ANLL的临床转归关系(如成人ALL易于复发)值得进一步探讨。
, http://www.100md.com
rhGM-CSF和rhG-CSF对ALL与ANLL患者骨髓CFU-F集落数量和增殖能力均有明显的促进作用 ,这与集落刺激因子对白血病的作用与FAB分型无关的报道相一致[6]。也有作者 认为骨髓造血微环境对ALL与ANLL的造血影响具有机能均同性[7],因而它们都可 能有助于ANLL的辅助治疗。
rhGM-CSF的作用是广谱的,可以影响多系造血祖细胞的生存、增殖和分化,而rhG-CSF的 作用范围相对局限,均由成纤维细胞产生[8]。成纤维细胞上存在rhGM-CSF受体 ,rhGM-CSF可与受体直接结合产生效应,而rhG-CSF与rhGM-CSF的受体同属于造血生长因 子超级家族成员。受体分子上有一共同的结构位点,rhG-CSF可能与成纤维细胞上的rhGM- CSF受体结合而发挥作用,而且CSF有不同的靶细胞群,一种CSF靶细胞可能被另一种CSF激活 。该实验结果还显示,rhGM-CSF对骨髓CFU-F集落数量生成的促进作用明显大于rhG-CSF ,而对其增殖能力的影响与rhG-CSF无显著差异,联用时的协同作用也只能表现在CFU-F集 落数量上。这可能与两者的作用不在同一水平上,以及一种因子与受体结合时促进另一种因 子的效应有关。此外,有作者认为rhGM-CSF和rhG-CSF可能通过巨噬细胞、内皮细胞或某 种液递性生长因子以及自泌调节作用而间接刺激CFU-F生长[8,9]。
, 百拇医药
实验结果和分析提示,rhGM-CSF和rhG-CSF也可通过刺激CFU-F的生长、改善骨髓造血微 环境从而更好地发挥其造血调节作用。有关它们的作用机制尚待深入探讨。
参考文献:
[1] Lifton R, Bennett JM. Clinical use of GM-CSF and G- CSF in neutropenia associated with malignancy[J]. Hematol Oncol Clin North Am , 1998,12(1):825-841.
[2] 姜学英,杨少光,邢凤楼.人骨髓成纤维细胞集落形成的体外培养技术[J].中华 血液学杂志,1985,6(6):378-380.
[3] Yifan Zhang, Lieschke GJ, Grail D, et al. Essential role for granuloc yte-macrophage colony stimulating factor(GM-CSF) and G-CSF in the sustained h ematopoietic response of listeria monocytogenes-infected mice[J]. Blood, 1998 ,91(3):863-869.
, http://www.100md.com
[4] 王椿,王辨明,李崇鱼,等.重组人造血细胞生长因子对正常造血细胞体外 生成的影响[J].中华血液学杂志,1992,13(2):81-83.
[5] Aiuti A, Friedrich C, Sieff CA, et al. Identification of distinct ele m ents of the stromal microenvironment that control human hematopoietic stem/prog enitor cell growth and differentiation[J]. Exp Hematol, 1998,26:143-157.
[6] Delwel R, Salem M, Pellens C, et al. Growth regulation of human acute myeloid leukemia: effects of five recombinant hematopoietic factor in a serum- free culture system[J]. Blood, 1988,72(6):1994-1998.
, 百拇医药
[7] Deryugina E, Ratnikov B, Bourdon M, et al. Clonal analysis of primar y marrow stroma; functional homogeneity in supports of lymphoid and myeloid cell ines and identification of positive and negative regulators[J]. Exp Hematol, 1 994,22:910-913.
[8] Lenhoff S, Sallerfors B, Olofsson T. IL-10 as an autocrine regulator of CSF secretion by monocytes: Disparate effects on GM-CSF and G-CSF secrection [J]. Exp Hematol, 1998,26:299-304.
[9] Qi-Ru Wang, Zhao-Jie Yan, Wolf N. Dissecting the hematopoietic microenv ironment Ⅵ. The effect of several growth factors on the in vitro growth of muri ne bone marrow CFU-F[J]. Exp Hematol, 1990,18:341-347., 百拇医药
单位:徐运孝(第二附属医院血液内科 长沙 410011);卢汉波(第二附属医院血液内科 长沙 410011);张广森(第二附属医院血液内科 长沙 410011)
关键词:白血病;淋巴细胞性;急性;粒-单核细胞集落刺激因子;集落形成单位测定;细胞;培养的
湖南医科大学学报000233[摘要] 应用人骨髓CFU-F体外培养技术,观察rhGM-CSF 和rhG-CSF对急性白血病骨髓CFU-F生成的影响。结果表明,上二者对CFU-F的形成均有明 显促进作用及协同效应,且rhGM-CSF的作用大于rhG-CSF。提示二者可能通过这种促进作 用和改善骨髓微环境而更有效地发挥造血调节机能。
[中图分类号] R773.71 [文献标识码] A [文章编号] 1000-5625(2000)02-0185-03
, 百拇医药
Effects of rhGM-CSF and rhG-CSF on growth of CFU-F derived
from acute leukemia(AL) patient bone marrow in vitro
XU Yun-xiao, LU Han-bo, ZHANG Guang-sen
Department of Haematological Research, The Second Affiliated Hospital, Hu nan Medical University(Changsha 410011)
[Abstract] By using the cultural method of CFU-F derived from bone marrow in the patient with acute leukemia in vitro, we dissected the effe cts of rhGM-CSF and rhG-CSF on growth of CFU-F derived from AL patient bone marrow. The results showed that rhGM-CSF and rhG-CSF enhanced the number of co lonies of CFU-F and its proliferation activity. Both factors had a synergy on t he above effects. The effects of rhGM-CSF on CFU-F were significantly greater than that of rhG-CSF. The deta indicate that rhGM-CSF and rhG-CSF might regul ate hemopoiesis more effectively by stimulating the growth of fibroblast and imp roving bone marrow microenvironment.
, 百拇医药
[Key words] leukemia,lymphocytic,acute; granulocyte-macroph age colony-stimulating factor; colony forming units assay; cells,cultured
重组人粒-巨噬细胞集落刺激因子(rhGM-CSF)和重组人 粒细胞集落刺激因子(rhG-CSF)是目前临床上研究较多和使用广泛的造血正调控细胞因子, 能刺激造血干细胞增殖、分化,增加中性粒细胞,促进巨噬细胞生长[1]。成纤维 细胞是骨髓造血微环境基质细胞中的一种主要成分,体外培养能贴壁生长形成成纤维细胞集 落(CFU-F),后者能产生多种造血调控因子。通过对CFU-F集落数量及增殖能力的分析,推 测造血微环境的改变及其对造血调节作用的影响。本实验将一定浓度的rhGM-CSF和rhG-CS F加入骨髓CFU-F培养体系中,观察它们对该体系形成的影响,探索其对骨髓造血微环境可 能的作用机制,从而为临床应用提供理论依据。
, 百拇医药
1 材料与方法
1.1 病例来源和试剂 根据细胞形态学、免疫学、细胞化学诊断及FAB分型 标准进行诊断分型。骨髓均取自非缓解期患者。急性淋巴细胞性白血病(ALL)14例,男6例, 女8例,中位年龄33(18~35)岁;急性非淋巴细胞性白血病(ANLL)17例,男8例,女9例,中 位年龄34(20~64)岁。rhG-CSF(商品名惠尔血)由麒麟(中国)有限公司赠送;rhGM-CSF(商 品名生白能)系美国产品,先灵雅葆雅厂赛格公司赠送;RPMI-1640培养液系美国GIBC产品 ;淋巴细胞分离液为上海生化试剂二厂产品。另有37℃恒温条件培养箱和倒置显微镜。
b 每一病例骨髓分4组培养体系,即rhGM-CSF组(20ng.ml -1)、rhG-CSF组(10ng.ml-1)、rhGM-CSF+rhG-CSF组(剂量分别同前)和对照 组(不加rhGM-CSF和rhG-CSF)。CFU-F体外培养方法参照文献方法[2]加以改进 。100ml培养皿中装入RPMI1640培养液10ml,含有核细胞1×107个,青霉素、 链霉 素各100μ.ml-1,20%小牛血清。7% CO2 37℃培养,至第14d作瑞氏姬姆萨染 色。成纤维细胞胞浆呈泡沫状,浅蓝色,核成细网状,紫红色,有2~3个清楚的核仁;巨噬 细胞呈星状形;内皮细胞呈扁平圆形或椭圆形。碱性磷酸酶染色,成纤维细胞阳性,巨噬细 胞及内皮细胞阴性。同时作vWF∶Ag测定进行鉴别。在倒置显微镜下计数CFU-F集落数量及 大小(以增殖能力表示),≥20个成纤维细胞为一个CFU-F集落,并以10个成纤维细胞数为等 差所组成的集落数进行百分累积统计。
, 百拇医药
1.3 统计学处理 结果用平均值加减标准差(
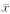 ±s)表示;显著 性用t检验和秩和检验
±s)表示;显著 性用t检验和秩和检验2 结 果
2.1 rhGM-CSF和rhG-CSF剂量依赖曲线 取急性粒细胞性白血病(M2)和 急性淋巴细胞性白血病(L2)各1例于培养体系中分别加入2~100mg.ml-1浓度的r hGM-CSF和rhG-CSF,每种浓度配备相同的两瓶培养体系,取其平均值分别作剂量依赖曲线 。rhGM-CSF和rhG-CSF浓度分别在20~40mg.ml-1和10~20mg.kg-1时C FU-F生长最好,超过该二浓度时集落数无明显增加。据此,实验中分别取20mg.kg- 1和10mg.kg-1浓度。剂量依赖曲线见图1。
, 百拇医药
2.2 rhGM-CSF和rhG-CSF对CFU-F集落数量的影响 附表示:rhGM-CSF 对ALL和ANLL患者骨髓CFU-F集落数量形成均有明显促进作用,且rhGM-CSF的作用大于rhG -CSF,即加入rhGM-CSF的ALL和ANLL组中CFU-F集落数均显著高于加入rhG-CSF(P<0. 05,P<0.01),二者合用时的作用均 大于它们单一使用时的作用。在4个组别 中,ALL和ANLL之间的CFU-F集落数均无显著差异 (P>0.05)。
附表 rhGM-CSF和rhG-CSF对CFU-F集落数影响的比较(
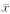 ±s) 分组
±s) 分组例数
CFU-F集落数①
rhGM-
, 百拇医药
CSF组
rhG-
CSF组
rhGM-CSF组
+rhG-CSF组
对照组
ALL
14
74.8±29.4 ②④
64.1±28.3③
92.5±30.4⑥
53.4±23.8
, 百拇医药
ANLL
17
70.5±27.0②⑤
59.7±19.5 ③
89.7±31.8⑥
48.8±16.8
①在4个组别中,ALL与ANLL之间比较均为P>0.05;②与对 照组比P<0 .01;③与对照组比P<0.05;④与rhG-CSF组比P<0.05; ⑤与rhG-CSF组比P <0.01;⑥与任一单用组相比P<0.012.3 rhGM-CSF和rhG-CSF对CFU-F增殖能力的影响 rhGM-CSF和rhG-C SF分别对ALL和ANLL CFU-F的增殖能力均有明显促进作用(P<0.01和P<0.05),而rh GM-CSF与rhG-CSF之间差异无显著性,亦无协同作用。但在对照组中ALL骨髓CFU-F增殖能 力明显高于ANLL,两者差异有显著性(P<0.05,图2)。

, http://www.100md.com
图1 rhGM-CSF和rhG-CSF剂量依赖曲线
Fig.1 The dose-depentent curve of r hGM-CSF and rhG-CSF


图2 CFU-F集落百分累积数比较
a ALL实验组;b ALL对照组;c ANLL实验组;d ANLL对照组;a vs b P<0.01; c vs d及b vs d均为P<0.05
Fig.2 The analysis of cumulative percenta ge of CFU-F colonies
, 百拇医药
3 讨 论
rhGM-CSF和rhG-CSF对粒细胞、巨噬细胞及巨核细胞作用及其机能已得到证实[1, 3],但它们对人骨髓成纤维细胞的作用国内报道尚少。本文结果表明,rhGM-CSF和rhG -CSF也能通过促进骨髓CFU-F形成而发挥造血调节效应。观察剂量依赖曲线,发现它们在 培养体系中达到一定浓度后,集落数不再明显增多,表明对某种因子敏感的克隆形成细胞数 量是有限的[4],或细胞因子在达到一定浓度时便能充分发挥其生物学活性。这 一浓度与有关报道及临床常用剂量致人体内所能具有的有效血清浓度相 近。故认 为该浓度对于指导临床应用可作为一种借鉴。
人骨髓造血微环境基质细胞主要是成纤维细胞,它参与骨髓血窦外壁支架的组成,具有支持 调节造血及转移造血微环境等多种重要机能。已有证据表明基质细胞集落能支持造血干细胞 群CD+34/CD38-增殖、分化和生长[5]。急性白血病与病人体内 某种体液因子 有关,且这种体液因子很可能来源于病人骨髓白血病细胞。在ALL和ANLL患者对照组中,两 者CFU-F集落数无明显差异,而ALL患者骨髓CFU-F增殖能力明显高于ANLL。这种差异与ALL 和ANLL的临床转归关系(如成人ALL易于复发)值得进一步探讨。
, http://www.100md.com
rhGM-CSF和rhG-CSF对ALL与ANLL患者骨髓CFU-F集落数量和增殖能力均有明显的促进作用 ,这与集落刺激因子对白血病的作用与FAB分型无关的报道相一致[6]。也有作者 认为骨髓造血微环境对ALL与ANLL的造血影响具有机能均同性[7],因而它们都可 能有助于ANLL的辅助治疗。
rhGM-CSF的作用是广谱的,可以影响多系造血祖细胞的生存、增殖和分化,而rhG-CSF的 作用范围相对局限,均由成纤维细胞产生[8]。成纤维细胞上存在rhGM-CSF受体 ,rhGM-CSF可与受体直接结合产生效应,而rhG-CSF与rhGM-CSF的受体同属于造血生长因 子超级家族成员。受体分子上有一共同的结构位点,rhG-CSF可能与成纤维细胞上的rhGM- CSF受体结合而发挥作用,而且CSF有不同的靶细胞群,一种CSF靶细胞可能被另一种CSF激活 。该实验结果还显示,rhGM-CSF对骨髓CFU-F集落数量生成的促进作用明显大于rhG-CSF ,而对其增殖能力的影响与rhG-CSF无显著差异,联用时的协同作用也只能表现在CFU-F集 落数量上。这可能与两者的作用不在同一水平上,以及一种因子与受体结合时促进另一种因 子的效应有关。此外,有作者认为rhGM-CSF和rhG-CSF可能通过巨噬细胞、内皮细胞或某 种液递性生长因子以及自泌调节作用而间接刺激CFU-F生长[8,9]。
, 百拇医药
实验结果和分析提示,rhGM-CSF和rhG-CSF也可通过刺激CFU-F的生长、改善骨髓造血微 环境从而更好地发挥其造血调节作用。有关它们的作用机制尚待深入探讨。
参考文献:
[1] Lifton R, Bennett JM. Clinical use of GM-CSF and G- CSF in neutropenia associated with malignancy[J]. Hematol Oncol Clin North Am , 1998,12(1):825-841.
[2] 姜学英,杨少光,邢凤楼.人骨髓成纤维细胞集落形成的体外培养技术[J].中华 血液学杂志,1985,6(6):378-380.
[3] Yifan Zhang, Lieschke GJ, Grail D, et al. Essential role for granuloc yte-macrophage colony stimulating factor(GM-CSF) and G-CSF in the sustained h ematopoietic response of listeria monocytogenes-infected mice[J]. Blood, 1998 ,91(3):863-869.
, http://www.100md.com
[4] 王椿,王辨明,李崇鱼,等.重组人造血细胞生长因子对正常造血细胞体外 生成的影响[J].中华血液学杂志,1992,13(2):81-83.
[5] Aiuti A, Friedrich C, Sieff CA, et al. Identification of distinct ele m ents of the stromal microenvironment that control human hematopoietic stem/prog enitor cell growth and differentiation[J]. Exp Hematol, 1998,26:143-157.
[6] Delwel R, Salem M, Pellens C, et al. Growth regulation of human acute myeloid leukemia: effects of five recombinant hematopoietic factor in a serum- free culture system[J]. Blood, 1988,72(6):1994-1998.
, 百拇医药
[7] Deryugina E, Ratnikov B, Bourdon M, et al. Clonal analysis of primar y marrow stroma; functional homogeneity in supports of lymphoid and myeloid cell ines and identification of positive and negative regulators[J]. Exp Hematol, 1 994,22:910-913.
[8] Lenhoff S, Sallerfors B, Olofsson T. IL-10 as an autocrine regulator of CSF secretion by monocytes: Disparate effects on GM-CSF and G-CSF secrection [J]. Exp Hematol, 1998,26:299-304.
[9] Qi-Ru Wang, Zhao-Jie Yan, Wolf N. Dissecting the hematopoietic microenv ironment Ⅵ. The effect of several growth factors on the in vitro growth of muri ne bone marrow CFU-F[J]. Exp Hematol, 1990,18:341-347., 百拇医药