ESR研究大鼠应答性巨噬细胞中一氧化氮的变化
作者:先宏 丛建波 张清俊 吴可 孙存普 张建中
单位:先宏 丛建波 吴可 孙存普(国家生物医学分析中心 自由基专业实验室,军事医学科学院 放射医学研究所 北京 100 850);张清俊(空军第四研究所 北京 100036);张建中(中国科学院研究生院 化学部 北京 100039)
关键词:一氧化氮;电子自旋共振;巨噬细胞;大鼠
中国医学物理学杂志000220 摘要: 应答性巨噬细胞(responsive macrophage,rMΦ)在发挥其重要的免疫功能过程中有一 氧化氮(NO)介导,该文旨在用电子自旋共振(electron spin resonance,ESR)就大鼠体内静 止的原发性巨噬细胞(pMΦ)和应答性巨噬细胞(rMΦ)中的NO波谱信号做一对比,并检测rMΦ 中 的NO在不同体系中的变化。结果表明:pMΦ中检测不到明显的NO波谱信号,而rMΦ中可检 测到 特征性的NO三重峰;加入刺激剂佛波脂(PMA)和超氧化物歧化酶(SOD),对于rMΦ中浓度较 高的外源性NO前体中的NO含量显著升高。
, 百拇医药
中图分类号:Q26 文献标识码:A 文章编号:1005-202X( 2000)02-0112-02
巨噬细胞(MΦ)在机体免疫活动中发挥着重 要职能,如抗感染、抗肿瘤、参与免疫应答和 免疫调节等[1]。内源性的一氧化氮(NO)作为一种信号传导分子,也作为一种氮类 自由基 ,它对体内、体外细胞的正常生理活动及病理状态有广泛的作用[2]。NO 的检测方法较 多,但多是从NO的催化酶(NOS)活性或NO的代谢产物来间接检测。本文用ESR仪直接检测原发 性的MΦ(primary MΦ,pMΦ)和应答性MΦ(responsive macrophage,rMΦ)中的NO产生,并 对rMΦ在不同体系中的变化,直接用ESR做一些探讨。
1 材料与方法
1.1 试剂及仪器
佛波脂(PMA),N-硝基-精氨酸(L-NNA ),活性氧类自由基自旋捕集剂5,5 -二甲基吡咯啉氮氧化合物(5,5-dimethyl-1-pyrroline-1-oxide, DMPO),自旋探针3 -氨基甲 酰-2,2,5,5-四甲基-3-吡咯啉氮氧化物(3-carbamoyl-2,2,5,5-tetramethyl-3-py rroline-1 -yloxy,CTPO)均购自Sigma公司;NO自旋捕捉剂为N-甲基-葡萄糖胺和硫酸亚铁络合物, 即(MGD)2-Fe2+,由中国科学院研究生院化学部提供,L-精氨酸(L-Arginine,L -Arg) 等其余试剂均为国产试剂,分析纯。
, 百拇医药
仪器 型号Bruker-ESP300的电子自旋共振仪(Electron spin resonance,ESR),德国制造。
1.2 巨噬细胞的分离、检测
Wistar纯系大鼠250~300 g 6只,分为原发性 (primary MΦ ,pMΦ)和应答性MΦ(responsive macrophage,rMΦ)两组各3只,前者大鼠腹腔注射生理盐 水,后者大鼠腹腔注射糖原(5 g/kg),过夜,第二天早晨剖杀,取腹水,无钙Hanks液反复 冲洗腹腔,1500 r/m低温离心10分钟,低渗除去红细胞,提纯 的MΦ计数后调整至1×108/ml,冰盒中放置,立即进行NO自由基的检测。
NO的ESR检测条件 ESR谱仪检测用X-波段,微波功率10 mW ,高频调制频率50 kHz,调制幅度0.2 mT,扫宽100 G,室温。
, http://www.100md.com
1.3 细胞氧耗的检测
原理和方法参见文献[3],参数K定义如下: K=(b+c)/(2a),b和c是自旋探针CTPO 甲基氢原子的超精细分裂两最高峰峰高,a为b和c两峰的最高和最低点的距离,如图2。 0.1 mmol/L的CTPO,rMΦ为2×107个/ml,加入和不加入100 ng/ml PMA,进样品腔检测。 ESR检测条件 X-波段,微波功率1 mW,调制频率100 kHz,调制幅度0.05 mT,中心磁场 3240 G,扫宽5 G,扫场0.37 G/秒,室温。
1.4 数据处理
NO浓度根据标准曲线所得的数据求出后,用SAS软件进行F方差分析和Dunett两两分析。
2 结果
2.1 pMΦ和rMΦ中的NO波谱比较
, http://www.100md.com
从收集的MΦ数量比较,rMΦ是pMΦ的150倍之多。pMΦ与(MGD)2-Fe2+在体系 中没有检测出 特征性三重峰的NO波谱信号,用刺激剂PMA后再检测,依然没有出现明显的NO特征波谱。而r MΦ则能在没用PMA的情况下就出现NO的特征性波谱(如图1)。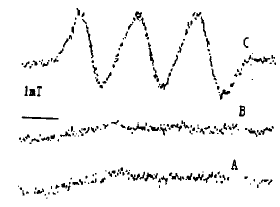
Fig 1 The NO spectrum in the pMΦ and rMΦ.
A: pMΦ B: pMΦ+PMA C: rMΦ
2.2 NO前体和NOS抑制剂对NO波谱信号的改变
在细胞数量为6×107/ml的rMΦ中加入(MGD)2-Fe2+,出现NO的特征性波谱 信号;在体系中加入0.02 mol/L的L-NNA,NO的波谱信号明显减弱,在此体系中再加入0.3 M的L-Arg后,则信号有所增强;而在不用抑制剂的体系中,即6×107/ml的rMΦ中加入(M GD)2-Fe2+后直接加入L-Arg,则能出现比rMΦ本身信号更强的NO波谱信号(如 图2)。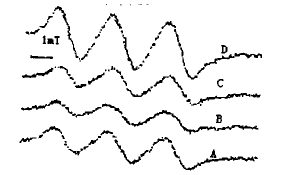
, http://www.100md.com
Fig 2 Changes of NO spectrum after L-NNA and L-arg. used. A : rMΦ B : rMΦ+L-NNA C : rMΦ+L-NNA+L-arg D : rMΦ+L-Arg
2.3 不同体系中rMΦ的NO浓度变化
在体外刺激剂PMA作用下,rMΦ在不同的L-Arg浓度中NO含量有相应的变化,其中在0.6 mo l/LL-Arg中NO含量升高最为显著,与另两组都有显著差异。再加入SOD后,NO产生量也出现 了一些组间差异,在0.6 mol/L的L-Arg体系中的NO含量与0.3 mol/L的L-Arg体系中的NO含 量差异显著。如下表1。
Table 1 Changes of NO concentration of rMΦ L-Arg(mol/L)
[NO](×10-8 mol)
, 百拇医药
rMΦ +PMA
rMΦ +PMA+SOD
0
44.44±4.95
49.92±10.01
0.3
43.22±13.81
32.63±8.29
0.6
58.93±3.77**△
55.93±7.84*
, 百拇医药
Note: 1. Data were mean±SD.
2 * P<0.05,** P<0.01 Compared with 0.3 mol/L L-Arg group.
3 △P<0.05.Compared with 0 mol/L L-Arg group.
2.4 外源性刺激剂PMA对rMΦ的氧耗的影响
rMΦ没有出现明显的耗氧;在加入刺激剂PMA后rMΦ则 氧耗大为增加,出现了明显的呼吸 爆发,rMΦ本身有较弱的RS发生,加入PMA刺激剂,RS发生更为显著,即耗氧量大大增加 。 K值对比,未加PMA的rMΦ在检测早期高于加了PMA的rMΦ,但随后PMA的刺激作用便很快发 挥,氧耗量急剧上升,K值随氧耗的增加而增大,两组对比出现明显差异。(如图3)。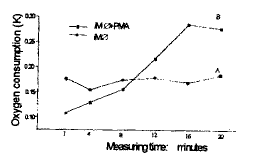
, http://www.100md.com
Fig 3 Changes of K relative to oxygen consumption
of 2×107/ml rMΦ. A : rMΦ B : rMΦ+PMA
3 讨论
MΦ是机体发生免疫变化的主要细胞之一,也是参与免疫信息提呈及免疫杀伤最早的细胞, 但体内的MΦ一般处于静止状态,受到某些因素如化学物质、病原体等异物刺激的腹腔渗出M Φ为rMΦ,通过细胞因子的进一步刺激可表达出细胞毒性[4]。具有细胞毒性的MΦ 所能体现的生物学功能,如抗感染、抗肿瘤作用,抗原提呈、免疫调节等特异性的 免疫应答,已证明是由诱导性的一氧化氮合酶(iNOS)生成的NO来介导,或部分是由NO介导的 [5]。近年来随着NO研究的日趋深入,对于NO的研究方法也日益增多。其中,利用 自旋探针和自旋捕集方法这一特殊的ESR技术,加上比较稳定、特异性强的捕集剂,可直接 检测不同体系中的NO,从特征性的波谱出现得到反映[6]。rMΦ中的NO与捕集剂结 合后其波谱也可 呈现出特征性的三重峰,并随体系中加入的NO前体或NOS抑制剂的不同而出现波谱强度的改 变,这说明rMΦ的功能也有NO的介导。
, http://www.100md.com
L-Arg在体内的代谢途径除了经NOS生成NO及瓜氨 酸外;还可以经精氨酸酶催化生成尿 素和L-鸟氨酸,或经精氨酸脱羧酶催化生成CO2及精胺。NO合成在精氨酸代谢途径中占很 小 一部分,非NOS途径对调节细胞内L-Arg浓度起着重要作用。PMA在激发了iNOS的同时,可能 也激发了精氨酸酶等,尤其精氨酸酶Ⅱ对NO的产生起着向下调节的作用[7];外 源性低浓 度的L-Arg比高浓度L-Arg的代谢在非NOS途径上的代谢可能更强,使得NO产生与外源性的L -A rg补充不相一致。应用SOD后,三组NO的产生都有变化,未用外源性的L-Arg组,其NO生成 有 少量升高,SOD可减少超氧阴离子自由基(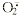 ),NO减少了与
),NO减少了与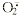 反应机会而使得过氧化亚硝酸产生 减少。与对于外源性的L-Arg另两组,SOD应用却导致NO产生不同程度的降低,究其原委尚 需进一步研究。
反应机会而使得过氧化亚硝酸产生 减少。与对于外源性的L-Arg另两组,SOD应用却导致NO产生不同程度的降低,究其原委尚 需进一步研究。
, 百拇医药
MΦ被激发产生NO发挥吞噬功能过程中,也发生呼吸爆发(respiration burst,RB), 这也是MΦ杀灭和吞噬病原体或微生物的重要途径,是MΦ的功能反映[8]。rMΦ本 身有较弱的RB发生,它反映的是rMΦ在通常情况下的呼吸耗氧;加入PMA刺激剂,RB发生更 为显著,K值对比,表明PMA可较好 的刺激rMΦ产生RB,增加氧吸收。rMΦ氧耗增加的过程就是其受PMA刺激后发生RB的过程。
基金项目:国家自然科学基金资助项目(29670209)
作者简介:先宏(1970年生),女,四川井研人,军 事医学科学院博士生,现从事自由基生物医学研究.
参考文献:
[1] Nathan CF. Mechanism of macrophages antimicrobial activity[] . Trans .R. Soc. Trop.Med . Hygiene.1983,77:620-630.
, http://www.100md.com
[2] 孙存普,丛建波,孙长凯.一氧化氮自由基(NO·).由基生物学导论[ M].中国科学技术出版社,1999.
[3] Zhao BL;Li XJ;He RG et al .ESR studies on active oxygen consumpt ion during the respiratory burst of human polymorphonuulear leukocytes[J] .Cell Biol.In t. Rep. 1989,13:317-328.
[4] Norby SW; James A; Weyhenmeyer et al .Stimulation and inhibition of nitric oxide production in macrophages and neural cells as observed by spin trapping [J].Free Radical Biology & Medicine.1997,22:1-9.
, 百拇医药
[5] Macmicking J; Xie QW; Nathan C. Nitric oxide and macrophage fun ction[J]. Annu.Rev.Immunol. 1997,15: 323-350.
[6] 李妍,丛建波,王澍等.生物体内的一氧化氮水平的定量检测研究[J].解 放军药学学报.1994,15(2):12-15.
[7] Sidney M;Morris JR;Diane KL et al.Differential regulation of arg inases and inducible nitric oxide synthase in murine macrophage cells[J]. Am. J. Physiol . 1998,275:E740-E747.
[8] Bernhard brune ;Christine Gotz;Udo K.Mebmer ei al Superoxide for mation and m acrophage resistance to nitric oxide-mediated apoptosis[J]. J. Biochem. 1997 , 272:7253-7258.
收稿日期:1999-09-08, 百拇医药
单位:先宏 丛建波 吴可 孙存普(国家生物医学分析中心 自由基专业实验室,军事医学科学院 放射医学研究所 北京 100 850);张清俊(空军第四研究所 北京 100036);张建中(中国科学院研究生院 化学部 北京 100039)
关键词:一氧化氮;电子自旋共振;巨噬细胞;大鼠
中国医学物理学杂志000220 摘要: 应答性巨噬细胞(responsive macrophage,rMΦ)在发挥其重要的免疫功能过程中有一 氧化氮(NO)介导,该文旨在用电子自旋共振(electron spin resonance,ESR)就大鼠体内静 止的原发性巨噬细胞(pMΦ)和应答性巨噬细胞(rMΦ)中的NO波谱信号做一对比,并检测rMΦ 中 的NO在不同体系中的变化。结果表明:pMΦ中检测不到明显的NO波谱信号,而rMΦ中可检 测到 特征性的NO三重峰;加入刺激剂佛波脂(PMA)和超氧化物歧化酶(SOD),对于rMΦ中浓度较 高的外源性NO前体中的NO含量显著升高。
, 百拇医药
中图分类号:Q26 文献标识码:A 文章编号:1005-202X( 2000)02-0112-02
巨噬细胞(MΦ)在机体免疫活动中发挥着重 要职能,如抗感染、抗肿瘤、参与免疫应答和 免疫调节等[1]。内源性的一氧化氮(NO)作为一种信号传导分子,也作为一种氮类 自由基 ,它对体内、体外细胞的正常生理活动及病理状态有广泛的作用[2]。NO 的检测方法较 多,但多是从NO的催化酶(NOS)活性或NO的代谢产物来间接检测。本文用ESR仪直接检测原发 性的MΦ(primary MΦ,pMΦ)和应答性MΦ(responsive macrophage,rMΦ)中的NO产生,并 对rMΦ在不同体系中的变化,直接用ESR做一些探讨。
1 材料与方法
1.1 试剂及仪器
佛波脂(PMA),N-硝基-精氨酸(L-NNA ),活性氧类自由基自旋捕集剂5,5 -二甲基吡咯啉氮氧化合物(5,5-dimethyl-1-pyrroline-1-oxide, DMPO),自旋探针3 -氨基甲 酰-2,2,5,5-四甲基-3-吡咯啉氮氧化物(3-carbamoyl-2,2,5,5-tetramethyl-3-py rroline-1 -yloxy,CTPO)均购自Sigma公司;NO自旋捕捉剂为N-甲基-葡萄糖胺和硫酸亚铁络合物, 即(MGD)2-Fe2+,由中国科学院研究生院化学部提供,L-精氨酸(L-Arginine,L -Arg) 等其余试剂均为国产试剂,分析纯。
, 百拇医药
仪器 型号Bruker-ESP300的电子自旋共振仪(Electron spin resonance,ESR),德国制造。
1.2 巨噬细胞的分离、检测
Wistar纯系大鼠250~300 g 6只,分为原发性 (primary MΦ ,pMΦ)和应答性MΦ(responsive macrophage,rMΦ)两组各3只,前者大鼠腹腔注射生理盐 水,后者大鼠腹腔注射糖原(5 g/kg),过夜,第二天早晨剖杀,取腹水,无钙Hanks液反复 冲洗腹腔,1500 r/m低温离心10分钟,低渗除去红细胞,提纯 的MΦ计数后调整至1×108/ml,冰盒中放置,立即进行NO自由基的检测。
NO的ESR检测条件 ESR谱仪检测用X-波段,微波功率10 mW ,高频调制频率50 kHz,调制幅度0.2 mT,扫宽100 G,室温。
, http://www.100md.com
1.3 细胞氧耗的检测
原理和方法参见文献[3],参数K定义如下: K=(b+c)/(2a),b和c是自旋探针CTPO 甲基氢原子的超精细分裂两最高峰峰高,a为b和c两峰的最高和最低点的距离,如图2。 0.1 mmol/L的CTPO,rMΦ为2×107个/ml,加入和不加入100 ng/ml PMA,进样品腔检测。 ESR检测条件 X-波段,微波功率1 mW,调制频率100 kHz,调制幅度0.05 mT,中心磁场 3240 G,扫宽5 G,扫场0.37 G/秒,室温。
1.4 数据处理
NO浓度根据标准曲线所得的数据求出后,用SAS软件进行F方差分析和Dunett两两分析。
2 结果
2.1 pMΦ和rMΦ中的NO波谱比较
, http://www.100md.com
从收集的MΦ数量比较,rMΦ是pMΦ的150倍之多。pMΦ与(MGD)2-Fe2+在体系 中没有检测出 特征性三重峰的NO波谱信号,用刺激剂PMA后再检测,依然没有出现明显的NO特征波谱。而r MΦ则能在没用PMA的情况下就出现NO的特征性波谱(如图1)。

Fig 1 The NO spectrum in the pMΦ and rMΦ.
A: pMΦ B: pMΦ+PMA C: rMΦ
2.2 NO前体和NOS抑制剂对NO波谱信号的改变
在细胞数量为6×107/ml的rMΦ中加入(MGD)2-Fe2+,出现NO的特征性波谱 信号;在体系中加入0.02 mol/L的L-NNA,NO的波谱信号明显减弱,在此体系中再加入0.3 M的L-Arg后,则信号有所增强;而在不用抑制剂的体系中,即6×107/ml的rMΦ中加入(M GD)2-Fe2+后直接加入L-Arg,则能出现比rMΦ本身信号更强的NO波谱信号(如 图2)。

, http://www.100md.com
Fig 2 Changes of NO spectrum after L-NNA and L-arg. used. A : rMΦ B : rMΦ+L-NNA C : rMΦ+L-NNA+L-arg D : rMΦ+L-Arg
2.3 不同体系中rMΦ的NO浓度变化
在体外刺激剂PMA作用下,rMΦ在不同的L-Arg浓度中NO含量有相应的变化,其中在0.6 mo l/LL-Arg中NO含量升高最为显著,与另两组都有显著差异。再加入SOD后,NO产生量也出现 了一些组间差异,在0.6 mol/L的L-Arg体系中的NO含量与0.3 mol/L的L-Arg体系中的NO含 量差异显著。如下表1。
Table 1 Changes of NO concentration of rMΦ L-Arg(mol/L)
[NO](×10-8 mol)
, 百拇医药
rMΦ +PMA
rMΦ +PMA+SOD
0
44.44±4.95
49.92±10.01
0.3
43.22±13.81
32.63±8.29
0.6
58.93±3.77**△
55.93±7.84*
, 百拇医药
Note: 1. Data were mean±SD.
2 * P<0.05,** P<0.01 Compared with 0.3 mol/L L-Arg group.
3 △P<0.05.Compared with 0 mol/L L-Arg group.
2.4 外源性刺激剂PMA对rMΦ的氧耗的影响
rMΦ没有出现明显的耗氧;在加入刺激剂PMA后rMΦ则 氧耗大为增加,出现了明显的呼吸 爆发,rMΦ本身有较弱的RS发生,加入PMA刺激剂,RS发生更为显著,即耗氧量大大增加 。 K值对比,未加PMA的rMΦ在检测早期高于加了PMA的rMΦ,但随后PMA的刺激作用便很快发 挥,氧耗量急剧上升,K值随氧耗的增加而增大,两组对比出现明显差异。(如图3)。

, http://www.100md.com
Fig 3 Changes of K relative to oxygen consumption
of 2×107/ml rMΦ. A : rMΦ B : rMΦ+PMA
3 讨论
MΦ是机体发生免疫变化的主要细胞之一,也是参与免疫信息提呈及免疫杀伤最早的细胞, 但体内的MΦ一般处于静止状态,受到某些因素如化学物质、病原体等异物刺激的腹腔渗出M Φ为rMΦ,通过细胞因子的进一步刺激可表达出细胞毒性[4]。具有细胞毒性的MΦ 所能体现的生物学功能,如抗感染、抗肿瘤作用,抗原提呈、免疫调节等特异性的 免疫应答,已证明是由诱导性的一氧化氮合酶(iNOS)生成的NO来介导,或部分是由NO介导的 [5]。近年来随着NO研究的日趋深入,对于NO的研究方法也日益增多。其中,利用 自旋探针和自旋捕集方法这一特殊的ESR技术,加上比较稳定、特异性强的捕集剂,可直接 检测不同体系中的NO,从特征性的波谱出现得到反映[6]。rMΦ中的NO与捕集剂结 合后其波谱也可 呈现出特征性的三重峰,并随体系中加入的NO前体或NOS抑制剂的不同而出现波谱强度的改 变,这说明rMΦ的功能也有NO的介导。
, http://www.100md.com
L-Arg在体内的代谢途径除了经NOS生成NO及瓜氨 酸外;还可以经精氨酸酶催化生成尿 素和L-鸟氨酸,或经精氨酸脱羧酶催化生成CO2及精胺。NO合成在精氨酸代谢途径中占很 小 一部分,非NOS途径对调节细胞内L-Arg浓度起着重要作用。PMA在激发了iNOS的同时,可能 也激发了精氨酸酶等,尤其精氨酸酶Ⅱ对NO的产生起着向下调节的作用[7];外 源性低浓 度的L-Arg比高浓度L-Arg的代谢在非NOS途径上的代谢可能更强,使得NO产生与外源性的L -A rg补充不相一致。应用SOD后,三组NO的产生都有变化,未用外源性的L-Arg组,其NO生成 有 少量升高,SOD可减少超氧阴离子自由基(
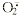 ),NO减少了与
),NO减少了与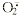 反应机会而使得过氧化亚硝酸产生 减少。与对于外源性的L-Arg另两组,SOD应用却导致NO产生不同程度的降低,究其原委尚 需进一步研究。
反应机会而使得过氧化亚硝酸产生 减少。与对于外源性的L-Arg另两组,SOD应用却导致NO产生不同程度的降低,究其原委尚 需进一步研究。, 百拇医药
MΦ被激发产生NO发挥吞噬功能过程中,也发生呼吸爆发(respiration burst,RB), 这也是MΦ杀灭和吞噬病原体或微生物的重要途径,是MΦ的功能反映[8]。rMΦ本 身有较弱的RB发生,它反映的是rMΦ在通常情况下的呼吸耗氧;加入PMA刺激剂,RB发生更 为显著,K值对比,表明PMA可较好 的刺激rMΦ产生RB,增加氧吸收。rMΦ氧耗增加的过程就是其受PMA刺激后发生RB的过程。
基金项目:国家自然科学基金资助项目(29670209)
作者简介:先宏(1970年生),女,四川井研人,军 事医学科学院博士生,现从事自由基生物医学研究.
参考文献:
[1] Nathan CF. Mechanism of macrophages antimicrobial activity[] . Trans .R. Soc. Trop.Med . Hygiene.1983,77:620-630.
, http://www.100md.com
[2] 孙存普,丛建波,孙长凯.一氧化氮自由基(NO·).由基生物学导论[ M].中国科学技术出版社,1999.
[3] Zhao BL;Li XJ;He RG et al .ESR studies on active oxygen consumpt ion during the respiratory burst of human polymorphonuulear leukocytes[J] .Cell Biol.In t. Rep. 1989,13:317-328.
[4] Norby SW; James A; Weyhenmeyer et al .Stimulation and inhibition of nitric oxide production in macrophages and neural cells as observed by spin trapping [J].Free Radical Biology & Medicine.1997,22:1-9.
, 百拇医药
[5] Macmicking J; Xie QW; Nathan C. Nitric oxide and macrophage fun ction[J]. Annu.Rev.Immunol. 1997,15: 323-350.
[6] 李妍,丛建波,王澍等.生物体内的一氧化氮水平的定量检测研究[J].解 放军药学学报.1994,15(2):12-15.
[7] Sidney M;Morris JR;Diane KL et al.Differential regulation of arg inases and inducible nitric oxide synthase in murine macrophage cells[J]. Am. J. Physiol . 1998,275:E740-E747.
[8] Bernhard brune ;Christine Gotz;Udo K.Mebmer ei al Superoxide for mation and m acrophage resistance to nitric oxide-mediated apoptosis[J]. J. Biochem. 1997 , 272:7253-7258.
收稿日期:1999-09-08, 百拇医药