刀豆素A诱发小鼠急性肝损害模型的形态改变及Fas和FasL的表达
作者:陈姬秀 韩絮琳 秦一中 万谟彬 王建军 徐向阳
单位:陈姬秀 韩絮琳 秦一中 万谟彬 徐向阳(200433 上海,第二军医大学长海医院);王建军(第二军医大学病理解剖学教研室)
关键词:
中华传染病杂志000216 刀豆素A(Concanavalin A, Con A)在体外可刺激T细胞进行有丝分裂,并释放细胞因子,诱导淋巴细胞及巨噬细胞的细胞素毒性[1]。而免疫性肝病病理变化的实质是T、B淋巴细胞介导的免疫损害,尤其是T细胞介导的细胞免疫在病毒性肝炎等疾病中是肝细胞损害的主要因素[2]。我们用尾静脉一次性注射一定剂量Con A的方法成功地建立了Balb/C小鼠特异性急性肝损害的动物模型,并对其病理损害机制作了初步的探讨。
材料和方法
, 百拇医药
一、实验材料
(一) 实验动物 雄性Balb/C小鼠,8~12周,体重20~27 g,第二军医大学动物中心提供。
(二) 主要试剂 Con A:美国Sigma公司;兔抗鼠Fas单抗及FasL单抗:美国Santa Cruz公司;羊抗兔IgG:上海医学化学检验所;LsAB试剂盒:丹麦DAKO公司提供。
二、实验方法
(一) 小鼠急性肝损害模型的建立 将Balb/C小鼠随机分成五组,A组(对照组)以0.25 ml注射用生理盐水代替,B、C、D、E组分别以每公斤体重10~40 mg Con A的剂量,以0.25 ml生理盐水充分溶解后尾静脉一次性注入,8 h后摘眼球放血,以2 500 r/min离心20 min后取血清待检,脏器用中性缓冲福尔马林液固定。
, 百拇医药 (二) 组织病理学检查 1. 肝脏等组织普通病理:常规HE染色,对A、B、D三组用病理指标评定肝损程度,病理指数的确定:在高倍镜下每次取20个视野,每一视野分三等份;“0”记整个视野无肝细胞病变;“1”记肝细胞发生病变<1/3视野;“2”记肝细胞发生病变1/3~2/3视野;“3”记肝细胞发生病变>2/3视野;20个视野得分相加即为肝细胞的病理指数PI值。2.链酶亲合素标记的辣根过氧化物酶显色法(S-P法)观察肝组织Fas及FasL表达:(1) 肝组织Fas表达:石蜡切片经二甲苯脱蜡至水,充分洗涤,微波抗原修复后冷却至室温,以LsAB试剂盒免疫组化检测,按说明操作。依次用正常兔血清(阻断)、兔抗鼠Fas单抗(反应)、生物素羊抗兔IgG(连接)、过氧化物酶-链酶亲合素反应,二氨基联苯胺(DAB)显色后,苏木素衬染。(2) 肝内FasL的表达检查:与检测Fas相同的免疫组织化学技术,改用兔抗鼠FasL单抗,以氨基乙基咔唑显色。(3) 实验对照:阴性对照:用PBS替代第一抗体设空白对照;用正常兔血清替代第一抗体设替代对照。阳性对照:用已知表达Fas及FasL的淋巴结为对照。(4)结果判定:阳性物质呈棕黄色,分布于胞膜和胞浆中,胞核经苏木素衬染为淡蓝色。
, 百拇医药
(三) 丙氨酸转氨酶(ALT)测定 赖氏法。
三、统计学处理
t检验,F检验,相关分析。
结果
一、不同剂量Con A作用8 h后ALT表达水平
在实验中观察到Con A 30 mg/kg及40 mg/kg用量组在用药后6 h左右出现少动,抓之无反抗,肢体逐步发凉,放出的血,血凝块收缩不良等,D组在7 h死亡1只。各组测定的ALT结果如表1所示。以Con A剂量为变量,以ALT为应变量的相关分析显示两者呈显著的正相关,相关系数r=0.59(P=0.002),说明肝功能的损害对Con A具有剂量依赖性。
二、组织病理学观察
, 百拇医药
(一) HE染色 心、肺、肝、肾、脾等脏器HE染色结果显示只有肝组织有明显的损害。不同程度地表现为肝小叶结构欠清晰,肝细胞肿胀、变性,肝窦及中央小静脉淤血,部分肝细胞内有大的脂肪空泡形成,胞浆透亮,核固缩,小灶性坏死多见,肝内小血管中可见到较多的炎性细胞集聚。此外,单个肝细胞嗜酸性变非常普遍。用病理指数作为肝损的量化指标,B、D组分别为:41.5±9.2、45.5±7.8,随着Con A剂量的加大,PI有上升趋势,与对照A组10±4.2差异有显著及非常显著性。
表1 不同剂量Con A处理后小鼠血清ALT表在水平 组别
Con A量(mg/kg)
实验只数
死亡数
ALT(U/L)
, 百拇医药
A
0
6
0
62±19
B
10
6
0
1 405±807**
C
20
6
0
, http://www.100md.com
3 182±1 494**
D
30
7
1
8 933±4 076**
E
40
7
0
10 229±9 071**
注:ALT值为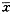 ±s **P<0.01
±s **P<0.01
, 百拇医药
(二) 免疫组织化学 Fas在对照组和Con A处理组肝细胞表面及肝窦内皮细胞表面均有表达,但Con A处理组比较显著;FasL只表达于Con A处理组肝组织中,靠近中央静脉的肝细胞内表达明显。讨论
Con A在体外能刺激T细胞分裂并释放各种细胞因子,诱导淋巴细胞和巨噬细胞的细胞毒性是其生物学特性之一。本实验在无需致敏的情况下用尾静脉一次性注射一定剂量Con A的方法成功地建立了纯种Balb/C小鼠特异性肝损害模型。通过Con A注射剂量与血清ALT表达水平的相关分析及病理指数的观察,提示在一定范围内肝损程度与Con A剂量有显著的正相关。
通过对Con A处理组Balb/C小鼠主要脏器的病理观察显示,只有肝组织有明显的损害,不同程度地表现为肝细胞肿胀、变性,坏死,肝内小血管中可见到较多的炎性细胞集聚。此外,单个肝细胞嗜酸性变非常普遍。免疫组织化学检查显示Fas在对照组的Balb/C小鼠肝组织中有表达,这与文献报道一致,而Con A处理组肝组织中Fas表达尤为明显,在肝细胞及肝窦内皮表面多见。FasL只表达于Con A处理组肝组织中,靠近中央静脉的肝细胞内呈强阳性。
, 百拇医药
Con A诱导特异性肝脏损害的原因尚不清楚。Gantner等[3]观察到Con A只聚集在肝窦内皮细胞表面。Con A对肝脏的特异性损害尚取决于T淋巴细胞的激活,并依赖于与巨噬细胞的互相作用。电镜还观察到淋巴细胞与肝细胞紧密接触的现象[4]。Keren等[5]认为Con A可能起到替代抗原提呈细胞提呈的MHC-Ⅱ类分子结合的多肽抗原的作用。近年的研究认为,肝脏的结构特异性-肝细胞和库普弗细胞的紧密接触,使其实质细胞与免疫细胞不必通过体液循环而相互作用,这可能增加了作用的直接性和强度而较别的脏器更容易遭受免疫攻击。本实验的结果显示肝实质细胞是Con A毒性的靶细胞,Con A在体内可能亦能通过诱导T细胞及巨噬细胞的细胞毒性,进一步分泌某些细胞因子发挥作用。此外,小鼠的淋巴细胞、肝细胞、胆管细胞,内皮细胞广泛地分布着Fas[6],而活化的T淋巴细胞,尤其是CD+8CTL细胞及CD+4Th1亚群可表达FasL[7],因而Con A可能通过激活T淋巴细胞表达FasL,以可溶性FasL的形式诱导肝细胞凋亡。既往认为只有成熟T细胞表达FasL。Galle等[8]首次在酒精性肝病肝细胞表面检测到FasL,并提出了“细胞自杀”及“同胞相杀”的假设。本实验初步观察到Con A处理组肝细胞内有FasL表达,提示表达FasL的肝细胞可能充当效应细胞,引起“细胞自杀”及“同胞相杀”的可能。
, http://www.100md.com
参考文献
1,Lis H, Sharon N. Biological properties of lectins. In The Lectins: Properties, Functions and Applications in Biology and Medicine. Liener JE, Sharon N, Goldstein IJ, editors. London: Academic Press, Inc, 1986. 256-291.
2,Mizuhara H, O'Neill E, Seki N, et al. T cell activation-associated hepatic injury: mediation by tumor necrosis factors and protection by interleukin-6. J Exp Med, 1994, 179:1529-1537.
, 百拇医药
3,Gantner F, Lrist M, Lohse AW, et al. Concanavalin A-induced T-cell-mediated hepatic injury in mice: The role of tumor necrosis factor. Hepatology, 1995, 21:190-198.
4,Tiegs G, Hentschel J, Wendel A. A T cell-dependent experimental liver injury in mice inducible by concanavalin A. J Clin Invest, 1992, 90:196-203.
5,Keren Z, Berke G. Selective binding of concanavalin A to target cell major histocompatibility antigens is required to induce non-specific conjugation and lysis by cytolytic T lymphocytes in Lectin-dependent cytotoxicity. Cell Immunol, 1984, 89:458-477.
, 百拇医药
6,Watanabe-Fukunga R, Brannan CI, Itoh N, et al. The cDNA structure expression and chromosomal assignment of the mouse Fas antigen. J Immunol, 1992, 148:1274-1279.
7,Anel A, Buferne M, Beyer C, et al. T cell receptor-induced Fas ligand expression in cytotoxic T lymphocyte clones is blocked by protein tyrosine kinase inhibitors and cyclosporin A. Eur J Immunol, 1994, 24:2469-2476.
8,Galle PR, Hofmann WJ, Walczak H, et al. Involvement of the CD95(Apo-1/Fas) receptor and ligand in liver damage. J Exp Med, 1995, 182:1223-1230.
收稿日期:2000-01-26, 百拇医药
单位:陈姬秀 韩絮琳 秦一中 万谟彬 徐向阳(200433 上海,第二军医大学长海医院);王建军(第二军医大学病理解剖学教研室)
关键词:
中华传染病杂志000216 刀豆素A(Concanavalin A, Con A)在体外可刺激T细胞进行有丝分裂,并释放细胞因子,诱导淋巴细胞及巨噬细胞的细胞素毒性[1]。而免疫性肝病病理变化的实质是T、B淋巴细胞介导的免疫损害,尤其是T细胞介导的细胞免疫在病毒性肝炎等疾病中是肝细胞损害的主要因素[2]。我们用尾静脉一次性注射一定剂量Con A的方法成功地建立了Balb/C小鼠特异性急性肝损害的动物模型,并对其病理损害机制作了初步的探讨。
材料和方法
, 百拇医药
一、实验材料
(一) 实验动物 雄性Balb/C小鼠,8~12周,体重20~27 g,第二军医大学动物中心提供。
(二) 主要试剂 Con A:美国Sigma公司;兔抗鼠Fas单抗及FasL单抗:美国Santa Cruz公司;羊抗兔IgG:上海医学化学检验所;LsAB试剂盒:丹麦DAKO公司提供。
二、实验方法
(一) 小鼠急性肝损害模型的建立 将Balb/C小鼠随机分成五组,A组(对照组)以0.25 ml注射用生理盐水代替,B、C、D、E组分别以每公斤体重10~40 mg Con A的剂量,以0.25 ml生理盐水充分溶解后尾静脉一次性注入,8 h后摘眼球放血,以2 500 r/min离心20 min后取血清待检,脏器用中性缓冲福尔马林液固定。
, 百拇医药 (二) 组织病理学检查 1. 肝脏等组织普通病理:常规HE染色,对A、B、D三组用病理指标评定肝损程度,病理指数的确定:在高倍镜下每次取20个视野,每一视野分三等份;“0”记整个视野无肝细胞病变;“1”记肝细胞发生病变<1/3视野;“2”记肝细胞发生病变1/3~2/3视野;“3”记肝细胞发生病变>2/3视野;20个视野得分相加即为肝细胞的病理指数PI值。2.链酶亲合素标记的辣根过氧化物酶显色法(S-P法)观察肝组织Fas及FasL表达:(1) 肝组织Fas表达:石蜡切片经二甲苯脱蜡至水,充分洗涤,微波抗原修复后冷却至室温,以LsAB试剂盒免疫组化检测,按说明操作。依次用正常兔血清(阻断)、兔抗鼠Fas单抗(反应)、生物素羊抗兔IgG(连接)、过氧化物酶-链酶亲合素反应,二氨基联苯胺(DAB)显色后,苏木素衬染。(2) 肝内FasL的表达检查:与检测Fas相同的免疫组织化学技术,改用兔抗鼠FasL单抗,以氨基乙基咔唑显色。(3) 实验对照:阴性对照:用PBS替代第一抗体设空白对照;用正常兔血清替代第一抗体设替代对照。阳性对照:用已知表达Fas及FasL的淋巴结为对照。(4)结果判定:阳性物质呈棕黄色,分布于胞膜和胞浆中,胞核经苏木素衬染为淡蓝色。
, 百拇医药
(三) 丙氨酸转氨酶(ALT)测定 赖氏法。
三、统计学处理
t检验,F检验,相关分析。
结果
一、不同剂量Con A作用8 h后ALT表达水平
在实验中观察到Con A 30 mg/kg及40 mg/kg用量组在用药后6 h左右出现少动,抓之无反抗,肢体逐步发凉,放出的血,血凝块收缩不良等,D组在7 h死亡1只。各组测定的ALT结果如表1所示。以Con A剂量为变量,以ALT为应变量的相关分析显示两者呈显著的正相关,相关系数r=0.59(P=0.002),说明肝功能的损害对Con A具有剂量依赖性。
二、组织病理学观察
, 百拇医药
(一) HE染色 心、肺、肝、肾、脾等脏器HE染色结果显示只有肝组织有明显的损害。不同程度地表现为肝小叶结构欠清晰,肝细胞肿胀、变性,肝窦及中央小静脉淤血,部分肝细胞内有大的脂肪空泡形成,胞浆透亮,核固缩,小灶性坏死多见,肝内小血管中可见到较多的炎性细胞集聚。此外,单个肝细胞嗜酸性变非常普遍。用病理指数作为肝损的量化指标,B、D组分别为:41.5±9.2、45.5±7.8,随着Con A剂量的加大,PI有上升趋势,与对照A组10±4.2差异有显著及非常显著性。
表1 不同剂量Con A处理后小鼠血清ALT表在水平 组别
Con A量(mg/kg)
实验只数
死亡数
ALT(U/L)
, 百拇医药
A
0
6
0
62±19
B
10
6
0
1 405±807**
C
20
6
0
, http://www.100md.com
3 182±1 494**
D
30
7
1
8 933±4 076**
E
40
7
0
10 229±9 071**
注:ALT值为
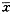 ±s **P<0.01
±s **P<0.01, 百拇医药
(二) 免疫组织化学 Fas在对照组和Con A处理组肝细胞表面及肝窦内皮细胞表面均有表达,但Con A处理组比较显著;FasL只表达于Con A处理组肝组织中,靠近中央静脉的肝细胞内表达明显。讨论
Con A在体外能刺激T细胞分裂并释放各种细胞因子,诱导淋巴细胞和巨噬细胞的细胞毒性是其生物学特性之一。本实验在无需致敏的情况下用尾静脉一次性注射一定剂量Con A的方法成功地建立了纯种Balb/C小鼠特异性肝损害模型。通过Con A注射剂量与血清ALT表达水平的相关分析及病理指数的观察,提示在一定范围内肝损程度与Con A剂量有显著的正相关。
通过对Con A处理组Balb/C小鼠主要脏器的病理观察显示,只有肝组织有明显的损害,不同程度地表现为肝细胞肿胀、变性,坏死,肝内小血管中可见到较多的炎性细胞集聚。此外,单个肝细胞嗜酸性变非常普遍。免疫组织化学检查显示Fas在对照组的Balb/C小鼠肝组织中有表达,这与文献报道一致,而Con A处理组肝组织中Fas表达尤为明显,在肝细胞及肝窦内皮表面多见。FasL只表达于Con A处理组肝组织中,靠近中央静脉的肝细胞内呈强阳性。
, 百拇医药
Con A诱导特异性肝脏损害的原因尚不清楚。Gantner等[3]观察到Con A只聚集在肝窦内皮细胞表面。Con A对肝脏的特异性损害尚取决于T淋巴细胞的激活,并依赖于与巨噬细胞的互相作用。电镜还观察到淋巴细胞与肝细胞紧密接触的现象[4]。Keren等[5]认为Con A可能起到替代抗原提呈细胞提呈的MHC-Ⅱ类分子结合的多肽抗原的作用。近年的研究认为,肝脏的结构特异性-肝细胞和库普弗细胞的紧密接触,使其实质细胞与免疫细胞不必通过体液循环而相互作用,这可能增加了作用的直接性和强度而较别的脏器更容易遭受免疫攻击。本实验的结果显示肝实质细胞是Con A毒性的靶细胞,Con A在体内可能亦能通过诱导T细胞及巨噬细胞的细胞毒性,进一步分泌某些细胞因子发挥作用。此外,小鼠的淋巴细胞、肝细胞、胆管细胞,内皮细胞广泛地分布着Fas[6],而活化的T淋巴细胞,尤其是CD+8CTL细胞及CD+4Th1亚群可表达FasL[7],因而Con A可能通过激活T淋巴细胞表达FasL,以可溶性FasL的形式诱导肝细胞凋亡。既往认为只有成熟T细胞表达FasL。Galle等[8]首次在酒精性肝病肝细胞表面检测到FasL,并提出了“细胞自杀”及“同胞相杀”的假设。本实验初步观察到Con A处理组肝细胞内有FasL表达,提示表达FasL的肝细胞可能充当效应细胞,引起“细胞自杀”及“同胞相杀”的可能。
, http://www.100md.com
参考文献
1,Lis H, Sharon N. Biological properties of lectins. In The Lectins: Properties, Functions and Applications in Biology and Medicine. Liener JE, Sharon N, Goldstein IJ, editors. London: Academic Press, Inc, 1986. 256-291.
2,Mizuhara H, O'Neill E, Seki N, et al. T cell activation-associated hepatic injury: mediation by tumor necrosis factors and protection by interleukin-6. J Exp Med, 1994, 179:1529-1537.
, 百拇医药
3,Gantner F, Lrist M, Lohse AW, et al. Concanavalin A-induced T-cell-mediated hepatic injury in mice: The role of tumor necrosis factor. Hepatology, 1995, 21:190-198.
4,Tiegs G, Hentschel J, Wendel A. A T cell-dependent experimental liver injury in mice inducible by concanavalin A. J Clin Invest, 1992, 90:196-203.
5,Keren Z, Berke G. Selective binding of concanavalin A to target cell major histocompatibility antigens is required to induce non-specific conjugation and lysis by cytolytic T lymphocytes in Lectin-dependent cytotoxicity. Cell Immunol, 1984, 89:458-477.
, 百拇医药
6,Watanabe-Fukunga R, Brannan CI, Itoh N, et al. The cDNA structure expression and chromosomal assignment of the mouse Fas antigen. J Immunol, 1992, 148:1274-1279.
7,Anel A, Buferne M, Beyer C, et al. T cell receptor-induced Fas ligand expression in cytotoxic T lymphocyte clones is blocked by protein tyrosine kinase inhibitors and cyclosporin A. Eur J Immunol, 1994, 24:2469-2476.
8,Galle PR, Hofmann WJ, Walczak H, et al. Involvement of the CD95(Apo-1/Fas) receptor and ligand in liver damage. J Exp Med, 1995, 182:1223-1230.
收稿日期:2000-01-26, 百拇医药