氢氧化钙调节骨代谢的体外研究
作者:梁宇红 王嘉德 于世凤 庞淑珍
单位:梁宇红 王嘉德(北京医科大学口腔医学院牙体牙髓科,100081);于世凤 庞淑珍(病理科)
关键词:动物实验;成骨细胞;碱性磷酸酶;氢氧化钙
中华口腔医学杂志000210 【摘要】 目的 观察氢氧化钙对骨组织成骨活性的影响,为根尖周病药物治疗学提供实验依据。方法 利用与牙槽骨生物学特点相似的小鼠颅骨建立体外培养模型,观察氢氧化钙作用下骨组织碱性磷酸酶(alkaline phosphatase ,ALP)分泌活性及无机磷含量的变化。结果 适当浓度的氢氧化钙可以提高成骨细胞ALP的分泌活性,同时培养基中无机 PO43-浓度也呈现有意义的变化。结论 Ca(OH)2具有激活成骨细胞钙化酶活性、增加局部环境中PO43-浓度的作用,使矿物沉积更易于发生,促进根尖病变修复。
, 百拇医药
Mechanisms of bone repairment in periapical diseases:studies on adjusting bone metabolism with calcium hydroxide in vitro
LIANG Yuhong
(Department of Operative Dentistry and Endodontics, School of Stomatology,Beijing Medical University ,Beijing 100081,China)
WANG Jiade , YU Shifeng
【Abstract】 Objective To provide experiment evidence for clinical practice and for further exploration on mechanism and medicinal control of periapical diseases. Methods The culture model of neonatal mouse calvariae which has the similar biological activity to alveolar bone was established in vitro to observe the influence of calcium hydroxide on osteo-activity. Results The results showed that calcium hydroxide with proper concentration at organ culture level could enhance osteoblast ALP secreting activity, and increased the tendency of bone formation. At the same time , the concentration of inorganic PO43- in culture medium also had significant changes. Conclusions The mechanism of calcium hydroxide promoting repairment of bone tissues is not only by providing rich Ca2+and alkaline environment mineral deposition, but also by stimulating calcification enzyme activity of osteoblast. Meanwhile, increased PO43- concentration might improve the mineralization environment, which causes mineralization easily.
, 百拇医药
【Key words】 Animals,laboratory; Osteoblasts; Alkaline phosphatase; Calcium,hydroxide
根尖周病是根尖周组织炎症破坏性疾病,经过常规临床治疗后吸收和破坏的牙槽骨完全性修复十分困难。多年来临床工作者在根管内应用氢氧化钙制剂,以期通过药物阻断根尖周骨吸收,促进骨修复。氢氧化钙引导牙本质桥形成和促进根尖病变修复的作用已得到临床和动物实验证实,但在生物矿化过程中的具体作用及机制并不十分清楚,Ca(OH)2对成骨活性的影响以及对局部骨组织的矿物代谢环境的改变,尚未见到文献报道[1]。我们利用与牙槽骨生物学活性相似的小鼠颅骨建立体外培养模型,观察氢氧化钙对体外培养骨器官的成骨活性影响,为进一步探索根尖周病骨吸收机制和药物防治提供理论依据。
材料和方法
一、材料
, 百拇医药
1.动物来源:北京医科大学实验动物部提供出生2~3 d的NIH小鼠。
2.主要仪器与设备: Hitachi 7060全自动生化分析仪(日本);pH计(Check 1 pH计,美国Hanna公司);二氧化碳恒温恒湿培养箱(美国Heraeus公司)。
3.培养用液:RPMI1640培养基(美国Gibco-BRC公司),10%小牛血清(天津血液制品研究所)。试剂:碱性磷酸酶(alkaline phosphatase ,ALP) 成套试剂、钙离子试剂盒、无机磷试剂盒(北京中生生物工程高技术公司),氢氧化钙试剂(北京制剂厂,化学纯)。
二、方法
1.Ca(OH)2溶液的制备:将120 mg Ca(OH)2干粉末溶于100 ml去离子水中,3 000 r/min条件下离心10 min,取上清液。pH计测试Ca(OH)2溶液的pH值为12.55,全自动生化分析仪测定Ca(OH)2溶液的Ca2+浓度,利用去离子水制备Ca(OH)2系列稀释液,灭菌备用(表1)。
, 百拇医药
2.RPMI1640完全培养液滴定实验重复3次,取均值。RPMI1640完全培养液含25 mmol/L HEPES缓冲液、5% 小牛血清、1×105 U/L青霉素、100 mg/L链霉素,pH 7.0。
表1 加入Ca(OH)2溶液的Ca2+浓度
与培养液pH值的对应关系 加入Ca(OH)2溶液的
Ca2+浓度(mmol/L)
培养液pH值(8 ml)
7.06
0(0 ml)
0.37(2 ml)
, http://www.100md.com
7.12
0.74(2 ml)
7.20
1.90(2 ml)
7.34
3.70(2 ml)
7.45
4.90(2 ml)
7.55
7.40(2 ml)
7.63
3.新生小鼠颅骨器官培养体系的建立:出生后2~3 d的NIH小鼠,无菌分离完整颅骨,去净软组织及骨膜,RPMI 1640培养液洗2次后,放入装有RPMI 1640完全培养液的培养皿中,在37℃,5% CO2恒温恒湿培养箱中预培养24 h,相差显微镜下观察器官培养情况。
, 百拇医药
4.骨代谢实验:①剂量效应:预培养后颅骨转移至培养板,每孔加入1个颅骨及0.8 ml RPMI 1640完全培养液,将其分为5组,每组6个样本,实验条件分别为:A组:加入0.74 mmol/L Ca(OH)2溶液200 μl;B组:加入1.90 mmol/L Ca(OH)2溶液200 μl;C组:加入4.90 mmol/L Ca(OH)2溶液200 μl;D组:加入7.40 mmol/L Ca(OH)2溶液200 μl;E组:对照组加入等量去离子水。添加药物完毕继续培养48 h,取上清液50 μl,Eppendorf管中保存备检。②时间效应:3块6孔培养板,分别作为12、24、48 h实验组,每块培养板,随机选择3孔为实验组,3孔为对照组,每孔1个颅骨、0.8 ml RPMI 1640完全培养液。实验组添加1.9 mmol/L Ca(OH)2溶液200 μl,对照组添加等量灭菌去离子水。其他方法同上。
5.实验指标的测定:培养上清液样本自冰箱中取出,去离子水倍比稀释至100 μl,利用全自动生化分析仪,检测骨器官ALP分泌活性(生化法)及上清液中无机磷含量。
, 百拇医药
6.统计学处理:实验结果以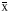 ±s表示(每组实验6个样本),用方差分析方法进行统计学检验(北京医科大学医学统计室SAS软件)。结果
±s表示(每组实验6个样本),用方差分析方法进行统计学检验(北京医科大学医学统计室SAS软件)。结果
1.从表2可以看出,4种不同浓度的Ca(OH)2溶液作用于新生小鼠颅骨培养体系,骨器官ALP分泌活性的变化:加入0.74 mmol/L、1.90 mmol/L及4.90 mmol/L Ca(OH)2溶液的实验组ALP活性增高,其中1.9 mmol/L组与对照组相比,差异有显著性(P<0.000 1)。加入高浓度Ca(OH)2溶液(7.40 mmol/L),骨器官的ALP分泌活性明显受到抑制(P<0.000 1)。从表3可以看出,0.74、1.90、4.90 mmol/L的Ca(OH)2溶液均引起培养基中磷含量明显升高(P<0.05),高浓度组(7.4 mmol/L)的磷含量低于同时间点对照组(P<0.05)。
, 百拇医药
2.Ca(OH)2溶液影响骨代谢的时间效应:在加入1.9 mmol/L Ca(OH)2溶液后的不同时间点收集培养上清液。由表4,5可以看出:Ca(OH)2作用下,骨器官培养液中ALP活性随时间延长而升高,48 h时间点,Ca(OH)2作用组ALP活性明显高于空白对照组(P<0.01);同时,培养液中无机磷含量亦明显升高,在24及48 h实验组,磷含量显著高于对照组(P<0.05)。
表2 不同浓度Ca(OH)2溶液(mmol/L)对ALP
分泌活性的影响(×103 IU/L,n=6) Ca(OH)2浓度
对照组
0.74
, http://www.100md.com
1.90
4.90
7.40
ALP(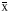 ±s)
±s)
78.7±
11.5
93.0±
14.6
117.0±
23.0*
88.8±
, http://www.100md.com
26.6
32.3±
10.2*
*与对照组相比P<0.000 1表3 不同浓度Ca(OH)2溶液对培养上清液中
无机磷含量的影响(mmol/L,n=6) Ca(OH)2浓度
对照组
0.74
1.90
4.90
7.40
, 百拇医药
P(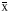 ±s)
±s)
5.56±
0.16
6.13±
0.10*
6.68±
0.04*
5.88±
0.09*
4.96±
0.17*
, 百拇医药
*与对照组相比P<0.05表4 骨器官培养液中ALP分泌活性
随时间的变化(×103IU/L,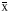 ±s,n=3) 组别
±s,n=3) 组别
时间(h)
12
24
48
对照
69.7±6.3
70.7±8.4
88.3±12.5
, 百拇医药
实验
98.5±6.4
104.0±28.6
196.7±31.3*
*与对照组相比P<0.01表5 骨器官培养液中无机磷含量随
时间的变化(mmol/L,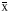 ±s,n=3) 组别
±s,n=3) 组别
时间(h)
12
24
48
, 百拇医药
对照
5.73±1.50
5.91±0.04
5.85±0.12
实验
6.51±0.06
6.65±0.03*
6.71±0.01*
*与对照组相比P<0.05讨论
本研究观察了口腔常用药物Ca(OH)2对骨组织代谢的影响:适当浓度的Ca(OH)2(1.90 mmol/L)可以刺激成骨细胞合成分泌ALP,48 h时间点即可观察到这种现象。Robison曾推测Ca(OH)2可以激活ALP活性,促进组织的修复[2]。Torneck等[3]证实来源于Ca(OH)2的Ca2+刺激牙髓ALP合成分泌。陈筠[4] 利用体外培养牙髓组织,观察到Ca(OH)2明显提高了牙髓细胞ALP活性,促进人牙髓细胞ALP基因表达,从分子水平证实Ca(OH)2对ALP基因的直接刺激作用。本实验表明,Ca(OH)2对骨组织与对牙髓组织的作用有一定相似性。
, http://www.100md.com
Ca(OH)2作用下骨组织培养液中无机PO43-浓度也呈现有意义的变化。局部无机磷浓度升高,以及Ca(OH)2提供的Ca2+和碱性pH值,均为骨矿物沉积的有利条件。培养基中无机磷浓度升高的原因,推测是ALP分解组织中无机磷酸盐和有机磷酸物的结果。De Broe等[5,6]也支持此观点。
本研究还发现:组织培养基中加入高浓度(7.40 mmol/L)的Ca(OH)2溶液后,骨组织ALP分泌活性明显受到抑制(P< 0.01),原因在于过高的pH值反而抑制了细胞的代谢。近年来研究者也在临床应用中发现由于Ca(OH)2药物与组织直接接触,强碱性造成对细胞的毒性作用。本实验为了解决这一问题,预先通过滴定实验,调整使培养液在加入Ca(OH)2溶液后的pH值仍在细胞生长所需范围内,这样更接近于体内真实情况。在体内,发挥药物活性作用的是Ca2+和OH,直接接触药物的稍远部位才发生组织的修复矿化。
, http://www.100md.com
本实验选取ALP作为评价新骨形成活性的指标,因为ALP与成骨细胞以及生物矿化过程有密切关系。ALP长期以来被公认是确定成骨细胞活性和新骨形成的确切标志物,它是成骨所必需的,其活性高低可反映相应组织细胞钙化能力和向成骨方向转化的趋势[6,7]。
本研究结果提示:Ca(OH)2可促进骨组织的修复,具有激活成骨细胞钙化酶活性和改善局部矿物环境的作用。实验提出的作用浓度和时间问题,可为临床改进Ca(OH)2制剂和使用方法提供依据。
参考文献:
[1] Foreman PC, Barnes IE. Review of calcium hydroxide. Int Endod J,1990,23:283-297.
[2] Tamburic SD, Vuleta GM, Ognjanovic JM. In vitro release of calcium and hydroxide ions from two types of calcium hydroxide preparation. Int Endod J, 1993,26:125-130.
, 百拇医药
[3] Torneck CD, Moe H, Howley TP. The effect of calcium hydroxide solution on porcine pulp fibroblast in vitro. J Endod ,1983,9:131-136.
[4] 陈筠. 氢氧化钙对人牙髓细胞碱性磷酸酶基因表达的作用 .牙体牙髓牙周病学杂志,1991,1:45-48.
[5] De Broe ME, Moss DW. Introduction :recent developments in alkaline phosphatase research. Clin Chem, 1992,38:2485-2491.
[6] Farley JR, Hall SL,Tanner MA, et al. Specific activity of skeletal alkaline phosphatase human osteoblast-line cells regulated by phosphate, phosphate esters, and phosphate analogs and release of alkaline phosphatase activity inversely regulated by calcium. J Bone Miners Res ,1994,9:497-508.
[7] Sajeda M. Bone remodeling. Bri Dent J,1992,21:235-242.
收稿日期:1999-02-24, 百拇医药
单位:梁宇红 王嘉德(北京医科大学口腔医学院牙体牙髓科,100081);于世凤 庞淑珍(病理科)
关键词:动物实验;成骨细胞;碱性磷酸酶;氢氧化钙
中华口腔医学杂志000210 【摘要】 目的 观察氢氧化钙对骨组织成骨活性的影响,为根尖周病药物治疗学提供实验依据。方法 利用与牙槽骨生物学特点相似的小鼠颅骨建立体外培养模型,观察氢氧化钙作用下骨组织碱性磷酸酶(alkaline phosphatase ,ALP)分泌活性及无机磷含量的变化。结果 适当浓度的氢氧化钙可以提高成骨细胞ALP的分泌活性,同时培养基中无机 PO43-浓度也呈现有意义的变化。结论 Ca(OH)2具有激活成骨细胞钙化酶活性、增加局部环境中PO43-浓度的作用,使矿物沉积更易于发生,促进根尖病变修复。
, 百拇医药
Mechanisms of bone repairment in periapical diseases:studies on adjusting bone metabolism with calcium hydroxide in vitro
LIANG Yuhong
(Department of Operative Dentistry and Endodontics, School of Stomatology,Beijing Medical University ,Beijing 100081,China)
WANG Jiade , YU Shifeng
【Abstract】 Objective To provide experiment evidence for clinical practice and for further exploration on mechanism and medicinal control of periapical diseases. Methods The culture model of neonatal mouse calvariae which has the similar biological activity to alveolar bone was established in vitro to observe the influence of calcium hydroxide on osteo-activity. Results The results showed that calcium hydroxide with proper concentration at organ culture level could enhance osteoblast ALP secreting activity, and increased the tendency of bone formation. At the same time , the concentration of inorganic PO43- in culture medium also had significant changes. Conclusions The mechanism of calcium hydroxide promoting repairment of bone tissues is not only by providing rich Ca2+and alkaline environment mineral deposition, but also by stimulating calcification enzyme activity of osteoblast. Meanwhile, increased PO43- concentration might improve the mineralization environment, which causes mineralization easily.
, 百拇医药
【Key words】 Animals,laboratory; Osteoblasts; Alkaline phosphatase; Calcium,hydroxide
根尖周病是根尖周组织炎症破坏性疾病,经过常规临床治疗后吸收和破坏的牙槽骨完全性修复十分困难。多年来临床工作者在根管内应用氢氧化钙制剂,以期通过药物阻断根尖周骨吸收,促进骨修复。氢氧化钙引导牙本质桥形成和促进根尖病变修复的作用已得到临床和动物实验证实,但在生物矿化过程中的具体作用及机制并不十分清楚,Ca(OH)2对成骨活性的影响以及对局部骨组织的矿物代谢环境的改变,尚未见到文献报道[1]。我们利用与牙槽骨生物学活性相似的小鼠颅骨建立体外培养模型,观察氢氧化钙对体外培养骨器官的成骨活性影响,为进一步探索根尖周病骨吸收机制和药物防治提供理论依据。
材料和方法
一、材料
, 百拇医药
1.动物来源:北京医科大学实验动物部提供出生2~3 d的NIH小鼠。
2.主要仪器与设备: Hitachi 7060全自动生化分析仪(日本);pH计(Check 1 pH计,美国Hanna公司);二氧化碳恒温恒湿培养箱(美国Heraeus公司)。
3.培养用液:RPMI1640培养基(美国Gibco-BRC公司),10%小牛血清(天津血液制品研究所)。试剂:碱性磷酸酶(alkaline phosphatase ,ALP) 成套试剂、钙离子试剂盒、无机磷试剂盒(北京中生生物工程高技术公司),氢氧化钙试剂(北京制剂厂,化学纯)。
二、方法
1.Ca(OH)2溶液的制备:将120 mg Ca(OH)2干粉末溶于100 ml去离子水中,3 000 r/min条件下离心10 min,取上清液。pH计测试Ca(OH)2溶液的pH值为12.55,全自动生化分析仪测定Ca(OH)2溶液的Ca2+浓度,利用去离子水制备Ca(OH)2系列稀释液,灭菌备用(表1)。
, 百拇医药
2.RPMI1640完全培养液滴定实验重复3次,取均值。RPMI1640完全培养液含25 mmol/L HEPES缓冲液、5% 小牛血清、1×105 U/L青霉素、100 mg/L链霉素,pH 7.0。
表1 加入Ca(OH)2溶液的Ca2+浓度
与培养液pH值的对应关系 加入Ca(OH)2溶液的
Ca2+浓度(mmol/L)
培养液pH值(8 ml)
7.06
0(0 ml)
0.37(2 ml)
, http://www.100md.com
7.12
0.74(2 ml)
7.20
1.90(2 ml)
7.34
3.70(2 ml)
7.45
4.90(2 ml)
7.55
7.40(2 ml)
7.63
3.新生小鼠颅骨器官培养体系的建立:出生后2~3 d的NIH小鼠,无菌分离完整颅骨,去净软组织及骨膜,RPMI 1640培养液洗2次后,放入装有RPMI 1640完全培养液的培养皿中,在37℃,5% CO2恒温恒湿培养箱中预培养24 h,相差显微镜下观察器官培养情况。
, 百拇医药
4.骨代谢实验:①剂量效应:预培养后颅骨转移至培养板,每孔加入1个颅骨及0.8 ml RPMI 1640完全培养液,将其分为5组,每组6个样本,实验条件分别为:A组:加入0.74 mmol/L Ca(OH)2溶液200 μl;B组:加入1.90 mmol/L Ca(OH)2溶液200 μl;C组:加入4.90 mmol/L Ca(OH)2溶液200 μl;D组:加入7.40 mmol/L Ca(OH)2溶液200 μl;E组:对照组加入等量去离子水。添加药物完毕继续培养48 h,取上清液50 μl,Eppendorf管中保存备检。②时间效应:3块6孔培养板,分别作为12、24、48 h实验组,每块培养板,随机选择3孔为实验组,3孔为对照组,每孔1个颅骨、0.8 ml RPMI 1640完全培养液。实验组添加1.9 mmol/L Ca(OH)2溶液200 μl,对照组添加等量灭菌去离子水。其他方法同上。
5.实验指标的测定:培养上清液样本自冰箱中取出,去离子水倍比稀释至100 μl,利用全自动生化分析仪,检测骨器官ALP分泌活性(生化法)及上清液中无机磷含量。
, 百拇医药
6.统计学处理:实验结果以
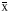 ±s表示(每组实验6个样本),用方差分析方法进行统计学检验(北京医科大学医学统计室SAS软件)。结果
±s表示(每组实验6个样本),用方差分析方法进行统计学检验(北京医科大学医学统计室SAS软件)。结果1.从表2可以看出,4种不同浓度的Ca(OH)2溶液作用于新生小鼠颅骨培养体系,骨器官ALP分泌活性的变化:加入0.74 mmol/L、1.90 mmol/L及4.90 mmol/L Ca(OH)2溶液的实验组ALP活性增高,其中1.9 mmol/L组与对照组相比,差异有显著性(P<0.000 1)。加入高浓度Ca(OH)2溶液(7.40 mmol/L),骨器官的ALP分泌活性明显受到抑制(P<0.000 1)。从表3可以看出,0.74、1.90、4.90 mmol/L的Ca(OH)2溶液均引起培养基中磷含量明显升高(P<0.05),高浓度组(7.4 mmol/L)的磷含量低于同时间点对照组(P<0.05)。
, 百拇医药
2.Ca(OH)2溶液影响骨代谢的时间效应:在加入1.9 mmol/L Ca(OH)2溶液后的不同时间点收集培养上清液。由表4,5可以看出:Ca(OH)2作用下,骨器官培养液中ALP活性随时间延长而升高,48 h时间点,Ca(OH)2作用组ALP活性明显高于空白对照组(P<0.01);同时,培养液中无机磷含量亦明显升高,在24及48 h实验组,磷含量显著高于对照组(P<0.05)。
表2 不同浓度Ca(OH)2溶液(mmol/L)对ALP
分泌活性的影响(×103 IU/L,n=6) Ca(OH)2浓度
对照组
0.74
, http://www.100md.com
1.90
4.90
7.40
ALP(
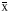 ±s)
±s)78.7±
11.5
93.0±
14.6
117.0±
23.0*
88.8±
, http://www.100md.com
26.6
32.3±
10.2*
*与对照组相比P<0.000 1表3 不同浓度Ca(OH)2溶液对培养上清液中
无机磷含量的影响(mmol/L,n=6) Ca(OH)2浓度
对照组
0.74
1.90
4.90
7.40
, 百拇医药
P(
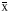 ±s)
±s)5.56±
0.16
6.13±
0.10*
6.68±
0.04*
5.88±
0.09*
4.96±
0.17*
, 百拇医药
*与对照组相比P<0.05表4 骨器官培养液中ALP分泌活性
随时间的变化(×103IU/L,
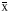 ±s,n=3) 组别
±s,n=3) 组别时间(h)
12
24
48
对照
69.7±6.3
70.7±8.4
88.3±12.5
, 百拇医药
实验
98.5±6.4
104.0±28.6
196.7±31.3*
*与对照组相比P<0.01表5 骨器官培养液中无机磷含量随
时间的变化(mmol/L,
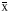 ±s,n=3) 组别
±s,n=3) 组别时间(h)
12
24
48
, 百拇医药
对照
5.73±1.50
5.91±0.04
5.85±0.12
实验
6.51±0.06
6.65±0.03*
6.71±0.01*
*与对照组相比P<0.05讨论
本研究观察了口腔常用药物Ca(OH)2对骨组织代谢的影响:适当浓度的Ca(OH)2(1.90 mmol/L)可以刺激成骨细胞合成分泌ALP,48 h时间点即可观察到这种现象。Robison曾推测Ca(OH)2可以激活ALP活性,促进组织的修复[2]。Torneck等[3]证实来源于Ca(OH)2的Ca2+刺激牙髓ALP合成分泌。陈筠[4] 利用体外培养牙髓组织,观察到Ca(OH)2明显提高了牙髓细胞ALP活性,促进人牙髓细胞ALP基因表达,从分子水平证实Ca(OH)2对ALP基因的直接刺激作用。本实验表明,Ca(OH)2对骨组织与对牙髓组织的作用有一定相似性。
, http://www.100md.com
Ca(OH)2作用下骨组织培养液中无机PO43-浓度也呈现有意义的变化。局部无机磷浓度升高,以及Ca(OH)2提供的Ca2+和碱性pH值,均为骨矿物沉积的有利条件。培养基中无机磷浓度升高的原因,推测是ALP分解组织中无机磷酸盐和有机磷酸物的结果。De Broe等[5,6]也支持此观点。
本研究还发现:组织培养基中加入高浓度(7.40 mmol/L)的Ca(OH)2溶液后,骨组织ALP分泌活性明显受到抑制(P< 0.01),原因在于过高的pH值反而抑制了细胞的代谢。近年来研究者也在临床应用中发现由于Ca(OH)2药物与组织直接接触,强碱性造成对细胞的毒性作用。本实验为了解决这一问题,预先通过滴定实验,调整使培养液在加入Ca(OH)2溶液后的pH值仍在细胞生长所需范围内,这样更接近于体内真实情况。在体内,发挥药物活性作用的是Ca2+和OH,直接接触药物的稍远部位才发生组织的修复矿化。
, http://www.100md.com
本实验选取ALP作为评价新骨形成活性的指标,因为ALP与成骨细胞以及生物矿化过程有密切关系。ALP长期以来被公认是确定成骨细胞活性和新骨形成的确切标志物,它是成骨所必需的,其活性高低可反映相应组织细胞钙化能力和向成骨方向转化的趋势[6,7]。
本研究结果提示:Ca(OH)2可促进骨组织的修复,具有激活成骨细胞钙化酶活性和改善局部矿物环境的作用。实验提出的作用浓度和时间问题,可为临床改进Ca(OH)2制剂和使用方法提供依据。
参考文献:
[1] Foreman PC, Barnes IE. Review of calcium hydroxide. Int Endod J,1990,23:283-297.
[2] Tamburic SD, Vuleta GM, Ognjanovic JM. In vitro release of calcium and hydroxide ions from two types of calcium hydroxide preparation. Int Endod J, 1993,26:125-130.
, 百拇医药
[3] Torneck CD, Moe H, Howley TP. The effect of calcium hydroxide solution on porcine pulp fibroblast in vitro. J Endod ,1983,9:131-136.
[4] 陈筠. 氢氧化钙对人牙髓细胞碱性磷酸酶基因表达的作用 .牙体牙髓牙周病学杂志,1991,1:45-48.
[5] De Broe ME, Moss DW. Introduction :recent developments in alkaline phosphatase research. Clin Chem, 1992,38:2485-2491.
[6] Farley JR, Hall SL,Tanner MA, et al. Specific activity of skeletal alkaline phosphatase human osteoblast-line cells regulated by phosphate, phosphate esters, and phosphate analogs and release of alkaline phosphatase activity inversely regulated by calcium. J Bone Miners Res ,1994,9:497-508.
[7] Sajeda M. Bone remodeling. Bri Dent J,1992,21:235-242.
收稿日期:1999-02-24, 百拇医药