牙囊在牙齿萌出时的调控作用
作者:李锐 李振钢 杨富生
单位:李锐(第四军医大学口腔医学院,陕西 西安 710032);李振钢(第四军医大学口腔医学院,陕西 西安 710032);杨富生(第四军医大学口腔医学院,陕西 西安 710032)
关键词:牙囊; 牙齿; 萌出;调控
牙体牙髓牙周病学杂志000240 【中图号】 R780.2 【文献标识码】 A
【文章编号】 1005-2593(20 00)02-0100-04
牙囊起源于外胚间充质,是包绕在成釉器外围的 一层致密的结缔组织 ,在牙齿发育后期形成牙骨质、牙周膜和固有牙槽骨。牙齿萌出是牙齿从颌骨中迁移至功能 位的一个复杂的生理过程。以往的研究证明,牙齿萌出需要依赖牙囊的存在,但其机制一直 未 明了。以下就近几年来关于牙囊从整体、细胞、分子水平上对牙齿萌出的调控作用所做的研 究进行综述。
, http://www.100md.com
1 牙囊在牙齿萌出时的整体调控作用
牙齿的萌出需要依赖牙囊的存在。Cahill DR的研究表明,以手术方法去除小鼠牙囊牙齿不 能萌出,而保留牙囊用其它物质置换牙胚结果置换物可以萌出[1]。Larson EK 在狗前磨 牙牙冠形成后、萌出前4周,去除牙囊,牙齿不能萌出;而将剥离的牙囊立即重放回造釉器 表面,牙齿即能萌出,但牙根的发育不能完成,且髓腔内有骨样牙本质的形成,原因不详 [2]。由此证明,牙齿萌出依赖牙囊或牙囊与成釉器共同作用,而不是单纯依赖成釉 器。研究表明,牙齿萌出时牙囊的冠向、周围、根尖组织均发生变化。其中冠向可见牙囊与 口腔 粘膜的固有层相连形成萌出通道,其中含有牙板残存物。萌出开始时牙囊组织形成牙周膜, 其中多数的成纤维细胞活跃进行纤维的合成和分泌。成纤维细胞胞内的收缩性细丝,通过细 胞膜与外部纤维的纤维连锁结构相连。成纤维细胞收缩带动牙周膜纤维收缩,牵引牙齿向萌 出方向移动。目前认为这种牙周膜的牵引力是牙齿萌出的主要力量。根尖部的牙囊组织一方 面为牙根形成提供必要的空间;另一方面牙槽骨的增生发育也是牙齿萌出的力源之一[ 3]。
, 百拇医药
2 牙囊在牙齿萌出时的细胞调节作用
2.1 牙囊细胞
Wise GE将6~7d龄小鼠的第1、2磨牙的牙囊,培养于有利于成纤维细胞生长的培 养基中 ,传代后,发现这种细胞具有成纤维细胞的形态,电镜观察细胞内有丰富的粗面内质网而没 有桥粒;凝胶电泳及Western印迹法显示培养的细胞分泌胞外基质fibronectin和原胶原;荧 光染色证明细胞内外均存在fibronectin和Ⅰ型胶原[4]。以上特点表明这种牙囊的 细胞主 要为成纤维细胞,这也解释了为什么有些生长因子可以调节牙齿的萌出。另外,这种细胞在 牙齿萌出时形成了牙周膜、牙骨质和固有牙槽骨。
2.2 单核细胞和破骨细胞
单核细胞和破骨细胞是调控牙齿萌出通道形成重要的细胞。Wise GE等研究认为,单核细胞 从 外周血中进入牙囊,并在牙囊中聚集是牙齿开始萌出的关键,之后便伴发可透射的牙萌出通 道的形成。由于牙胚冠部相对的骨陷窝处的破骨细胞数目与单核细胞的增减趋势相同,因此 认为单核细胞的聚集与破骨细胞的形成有关[5]。目前已证明单核/巨噬细胞系的 单核细胞可以形成破骨细胞。破骨细胞也是牙齿萌出所必须的,患骨硬化症的小鼠由于破骨 细胞数量减少,导致牙齿不能萌出。
, 百拇医药
3 牙囊在牙齿萌出时的分子调控作用
目前对启动牙齿萌出的分子调控机制,主要集中在一些生长因子对牙囊等的调节作用。这些调控因子主要包括巨噬细胞集落刺激因子-1(CSF-1) 、转化生长因子 -β1(TGF-β1)、上皮生长因子(EGF)及其受体、白细胞介素-1α(IL-1α)及其受体、 单核细胞趋化性蛋白-1(MCP-1)、c-fos。值得注意的是这些因子间的相互作用组成了调控 牙齿萌出的调节体系。
3.1 CSF-1(巨噬细胞集落刺激因子-1)
由于骨硬化症小鼠体内缺乏CSF-1,导致牙齿不能萌出,且CSF-1在细胞水平上是单核细胞趋 化物,引起人们对于CSF-1作为一种重要的牙齿萌出的调控分子的关注。对CSF-1的研究主 要从体内、体外实验两方面进行,体内实验主要围绕骨硬化性小鼠动物模型展开。骨硬化型 小鼠(op/op)的特点是体内只有少量的破骨细胞、单核细胞、外周血巨噬细胞,并且不能 通过骨髓、脾移植治愈。这种小鼠不能产生CSF-1,在给其体内注射CSF-1后,可以增加牙囊 内单核细胞的数目,引发破骨细胞性骨吸收,使小鼠的磨牙及切牙萌出[6]。少牙 型小鼠(tl/tl)的特点是牙齿不能萌出,体内只有少量的破骨细胞,且这些破骨细胞呈抗 酒石酸酸性磷酸酶弱阳性。实验证明,这种变异鼠的骨微环境不利于破骨细胞正常的发育与 分 化。Iizuka T给这种小鼠自生后每天注射CSF-1,发现可以改善其牙齿的萌出情况,且改善 的程度与注射开始的时间有关。此外,注射后的小鼠的破骨细胞抗酒石酸酸性磷酸酶和抗酒 石酸酸性ATP酶染色均呈强阳性[7]。
, 百拇医药
小鼠牙囊经免疫染色,可观测到CSF-1基因翻译及转录的产物分布的时空性与单核细胞相同 。另外,体内注射CSF-1可增加正常小鼠单核细胞和破骨细胞的数目以及加速牙齿的萌出 [8]。这一结果与其它研究中得出的CSF-1与破骨细胞分化有关的结论相吻合。CSF-1基 因表达的结果提示它们在牙囊上的翻译和转录可能直接启动了有关牙齿萌出的细胞性物质。
体外实验中Wise GE发现,培养的小鼠牙囊细胞经CSF-1免疫染色呈阳性;经反转录PCR技术 研究培养的牙囊细胞,发现细胞上有CSF-1mRNA的翻译;将牙囊细胞培养于含CSF-1的基质中 时,发现CSF-1对于CSF-1基因表达有自分泌作用。这种正反馈作用可能与CSF-1基因翻译及 转录的产物在生后早期达最高峰有关,这时也是牙囊中的成纤维细胞对CSF-1最敏感的时间 。为测定这种自分泌作用是否因CSF-1受体而受到抑制,Wise GE又利用培养的牙囊细胞来分 析其CSF-1受体mRNA水平,结果显示高浓度的CSF-1会降低CSF-1受体在牙囊细胞上的基因表 达。对CSF-1受体蛋白进行免疫染色发现其出现在生后早期的牙囊中,而在生后第10天已基 本消失。早期的研究表明,CSF-1受体的mRNA水平与之平行[8]。以上结果提示对CS F-1自分泌作用的反馈抑制是通过CSF-1对于其受体的抑制作用来实现的。
, 百拇医药
3.2 IL-1α、IL-1α受体和EGF对CSF-1调节作用
Wise GE研究了生后0~12d的鼠下颌第1磨牙上IL-1α分布情况,发现这种蛋白分布于 靠近牙 囊的星网层细胞中。在生后早期星网层上的着色很明显,在第11天时消失[6]。他 给生后不同时期的小鼠注射IL-1α,经反转录PCR证明IL-1α可增大牙囊中CSF-1表达。因此 认为IL-1α从星网层中分泌,作用于邻近的牙囊组织,刺激牙囊中CSF-1表达,提示IL- 1α 是作为一个级联分子信号来启动牙齿的萌出[9]。IL-1αⅠ型受体分布的时空性与C SF-1相同。IL-1α不能增加IL-1αⅠ型受体的表达;EGF在体内体外中均可扩大牙囊细胞中I L-1α受体mRNA的转录,在体外EGF还可以扩大星网层细胞上IL-1α基因的表达。EGF使牙囊 有更多的受体来对应IL-1α分泌的增多,从而间接调节CSF-1水平。因此,EGF对于IL-1αⅠ 型受体和IL-1α的调节可能是一种主要的调节牙囊中CSF-1变化的手段,而且EGF可能是调节 牙齿萌出的级联分子的启动分子[6]。另外,观察EGF及其受体(EGFR)在出生后0 ~12d的小鼠下颌第1、2磨牙牙胚、牙槽骨上的分布时发现,0~8d的牙囊组织呈EGFR强阳 性,至第9天时减弱,第10天时转阴。牙槽骨的破骨细胞前体细胞和破骨细胞均呈EFGR阳性 ;成釉细胞及成牙本质细胞则呈弱阳性;星网层细胞呈阴性。0d时第1磨牙牙髓呈EFGR弱阳 性,而第2磨牙牙髓则直至第6天时才出现阳性反映。对于EGF而言,牙囊组织在12d内一直呈 阳性;早期体内注射EGF也可以导致牙齿早萌。由于单核细胞是在早期进入牙囊,而EGFR是 在早期的牙囊组织上呈强阳性,所以认为EGF对于牙囊的作用是通过牙囊上的EGFR来实现 [10]。最后,EGF在牙囊组织、成釉器呈阳性,说明内源性的EGF是以自分泌 或旁分 泌 的方 式对于牙齿萌出进行调节的。
, 百拇医药
3.3 TGF-β1
转化生长因子-β1 (TGF-β1)对单核细胞具有化学趋化性。Wise GE应用免疫化学方法分析 了TGF-β1在鼠下颌第一磨牙牙胚上的分布。结果显示TGF-β1在鼠磨牙上的分布具有时空性 。它主要分布在星网层上,时间是生后1~2d,先于单核细胞进入牙囊,其后即消失。因此 认为,TGF-β1的作用是吸引外周血中的单核细胞进入牙囊中[11]。另外,TGF-β1 还可以扩大星网层细胞上IL-1α mRNA的表达。
3.4 EGF对 TGF-β1调节
Lin F通过体外实验研究EGF对于星网层细胞上TGF-β1 mRNA表达的影响时发现:细胞在含EG F的基质中培养至6h,细胞上TGF-β1 mRNA表达增加2倍,相反若星网层细胞在TGF-β1中 培养6h,其上TGF-β1 mRNA表达不增加,说明TGF-β1无自分泌作用。由此认为EGF作用的 部位是成釉器中的星网层细胞,刺激其合成TGF-β1 mRNA,导致细胞合成TGF-β1的增加。 这 种新合成的TGF-β1可能通过影响邻近的牙囊组织,来启动有关萌出的细胞物质或者使牙囊 组织分泌胞外基质来形成牙周韧带[12]。
, 百拇医药
3.5 c-fos
骨硬化性小鼠因缺少c-fos会导致牙齿不能萌出。CSF-1和c-fos都在牙囊中得到转录和 表达 。近年来的研究证实,CSF-1在体外可以扩大培养的牙囊细胞中c-fos的表达。Wise GE在不 同 时间点给小鼠注射CSF-1 10单位,并提取其牙囊中RNA,应用反转录PCR技术发现:注射组和 对照组相比,c-fos的表达成倍扩增,而且c-fos翻译和转录的时空性与CSF-1相同[13 ]。这个结果证明,CSF-1在牙齿萌出过程中的一个作用是扩大c-fos的早期表达,而c-fo s是参与破骨细胞的分化,所以c-fos是牙齿萌出所必须的。另外,EGF可以扩大c-fos的表 达,说明这些分子相互之间的级联作用。现将启动牙齿萌出的调控分子的作用小结下图。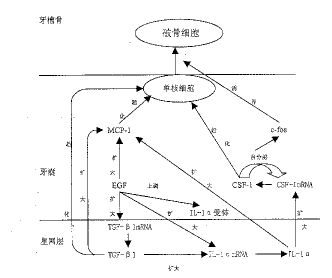
图1 启动牙齿萌出的调控分子作用示意图
, 百拇医药
3.6 MCP-1
单核细胞流入牙囊激活牙齿萌出的细胞化学趋化物是单核细胞趋化性蛋白-1(MCP-1),MCP -1由牙囊细胞分泌,其基因表达主要集中于生后早期,与单核细胞流入牙囊有关。利用反转 录PCR技术发现生后3d小鼠的下颌第一磨牙牙囊细胞MCP-1的表达量最高,并证明这些由牙 囊产生的分子对于单核细胞均有趋化性。另外培养细胞的条件介质也具有趋化性。将条件介 质与抗CSF-1或抗MCP-1的抗体一起孵育,发现趋化性被减弱。表明,由牙囊产生的CSF-1和M CP-1都具有单核细胞趋化性。这些化学趋化物可能是单核细胞进入牙囊,诱导牙齿萌出通道 的形成所必须的。Que BG发现EGF、IL-1α、TGF-β、CSF-1因子均可增加培养的牙囊细胞中 MCP-1的基因表达。给小鼠体内注射IL-1α和EGF可使MCP-1基因的表达在生后早期达到最高 峰。所以现在有很多不同的有关牙齿萌出的基因可以证明MCP-1基因在牙齿萌出过程中的表 达。作者认为MCP-1的表达可能是引导单核细胞流入牙囊,启动有关牙齿萌出的细胞性物质 的关键[14]。
, 百拇医药
通过以上的文献复习可知,牙囊在牙齿的萌出过程中无论是从整体、细胞以及分子水平 上对牙齿的萌出都有重要的调控作用,牙齿的萌出也是多种组织、细胞分子协调作用的结果 。同时还需进一步对这种协调作用进行研究与探讨,以真正搞清牙齿萌出的机制。
【参考文献】
[1] Cahill DR, Marks SC Jr. Tooth eruption: evidence fo r the central role of the dental follicle. J Oral Pathol, 1980, 9: 189
[2] Larson EK, Cahill DR, Gorski JP, et al. The effect of removin g the true dent al follicle on premolar eruption in the dog. Arch Oral Biol, 1994, 39(4): 271
, 百拇医药
[3] 檀桓旺夫, 祖父江镇雄, 编集. 小儿齿科保健新书. 东京: 永末书店, 199 4. 82, 134
[4] Wise GE, Lin F. Culture and characterization of dental follicle cells from rat molars. Cell Tissue Res, 1992, 267(3): 483
[5] Wise GE, Marks SC Jr. Ultrastructural features of the de ntal follicle associates with formation of the tooth eruption pathway in the do g. J Oral Pathol, 1985, 14(1): 15
[6] Wise GE, Zhao L. Immunostaining and transcriptional enhancement o f intreleukin-1 receptor type Ⅰin the rat dental follice. Aroh Oral Biol, 1997, 42(5):339
, 百拇医药
[7] Iizuka T, Cielinske M. The effect of colony-stimulating fa ctor-1( CSF-1) on tooth eruption in the toothless (osteopetrotic) rat illustrate the cri tical periods for bone resor ption during tooth eruption. Arch Oral Biol, 1992, 37: 629
[8] Wise GE, Lin F, Zhao L. Transcription and translation of CSF-1 in the dental follicle. J Dent Res, 1995, 74(9): 1551
[9] Wise GE. In vivo effect of intreleukin-1α on colony-stimulating factor-1 gene expression in the dental follicle of the rat molar. Arch Oral B iol, 1998, 43(2):163
, 百拇医药
[10] Wies GE, Lin F, Fan W. Localization of epidermal growth f actor an d its receptor in mandibular of the rat prior to and during prefunctional tooth eruption.Dev Dyn, 1992,195(2):121
[11] Wise GE, Fan W. Immunolocalization of transforming growth factor beta in rat molars. J Oral Pathol Med, 1991, 20(2): 74
[12] Lin F, Wise GE. Effect of epidermal growth factor on expr ession of transforming growth factor beta 1 mRNA in stellate reticulum cells of ra t mandibular molars. Dev Dyn, 1993, 1998(1): 22
, 百拇医药
[13] Wise GE. Effect of CSF-1 on in vivo expression of c-f os in the de ntal follicle during tooth eruption. Eur J Oral Sci, 1998, 106(suppl 1): 397
[14] Que BG, Wise GE. Tooth eruption molecuces enhance MCP-1 g ene exp ression in the dental follicle of the rat. Dev Dyn, 1998, 212(3): 346
收稿日期:1999-05-26, 百拇医药
单位:李锐(第四军医大学口腔医学院,陕西 西安 710032);李振钢(第四军医大学口腔医学院,陕西 西安 710032);杨富生(第四军医大学口腔医学院,陕西 西安 710032)
关键词:牙囊; 牙齿; 萌出;调控
牙体牙髓牙周病学杂志000240 【中图号】 R780.2 【文献标识码】 A
【文章编号】 1005-2593(20 00)02-0100-04
牙囊起源于外胚间充质,是包绕在成釉器外围的 一层致密的结缔组织 ,在牙齿发育后期形成牙骨质、牙周膜和固有牙槽骨。牙齿萌出是牙齿从颌骨中迁移至功能 位的一个复杂的生理过程。以往的研究证明,牙齿萌出需要依赖牙囊的存在,但其机制一直 未 明了。以下就近几年来关于牙囊从整体、细胞、分子水平上对牙齿萌出的调控作用所做的研 究进行综述。
, http://www.100md.com
1 牙囊在牙齿萌出时的整体调控作用
牙齿的萌出需要依赖牙囊的存在。Cahill DR的研究表明,以手术方法去除小鼠牙囊牙齿不 能萌出,而保留牙囊用其它物质置换牙胚结果置换物可以萌出[1]。Larson EK 在狗前磨 牙牙冠形成后、萌出前4周,去除牙囊,牙齿不能萌出;而将剥离的牙囊立即重放回造釉器 表面,牙齿即能萌出,但牙根的发育不能完成,且髓腔内有骨样牙本质的形成,原因不详 [2]。由此证明,牙齿萌出依赖牙囊或牙囊与成釉器共同作用,而不是单纯依赖成釉 器。研究表明,牙齿萌出时牙囊的冠向、周围、根尖组织均发生变化。其中冠向可见牙囊与 口腔 粘膜的固有层相连形成萌出通道,其中含有牙板残存物。萌出开始时牙囊组织形成牙周膜, 其中多数的成纤维细胞活跃进行纤维的合成和分泌。成纤维细胞胞内的收缩性细丝,通过细 胞膜与外部纤维的纤维连锁结构相连。成纤维细胞收缩带动牙周膜纤维收缩,牵引牙齿向萌 出方向移动。目前认为这种牙周膜的牵引力是牙齿萌出的主要力量。根尖部的牙囊组织一方 面为牙根形成提供必要的空间;另一方面牙槽骨的增生发育也是牙齿萌出的力源之一[ 3]。
, 百拇医药
2 牙囊在牙齿萌出时的细胞调节作用
2.1 牙囊细胞
Wise GE将6~7d龄小鼠的第1、2磨牙的牙囊,培养于有利于成纤维细胞生长的培 养基中 ,传代后,发现这种细胞具有成纤维细胞的形态,电镜观察细胞内有丰富的粗面内质网而没 有桥粒;凝胶电泳及Western印迹法显示培养的细胞分泌胞外基质fibronectin和原胶原;荧 光染色证明细胞内外均存在fibronectin和Ⅰ型胶原[4]。以上特点表明这种牙囊的 细胞主 要为成纤维细胞,这也解释了为什么有些生长因子可以调节牙齿的萌出。另外,这种细胞在 牙齿萌出时形成了牙周膜、牙骨质和固有牙槽骨。
2.2 单核细胞和破骨细胞
单核细胞和破骨细胞是调控牙齿萌出通道形成重要的细胞。Wise GE等研究认为,单核细胞 从 外周血中进入牙囊,并在牙囊中聚集是牙齿开始萌出的关键,之后便伴发可透射的牙萌出通 道的形成。由于牙胚冠部相对的骨陷窝处的破骨细胞数目与单核细胞的增减趋势相同,因此 认为单核细胞的聚集与破骨细胞的形成有关[5]。目前已证明单核/巨噬细胞系的 单核细胞可以形成破骨细胞。破骨细胞也是牙齿萌出所必须的,患骨硬化症的小鼠由于破骨 细胞数量减少,导致牙齿不能萌出。
, 百拇医药
3 牙囊在牙齿萌出时的分子调控作用
目前对启动牙齿萌出的分子调控机制,主要集中在一些生长因子对牙囊等的调节作用。这些调控因子主要包括巨噬细胞集落刺激因子-1(CSF-1) 、转化生长因子 -β1(TGF-β1)、上皮生长因子(EGF)及其受体、白细胞介素-1α(IL-1α)及其受体、 单核细胞趋化性蛋白-1(MCP-1)、c-fos。值得注意的是这些因子间的相互作用组成了调控 牙齿萌出的调节体系。
3.1 CSF-1(巨噬细胞集落刺激因子-1)
由于骨硬化症小鼠体内缺乏CSF-1,导致牙齿不能萌出,且CSF-1在细胞水平上是单核细胞趋 化物,引起人们对于CSF-1作为一种重要的牙齿萌出的调控分子的关注。对CSF-1的研究主 要从体内、体外实验两方面进行,体内实验主要围绕骨硬化性小鼠动物模型展开。骨硬化型 小鼠(op/op)的特点是体内只有少量的破骨细胞、单核细胞、外周血巨噬细胞,并且不能 通过骨髓、脾移植治愈。这种小鼠不能产生CSF-1,在给其体内注射CSF-1后,可以增加牙囊 内单核细胞的数目,引发破骨细胞性骨吸收,使小鼠的磨牙及切牙萌出[6]。少牙 型小鼠(tl/tl)的特点是牙齿不能萌出,体内只有少量的破骨细胞,且这些破骨细胞呈抗 酒石酸酸性磷酸酶弱阳性。实验证明,这种变异鼠的骨微环境不利于破骨细胞正常的发育与 分 化。Iizuka T给这种小鼠自生后每天注射CSF-1,发现可以改善其牙齿的萌出情况,且改善 的程度与注射开始的时间有关。此外,注射后的小鼠的破骨细胞抗酒石酸酸性磷酸酶和抗酒 石酸酸性ATP酶染色均呈强阳性[7]。
, 百拇医药
小鼠牙囊经免疫染色,可观测到CSF-1基因翻译及转录的产物分布的时空性与单核细胞相同 。另外,体内注射CSF-1可增加正常小鼠单核细胞和破骨细胞的数目以及加速牙齿的萌出 [8]。这一结果与其它研究中得出的CSF-1与破骨细胞分化有关的结论相吻合。CSF-1基 因表达的结果提示它们在牙囊上的翻译和转录可能直接启动了有关牙齿萌出的细胞性物质。
体外实验中Wise GE发现,培养的小鼠牙囊细胞经CSF-1免疫染色呈阳性;经反转录PCR技术 研究培养的牙囊细胞,发现细胞上有CSF-1mRNA的翻译;将牙囊细胞培养于含CSF-1的基质中 时,发现CSF-1对于CSF-1基因表达有自分泌作用。这种正反馈作用可能与CSF-1基因翻译及 转录的产物在生后早期达最高峰有关,这时也是牙囊中的成纤维细胞对CSF-1最敏感的时间 。为测定这种自分泌作用是否因CSF-1受体而受到抑制,Wise GE又利用培养的牙囊细胞来分 析其CSF-1受体mRNA水平,结果显示高浓度的CSF-1会降低CSF-1受体在牙囊细胞上的基因表 达。对CSF-1受体蛋白进行免疫染色发现其出现在生后早期的牙囊中,而在生后第10天已基 本消失。早期的研究表明,CSF-1受体的mRNA水平与之平行[8]。以上结果提示对CS F-1自分泌作用的反馈抑制是通过CSF-1对于其受体的抑制作用来实现的。
, 百拇医药
3.2 IL-1α、IL-1α受体和EGF对CSF-1调节作用
Wise GE研究了生后0~12d的鼠下颌第1磨牙上IL-1α分布情况,发现这种蛋白分布于 靠近牙 囊的星网层细胞中。在生后早期星网层上的着色很明显,在第11天时消失[6]。他 给生后不同时期的小鼠注射IL-1α,经反转录PCR证明IL-1α可增大牙囊中CSF-1表达。因此 认为IL-1α从星网层中分泌,作用于邻近的牙囊组织,刺激牙囊中CSF-1表达,提示IL- 1α 是作为一个级联分子信号来启动牙齿的萌出[9]。IL-1αⅠ型受体分布的时空性与C SF-1相同。IL-1α不能增加IL-1αⅠ型受体的表达;EGF在体内体外中均可扩大牙囊细胞中I L-1α受体mRNA的转录,在体外EGF还可以扩大星网层细胞上IL-1α基因的表达。EGF使牙囊 有更多的受体来对应IL-1α分泌的增多,从而间接调节CSF-1水平。因此,EGF对于IL-1αⅠ 型受体和IL-1α的调节可能是一种主要的调节牙囊中CSF-1变化的手段,而且EGF可能是调节 牙齿萌出的级联分子的启动分子[6]。另外,观察EGF及其受体(EGFR)在出生后0 ~12d的小鼠下颌第1、2磨牙牙胚、牙槽骨上的分布时发现,0~8d的牙囊组织呈EGFR强阳 性,至第9天时减弱,第10天时转阴。牙槽骨的破骨细胞前体细胞和破骨细胞均呈EFGR阳性 ;成釉细胞及成牙本质细胞则呈弱阳性;星网层细胞呈阴性。0d时第1磨牙牙髓呈EFGR弱阳 性,而第2磨牙牙髓则直至第6天时才出现阳性反映。对于EGF而言,牙囊组织在12d内一直呈 阳性;早期体内注射EGF也可以导致牙齿早萌。由于单核细胞是在早期进入牙囊,而EGFR是 在早期的牙囊组织上呈强阳性,所以认为EGF对于牙囊的作用是通过牙囊上的EGFR来实现 [10]。最后,EGF在牙囊组织、成釉器呈阳性,说明内源性的EGF是以自分泌 或旁分 泌 的方 式对于牙齿萌出进行调节的。
, 百拇医药
3.3 TGF-β1
转化生长因子-β1 (TGF-β1)对单核细胞具有化学趋化性。Wise GE应用免疫化学方法分析 了TGF-β1在鼠下颌第一磨牙牙胚上的分布。结果显示TGF-β1在鼠磨牙上的分布具有时空性 。它主要分布在星网层上,时间是生后1~2d,先于单核细胞进入牙囊,其后即消失。因此 认为,TGF-β1的作用是吸引外周血中的单核细胞进入牙囊中[11]。另外,TGF-β1 还可以扩大星网层细胞上IL-1α mRNA的表达。
3.4 EGF对 TGF-β1调节
Lin F通过体外实验研究EGF对于星网层细胞上TGF-β1 mRNA表达的影响时发现:细胞在含EG F的基质中培养至6h,细胞上TGF-β1 mRNA表达增加2倍,相反若星网层细胞在TGF-β1中 培养6h,其上TGF-β1 mRNA表达不增加,说明TGF-β1无自分泌作用。由此认为EGF作用的 部位是成釉器中的星网层细胞,刺激其合成TGF-β1 mRNA,导致细胞合成TGF-β1的增加。 这 种新合成的TGF-β1可能通过影响邻近的牙囊组织,来启动有关萌出的细胞物质或者使牙囊 组织分泌胞外基质来形成牙周韧带[12]。
, 百拇医药
3.5 c-fos
骨硬化性小鼠因缺少c-fos会导致牙齿不能萌出。CSF-1和c-fos都在牙囊中得到转录和 表达 。近年来的研究证实,CSF-1在体外可以扩大培养的牙囊细胞中c-fos的表达。Wise GE在不 同 时间点给小鼠注射CSF-1 10单位,并提取其牙囊中RNA,应用反转录PCR技术发现:注射组和 对照组相比,c-fos的表达成倍扩增,而且c-fos翻译和转录的时空性与CSF-1相同[13 ]。这个结果证明,CSF-1在牙齿萌出过程中的一个作用是扩大c-fos的早期表达,而c-fo s是参与破骨细胞的分化,所以c-fos是牙齿萌出所必须的。另外,EGF可以扩大c-fos的表 达,说明这些分子相互之间的级联作用。现将启动牙齿萌出的调控分子的作用小结下图。

图1 启动牙齿萌出的调控分子作用示意图
, 百拇医药
3.6 MCP-1
单核细胞流入牙囊激活牙齿萌出的细胞化学趋化物是单核细胞趋化性蛋白-1(MCP-1),MCP -1由牙囊细胞分泌,其基因表达主要集中于生后早期,与单核细胞流入牙囊有关。利用反转 录PCR技术发现生后3d小鼠的下颌第一磨牙牙囊细胞MCP-1的表达量最高,并证明这些由牙 囊产生的分子对于单核细胞均有趋化性。另外培养细胞的条件介质也具有趋化性。将条件介 质与抗CSF-1或抗MCP-1的抗体一起孵育,发现趋化性被减弱。表明,由牙囊产生的CSF-1和M CP-1都具有单核细胞趋化性。这些化学趋化物可能是单核细胞进入牙囊,诱导牙齿萌出通道 的形成所必须的。Que BG发现EGF、IL-1α、TGF-β、CSF-1因子均可增加培养的牙囊细胞中 MCP-1的基因表达。给小鼠体内注射IL-1α和EGF可使MCP-1基因的表达在生后早期达到最高 峰。所以现在有很多不同的有关牙齿萌出的基因可以证明MCP-1基因在牙齿萌出过程中的表 达。作者认为MCP-1的表达可能是引导单核细胞流入牙囊,启动有关牙齿萌出的细胞性物质 的关键[14]。
, 百拇医药
通过以上的文献复习可知,牙囊在牙齿的萌出过程中无论是从整体、细胞以及分子水平 上对牙齿的萌出都有重要的调控作用,牙齿的萌出也是多种组织、细胞分子协调作用的结果 。同时还需进一步对这种协调作用进行研究与探讨,以真正搞清牙齿萌出的机制。
【参考文献】
[1] Cahill DR, Marks SC Jr. Tooth eruption: evidence fo r the central role of the dental follicle. J Oral Pathol, 1980, 9: 189
[2] Larson EK, Cahill DR, Gorski JP, et al. The effect of removin g the true dent al follicle on premolar eruption in the dog. Arch Oral Biol, 1994, 39(4): 271
, 百拇医药
[3] 檀桓旺夫, 祖父江镇雄, 编集. 小儿齿科保健新书. 东京: 永末书店, 199 4. 82, 134
[4] Wise GE, Lin F. Culture and characterization of dental follicle cells from rat molars. Cell Tissue Res, 1992, 267(3): 483
[5] Wise GE, Marks SC Jr. Ultrastructural features of the de ntal follicle associates with formation of the tooth eruption pathway in the do g. J Oral Pathol, 1985, 14(1): 15
[6] Wise GE, Zhao L. Immunostaining and transcriptional enhancement o f intreleukin-1 receptor type Ⅰin the rat dental follice. Aroh Oral Biol, 1997, 42(5):339
, 百拇医药
[7] Iizuka T, Cielinske M. The effect of colony-stimulating fa ctor-1( CSF-1) on tooth eruption in the toothless (osteopetrotic) rat illustrate the cri tical periods for bone resor ption during tooth eruption. Arch Oral Biol, 1992, 37: 629
[8] Wise GE, Lin F, Zhao L. Transcription and translation of CSF-1 in the dental follicle. J Dent Res, 1995, 74(9): 1551
[9] Wise GE. In vivo effect of intreleukin-1α on colony-stimulating factor-1 gene expression in the dental follicle of the rat molar. Arch Oral B iol, 1998, 43(2):163
, 百拇医药
[10] Wies GE, Lin F, Fan W. Localization of epidermal growth f actor an d its receptor in mandibular of the rat prior to and during prefunctional tooth eruption.Dev Dyn, 1992,195(2):121
[11] Wise GE, Fan W. Immunolocalization of transforming growth factor beta in rat molars. J Oral Pathol Med, 1991, 20(2): 74
[12] Lin F, Wise GE. Effect of epidermal growth factor on expr ession of transforming growth factor beta 1 mRNA in stellate reticulum cells of ra t mandibular molars. Dev Dyn, 1993, 1998(1): 22
, 百拇医药
[13] Wise GE. Effect of CSF-1 on in vivo expression of c-f os in the de ntal follicle during tooth eruption. Eur J Oral Sci, 1998, 106(suppl 1): 397
[14] Que BG, Wise GE. Tooth eruption molecuces enhance MCP-1 g ene exp ression in the dental follicle of the rat. Dev Dyn, 1998, 212(3): 346
收稿日期:1999-05-26, 百拇医药