萄糖转运蛋白
作者:刘志红
单位:南京军区南京总医院 解放军肾脏病研究所 南京,210002
关键词:葡萄糖转运蛋白;易化转运体;胰岛素调节
肾脏病与透折肾移植杂志000215
葡萄糖是维持细胞能量代谢和生命活动的重要原料,小肠吸收的或肝脏产生的葡萄糖通过血液流向体内的各个器官和组织,提供能源和其它碳水化合物的最初前体。葡萄糖是一种极性分子,不能以自由扩散的方式通过细胞膜脂双层结构的疏水区,除了小肠和肾小管可以通过主动运输方式吸收葡萄糖外,其它组织的细胞都必须通过细胞膜上的一类葡萄糖转运蛋白(glucose transporters)通过易化扩散来摄入葡萄糖。葡萄糖转运蛋白是细胞膜上的跨膜糖蛋白,介导细胞内外的葡萄糖以易化扩散的方式相互转运。
易化扩散转运体通常叫做被动载体(passive carriers),葡萄糖的易化扩散转运蛋白是目前研究最为彻底的易化扩散转运体。被动载体是一种不耗能的系统,只能顺浓度梯度转运底物。因此,被动载体一般仅限于具有稳定内环境的多细胞生物。易化扩散的葡萄糖转运体的最主要功能是介导葡萄糖在血液与细胞胞浆间的转运。它们各自的功能取决于细胞的类型与代谢状态[1,2]。
, http://www.100md.com
1 葡萄糖的易化转运体家族
到目前为止已有六种葡萄糖转运蛋白(glucose transporters GLUTs)被鉴定,分别命名为葡萄糖转运蛋白1~5,和葡萄糖转运蛋白7(GLUT1~5 and GLUT7)。GLUT7的序列目前还不清楚。经比较,表明人的GLUT1~5具有39%~65%的序列同源性以及50%~76%的序列相似性。同时比较五种葡萄糖转运蛋白亚型,表明它们具有26%的序列同源性。某一特定的亚型在种属间也略有差异,其中GLUT1最为保守,人的GLUT1蛋白与小鼠、大鼠和猪的GLUT1蛋白同源性高达97%~98%[1]。
然而由于不同的葡萄糖转运蛋白对萄萄糖具有不同的转运效率和转运动力学,因而它们的生理功能和组织分布完全不同(附表)。GLUT5主要负责果糖的转运,在生理条件下不参与葡萄糖的转运。其它四种葡萄糖转运蛋白根据对葡萄糖的亲和力又可以分为三组,其中GLUT3对葡萄糖的亲和力最高,而GLUT2最低。GLUT1和GLUT4对葡萄糖的亲和力介于GLUT3和GLUT2之间[3]。
, 百拇医药
附表 葡萄糖转运蛋白在体内的分布 名称
组织分布
主要功能
SGLT1
肾脏,小肠
钠离子依赖的主动运输
GLUT1
大部分胚胎和成体组织中,其中红细胞,内皮细胞,以及永生性的细胞系中含量较为丰富
为细胞提供基本的葡萄糖供应,并为增殖分裂细胞提供相应增加的葡萄糖,负责血脑屏障及其它体内屏障的葡萄转运
GLUT2
, http://www.100md.com
肝细胞,胰岛β-细胞(啮齿类),小肠,肾脏
高容量,低亲和力的葡萄糖转运,负责上皮细胞基膜侧的葡萄糖转运
GLUT3
广泛分布于人体各组织中,脑中含量丰富
脑组织间液与脑实质细胞间的葡萄糖转运
GLUT4
骨胳肌,心脏,脂肪细胞
负责胰岛素增高条件下葡萄糖摄入的迅速增加,在整个机体的葡萄糖利用中非常重要
GLUT5
小肠,脂肪,肌肉,脑,肾
, 百拇医药
负责小肠果糖的吸收
GLUT7
肝细胞及其它糖原异生组织
负责内质网膜葡萄糖的跨膜运输
2 葡萄糖转运蛋白-1(glucose transporter 1,GLUT1)
2.1 结构与生化特性 细胞膜上的葡萄糖转运动力学已经研究了四十年,但研究主要集中在人的红细胞。Widder等于1952年第一次提出胎盘的葡萄糖转运存在一种可饱和的载体。他用米氏方程(Michaelis-Menton equation)成功地预测了红细胞和其它细胞葡萄转运的动力学特征。1977年Kasahara和Hinkle从人的红细胞膜中纯化出了GLUT1蛋白质,开创了葡萄糖转运蛋白研究的新时代。这种纯化出的蛋白是一种高度的、疏水的、糖基化程度各异的蛋白质,其动力学特征与完整的红细胞基本相同。1985年,Mueckler等[2]利用从红细胞膜中纯化的GLUT1蛋白质制备的抗体成功地从HepG2细胞(human hepatocellilar carcinoma cell line)的cDNA文库中克隆了人的GLUT1基因,因而GLUT1通常也被称为HepG2型葡萄糖转运蛋白。
, 百拇医药
目前已知人、小鼠、大鼠、兔和猪的GLUT1都是由492氨基酸残基构成的蛋白质,它们具有高达97%的同源性。Mueckler根据GLUT1的氨基酸序列疏水性分析结果提出了十二个跨膜区的结构模型。尽管这种模型目前还未被完全证实,但很多细节已被实验所验证。GLUT1蛋白的三维结构目前还不清楚[1~4]。
2.2 组织分布 GLUT1是已知的分布最为广泛的转运体。在很多种哺乳动物的胚胎和成体细胞中都有表达,然而它的表达量往往很低,一般与其它组织特异性表达的葡萄糖转运体亚型一起承担细胞的葡萄糖转运。在早期小鼠胚胎发育时期,从卵母细胞到胚胎细胞,都能检测到GLUT1 mRNA的表达。在胚胎发育的晚期,GLUT1表达分布的方式则相差很大,随不同组织而各异。GLUT1负责各种组织与血液间葡萄糖的转运。因此GLUT1在脑,眼,外周神经组织和胎盘的内皮及上皮样屏障细胞中的表达量较高。最典型的例子是构成脑部血脑屏障的毛细血管,GLUT1表达量非常高。这是因为,脑实质细胞在正常情况下完全依赖葡萄糖作为能源物质,葡萄糖的转运就非常重要。人的红细胞膜上的GLUT1含量非常丰富,占总膜蛋白的6%之多,人红细胞富含GLUT1的生理意义目前还不清楚[1,4]。目前在肾小球和肾小管中都发现了GLUT1的表达,而GLUT1在肾小球系膜细胞和肾小球上皮细胞的表达已经得到了确认[5,6]。
, 百拇医药
2.3 表达调控 目前有关GLUT1表达与调控的研究很多,但主要集中在体外培养细胞系中。在很多体外培养的细胞系中,GLUT1是最主要的葡萄糖转运体类型,这可能是细胞系去分化与胚胎化的一种表现,因为GLUT1是胚胎细胞主要的葡萄糖转运体类型。同时也反映出GLUT1的表达可以被刺激细胞生长的物质所诱导,因为分裂的细胞对能量和生物合成的需要增加了[1]。对体外培养细胞GLUT1的调控可以分为急性调控和慢性调控两个方面。急性调控不涉及mRNA和蛋白质的合成,主要是GLUT1从细胞内的贮存囊泡向细胞膜的转位以及GLUT1内在活性的改变。细胞在应激情况下GLUT1会发生转位而使细胞葡萄糖摄入大幅度增加[4];同时细胞的生长状态也影响GLUT1的亚细胞分布,对于成纤维细胞而言,当细胞处于亚融合状态时GLUT1主要分布于细胞表面,这时候细胞葡萄糖转运速度高而且不受胰岛素的影响,而当细胞处于融合状态时75%的GLUT1位于细胞内的囊泡中,在刺激因子作用下通过GLUT1转位细胞的葡萄糖摄入增加2.5倍[4,7]。
, 百拇医药
GLUT1的表达受很多因素的影响。长时间的葡萄糖缺乏状态(glucose deprivation)会引起GLUT1 mRNA与蛋白质的升高。除此之外,下列因子均可以增加GLUT1的表达:佛波酯(phorbol esters),降糖药(sulfonylureas),钒酸盐(vanadate),丁酸盐(butyrate),低氧,cAMP,甲状腺激素(thyroid hormone),血清,胰岛素,胰岛素样生长因子1(IGF-1),血小板来源生长因子(PDGF),成纤维细胞生长因子(FGF),肿瘤坏死因子α(TNF-α),生长激素,转化生长因子β(TGF-β)和癌基因等[8~10]。目前已在人GLUT1基因5端非翻译区的启动子中发现了佛波酯反应元件(phorbol ester responsive element),而在小鼠GLUT1基因的增强子区则发现了佛波酯反应元件、cAMP反应元件和血清反应元件(phorbol ester responsive element,cAMP responsive element and serum responsive element)[11]。培养液中葡萄糖的浓度与GLUT1蛋白质或mRNA的表达量呈反比关系,但还没有在GLUT1基因中发现葡萄糖或其代谢产物的反应元件[12]。
, 百拇医药
有关整体动物中GLUT1表达调控的研究还很少,大鼠血脑屏障中GLUT1的表达量与血糖浓度呈反比关系,血糖浓度的降低将刺激GLUT1表达量的增加,这对维持脑的相对稳定的葡萄糖供应有重要意义。人肿瘤组织中GLUT1的表达量明显增加,这与体外细胞培养的结果相一致。甲状腺功能低下增加大鼠心脏GLUT1的水平,去神经支配也会增加骨胳肌GLUT1的表达量[1]。
3 葡萄糖转运蛋白-2(glucose transporter 2,GLUT2)
3.1 组织分布与生理功能 GLUT2是肝细胞,胰岛β细胞(啮齿类)及小肠和肾脏具吸收功能的上皮细胞最主要的葡萄糖转运体类型,上皮细胞中GLUT2主要分布在基膜侧,和钠-葡萄糖共转运体一起完成葡萄糖的吸收与转运。肾脏中GLUT2除了分布于肾小管上皮细胞外还被发现在肾小球有表达。它最显著的特征是对葡萄糖的高饱和度和低亲和性。在爪蟾卵母细胞表达体系中GLUT2的Km值为42 mmol/L,而GLUT1为18~21 mmol/L。高Km值决定了GLUT2的功能特点,在肝细胞和β细胞中GLUT2和高Km值的Ⅳ型葡萄糖激酶相配合,起葡萄糖感受器的作用。而GLUT2的转运速度往往高于葡萄糖激酶的反应速度,因此在这些细胞中葡萄糖激酶是葡萄糖摄入的限制步骤。GLUT2高容量和低亲和性的特点是餐后小肠细胞和肾小管细胞摄入大量葡萄糖所必需的[1]。
, 百拇医药
GLUT2受到广泛关注,是因为它可能参与糖尿病的发生。包括自身免疫性糖尿病BB大鼠以及Zuker肥胖糖尿病大鼠在内的很多糖尿病动物模型中,胰岛β细胞GLUT2的表达减少。在这些模型中胰岛β细胞GLUT2的减少与葡萄糖刺激下胰岛素分泌能力下降密切相关,但进一步的实验表明,GLUT2的减少不是胰岛β细胞葡萄糖敏感性降低的原因,而是糖尿病的结果。
尽管有在1型糖尿病患者中发现了GLUT2的自身抗体的报道[3],然而最近研究发现,人类和啮齿类的胰岛β细胞所表达的葡萄糖转运蛋白种类完全不同。GLUT2在啮齿类的胰岛β细胞所扮演的角色在人类中被GLUT1所取代[14]。种属之间的这种明显差异已经引起人们的高度重视。
3.2 表达调控 除了糖尿病状态下GLUT2的表达下调外,在其它很多情况下GLUT2的表达也会发生相似改变。在葡萄糖灌注或胰岛素灌注的大鼠中,β细胞GLUT2的表达量直接随血糖的变化而改变。在胰岛培养物以及HITT15细胞中也发现GLUT2的表达量与培养液中葡萄糖的浓度有类似的关系。然而新鲜分离饥饿或注射胰岛素所致的低血糖大鼠的胰岛,发现GLUT2的mRNA表达在上述两种情况下均明显升高。注射胰岛素可使胰岛细胞GLUT2蛋白质降低39%,而饥饿对GLUT2蛋白质则无明显影响[1]。
, 百拇医药
有关血糖浓度对肝脏GLUT2的表达的研究结果并不完全一致。如有人报道链脲佐菌素(STZ)所诱导的糖尿病大鼠肝脏中GLUT2 mRNA和蛋白质上升,也有人发现其没有变化。一项动态观察研究发现,单次注射STZ 6h后肝脏GLUT2表达下降,并维持至30h,然后开始上升,48h后回到正常水平。短期内GLUT2 mRNA的减少可能与STZ处理后胰岛素的暂时升高有关。用phlorizin使糖尿病大鼠的血糖恢复正常的同时也使GLUT2的表达恢复正常。而用胰岛素灌注可使GLUT2 mRNA减少至对照的25%,GLUT2蛋白质也呈类似的改变。这些结果以及后来一系列研究都表明,高胰岛素降低GLUT2的表达,而高血糖升高GLUT2的表达。有关上皮细胞GLUT2表达的研究发现,在STZ糖尿病大鼠和高糖饮食大鼠中,小肠细胞基膜侧GLUT2蛋白质升高,而在葡萄糖灌注所引起的高血糖大鼠中无显著变化,葡萄糖的转运活性在上述三种情况下均升高[1]。
4 葡萄糖转运蛋白-3(glucose transporter 3,GLUT3)
, 百拇医药
GLUT3是成人大脑实质细胞最主要的葡萄糖转运体类型。在小鼠中GLUT3的表达仅限于神经细胞,但在人的胎盘,肝脏和肾脏中都发现GLUT3 mRNA和蛋白质的表达。GLUT3是大鼠胎盘最主要的葡萄糖转运蛋白,它可能参与了葡萄糖向胚胎的转运。尽管在人脑中GLUT3蛋白分布于多种细胞中,但神经细胞的表达量明显高于胶质细胞和内皮细胞。这种转运体最重要的特征是低Km值,这表示GLUT3对于葡萄糖的高亲和性,也就是说在葡萄糖浓度比较低的情况下,GLUT3的转运效率比其它的转运体要高。GLUT3和GLUT1一样在很多细胞系中都有表达,例如骨胳肌来源的L6细胞。这表明GLUT3在胚胎肌细胞中可能是一种正常表达的葡萄糖转运体,而体外培养的肌肉细胞去分化而使GLUT3重新表达[1,4]。
5 葡萄糖转运蛋白-4(glucose transporter 4,GLUT4)
5.1 组织分布与生理功能 GLUT4主要分布于脂肪细胞和肌肉细胞,它们都是所谓的胰岛素敏感性细胞,也就是说这些细胞在胰岛素刺激下葡萄糖摄入迅速升高。GLUT4在棕色脂肪中含量最高,其次是心肌,骨胳肌,平滑肌和白色脂肪。尽管这些组织中也有其它葡萄糖转运体的表达,如GLUT1,但很多证据都表明,GLUT4是胰岛素反应性转运体。一方面GLUT4是骨胳肌和脂肪中最丰富的转运体,而3T3L1脂肪细胞的分化中GLUT4的表达与胰岛素反应性糖摄入增加密切相关,同时在不同类型的脂肪细胞中,GLUT4的表达量与各种细胞葡萄糖利用能力相符,而且GLUT4过量表达的L6细胞中胰岛素所刺激的葡萄糖转运明显升高[1]。
, 百拇医药
GLUT4引起人们关注主要是由于胰岛素敏感性组织中,葡萄糖的摄入对维持血糖的内稳态具有重要的意义。骨胳肌葡萄糖利用在基础和高胰岛素情况下,占全身葡萄糖利用的比例分别为20%和75%~95%。在高胰岛素的情况下,肌肉细胞所摄入的葡萄糖几乎全部都转化为糖原。在多数情况下,葡萄糖转运都是肌肉细胞葡萄糖利用的限制步骤,因此肌肉细胞葡萄糖的转运,对于全身葡萄糖的利用具有非常重要的意义。最近的一些实验证实,如用葡萄糖钳技术研究表明,肌肉GLUT4水平与机体全身的葡萄糖利用率密切相关。对葡萄糖转运蛋白在骨胳肌大量表达的转基因小鼠的研究发现,这种小鼠血糖调定点改变,表现出低血糖,而同时骨胳肌糖原含量增加了十倍,乳酸含量增加了两倍。这些都说明骨胳肌葡萄糖转运是其糖原合成及糖酵解的限制步骤,而这对血糖内稳态有重要影响[1,4]。
研究发现GLUT4同样在肾血管、肾小球与肾小管有表达。在糖尿病状态下,肾血管平滑肌GLUT4表达下降,同时由于葡萄糖摄入率减少,细胞内ATP产生减少,这使得细胞膜KATP钾通道开放,导致血管松弛,并可能参与高滤过的形成[1,6]。
, 百拇医药
5.2 表达调控 早在1980年人们就已经用实验证明,胰岛素是通过使转运分子从细胞浆到细胞膜的重新分布而使脂肪细胞的葡萄糖转运增加。此后,人们发现这种转运分子转位现象,是胰岛素能迅速刺激脂肪细胞和骨胳肌细胞葡萄糖摄入增加的主要机制(附图A),而细胞胰岛素抵抗状态的出现,与GLUT4转位功能的缺陷密切相关(附图B)[12]。其它一些因素也可通过加速GLUT4的膜转位促进葡萄糖转运,包括cAMP,佛波脂及肌肉收缩。胰岛素和肌肉收缩是已知的生理状况下能促进GLUT4转位的两种因素。在向细胞膜转位的同时,GLUT4的内在活性可能也升高了,但这还需进一步的实验来证实[1]。
最早有关转位的研究手段包括质膜与细胞膜的分离制备和转运活性的测定,以及细胞松弛素B结合实验。特异性抗体及特异性配体等研究手段的应用,使得这项研究取得了很大进展[15,16]。Slot等用葡萄糖转运蛋白抗体完成了一系列出色的实验,他把超薄冰冻切片进行免疫胶体金染色,展现了棕色脂肪,心肌和骨胳肌中GLUT4从高尔基体转位到细胞膜的过程。Smith等报道白色脂肪中细胞内的GLUT4是质膜的凹入部分,现在还不清楚这种现象,是由于不同细胞GLUT4贮藏方式不同还是由于技术上的因素。目前对贮存GLUT4的细胞内囊泡研究的还很少。在脂肪细胞富含GLUT4的低密度囊泡中,发现了低分子量的GTP结合蛋白。这种蛋白属于ras蛋白超家族,与囊泡转运有密切关系。Baldini等用实验证实,GTP结合蛋白参与胰岛素所刺激的GLUT4的转位。鉴定富含GLUT4的囊泡中其它蛋白质,对于理解这种细胞器的结构和功能将有非常重要的意义[1]。
, http://www.100md.com
人们对不同代谢状态下,尤其是胰岛素抵抗状态下GLUT4基因的表达做了大量的研究。在STZ所诱导的糖尿病大鼠的脂肪细胞中,GLUT4的mRNA和蛋白质都明显降低。脂肪细胞GLUT4表达量的减少,是由于脂肪细胞GLUT4基因转录率降低所造成的。GLUT4的这种降低与从STZ大鼠中分离的脂肪组织中出现的胰岛素抵抗状态相符。同样2型糖尿病患者中,脂肪细胞所表现出的胰岛素抵抗状态也与GLUT4表达量减少密切相关。但是单纯用骨胳肌细胞GLUT4的减少很难对2型糖尿病患者的胰岛素抵抗状态进行全面阐释[4,12,17,18]。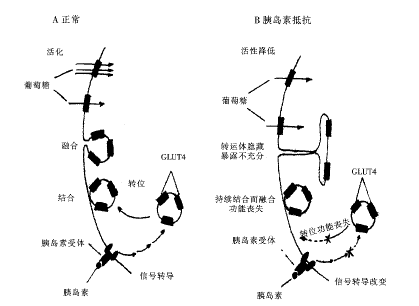
附图 胰岛素刺激脂肪和肌肉细胞增加葡萄糖摄入的机制
(A)正常脂肪与肌肉细胞在胰岛素刺激下葡萄糖摄入增加的过程
(B)在胰岛素抵抗状态下各个环节可能的功能改变
, http://www.100md.com
饥饿是机体的另外一种胰岛素抵抗状态,在饥饿大鼠的脂肪细胞中GLUT4蛋白和RNA明显减少,但骨胳肌细胞却明显增加。对于遗传性肥胖及糖尿病大鼠的研究发现,其脂肪组织中GLUT4的含量与正常大鼠无明显差异。年轻的肥胖Zuker大鼠与消瘦Zuker大鼠相比,脂肪细胞GLUT4 mRNA和蛋白含量升高。这可能是由非特异性的细胞蛋白和RNA含量升高所引起的,但进一步的研究发现,GLUT4的从细胞内囊泡转运至细胞膜的转运机制有缺陷(附图B)。最近发现己糖激酶Ⅱ的活性和mRNA含量,在骨胳肌细胞中可以被胰岛素所调控。阐明肌肉细胞中这种酶在不同胰岛素抵抗状态下的作用将会很有意义[12]。此外,长期的体育锻炼可以升高骨胳肌细胞GLUT4的含量,这种升高与在分离的骨胳肌中观察到的胰岛素刺激下葡萄糖摄入升高以及胰岛素敏感性增加相符[19]。而在去神经支配所导致的胰岛素抵抗中肌肉细胞GLUT4的表达降低。葡萄糖缺乏可以升高体外培养的3T3L1脂肪细胞的葡萄糖摄入,这部分是由于GLUT4在细胞膜表面含量增加。尽管细胞GLUT4蛋白总量未变,而GLUT4 mRNA明显下降,葡萄糖缺乏同样可以升高骨胳肌来源的L6细胞的细胞膜表面的GLUT4含量[1,4,12,20]。
, 百拇医药
6 葡萄糖转运蛋白-5(glucose transporter 5,GLUT5)
GLUT5与GLUTs家族的其它成员同源性最小,实际上它是一种果糖转运体,但它可以转运葡萄糖。它在小肠的游离面表达较高,可能是食物中果糖摄入的主要途径。它在成熟精子表面有高表达,这与精子利用精液中的果糖为能源相关。有趣的是GLUT5所介导的果糖的转运不被细胞松弛素所抑制。GLUT5在大脑的内皮以及肌肉和脂肪细胞中也有表达,尽管其生理机制还不清楚。在肌肉和脂肪细胞中GLUT5的表达不受胰岛素的调节[1]。
7 葡萄糖转运蛋白-7(glucose transporter 7,GLUT7)
GLUT7是最近发现的一种葡萄糖转运体类型,目前对它的了解还很少。GLUT7与GLUT2有68%的序列同源性。它分布在糖原合成组织细胞的内质网上,负责把葡萄糖-6-磷酸酶的作用产物从内质网中运出。研究GLUT7将有利于阐明葡萄糖-6-磷酸系统在肝脏葡萄糖代谢中的作用[1]。
, 百拇医药
目前已知的六种葡萄糖转运蛋白结构类似,但功能特性和组织分布却各不相同。这六种转运蛋白的共同作用,维持了机体相对稳定的血糖水平,保证了各个器官正常的葡萄糖代谢[17]。而一种葡萄糖转运蛋白功能的异常会影响其它葡萄糖转运蛋白的功能。在肌肉细胞中GLUT1的表达与功能活化会引起细胞己糖胺途径(hexosamine pathway)的活化,进而抑制GLUT4的活性并导致胰岛素抵抗[21]。临床研究已经证实,2型糖尿病与肥胖患者成纤维细胞与肌肉细胞的细胞表面GLUT1含量明显增加,而这种GLUT1的异常增加,可能与GLUT4转位功能与活性的丧失以及组织的胰岛素抵抗状态密切相关[22]。研究疾病状态下各种葡萄糖转运蛋白表达与功能的变化,对于了解它们的生理功能以及阐明疾病的发病机制都将是非常有意义的。
参考文献
1,Mueckler M.Facilitative glucose transporters.Eur J Biochem,1994,219:713
, 百拇医药
2,Mueckler M,Caruso C,Baldwin SA et al.Sequence and structure of a human glucose transporter.Science,1985,229:941
3,Zierler K.Whole body glucose metabolism.Am J Physiol,1999,276:E409
4,Baldwin SA.Mammalian passive glucose transporters members of a ubiquitous family of active and passive transport proteins.Biochim Biophys Acta,1993,1154:17
5,李颖健,刘志红,章 精等.人肾小球系膜细胞葡萄糖转运蛋白的研究.细胞生物学杂志,1999,21:185
, 百拇医药
6,Heilig CW,Brosius FC,Henry DN.Glucose transporters of the glomerulus and the implications for diabetic nephropathy.Kidney Int,1997,52:S91
7,Yang J,Clark AE,Kozka IJ et al.Development of an intracellular pool of glucose transporters in 3T3-L1 cells.J Biol Chem,1992,267:10393
8,Kitagawa T,Tanaka M,Akamatzu Y.Regulation of glucose transport activity and expression of glucose transporter mRNA by serum,growth factors and phorbol ester in quiescent mouse fibroblast.Biochim Biophys Acta,1989,980:100
, 百拇医药
9,Kitagawa T,Mtsuko M,Akamatsu Y.Transforming growth factor-β1 stimulates glucose uptake and the expression of glucose transporter mRNA in quiescent swiss mouse 3T3 cells.J Biol Chem,1991,266:18066
10,Klip A,Tsakiridis T,Marette A et al.Regulation of expression of glucose transporters by glucose:a review of studies in vivo and in cell culture.FASEB J,1994,8:43
11,Murakami T,Nishiyama T,Shirotani T et al.Identification of two enhancer elements in the gene encoding the type 1 glucose transporter from the mouse which are responsive to serum,growth factor and oncogenes.J Biol Chem,1992,267:9300
, 百拇医药
12,Kahn BB.Facilitative glucose transporters:regulatory mechanism and dysregulation in diabetes.J Clin Invest,1992,89:1367
13,Inman LR,McAllister CT,Chen L et al.Autoantibodies to the GLUT-2 glucose transporter of beta cells in insulin-dependent diabetes mellitus of recent onset.Proc Natl Acad Sci USA,1993,90:1281
14,De Vos A,Heimberg H,Quartier E et al.Human and rat beta cells differ in glucose transporter but not in glucokinase gene expression.J Clin Invest,1995,96:2489
, 百拇医药
15,Rea S,James DE.Moving GLUT4:the biogenesis and trafficking of GLUT4 storage vesicles.Diabetes,1997,46:1667
16,Zorzano A,Sevilla L,Camps M et al.Regulation of glucose transport,and glucose transporters expression and trafficking in the heart:studies in cardiac myocytes.Am J Cardiol,1997,80:65A
17,Mueckler M,Holman G.Homeostasis without a GLUT.Nature,1995,377:100
18,Zorzano A,Sevilla L,Tomas E et al.GLUT4 trafficking in cardiac and skeletal muscle:isolation and characterization of distinct intracellular GLUT4-containing vesicle populations.Biochem Soc Trans,1997,25:968
, 百拇医药
19,Goodyear LJ,Kahn BB.Exercise,glucose transport,and insulin sensitivity.Annu Rev Med,1998,49:235
20,Ezaki O.Regulatory elements in the insulin-responsive glucose transporter(GLUT4)gene.Biochem Biophys Res Commun,1997,241:1
21,Ebeling P,Koistinen HA,Koivisto VA.Insulin-independent glucose transport regulates insulin sensitivity.FEBS Lett,1998,436:301
22,Miele C,Formisano P,Condorelli G et al.Abnormal glucose transport and GLUT1 cell-surface content in fibroblasts and skeletal muscle from NIDDM and obese subjects.Diabetologia,1997,40:421
(2000-02-20收稿)
, http://www.100md.com
单位:南京军区南京总医院 解放军肾脏病研究所 南京,210002
关键词:葡萄糖转运蛋白;易化转运体;胰岛素调节
肾脏病与透折肾移植杂志000215
葡萄糖是维持细胞能量代谢和生命活动的重要原料,小肠吸收的或肝脏产生的葡萄糖通过血液流向体内的各个器官和组织,提供能源和其它碳水化合物的最初前体。葡萄糖是一种极性分子,不能以自由扩散的方式通过细胞膜脂双层结构的疏水区,除了小肠和肾小管可以通过主动运输方式吸收葡萄糖外,其它组织的细胞都必须通过细胞膜上的一类葡萄糖转运蛋白(glucose transporters)通过易化扩散来摄入葡萄糖。葡萄糖转运蛋白是细胞膜上的跨膜糖蛋白,介导细胞内外的葡萄糖以易化扩散的方式相互转运。
易化扩散转运体通常叫做被动载体(passive carriers),葡萄糖的易化扩散转运蛋白是目前研究最为彻底的易化扩散转运体。被动载体是一种不耗能的系统,只能顺浓度梯度转运底物。因此,被动载体一般仅限于具有稳定内环境的多细胞生物。易化扩散的葡萄糖转运体的最主要功能是介导葡萄糖在血液与细胞胞浆间的转运。它们各自的功能取决于细胞的类型与代谢状态[1,2]。
, http://www.100md.com
1 葡萄糖的易化转运体家族
到目前为止已有六种葡萄糖转运蛋白(glucose transporters GLUTs)被鉴定,分别命名为葡萄糖转运蛋白1~5,和葡萄糖转运蛋白7(GLUT1~5 and GLUT7)。GLUT7的序列目前还不清楚。经比较,表明人的GLUT1~5具有39%~65%的序列同源性以及50%~76%的序列相似性。同时比较五种葡萄糖转运蛋白亚型,表明它们具有26%的序列同源性。某一特定的亚型在种属间也略有差异,其中GLUT1最为保守,人的GLUT1蛋白与小鼠、大鼠和猪的GLUT1蛋白同源性高达97%~98%[1]。
然而由于不同的葡萄糖转运蛋白对萄萄糖具有不同的转运效率和转运动力学,因而它们的生理功能和组织分布完全不同(附表)。GLUT5主要负责果糖的转运,在生理条件下不参与葡萄糖的转运。其它四种葡萄糖转运蛋白根据对葡萄糖的亲和力又可以分为三组,其中GLUT3对葡萄糖的亲和力最高,而GLUT2最低。GLUT1和GLUT4对葡萄糖的亲和力介于GLUT3和GLUT2之间[3]。
, 百拇医药
附表 葡萄糖转运蛋白在体内的分布 名称
组织分布
主要功能
SGLT1
肾脏,小肠
钠离子依赖的主动运输
GLUT1
大部分胚胎和成体组织中,其中红细胞,内皮细胞,以及永生性的细胞系中含量较为丰富
为细胞提供基本的葡萄糖供应,并为增殖分裂细胞提供相应增加的葡萄糖,负责血脑屏障及其它体内屏障的葡萄转运
GLUT2
, http://www.100md.com
肝细胞,胰岛β-细胞(啮齿类),小肠,肾脏
高容量,低亲和力的葡萄糖转运,负责上皮细胞基膜侧的葡萄糖转运
GLUT3
广泛分布于人体各组织中,脑中含量丰富
脑组织间液与脑实质细胞间的葡萄糖转运
GLUT4
骨胳肌,心脏,脂肪细胞
负责胰岛素增高条件下葡萄糖摄入的迅速增加,在整个机体的葡萄糖利用中非常重要
GLUT5
小肠,脂肪,肌肉,脑,肾
, 百拇医药
负责小肠果糖的吸收
GLUT7
肝细胞及其它糖原异生组织
负责内质网膜葡萄糖的跨膜运输
2 葡萄糖转运蛋白-1(glucose transporter 1,GLUT1)
2.1 结构与生化特性 细胞膜上的葡萄糖转运动力学已经研究了四十年,但研究主要集中在人的红细胞。Widder等于1952年第一次提出胎盘的葡萄糖转运存在一种可饱和的载体。他用米氏方程(Michaelis-Menton equation)成功地预测了红细胞和其它细胞葡萄转运的动力学特征。1977年Kasahara和Hinkle从人的红细胞膜中纯化出了GLUT1蛋白质,开创了葡萄糖转运蛋白研究的新时代。这种纯化出的蛋白是一种高度的、疏水的、糖基化程度各异的蛋白质,其动力学特征与完整的红细胞基本相同。1985年,Mueckler等[2]利用从红细胞膜中纯化的GLUT1蛋白质制备的抗体成功地从HepG2细胞(human hepatocellilar carcinoma cell line)的cDNA文库中克隆了人的GLUT1基因,因而GLUT1通常也被称为HepG2型葡萄糖转运蛋白。
, 百拇医药
目前已知人、小鼠、大鼠、兔和猪的GLUT1都是由492氨基酸残基构成的蛋白质,它们具有高达97%的同源性。Mueckler根据GLUT1的氨基酸序列疏水性分析结果提出了十二个跨膜区的结构模型。尽管这种模型目前还未被完全证实,但很多细节已被实验所验证。GLUT1蛋白的三维结构目前还不清楚[1~4]。
2.2 组织分布 GLUT1是已知的分布最为广泛的转运体。在很多种哺乳动物的胚胎和成体细胞中都有表达,然而它的表达量往往很低,一般与其它组织特异性表达的葡萄糖转运体亚型一起承担细胞的葡萄糖转运。在早期小鼠胚胎发育时期,从卵母细胞到胚胎细胞,都能检测到GLUT1 mRNA的表达。在胚胎发育的晚期,GLUT1表达分布的方式则相差很大,随不同组织而各异。GLUT1负责各种组织与血液间葡萄糖的转运。因此GLUT1在脑,眼,外周神经组织和胎盘的内皮及上皮样屏障细胞中的表达量较高。最典型的例子是构成脑部血脑屏障的毛细血管,GLUT1表达量非常高。这是因为,脑实质细胞在正常情况下完全依赖葡萄糖作为能源物质,葡萄糖的转运就非常重要。人的红细胞膜上的GLUT1含量非常丰富,占总膜蛋白的6%之多,人红细胞富含GLUT1的生理意义目前还不清楚[1,4]。目前在肾小球和肾小管中都发现了GLUT1的表达,而GLUT1在肾小球系膜细胞和肾小球上皮细胞的表达已经得到了确认[5,6]。
, 百拇医药
2.3 表达调控 目前有关GLUT1表达与调控的研究很多,但主要集中在体外培养细胞系中。在很多体外培养的细胞系中,GLUT1是最主要的葡萄糖转运体类型,这可能是细胞系去分化与胚胎化的一种表现,因为GLUT1是胚胎细胞主要的葡萄糖转运体类型。同时也反映出GLUT1的表达可以被刺激细胞生长的物质所诱导,因为分裂的细胞对能量和生物合成的需要增加了[1]。对体外培养细胞GLUT1的调控可以分为急性调控和慢性调控两个方面。急性调控不涉及mRNA和蛋白质的合成,主要是GLUT1从细胞内的贮存囊泡向细胞膜的转位以及GLUT1内在活性的改变。细胞在应激情况下GLUT1会发生转位而使细胞葡萄糖摄入大幅度增加[4];同时细胞的生长状态也影响GLUT1的亚细胞分布,对于成纤维细胞而言,当细胞处于亚融合状态时GLUT1主要分布于细胞表面,这时候细胞葡萄糖转运速度高而且不受胰岛素的影响,而当细胞处于融合状态时75%的GLUT1位于细胞内的囊泡中,在刺激因子作用下通过GLUT1转位细胞的葡萄糖摄入增加2.5倍[4,7]。
, 百拇医药
GLUT1的表达受很多因素的影响。长时间的葡萄糖缺乏状态(glucose deprivation)会引起GLUT1 mRNA与蛋白质的升高。除此之外,下列因子均可以增加GLUT1的表达:佛波酯(phorbol esters),降糖药(sulfonylureas),钒酸盐(vanadate),丁酸盐(butyrate),低氧,cAMP,甲状腺激素(thyroid hormone),血清,胰岛素,胰岛素样生长因子1(IGF-1),血小板来源生长因子(PDGF),成纤维细胞生长因子(FGF),肿瘤坏死因子α(TNF-α),生长激素,转化生长因子β(TGF-β)和癌基因等[8~10]。目前已在人GLUT1基因5端非翻译区的启动子中发现了佛波酯反应元件(phorbol ester responsive element),而在小鼠GLUT1基因的增强子区则发现了佛波酯反应元件、cAMP反应元件和血清反应元件(phorbol ester responsive element,cAMP responsive element and serum responsive element)[11]。培养液中葡萄糖的浓度与GLUT1蛋白质或mRNA的表达量呈反比关系,但还没有在GLUT1基因中发现葡萄糖或其代谢产物的反应元件[12]。
, 百拇医药
有关整体动物中GLUT1表达调控的研究还很少,大鼠血脑屏障中GLUT1的表达量与血糖浓度呈反比关系,血糖浓度的降低将刺激GLUT1表达量的增加,这对维持脑的相对稳定的葡萄糖供应有重要意义。人肿瘤组织中GLUT1的表达量明显增加,这与体外细胞培养的结果相一致。甲状腺功能低下增加大鼠心脏GLUT1的水平,去神经支配也会增加骨胳肌GLUT1的表达量[1]。
3 葡萄糖转运蛋白-2(glucose transporter 2,GLUT2)
3.1 组织分布与生理功能 GLUT2是肝细胞,胰岛β细胞(啮齿类)及小肠和肾脏具吸收功能的上皮细胞最主要的葡萄糖转运体类型,上皮细胞中GLUT2主要分布在基膜侧,和钠-葡萄糖共转运体一起完成葡萄糖的吸收与转运。肾脏中GLUT2除了分布于肾小管上皮细胞外还被发现在肾小球有表达。它最显著的特征是对葡萄糖的高饱和度和低亲和性。在爪蟾卵母细胞表达体系中GLUT2的Km值为42 mmol/L,而GLUT1为18~21 mmol/L。高Km值决定了GLUT2的功能特点,在肝细胞和β细胞中GLUT2和高Km值的Ⅳ型葡萄糖激酶相配合,起葡萄糖感受器的作用。而GLUT2的转运速度往往高于葡萄糖激酶的反应速度,因此在这些细胞中葡萄糖激酶是葡萄糖摄入的限制步骤。GLUT2高容量和低亲和性的特点是餐后小肠细胞和肾小管细胞摄入大量葡萄糖所必需的[1]。
, 百拇医药
GLUT2受到广泛关注,是因为它可能参与糖尿病的发生。包括自身免疫性糖尿病BB大鼠以及Zuker肥胖糖尿病大鼠在内的很多糖尿病动物模型中,胰岛β细胞GLUT2的表达减少。在这些模型中胰岛β细胞GLUT2的减少与葡萄糖刺激下胰岛素分泌能力下降密切相关,但进一步的实验表明,GLUT2的减少不是胰岛β细胞葡萄糖敏感性降低的原因,而是糖尿病的结果。
尽管有在1型糖尿病患者中发现了GLUT2的自身抗体的报道[3],然而最近研究发现,人类和啮齿类的胰岛β细胞所表达的葡萄糖转运蛋白种类完全不同。GLUT2在啮齿类的胰岛β细胞所扮演的角色在人类中被GLUT1所取代[14]。种属之间的这种明显差异已经引起人们的高度重视。
3.2 表达调控 除了糖尿病状态下GLUT2的表达下调外,在其它很多情况下GLUT2的表达也会发生相似改变。在葡萄糖灌注或胰岛素灌注的大鼠中,β细胞GLUT2的表达量直接随血糖的变化而改变。在胰岛培养物以及HITT15细胞中也发现GLUT2的表达量与培养液中葡萄糖的浓度有类似的关系。然而新鲜分离饥饿或注射胰岛素所致的低血糖大鼠的胰岛,发现GLUT2的mRNA表达在上述两种情况下均明显升高。注射胰岛素可使胰岛细胞GLUT2蛋白质降低39%,而饥饿对GLUT2蛋白质则无明显影响[1]。
, 百拇医药
有关血糖浓度对肝脏GLUT2的表达的研究结果并不完全一致。如有人报道链脲佐菌素(STZ)所诱导的糖尿病大鼠肝脏中GLUT2 mRNA和蛋白质上升,也有人发现其没有变化。一项动态观察研究发现,单次注射STZ 6h后肝脏GLUT2表达下降,并维持至30h,然后开始上升,48h后回到正常水平。短期内GLUT2 mRNA的减少可能与STZ处理后胰岛素的暂时升高有关。用phlorizin使糖尿病大鼠的血糖恢复正常的同时也使GLUT2的表达恢复正常。而用胰岛素灌注可使GLUT2 mRNA减少至对照的25%,GLUT2蛋白质也呈类似的改变。这些结果以及后来一系列研究都表明,高胰岛素降低GLUT2的表达,而高血糖升高GLUT2的表达。有关上皮细胞GLUT2表达的研究发现,在STZ糖尿病大鼠和高糖饮食大鼠中,小肠细胞基膜侧GLUT2蛋白质升高,而在葡萄糖灌注所引起的高血糖大鼠中无显著变化,葡萄糖的转运活性在上述三种情况下均升高[1]。
4 葡萄糖转运蛋白-3(glucose transporter 3,GLUT3)
, 百拇医药
GLUT3是成人大脑实质细胞最主要的葡萄糖转运体类型。在小鼠中GLUT3的表达仅限于神经细胞,但在人的胎盘,肝脏和肾脏中都发现GLUT3 mRNA和蛋白质的表达。GLUT3是大鼠胎盘最主要的葡萄糖转运蛋白,它可能参与了葡萄糖向胚胎的转运。尽管在人脑中GLUT3蛋白分布于多种细胞中,但神经细胞的表达量明显高于胶质细胞和内皮细胞。这种转运体最重要的特征是低Km值,这表示GLUT3对于葡萄糖的高亲和性,也就是说在葡萄糖浓度比较低的情况下,GLUT3的转运效率比其它的转运体要高。GLUT3和GLUT1一样在很多细胞系中都有表达,例如骨胳肌来源的L6细胞。这表明GLUT3在胚胎肌细胞中可能是一种正常表达的葡萄糖转运体,而体外培养的肌肉细胞去分化而使GLUT3重新表达[1,4]。
5 葡萄糖转运蛋白-4(glucose transporter 4,GLUT4)
5.1 组织分布与生理功能 GLUT4主要分布于脂肪细胞和肌肉细胞,它们都是所谓的胰岛素敏感性细胞,也就是说这些细胞在胰岛素刺激下葡萄糖摄入迅速升高。GLUT4在棕色脂肪中含量最高,其次是心肌,骨胳肌,平滑肌和白色脂肪。尽管这些组织中也有其它葡萄糖转运体的表达,如GLUT1,但很多证据都表明,GLUT4是胰岛素反应性转运体。一方面GLUT4是骨胳肌和脂肪中最丰富的转运体,而3T3L1脂肪细胞的分化中GLUT4的表达与胰岛素反应性糖摄入增加密切相关,同时在不同类型的脂肪细胞中,GLUT4的表达量与各种细胞葡萄糖利用能力相符,而且GLUT4过量表达的L6细胞中胰岛素所刺激的葡萄糖转运明显升高[1]。
, 百拇医药
GLUT4引起人们关注主要是由于胰岛素敏感性组织中,葡萄糖的摄入对维持血糖的内稳态具有重要的意义。骨胳肌葡萄糖利用在基础和高胰岛素情况下,占全身葡萄糖利用的比例分别为20%和75%~95%。在高胰岛素的情况下,肌肉细胞所摄入的葡萄糖几乎全部都转化为糖原。在多数情况下,葡萄糖转运都是肌肉细胞葡萄糖利用的限制步骤,因此肌肉细胞葡萄糖的转运,对于全身葡萄糖的利用具有非常重要的意义。最近的一些实验证实,如用葡萄糖钳技术研究表明,肌肉GLUT4水平与机体全身的葡萄糖利用率密切相关。对葡萄糖转运蛋白在骨胳肌大量表达的转基因小鼠的研究发现,这种小鼠血糖调定点改变,表现出低血糖,而同时骨胳肌糖原含量增加了十倍,乳酸含量增加了两倍。这些都说明骨胳肌葡萄糖转运是其糖原合成及糖酵解的限制步骤,而这对血糖内稳态有重要影响[1,4]。
研究发现GLUT4同样在肾血管、肾小球与肾小管有表达。在糖尿病状态下,肾血管平滑肌GLUT4表达下降,同时由于葡萄糖摄入率减少,细胞内ATP产生减少,这使得细胞膜KATP钾通道开放,导致血管松弛,并可能参与高滤过的形成[1,6]。
, 百拇医药
5.2 表达调控 早在1980年人们就已经用实验证明,胰岛素是通过使转运分子从细胞浆到细胞膜的重新分布而使脂肪细胞的葡萄糖转运增加。此后,人们发现这种转运分子转位现象,是胰岛素能迅速刺激脂肪细胞和骨胳肌细胞葡萄糖摄入增加的主要机制(附图A),而细胞胰岛素抵抗状态的出现,与GLUT4转位功能的缺陷密切相关(附图B)[12]。其它一些因素也可通过加速GLUT4的膜转位促进葡萄糖转运,包括cAMP,佛波脂及肌肉收缩。胰岛素和肌肉收缩是已知的生理状况下能促进GLUT4转位的两种因素。在向细胞膜转位的同时,GLUT4的内在活性可能也升高了,但这还需进一步的实验来证实[1]。
最早有关转位的研究手段包括质膜与细胞膜的分离制备和转运活性的测定,以及细胞松弛素B结合实验。特异性抗体及特异性配体等研究手段的应用,使得这项研究取得了很大进展[15,16]。Slot等用葡萄糖转运蛋白抗体完成了一系列出色的实验,他把超薄冰冻切片进行免疫胶体金染色,展现了棕色脂肪,心肌和骨胳肌中GLUT4从高尔基体转位到细胞膜的过程。Smith等报道白色脂肪中细胞内的GLUT4是质膜的凹入部分,现在还不清楚这种现象,是由于不同细胞GLUT4贮藏方式不同还是由于技术上的因素。目前对贮存GLUT4的细胞内囊泡研究的还很少。在脂肪细胞富含GLUT4的低密度囊泡中,发现了低分子量的GTP结合蛋白。这种蛋白属于ras蛋白超家族,与囊泡转运有密切关系。Baldini等用实验证实,GTP结合蛋白参与胰岛素所刺激的GLUT4的转位。鉴定富含GLUT4的囊泡中其它蛋白质,对于理解这种细胞器的结构和功能将有非常重要的意义[1]。
, http://www.100md.com
人们对不同代谢状态下,尤其是胰岛素抵抗状态下GLUT4基因的表达做了大量的研究。在STZ所诱导的糖尿病大鼠的脂肪细胞中,GLUT4的mRNA和蛋白质都明显降低。脂肪细胞GLUT4表达量的减少,是由于脂肪细胞GLUT4基因转录率降低所造成的。GLUT4的这种降低与从STZ大鼠中分离的脂肪组织中出现的胰岛素抵抗状态相符。同样2型糖尿病患者中,脂肪细胞所表现出的胰岛素抵抗状态也与GLUT4表达量减少密切相关。但是单纯用骨胳肌细胞GLUT4的减少很难对2型糖尿病患者的胰岛素抵抗状态进行全面阐释[4,12,17,18]。

附图 胰岛素刺激脂肪和肌肉细胞增加葡萄糖摄入的机制
(A)正常脂肪与肌肉细胞在胰岛素刺激下葡萄糖摄入增加的过程
(B)在胰岛素抵抗状态下各个环节可能的功能改变
, http://www.100md.com
饥饿是机体的另外一种胰岛素抵抗状态,在饥饿大鼠的脂肪细胞中GLUT4蛋白和RNA明显减少,但骨胳肌细胞却明显增加。对于遗传性肥胖及糖尿病大鼠的研究发现,其脂肪组织中GLUT4的含量与正常大鼠无明显差异。年轻的肥胖Zuker大鼠与消瘦Zuker大鼠相比,脂肪细胞GLUT4 mRNA和蛋白含量升高。这可能是由非特异性的细胞蛋白和RNA含量升高所引起的,但进一步的研究发现,GLUT4的从细胞内囊泡转运至细胞膜的转运机制有缺陷(附图B)。最近发现己糖激酶Ⅱ的活性和mRNA含量,在骨胳肌细胞中可以被胰岛素所调控。阐明肌肉细胞中这种酶在不同胰岛素抵抗状态下的作用将会很有意义[12]。此外,长期的体育锻炼可以升高骨胳肌细胞GLUT4的含量,这种升高与在分离的骨胳肌中观察到的胰岛素刺激下葡萄糖摄入升高以及胰岛素敏感性增加相符[19]。而在去神经支配所导致的胰岛素抵抗中肌肉细胞GLUT4的表达降低。葡萄糖缺乏可以升高体外培养的3T3L1脂肪细胞的葡萄糖摄入,这部分是由于GLUT4在细胞膜表面含量增加。尽管细胞GLUT4蛋白总量未变,而GLUT4 mRNA明显下降,葡萄糖缺乏同样可以升高骨胳肌来源的L6细胞的细胞膜表面的GLUT4含量[1,4,12,20]。
, 百拇医药
6 葡萄糖转运蛋白-5(glucose transporter 5,GLUT5)
GLUT5与GLUTs家族的其它成员同源性最小,实际上它是一种果糖转运体,但它可以转运葡萄糖。它在小肠的游离面表达较高,可能是食物中果糖摄入的主要途径。它在成熟精子表面有高表达,这与精子利用精液中的果糖为能源相关。有趣的是GLUT5所介导的果糖的转运不被细胞松弛素所抑制。GLUT5在大脑的内皮以及肌肉和脂肪细胞中也有表达,尽管其生理机制还不清楚。在肌肉和脂肪细胞中GLUT5的表达不受胰岛素的调节[1]。
7 葡萄糖转运蛋白-7(glucose transporter 7,GLUT7)
GLUT7是最近发现的一种葡萄糖转运体类型,目前对它的了解还很少。GLUT7与GLUT2有68%的序列同源性。它分布在糖原合成组织细胞的内质网上,负责把葡萄糖-6-磷酸酶的作用产物从内质网中运出。研究GLUT7将有利于阐明葡萄糖-6-磷酸系统在肝脏葡萄糖代谢中的作用[1]。
, 百拇医药
目前已知的六种葡萄糖转运蛋白结构类似,但功能特性和组织分布却各不相同。这六种转运蛋白的共同作用,维持了机体相对稳定的血糖水平,保证了各个器官正常的葡萄糖代谢[17]。而一种葡萄糖转运蛋白功能的异常会影响其它葡萄糖转运蛋白的功能。在肌肉细胞中GLUT1的表达与功能活化会引起细胞己糖胺途径(hexosamine pathway)的活化,进而抑制GLUT4的活性并导致胰岛素抵抗[21]。临床研究已经证实,2型糖尿病与肥胖患者成纤维细胞与肌肉细胞的细胞表面GLUT1含量明显增加,而这种GLUT1的异常增加,可能与GLUT4转位功能与活性的丧失以及组织的胰岛素抵抗状态密切相关[22]。研究疾病状态下各种葡萄糖转运蛋白表达与功能的变化,对于了解它们的生理功能以及阐明疾病的发病机制都将是非常有意义的。
参考文献
1,Mueckler M.Facilitative glucose transporters.Eur J Biochem,1994,219:713
, 百拇医药
2,Mueckler M,Caruso C,Baldwin SA et al.Sequence and structure of a human glucose transporter.Science,1985,229:941
3,Zierler K.Whole body glucose metabolism.Am J Physiol,1999,276:E409
4,Baldwin SA.Mammalian passive glucose transporters members of a ubiquitous family of active and passive transport proteins.Biochim Biophys Acta,1993,1154:17
5,李颖健,刘志红,章 精等.人肾小球系膜细胞葡萄糖转运蛋白的研究.细胞生物学杂志,1999,21:185
, 百拇医药
6,Heilig CW,Brosius FC,Henry DN.Glucose transporters of the glomerulus and the implications for diabetic nephropathy.Kidney Int,1997,52:S91
7,Yang J,Clark AE,Kozka IJ et al.Development of an intracellular pool of glucose transporters in 3T3-L1 cells.J Biol Chem,1992,267:10393
8,Kitagawa T,Tanaka M,Akamatzu Y.Regulation of glucose transport activity and expression of glucose transporter mRNA by serum,growth factors and phorbol ester in quiescent mouse fibroblast.Biochim Biophys Acta,1989,980:100
, 百拇医药
9,Kitagawa T,Mtsuko M,Akamatsu Y.Transforming growth factor-β1 stimulates glucose uptake and the expression of glucose transporter mRNA in quiescent swiss mouse 3T3 cells.J Biol Chem,1991,266:18066
10,Klip A,Tsakiridis T,Marette A et al.Regulation of expression of glucose transporters by glucose:a review of studies in vivo and in cell culture.FASEB J,1994,8:43
11,Murakami T,Nishiyama T,Shirotani T et al.Identification of two enhancer elements in the gene encoding the type 1 glucose transporter from the mouse which are responsive to serum,growth factor and oncogenes.J Biol Chem,1992,267:9300
, 百拇医药
12,Kahn BB.Facilitative glucose transporters:regulatory mechanism and dysregulation in diabetes.J Clin Invest,1992,89:1367
13,Inman LR,McAllister CT,Chen L et al.Autoantibodies to the GLUT-2 glucose transporter of beta cells in insulin-dependent diabetes mellitus of recent onset.Proc Natl Acad Sci USA,1993,90:1281
14,De Vos A,Heimberg H,Quartier E et al.Human and rat beta cells differ in glucose transporter but not in glucokinase gene expression.J Clin Invest,1995,96:2489
, 百拇医药
15,Rea S,James DE.Moving GLUT4:the biogenesis and trafficking of GLUT4 storage vesicles.Diabetes,1997,46:1667
16,Zorzano A,Sevilla L,Camps M et al.Regulation of glucose transport,and glucose transporters expression and trafficking in the heart:studies in cardiac myocytes.Am J Cardiol,1997,80:65A
17,Mueckler M,Holman G.Homeostasis without a GLUT.Nature,1995,377:100
18,Zorzano A,Sevilla L,Tomas E et al.GLUT4 trafficking in cardiac and skeletal muscle:isolation and characterization of distinct intracellular GLUT4-containing vesicle populations.Biochem Soc Trans,1997,25:968
, 百拇医药
19,Goodyear LJ,Kahn BB.Exercise,glucose transport,and insulin sensitivity.Annu Rev Med,1998,49:235
20,Ezaki O.Regulatory elements in the insulin-responsive glucose transporter(GLUT4)gene.Biochem Biophys Res Commun,1997,241:1
21,Ebeling P,Koistinen HA,Koivisto VA.Insulin-independent glucose transport regulates insulin sensitivity.FEBS Lett,1998,436:301
22,Miele C,Formisano P,Condorelli G et al.Abnormal glucose transport and GLUT1 cell-surface content in fibroblasts and skeletal muscle from NIDDM and obese subjects.Diabetologia,1997,40:421
(2000-02-20收稿)
, http://www.100md.com