大鼠脑纹状体边缘区内5-HT2A受体的分布
作者:张魁华 舒斯云 包新民 徐重
单位:张魁华(第一军医大学神经科学研究所,珠江医院,广东 广州 510282);舒斯云(第一军医大学神经科学研究所,珠江医院,广东 广州 510282);包新民(第一军医大学神经科学研究所,珠江医院,广东 广州 510282);徐重(第一军医大学神经科学研究所,珠江医院,广东 广州 510282)
关键词:5-HT2A受体;纹状体边缘区;原位杂交;免疫组织化学
第一军医大学学报000311 摘要:目的 已知纹状体边缘区内有密集的五羟色胺(5-HT)纤维及终末分布,在此认识的基础上观察5-HT2A 受体mRNA是否在大鼠纹状体边缘区内表达,从基因分子水平和细胞水平进一步证明大鼠纹状体边缘区能否合成5-HT2A受体。方法 用地高辛标记的寡核苷酸探针进行原位杂交,研究大鼠纹状体边缘区内5-HT2A 受体mRNA的表达及分布。结果 原位杂交结果发现,5-HT2A受体 mRNA阳性杂交信号在纹状体内的分布不均匀,尾壳核内只有少量中等大小的阳性胞体,苍白球内也只有少量较大的阳性胞体,而在尾壳核和苍白球之间的边缘区部位则可见许多中等大小的梭形阳性神经元胞体,并呈现密集的带状分布。免疫组织化学结果观察到5-HT受体阳性神经元胞体在纹状体内的分布与原位杂交结果一致。结论 推测大鼠纹状体边缘区内可以合成5-HT2A受体,具有接受和整合5-HT神经递质的功能。
, http://www.100md.com
中图分类号:R741 文献标识码:A 文章编号:1000-2588 (2000)-03-0228-03
Distribution of 5-HT2A receptor in the marginal region of rat striatum
ZHANG Kui-hua, SHU Si-yun, BAO Xin-min, XU Zhong
(Institute of Neuroscience, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, China)
Abstracts: Objective To observe the expression of 5-HT2A receptor mRNA in the marginal region of rat striatum to investigate whether the synthesis of 5-HT2R takes place in the marginal region. Methods The in situ hybridization and immunohistochemical method were used in this study. Results Positive signals of 5-HT2A receptor mRNA hybridization were distributed non-uniformly in the central nervous system. Positive neurons were present in the marginal region of rat striatum, as also confirmed by immunohistochemical examination. Conclusion The 5-HT2A receptor could be synthesized in the marginal region of rat striatum.
, 百拇医药
Key words: 5-HT2A receptor; marginal division; in situ hybridization; immunohistochemistry
五羟色胺(5-HT)是脑内一种重要的神经递质。5-HT胞体位于脑干的中缝核群,它发出的投射纤维广泛分布于脑的各部。5-HT从突触释放后,一方面作用于受体,另一方面通过突触前膜上的5-HT转运体重新被摄取。近来的研究报道[1, 2]5-HT可能与精神机能(受体亚型可能是5-HT1A、5-HT2、5-HT3)、学习记忆(受体亚型可能是5-HT1A、5-HT1B、5-HT2、5-HT3)、痛觉传导的控制(受体亚型可能是5-HT1B、5-HT2、5-HT3)及呕吐调节(受体亚型是5-HT3)等有关。
纹状体边缘区(Marginal division,MrD)是舒斯云等[3, 4]自1987年以来先后在大鼠、猫和猴等哺乳动物脑的纹状体尾侧,环绕苍白球外侧处发现的一层梭形细胞区。该区富含P物质(SP)、5-HT、脑啡肽和神经降压肽等免疫阳性物质 [5~8]。它和Meynert基底核及黑质等部位有纤维联系[9~11]。迷宫行为实验证明边缘区的功能可能与大鼠的学习记忆有关[12~14]。Chudler等[15]发现大鼠对伤害性反应的神经元集中在纹状体边缘区部位,认为该区和痛觉有关。纹状体边缘区的学习记忆和痛觉功能可能与边缘区中存在多种神经肽和单胺类物质有关(如SP和5-HT等)。另外,我们以前的研究曾观察到纹状体边缘区内有密集的SP和5-HT免疫阳性纤维及终末分布[5, 6]。但边缘区中有关这些神经递质的靶区- 受体的分布尚不清楚。为了进一步研究纹状体边缘区中与学习记忆及痛觉有关的神经递质的受体分布,观察5-HT2A mRNA是否在大鼠纹状体边缘区内表达,从基因分子水平和细胞水平证明大鼠纹状体边缘区能否合成5-HT2AR。本实验用地高辛标记的寡核苷酸探针,用原位杂交(ISH)和免疫组织化学技术研究了5-HT2A受体阳性反应在纹状体边缘区中的分布。
, http://www.100md.com
1 材料和方法
1.1 实验动物
18只雄性SD大鼠,体质量200~250 g(第一军医大学实验动物中心提供)。用颗粒型大鼠饲料喂养,饮用自来水,动物房温度8~26℃,光暗周期为12: 12 h。实验前在上述条件下喂养2 d。腹腔内注射10%的水合氯醛(4 ml/ kg× b.w.)麻醉后开胸,经左心室通过升主动脉快速输入0.9%生理盐水100 ml (室温),继而快速输入4%的多聚甲醛磷酸缓冲液(PBS)200 ml(4 ℃ ),再缓慢滴注4%的多聚甲醛PBS 300 ml。开颅取脑,放置于30%蔗糖PBS(pH 7.4,4 ℃)直至沉底。冰冻连续切片(40 μm)。将切片分成3套,1套做5-HT2A 受体的寡核苷酸探针地高辛标记的原位杂交、1套做5-HT受体的多克隆抗体的免疫组织化学、另1套作为对照。
1.2 原位杂交
, 百拇医药
1.2.1 5-HT2A 受体cDNA探针的制备 参照文献[6],它的两段特异性核苷酸片段序列分别为:a,5`-CAT GCC TCT CCA TTC TTC ATC TTC AGG AA-3`;b,5`-CAA GGT GGC TTC TTT CTG AAG TGA CTT GA-3`。由中国科学院上海生化所DNA合成室合成上述5-HT2A受体 cDNA寡核苷酸探针。按非放射性DNA标记及检测试剂盒(Boehringer Mannheim公司)说明的方法将半抗原地高辛配基标记到5-HT2A受体 cDNA寡核苷酸上。标记后的探针用DNA斑点杂交试验进行灵敏度检测合格,- 20 oC保存备用。
1.2.2 原位分子杂交 以下各步骤直至杂交后,所有容器和称量、搅拌等物品均经酸泡及冲洗干净后,置160 oC~200 oC中8 h。配制液体的四蒸水用DEPC处理后,高压灭菌。
1.2.2.1 杂交前处理 将冰冻切片放入反应板内,PBS漂洗4次,每次5 min。PTW漂洗4次,每次15 min。加入不含探针的杂交液(内含50% Formamide、5´ SSC、200 g/L Blocking agent、50 g/L肝素、0.1% Tween-20)预杂交1.5 h(41℃水浴)。
, 百拇医药
1.2.2.2 杂交反应 在反应板内加入0.3 ml/孔含1 mg/L探针杂交液,每孔加入6~8张切片,置41 oC水浴箱中孵育16 h (或过夜)。然后用不含探针的杂交液漂洗2次,每次15 min,PTW漂洗4次,每次15 min,PBT漂洗4次,每次15 min。加入1:200抗地高辛抗体 (PBT稀释),置室温2 h, PBT、SMT各漂洗4次,每次5 min,用NBT和PCIT显色剂(1:100)放置4 oC冰箱中显色,每隔15 min检查1次,直至显色良好为止(2~3 h)。PBS漂洗2次后,用0.5%的明胶贴片,干燥后脱水、透明、封片,Olympus AH-3显微镜观察、照相。
1.2.3 设立对照组 设立RNA消化酶对照、5-HT2A受体 cDNA寡核苷酸对照及空白对照组。
1.3 免疫组织化学
(1) 0.01 mol/L PBS (pH 7.4) 漂洗 3´ 10 min;(2) 0.3% TritonX-100/PBS 37 oC孵育30 min;(3) 0.01 mol/L PBS (pH 7.4) 漂洗 3´ 10 min; (4) 加入一抗(5-HT受体抗体, 第四军医大学组胚教研室,1:100)置湿盒中4 oC, 48 h;(5) 0.01 mol/L PBS (pH7.4) 漂洗3´ 10 min;(6) 加入Biotinyted-IgG (Anti-rabbit,1:200) 置湿盒中室温, 3 h;(7) 0.01 mol/L PBS (pH 7.4) 漂洗 3´ 10 min;(8) 加入ABC复合物 (1:100, Vector) 置湿盒中于室温反应 2 h;(9) GDN法 (葡萄糖氧化酶-DAB-硫酸镍胺) 显色,室温30 min;(10) 明胶贴片、干燥、脱水、透明,DPX封片后在 Olympus AH-3显微镜下观察,照相。
, 百拇医药
1.4 空白对照组
用血清稀释液代替抗5-HT血清进行上述免疫组织化学步骤。
2 结果
地高辛标记的5-HT2A受体杂交阳性反应物呈蓝色或紫黑色颗粒状,主要位于核周围胞浆和树突基部,呈弥散或块状分布。纹状体内的5-HT2A受体阳性神经元分布不均匀,尾壳核中只有少量中等大小的多极形5-HT2A受体阳性胞体,苍白球内只有少量较大的多极形5-HT2A受体阳性胞体。但在尾壳核和苍白球之间的边缘区部位可见较多中等大小的5-HT2A受体阳性梭形细胞,并密集排列呈带状分布,梭形细胞的长轴主要呈背腹方向行走(图1,2)。边缘区内的5-HT2A受体阳性胞体向腹侧和中央杏仁核中的5-HT2A受体阳性细胞相连续,形成一条密集的连接带。此外,在大脑皮层、海马、杏仁核、丘脑下部等部位也观察到较多的5-HT2A受体阳性神经元胞体。
, 百拇医药
大鼠脑显微照相。标尺=50 μm。Microphotographs of rat brain.
Bar=50 μm. Cpu: caudate putamen; GP: globus pallidus; MrD: marginal region
图1 5-HT2A 受体 mRNA 在纹状体边缘区部位的表达
Fig.1 The expression of 5-HT2A receptor mRNA in the striatum
5-HT2A receptor mRNA-positive fusiform cells abounding in the marginal division,locating between the caudate putamen and globus pallidus.
, 百拇医药
图2 图1的放大, 示边缘区(MrD)中的5-HT2A 受体阳性梭形细胞
Fig 2 A magnification of Fig.1, showing the 5-HT2A receptor
mRNA-positive fusiform cells in the marginal region
免疫组化检查可见5-HT受体免疫反应物呈紫蓝色,位于阳性神经元胞体的核周及突起内。尾壳核和苍白球内只见少量多极形阳性胞体,而在尾壳核和苍白球之间的边缘区部位则可见较多中等大小的梭形阳性胞体,呈密集的带状分布,梭性细胞的走向主要呈背腹方向(图3,4)。阳性细胞分布的情况和原位杂交的结果相似。另外,在大脑皮层、海马、杏仁核和下丘脑等处也可见较多的5-HT受体阳性胞体分布。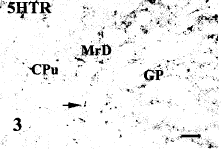
, 百拇医药
图3 5-HT受体免疫组化阳性胞体在纹状体及苍白球中的少量分布
Fig. 3 Sparse distribution of neurons showing positive immunoreaction
for 5-HT receptor in the striatum and globus pallidus
A lot of 5-HT receptor-positive fusiform cells in the marginal division,locating between the caudate putamen and globus pallidus.
The positive neurons arrange densely and show a belt shape.
, 百拇医药
图4 图3的放大, 示纹状体边缘区(MrD)中的5-HT受体阳性梭形细胞
Fig 4 A magnification of Fig 5, showing the 5-HT receptor-positive
fusiform cells in the marginal division
对照组试验未见5-HT受体阳性神经元胞体。
3 讨论
释放5-HT的神经细胞仅位于脑干中缝的几组核团,但它们发出的投射纤维则分布于大脑皮质、皮质下区、小脑、脑干及脊髓等广大部位的脑区。同样,5-HT受体也广泛分布于整个中枢神经系统。舒斯云等[4]曾观察到纹状体边缘区有许多5-HT纤维和终未,但对边缘区内有无5-HT受体存在尚未见报道。本研究用5-HT2A受体原位杂交方法显示纹状体边缘区内有较多的5-HT2A受体 mRNA存在,并用免疫组化方法观察到有5-HT受体的蛋白表达,说明纹状体边缘区能接受外来5-HT神经递质的调控,并参与其功能的调制。5-HT2A受体被认为是典型的5-HT受体,在海马、杏仁核、额叶皮质和梨状内嗅皮质等部位分布密集。5-HT受体可偶联G蛋白,与磷脂酶相联,引起磷脂的代谢变化,从而引导一系列生理生化过程的形成,包括LTP等。Ogren等[17, 18]报道应用一种5-HT释放剂(p chloroam phetamine,PCA)注射后能显著降低大脑皮层、海马及纹状体中的5-HT水平,产生剂量依赖性逃避学习及保持功能的损害,推测脑中的5-HT在逃避性学习中起重要作用,推测5-HT及其受体(主要是5-HT2A)是中枢神经系统产生和保留学习记忆的一个重要因素。Kubo 等[19]报道学习记忆是一个时间获得过程,而这个过程由中枢神经系统5-HT及其受体机制的介导产生。Papolos 等[20]向大鼠脑室内注射5-HT2A反义寡核苷酸后,半数大鼠出现学习困难,海马CA3中5-HT2A受体密度降低,认为中枢5-HT可经5-HT2A受体介导,参与调节行为。Normile 等[21]用5-HT2A拮抗剂ketanserin和乙酰胆硷酯酶抑制剂physostigmine均能增强大鼠的记忆能力,两者联合使用比单独使用效果更好,证明5-HT 和ACh系统在学习记忆过程中是互相作用的。我们曾证明大鼠纹状体边缘区与学习记忆有关[9]。本研究又证明纹状体边缘区中有较多的5-HT2A受体mRNA及5-HT受体蛋白的表达。进一步证明了纹状体边缘区和学习记忆功能有密切关系。推测5-HT递质及其受体的介导作用可能是纹状体边缘区参与学习记忆过程的一个重要因素。
, 百拇医药
国家自然科学基金(39770250)及广东省自然科学基金(950554)资助
张魁华(1966-),男,1999年毕业于第一军医大学,现为广州中医药大学博士后
参考文献
[1] Peroutka SJ. 5-HT receptor: past, present and future[J].Trends Neurosci, 1995, 18(2):68~9.
[2] Meneses A, Hong E. Effect of fluoxetine on learning and memory involves multiple 5-HT systems[J]. Pharmacol Biochem Behav, 1995, 52(2):341~6.
, 百拇医药 [3] Shu SY, Penny GR, Peterson GM. The “marginal division”, a new subdivision in the neostriatum of the rat[J]. J Chem Neuroanat, 1988, 1:147~55.
[4] Shu SY, Bao XM, Zhang CY et al. A new subdivision, marginal division, in the neostriatum of the monkey brain. Neurochemical Research, 2000, 25(2):231~9.
[5] Shu SY, McGinty JF, Peterson GM. High density of zinc-containing and substance P-immunoreactive terminals in the marginal division of rat striatum[J]. Brain Res Bull, 1990, 24(2):201~5.
, 百拇医药
[6] 包新民, 舒斯云. 大鼠纹状体边缘区内P物质、脑啡肽和胆囊收缩素免疫阳性反应的分布[J]. 解剖学杂, 1997, 13(2):107~10.
[7] 舒斯云, 包新民.大鼠纹状体边缘区内P物质阳性终末的突触特征[J].第一军医大学学报, 1991,11:283~6.
[8] 李耀宇, 舒斯云, 包新民等. 降钙素基因相关肽在纹状体及边缘区内分布及联系的研究[J].第一军医大学学报, 1999, 19(3): 201~4.
[9] 舒斯云, 包新民.大鼠纹状体边缘区内传人投射细胞的免疫组织化学特性[J]. 解剖学杂志, 1993, 16: 509~11.
[10] Shu SY, Bao XM, Li SX. The afferent connection and its immuno- histochemical characteristics of the marginal division in rat corpus striatum[J]. J Med Coll PLA, 1995, 10:259~63.
, http://www.100md.com
[11] 包新民, 舒斯云, 李胜修等. 海人藻酸注射大鼠Meynert基底核后 c-Fos原癌基因蛋白在脑纹状体边缘区及边缘系统内的表达[J]. 第一军医大学学报, 1999, 19(3):193~6.
[12] 舒斯云, 包蓉, 包新民等. 大鼠纹状体边缘区与Meynert氏基底核的突触联系及其与学习和记忆功能的关系[J]. 中国组织化学与细胞化学杂志, 1998, 7(1):1~11.
[13] 李胜修, 舒斯云, 包新民等. 海人藻酸破坏纹状体边缘区后对大鼠学习和记忆功能影响的研究[J]. 神经解剖学杂志, 1993; 12(1):37
[14] 曾建新, 舒斯云, 包新民等. 大鼠纹状体边缘区神经元中乙酰胆碱激活的离子通道特性[J]. 第一军医大学学报, 1999, 19(4):308~11.
, http://www.100md.com
[15] Chudler EH, Suguyama K, Dong WK. Nociceptive responses in the neostriatum and globus pallidus of the anesthetized rat[J]. J Neuro-physiol, 1993, 69(6):1890~903.
[15] Lubbert H, Hoffman BJ, Snutch TP et al. cDNA cloning of a serotonin 5-HT1C receptor by electrophysiological assays of mRNA-injected Xenopus oocytes[J]. Proc Natl Acad Sci USA, 1987, 84(12):4332~9.
[16] Ogren SO. Forebrain serotonin and avoidance learning: behavioral and biochemical studies on the acute effect of p-chloroamphetamine on one-way active avoidance learning in the male rat[J]. Pharmacol Biochem Behav, 1982, 16(6):881~9.
, 百拇医药
[17] Ogren SO. Evidence for a role of brain serotonergic neurotransmission in avoidance learning[J]. Acta Physiol Scand Supp, 1985, 544:1~7.
[18] Kubo T, Shibanoki S, Matsumoto A et al. Portacaval anastomosis attenuates the impairing effect of cyproheptadine on avoidance learning in rat--an involvement of the serotonergic system[J]. Behav Brain Res, 1988, 30(3):279~88.
[19] Papolos DF, Yu YM, Rosenbaum E et al. Modulation of learned helplessness by 5-hydroxytryptamine 2A receptor antisense oligode-oxynucleotides[J]. Psychiatry Res, 1996, 63(2-3):197~203
[20] Normile HJ, Altman HJ. Effects of combined acetylcholinesterase inhibition and serotonergic receptor blockade on age-associated memory impairments in rats[J].Neurobiology Aging, 1992, 13(6):735~40.
1999-09-28, 百拇医药
单位:张魁华(第一军医大学神经科学研究所,珠江医院,广东 广州 510282);舒斯云(第一军医大学神经科学研究所,珠江医院,广东 广州 510282);包新民(第一军医大学神经科学研究所,珠江医院,广东 广州 510282);徐重(第一军医大学神经科学研究所,珠江医院,广东 广州 510282)
关键词:5-HT2A受体;纹状体边缘区;原位杂交;免疫组织化学
第一军医大学学报000311 摘要:目的 已知纹状体边缘区内有密集的五羟色胺(5-HT)纤维及终末分布,在此认识的基础上观察5-HT2A 受体mRNA是否在大鼠纹状体边缘区内表达,从基因分子水平和细胞水平进一步证明大鼠纹状体边缘区能否合成5-HT2A受体。方法 用地高辛标记的寡核苷酸探针进行原位杂交,研究大鼠纹状体边缘区内5-HT2A 受体mRNA的表达及分布。结果 原位杂交结果发现,5-HT2A受体 mRNA阳性杂交信号在纹状体内的分布不均匀,尾壳核内只有少量中等大小的阳性胞体,苍白球内也只有少量较大的阳性胞体,而在尾壳核和苍白球之间的边缘区部位则可见许多中等大小的梭形阳性神经元胞体,并呈现密集的带状分布。免疫组织化学结果观察到5-HT受体阳性神经元胞体在纹状体内的分布与原位杂交结果一致。结论 推测大鼠纹状体边缘区内可以合成5-HT2A受体,具有接受和整合5-HT神经递质的功能。
, http://www.100md.com
中图分类号:R741 文献标识码:A 文章编号:1000-2588 (2000)-03-0228-03
Distribution of 5-HT2A receptor in the marginal region of rat striatum
ZHANG Kui-hua, SHU Si-yun, BAO Xin-min, XU Zhong
(Institute of Neuroscience, Zhujiang Hospital, First Military Medical University, Guangzhou 510282, China)
Abstracts: Objective To observe the expression of 5-HT2A receptor mRNA in the marginal region of rat striatum to investigate whether the synthesis of 5-HT2R takes place in the marginal region. Methods The in situ hybridization and immunohistochemical method were used in this study. Results Positive signals of 5-HT2A receptor mRNA hybridization were distributed non-uniformly in the central nervous system. Positive neurons were present in the marginal region of rat striatum, as also confirmed by immunohistochemical examination. Conclusion The 5-HT2A receptor could be synthesized in the marginal region of rat striatum.
, 百拇医药
Key words: 5-HT2A receptor; marginal division; in situ hybridization; immunohistochemistry
五羟色胺(5-HT)是脑内一种重要的神经递质。5-HT胞体位于脑干的中缝核群,它发出的投射纤维广泛分布于脑的各部。5-HT从突触释放后,一方面作用于受体,另一方面通过突触前膜上的5-HT转运体重新被摄取。近来的研究报道[1, 2]5-HT可能与精神机能(受体亚型可能是5-HT1A、5-HT2、5-HT3)、学习记忆(受体亚型可能是5-HT1A、5-HT1B、5-HT2、5-HT3)、痛觉传导的控制(受体亚型可能是5-HT1B、5-HT2、5-HT3)及呕吐调节(受体亚型是5-HT3)等有关。
纹状体边缘区(Marginal division,MrD)是舒斯云等[3, 4]自1987年以来先后在大鼠、猫和猴等哺乳动物脑的纹状体尾侧,环绕苍白球外侧处发现的一层梭形细胞区。该区富含P物质(SP)、5-HT、脑啡肽和神经降压肽等免疫阳性物质 [5~8]。它和Meynert基底核及黑质等部位有纤维联系[9~11]。迷宫行为实验证明边缘区的功能可能与大鼠的学习记忆有关[12~14]。Chudler等[15]发现大鼠对伤害性反应的神经元集中在纹状体边缘区部位,认为该区和痛觉有关。纹状体边缘区的学习记忆和痛觉功能可能与边缘区中存在多种神经肽和单胺类物质有关(如SP和5-HT等)。另外,我们以前的研究曾观察到纹状体边缘区内有密集的SP和5-HT免疫阳性纤维及终末分布[5, 6]。但边缘区中有关这些神经递质的靶区- 受体的分布尚不清楚。为了进一步研究纹状体边缘区中与学习记忆及痛觉有关的神经递质的受体分布,观察5-HT2A mRNA是否在大鼠纹状体边缘区内表达,从基因分子水平和细胞水平证明大鼠纹状体边缘区能否合成5-HT2AR。本实验用地高辛标记的寡核苷酸探针,用原位杂交(ISH)和免疫组织化学技术研究了5-HT2A受体阳性反应在纹状体边缘区中的分布。
, http://www.100md.com
1 材料和方法
1.1 实验动物
18只雄性SD大鼠,体质量200~250 g(第一军医大学实验动物中心提供)。用颗粒型大鼠饲料喂养,饮用自来水,动物房温度8~26℃,光暗周期为12: 12 h。实验前在上述条件下喂养2 d。腹腔内注射10%的水合氯醛(4 ml/ kg× b.w.)麻醉后开胸,经左心室通过升主动脉快速输入0.9%生理盐水100 ml (室温),继而快速输入4%的多聚甲醛磷酸缓冲液(PBS)200 ml(4 ℃ ),再缓慢滴注4%的多聚甲醛PBS 300 ml。开颅取脑,放置于30%蔗糖PBS(pH 7.4,4 ℃)直至沉底。冰冻连续切片(40 μm)。将切片分成3套,1套做5-HT2A 受体的寡核苷酸探针地高辛标记的原位杂交、1套做5-HT受体的多克隆抗体的免疫组织化学、另1套作为对照。
1.2 原位杂交
, 百拇医药
1.2.1 5-HT2A 受体cDNA探针的制备 参照文献[6],它的两段特异性核苷酸片段序列分别为:a,5`-CAT GCC TCT CCA TTC TTC ATC TTC AGG AA-3`;b,5`-CAA GGT GGC TTC TTT CTG AAG TGA CTT GA-3`。由中国科学院上海生化所DNA合成室合成上述5-HT2A受体 cDNA寡核苷酸探针。按非放射性DNA标记及检测试剂盒(Boehringer Mannheim公司)说明的方法将半抗原地高辛配基标记到5-HT2A受体 cDNA寡核苷酸上。标记后的探针用DNA斑点杂交试验进行灵敏度检测合格,- 20 oC保存备用。
1.2.2 原位分子杂交 以下各步骤直至杂交后,所有容器和称量、搅拌等物品均经酸泡及冲洗干净后,置160 oC~200 oC中8 h。配制液体的四蒸水用DEPC处理后,高压灭菌。
1.2.2.1 杂交前处理 将冰冻切片放入反应板内,PBS漂洗4次,每次5 min。PTW漂洗4次,每次15 min。加入不含探针的杂交液(内含50% Formamide、5´ SSC、200 g/L Blocking agent、50 g/L肝素、0.1% Tween-20)预杂交1.5 h(41℃水浴)。
, 百拇医药
1.2.2.2 杂交反应 在反应板内加入0.3 ml/孔含1 mg/L探针杂交液,每孔加入6~8张切片,置41 oC水浴箱中孵育16 h (或过夜)。然后用不含探针的杂交液漂洗2次,每次15 min,PTW漂洗4次,每次15 min,PBT漂洗4次,每次15 min。加入1:200抗地高辛抗体 (PBT稀释),置室温2 h, PBT、SMT各漂洗4次,每次5 min,用NBT和PCIT显色剂(1:100)放置4 oC冰箱中显色,每隔15 min检查1次,直至显色良好为止(2~3 h)。PBS漂洗2次后,用0.5%的明胶贴片,干燥后脱水、透明、封片,Olympus AH-3显微镜观察、照相。
1.2.3 设立对照组 设立RNA消化酶对照、5-HT2A受体 cDNA寡核苷酸对照及空白对照组。
1.3 免疫组织化学
(1) 0.01 mol/L PBS (pH 7.4) 漂洗 3´ 10 min;(2) 0.3% TritonX-100/PBS 37 oC孵育30 min;(3) 0.01 mol/L PBS (pH 7.4) 漂洗 3´ 10 min; (4) 加入一抗(5-HT受体抗体, 第四军医大学组胚教研室,1:100)置湿盒中4 oC, 48 h;(5) 0.01 mol/L PBS (pH7.4) 漂洗3´ 10 min;(6) 加入Biotinyted-IgG (Anti-rabbit,1:200) 置湿盒中室温, 3 h;(7) 0.01 mol/L PBS (pH 7.4) 漂洗 3´ 10 min;(8) 加入ABC复合物 (1:100, Vector) 置湿盒中于室温反应 2 h;(9) GDN法 (葡萄糖氧化酶-DAB-硫酸镍胺) 显色,室温30 min;(10) 明胶贴片、干燥、脱水、透明,DPX封片后在 Olympus AH-3显微镜下观察,照相。
, 百拇医药
1.4 空白对照组
用血清稀释液代替抗5-HT血清进行上述免疫组织化学步骤。
2 结果
地高辛标记的5-HT2A受体杂交阳性反应物呈蓝色或紫黑色颗粒状,主要位于核周围胞浆和树突基部,呈弥散或块状分布。纹状体内的5-HT2A受体阳性神经元分布不均匀,尾壳核中只有少量中等大小的多极形5-HT2A受体阳性胞体,苍白球内只有少量较大的多极形5-HT2A受体阳性胞体。但在尾壳核和苍白球之间的边缘区部位可见较多中等大小的5-HT2A受体阳性梭形细胞,并密集排列呈带状分布,梭形细胞的长轴主要呈背腹方向行走(图1,2)。边缘区内的5-HT2A受体阳性胞体向腹侧和中央杏仁核中的5-HT2A受体阳性细胞相连续,形成一条密集的连接带。此外,在大脑皮层、海马、杏仁核、丘脑下部等部位也观察到较多的5-HT2A受体阳性神经元胞体。

, 百拇医药
大鼠脑显微照相。标尺=50 μm。Microphotographs of rat brain.
Bar=50 μm. Cpu: caudate putamen; GP: globus pallidus; MrD: marginal region
图1 5-HT2A 受体 mRNA 在纹状体边缘区部位的表达
Fig.1 The expression of 5-HT2A receptor mRNA in the striatum
5-HT2A receptor mRNA-positive fusiform cells abounding in the marginal division,locating between the caudate putamen and globus pallidus.

, 百拇医药
图2 图1的放大, 示边缘区(MrD)中的5-HT2A 受体阳性梭形细胞
Fig 2 A magnification of Fig.1, showing the 5-HT2A receptor
mRNA-positive fusiform cells in the marginal region
免疫组化检查可见5-HT受体免疫反应物呈紫蓝色,位于阳性神经元胞体的核周及突起内。尾壳核和苍白球内只见少量多极形阳性胞体,而在尾壳核和苍白球之间的边缘区部位则可见较多中等大小的梭形阳性胞体,呈密集的带状分布,梭性细胞的走向主要呈背腹方向(图3,4)。阳性细胞分布的情况和原位杂交的结果相似。另外,在大脑皮层、海马、杏仁核和下丘脑等处也可见较多的5-HT受体阳性胞体分布。

, 百拇医药
图3 5-HT受体免疫组化阳性胞体在纹状体及苍白球中的少量分布
Fig. 3 Sparse distribution of neurons showing positive immunoreaction
for 5-HT receptor in the striatum and globus pallidus
A lot of 5-HT receptor-positive fusiform cells in the marginal division,locating between the caudate putamen and globus pallidus.
The positive neurons arrange densely and show a belt shape.

, 百拇医药
图4 图3的放大, 示纹状体边缘区(MrD)中的5-HT受体阳性梭形细胞
Fig 4 A magnification of Fig 5, showing the 5-HT receptor-positive
fusiform cells in the marginal division
对照组试验未见5-HT受体阳性神经元胞体。
3 讨论
释放5-HT的神经细胞仅位于脑干中缝的几组核团,但它们发出的投射纤维则分布于大脑皮质、皮质下区、小脑、脑干及脊髓等广大部位的脑区。同样,5-HT受体也广泛分布于整个中枢神经系统。舒斯云等[4]曾观察到纹状体边缘区有许多5-HT纤维和终未,但对边缘区内有无5-HT受体存在尚未见报道。本研究用5-HT2A受体原位杂交方法显示纹状体边缘区内有较多的5-HT2A受体 mRNA存在,并用免疫组化方法观察到有5-HT受体的蛋白表达,说明纹状体边缘区能接受外来5-HT神经递质的调控,并参与其功能的调制。5-HT2A受体被认为是典型的5-HT受体,在海马、杏仁核、额叶皮质和梨状内嗅皮质等部位分布密集。5-HT受体可偶联G蛋白,与磷脂酶相联,引起磷脂的代谢变化,从而引导一系列生理生化过程的形成,包括LTP等。Ogren等[17, 18]报道应用一种5-HT释放剂(p chloroam phetamine,PCA)注射后能显著降低大脑皮层、海马及纹状体中的5-HT水平,产生剂量依赖性逃避学习及保持功能的损害,推测脑中的5-HT在逃避性学习中起重要作用,推测5-HT及其受体(主要是5-HT2A)是中枢神经系统产生和保留学习记忆的一个重要因素。Kubo 等[19]报道学习记忆是一个时间获得过程,而这个过程由中枢神经系统5-HT及其受体机制的介导产生。Papolos 等[20]向大鼠脑室内注射5-HT2A反义寡核苷酸后,半数大鼠出现学习困难,海马CA3中5-HT2A受体密度降低,认为中枢5-HT可经5-HT2A受体介导,参与调节行为。Normile 等[21]用5-HT2A拮抗剂ketanserin和乙酰胆硷酯酶抑制剂physostigmine均能增强大鼠的记忆能力,两者联合使用比单独使用效果更好,证明5-HT 和ACh系统在学习记忆过程中是互相作用的。我们曾证明大鼠纹状体边缘区与学习记忆有关[9]。本研究又证明纹状体边缘区中有较多的5-HT2A受体mRNA及5-HT受体蛋白的表达。进一步证明了纹状体边缘区和学习记忆功能有密切关系。推测5-HT递质及其受体的介导作用可能是纹状体边缘区参与学习记忆过程的一个重要因素。
, 百拇医药
国家自然科学基金(39770250)及广东省自然科学基金(950554)资助
张魁华(1966-),男,1999年毕业于第一军医大学,现为广州中医药大学博士后
参考文献
[1] Peroutka SJ. 5-HT receptor: past, present and future[J].Trends Neurosci, 1995, 18(2):68~9.
[2] Meneses A, Hong E. Effect of fluoxetine on learning and memory involves multiple 5-HT systems[J]. Pharmacol Biochem Behav, 1995, 52(2):341~6.
, 百拇医药 [3] Shu SY, Penny GR, Peterson GM. The “marginal division”, a new subdivision in the neostriatum of the rat[J]. J Chem Neuroanat, 1988, 1:147~55.
[4] Shu SY, Bao XM, Zhang CY et al. A new subdivision, marginal division, in the neostriatum of the monkey brain. Neurochemical Research, 2000, 25(2):231~9.
[5] Shu SY, McGinty JF, Peterson GM. High density of zinc-containing and substance P-immunoreactive terminals in the marginal division of rat striatum[J]. Brain Res Bull, 1990, 24(2):201~5.
, 百拇医药
[6] 包新民, 舒斯云. 大鼠纹状体边缘区内P物质、脑啡肽和胆囊收缩素免疫阳性反应的分布[J]. 解剖学杂, 1997, 13(2):107~10.
[7] 舒斯云, 包新民.大鼠纹状体边缘区内P物质阳性终末的突触特征[J].第一军医大学学报, 1991,11:283~6.
[8] 李耀宇, 舒斯云, 包新民等. 降钙素基因相关肽在纹状体及边缘区内分布及联系的研究[J].第一军医大学学报, 1999, 19(3): 201~4.
[9] 舒斯云, 包新民.大鼠纹状体边缘区内传人投射细胞的免疫组织化学特性[J]. 解剖学杂志, 1993, 16: 509~11.
[10] Shu SY, Bao XM, Li SX. The afferent connection and its immuno- histochemical characteristics of the marginal division in rat corpus striatum[J]. J Med Coll PLA, 1995, 10:259~63.
, http://www.100md.com
[11] 包新民, 舒斯云, 李胜修等. 海人藻酸注射大鼠Meynert基底核后 c-Fos原癌基因蛋白在脑纹状体边缘区及边缘系统内的表达[J]. 第一军医大学学报, 1999, 19(3):193~6.
[12] 舒斯云, 包蓉, 包新民等. 大鼠纹状体边缘区与Meynert氏基底核的突触联系及其与学习和记忆功能的关系[J]. 中国组织化学与细胞化学杂志, 1998, 7(1):1~11.
[13] 李胜修, 舒斯云, 包新民等. 海人藻酸破坏纹状体边缘区后对大鼠学习和记忆功能影响的研究[J]. 神经解剖学杂志, 1993; 12(1):37
[14] 曾建新, 舒斯云, 包新民等. 大鼠纹状体边缘区神经元中乙酰胆碱激活的离子通道特性[J]. 第一军医大学学报, 1999, 19(4):308~11.
, http://www.100md.com
[15] Chudler EH, Suguyama K, Dong WK. Nociceptive responses in the neostriatum and globus pallidus of the anesthetized rat[J]. J Neuro-physiol, 1993, 69(6):1890~903.
[15] Lubbert H, Hoffman BJ, Snutch TP et al. cDNA cloning of a serotonin 5-HT1C receptor by electrophysiological assays of mRNA-injected Xenopus oocytes[J]. Proc Natl Acad Sci USA, 1987, 84(12):4332~9.
[16] Ogren SO. Forebrain serotonin and avoidance learning: behavioral and biochemical studies on the acute effect of p-chloroamphetamine on one-way active avoidance learning in the male rat[J]. Pharmacol Biochem Behav, 1982, 16(6):881~9.
, 百拇医药
[17] Ogren SO. Evidence for a role of brain serotonergic neurotransmission in avoidance learning[J]. Acta Physiol Scand Supp, 1985, 544:1~7.
[18] Kubo T, Shibanoki S, Matsumoto A et al. Portacaval anastomosis attenuates the impairing effect of cyproheptadine on avoidance learning in rat--an involvement of the serotonergic system[J]. Behav Brain Res, 1988, 30(3):279~88.
[19] Papolos DF, Yu YM, Rosenbaum E et al. Modulation of learned helplessness by 5-hydroxytryptamine 2A receptor antisense oligode-oxynucleotides[J]. Psychiatry Res, 1996, 63(2-3):197~203
[20] Normile HJ, Altman HJ. Effects of combined acetylcholinesterase inhibition and serotonergic receptor blockade on age-associated memory impairments in rats[J].Neurobiology Aging, 1992, 13(6):735~40.
1999-09-28, 百拇医药