运动状态下骨骼肌细胞线粒体膜电位的变化与细胞凋亡
作者:郑师陵 王建军 王青 张明
单位:郑师陵 王建军 王青(河北省人民医院临床医学研究中心 石家庄 050051);张明(河北医科大学解剖学教研室)
关键词:细胞衰老;生理学;线粒体,肌;细胞学;运动;生理学;流式细胞术;方法;大鼠
河北医科大学学报000306
摘 要 目的 研究运动大鼠骨骼肌细胞线粒体膜电位的变化与细胞凋亡的关系。方法 用流式细胞仪(flow cytometry,FCM)检测肌细胞线粒体膜电位、DNA倍体分析及脱氧核糖核苷酸末端转移酶介导的缺口末端标记技术(terminal deoxynucleotidyl transferase mediated d-UTP nick end labeling, TUNEL)。结果 线粒体膜电位在游泳运动后第1周降低,第2周后开始明显增高,第3周略有降低,运动后各组的DNA均出现亚“G1”峰即凋亡峰。TUNEL显示,运动后第1周凋亡比例最高,第2周后比例降低。结论 运动引起线粒体膜电位的改变,该方法快速、特异性强、灵敏度高。
, 百拇医药
中图号 R337.1
MITOCHONDRIAL MEMBRANE POTENTIAL
CHANGE AND APOPTOSIS OF
MUSCULAR CELL DURING EXERCISE
Zheng Shiling Wang Jianjun Wang Qing Zhang Ming
(Research Center Clinical Medicine of,Hebei Province People's Hospital
Shijiazhuang 050051)
ABSTRACT Objective To investigate the relationship between mitochondrial membrane potential change, and apoptosis of muscular cells in rats after exercise.Methods Mitochondrial membrane potential in the muscular cell was determined with analysis of DNA double by the technique of flow cytometry,and terminal deoxynucleotidyl transferase d-UTP nick end labelling(TUNEL) test was conducted. Results The mitochondrial membrane potential decreased in one week, then increased markedly in two weeks, and it become much lower compared with control by three weeks after exercise. DNA double analysis demonstrated that sub-G1 namely apoptosis peak appeared at different level in three groups after exercise. TUNEL showed that the apoptosis rats augmented after exercise compared with control rats, and the rate reached the highest value after one week.Conclusion Exercise may cause mitochondrial membrane potential change and induce muscular cell apoptosis.The procedures of these measurements are performed quickly with high specificity and sensitivity.
, http://www.100md.com
MeSH cell aging/physiol;mitochondria,muscle/cytol;exercise/physiol;flow cytometry/methods;rats▲
研究表明生物体内外多种因素可影响细胞凋亡的发生和发展,机体可通过凋亡清除衰老的细胞并代之以富有活力的新生细胞,而保证器官的正常功能状态。适量的运动可以提高机体的有氧工作能力,改善氧化磷酸化功能,运动状态下肌肉细胞线粒体膜电位的变化及是否诱发凋亡,目前报道的不多。本研究通过观测线粒体功能的改变,DNA倍体分析及原位末端标记技术,建立了1套细胞凋亡的检测方法,可用于探讨不同运动量与细胞凋亡间的关系。
1 材料与方法
1.1 材料:雄性SD种大鼠40只,体质量(200±10) g,随机分为对照组和运动组,运动组分为运动后第1周、2周、3周共3组,每组10只,进行游泳训练,水温(26±1) ℃,水深55 cm,每周游泳6 d,30 min/d,每组训练后立即断头处死,迅速取出后肢骨骼肌,参照文献[1]制备成单细胞悬液,部分采用常规石蜡包埋。
, 百拇医药
1.2 试剂与仪器:Rhodamine 123 购自美国Bioteam laboratories;PI,蛋白酶K,Sigina公司;TUNEL试剂盒为德国Boehringer Mannheim公司产品;FACS Vantage流式细胞仪,美国BD公司;超高倍多媒体显微镜,清华同方。
1.3 方法
1.3.1 线粒体膜电位检测:取肌细胞悬液2×109/L,加入等体积的亲脂性的阳离子荧光染料Rhodamine 123,使其最终浓度为25 μmol/L,37 ℃避光孵育30 min,PBS洗2次,1 000 r/min离心10 min,FCM检测,488 nm激光激发,发射波长为534 nm,每份样本获取10 000个细胞,Cell Quest软件分析。
1.3.2 DNA倍体分析:取肌细胞悬液2×109/L,70 %冷乙醇固定-20 ℃留置2 h,将固定液弃去,PBS洗涤2次,用PI一步染色法4 ℃避光染色30 min,上机,FCM检测,488 nm激光激发,获取前用2 μm beads 调仪器的CV值小于2,每份样本获取10 000个细胞。
, 百拇医药
1.3.3 TUNEL染色:石蜡切片脱蜡水化,采用蛋白酶K 20 mg/L消化15 min,2 % H2O2溶液灭活内源性过氧化物酶活性,PBS洗3次,加入末端脱氧核苷酸转移酶(terminal deoxynucleotodyl transfase,TdT)缓冲液,湿盒37 ℃孵育1 h,PBS洗3次,加入过氧化物酶标记的抗地高辛抗体,湿盒37 ℃孵育30 min,PBS洗3次,DAB显色,甲绿复染,树胶封片,光镜下每张切片计数1 000个细胞,计算阳性凋亡细胞的百分数,上述步骤中以不加TdT酶为阴性对照,DNAseI诱导的组织为阳性对照,光镜下可见正常的骨骼肌细胞为蓝绿色,凋亡细胞显示出特异性的棕黄色。
2 结 果
2.1 肌细胞线粒体膜电位:游泳运动后第1周线粒体膜电位较对照组减低,第2周最高,与对照组相比有显著性差异。运动后第2周、第3周与运动第1周组比较P<0.05,运动第3周与对照组和运动第2周组比较,差异不显著P>0.05,见表1。
, 百拇医药
表1 大鼠运动训练前后线粒体膜电位变化
Table 1 Mitochondrial membrane potential changes
after exercise
(n=10,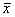 ±s,CB/μmol.L-1)
±s,CB/μmol.L-1)
Groups
Mitochondrial membrane potential(μmol/L)
Control
34.74±4.08
, 百拇医药
One week
23.04±7.46
Two weeks
85.58±11.86*△
Three weeks
57.95 ±10.87△○
P<0.05 vs control by t test ○ P<0.05 vs two weeks by t test
△ P<0.05 vs one week by t test2.2 DNA倍体分析:游泳运动训练组在DNA二倍体G0/G1期前均可看到亚“G1”峰,证实有细胞凋亡出现,而对照组没有凋亡峰(图1)。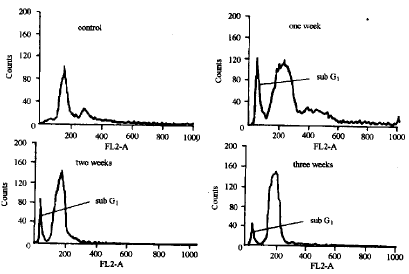
, 百拇医药
图1 DAN倍体分析
Figure 1 DNA double analysis
2.3 TUNEL染色:游泳运动训练后大鼠骨骼肌细胞中呈棕黄色的凋亡细胞明显增加,运动后第1周比例最高,运动后第2周开始下降,但运动后第2、3周组与对照组比仍有显著性差异,见表2。
表2 大鼠运动训练前后骨骼肌凋亡细胞的数量
Table 2 Apoptosis muscular cells after exercise
(n=10,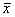 ±s,%) Groups
±s,%) Groups
Apoptosis
, 百拇医药
Control
11.07±1.14
One week
37.75±3.5*
Two weeks
24.60±3.85*△
Three weeks
23.46±3.97*△
*P<0.05 vs control by t test △ P<0.05 vs one week by t test
3 讨 论
, 百拇医药
细胞凋亡可以被多种生理性、病理性刺激诱发,是细胞对所处环境中某些特定信息的1种应答反应,是保证个体发育成熟所必需的,贯穿于全部生命周期中。线粒体是促进能量转换,参与细胞凋亡的重要细胞器,由于细胞膜上各种生物泵的作用,使细胞膜内外维持着不同梯度的离子浓度,产生细胞膜电位。
Rhodamine 123对线粒体膜电位非常敏感,其荧光增强说明线粒体数量的增多和线粒体内电负性的增强。运动后第1周线粒体膜电位降低,说明开始过量运动会引起心肌、骨骼肌线粒体磷脂含量下降及膜的流动性下降,运动后第2周线粒体膜电位明显升高,第3周逐渐降低,但仍高于对照组,说明有规律的运动训练达到一定程度后,不仅使肌细胞氧化磷酸化功能增强,还可使有氧代谢功能储备增加。长期的有氧运动训练可使线粒体产生适应性改变,有报道大鼠在运动训练8周后肌细胞线粒体密度及肌原纤维比值明显高于对照组[2]。在线粒体中ADP磷酸化转为ATP,而ATP降低到一定量时,细胞将发生凋亡。近几年的资料已从多方面证明线粒体参与对凋亡的调控[3,4],正常的膜电位是细胞生存所必需的,膜电位下降的细胞将不可避免的发生凋亡。因为在凋亡的早期阶段,电子从线粒体膜的漏出靠NADH流入增加,使细胞膜保持完整,而在凋亡的后期,NADH流入的增加已无法维持线粒体膜电位[5],使胞浆内大量以底物形式存在的NADH不能进入呼吸链而堆积,导致线粒体氧化利用能力降低,ATP缺失而细胞死亡,这种死亡不同于病理性的细胞坏死。本研究通过TUNEL也证实了运动后第1周凋亡细胞比例最高,而伴随着膜电位的下降,第2周后明显升高,第3周后逐渐下降,但仍高于对照组。说明运动引起膜电位的改变而导致细胞凋亡。
, http://www.100md.com
本实验中,应用流式细胞仪测定线粒体膜电位及进行DNA倍体分析,可在短时间内对大量细胞进行定性、定量分析,FACS Vantage具有分析细胞数量多,敏感性高,速度快的优点,加之应用了Ansari等[6]发展的细胞凋亡原位末端脱氧核糖核酸转移酶法,用TdT酶使标记的核苷酸在DNA双链的断端延伸,并且不需要膜板的存在[7,8],可以在切片上原位直观地检测细胞凋亡,更增强了它的特异性和灵敏度,既能对细胞是否发生凋亡提供客观依据,也能对凋亡的影响因素及其作用机制的临床基础研究提供可靠的方法。■
参考文献
[1]Diamond LW, Braylon RC. Flow analysis of DNA content and cell size in non-Hodgkin's lymphoma. Cancer Res, 1980, 40(9): 703
, 百拇医药 [2]常芸,林福美,陈子同,等.运动心脏可复性的研究.中国运动医学杂志,1999,18(3):202
[3]Fall C, Bennetl JJ. Visualization of cyclosporion A and Ca2+ sensitive cyclical mitochondrial depolarization in cell culture. Biochim Biophys Acta, 1999, 1410(1):77
[4]Cai J, Wu M , Nelson KC, et al. Oxidant-induced apoptosis in cultured human retinal pigment epithelial cells. Inves Ophthalmol Vis Sci,1999,40(5):959
[5]Martin P, Robert HP. Destection of change in mitochondrial function during apoptosis by simultaneous staining with multiple fluorescent dyes and correlateel multiparameter flow cytometry.Cytomety,1999,35(4):311
, 百拇医药
[6]Ansair B, Coates P, Greenstein B,et al.In situ end labelling detects DNA strand break in apoptosis and other physiological and pathological states.J Pathol, 1993,170(1):1
[7]Gold R,Schmied M,Giegerich G,et al. Differentiation between cellular apoptosis and necrosis by the combined use of in situ tailing and nick translation techniques.Lab Invest,1994,71(2):219
[8]Gavrieli Y,Sherman Y,Ben-Sasson SA,et al. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J Cell Biol,1992,119(3):493
收稿日期:1999-10-15, 百拇医药
单位:郑师陵 王建军 王青(河北省人民医院临床医学研究中心 石家庄 050051);张明(河北医科大学解剖学教研室)
关键词:细胞衰老;生理学;线粒体,肌;细胞学;运动;生理学;流式细胞术;方法;大鼠
河北医科大学学报000306
摘 要 目的 研究运动大鼠骨骼肌细胞线粒体膜电位的变化与细胞凋亡的关系。方法 用流式细胞仪(flow cytometry,FCM)检测肌细胞线粒体膜电位、DNA倍体分析及脱氧核糖核苷酸末端转移酶介导的缺口末端标记技术(terminal deoxynucleotidyl transferase mediated d-UTP nick end labeling, TUNEL)。结果 线粒体膜电位在游泳运动后第1周降低,第2周后开始明显增高,第3周略有降低,运动后各组的DNA均出现亚“G1”峰即凋亡峰。TUNEL显示,运动后第1周凋亡比例最高,第2周后比例降低。结论 运动引起线粒体膜电位的改变,该方法快速、特异性强、灵敏度高。
, 百拇医药
中图号 R337.1
MITOCHONDRIAL MEMBRANE POTENTIAL
CHANGE AND APOPTOSIS OF
MUSCULAR CELL DURING EXERCISE
Zheng Shiling Wang Jianjun Wang Qing Zhang Ming
(Research Center Clinical Medicine of,Hebei Province People's Hospital
Shijiazhuang 050051)
ABSTRACT Objective To investigate the relationship between mitochondrial membrane potential change, and apoptosis of muscular cells in rats after exercise.Methods Mitochondrial membrane potential in the muscular cell was determined with analysis of DNA double by the technique of flow cytometry,and terminal deoxynucleotidyl transferase d-UTP nick end labelling(TUNEL) test was conducted. Results The mitochondrial membrane potential decreased in one week, then increased markedly in two weeks, and it become much lower compared with control by three weeks after exercise. DNA double analysis demonstrated that sub-G1 namely apoptosis peak appeared at different level in three groups after exercise. TUNEL showed that the apoptosis rats augmented after exercise compared with control rats, and the rate reached the highest value after one week.Conclusion Exercise may cause mitochondrial membrane potential change and induce muscular cell apoptosis.The procedures of these measurements are performed quickly with high specificity and sensitivity.
, http://www.100md.com
MeSH cell aging/physiol;mitochondria,muscle/cytol;exercise/physiol;flow cytometry/methods;rats▲
研究表明生物体内外多种因素可影响细胞凋亡的发生和发展,机体可通过凋亡清除衰老的细胞并代之以富有活力的新生细胞,而保证器官的正常功能状态。适量的运动可以提高机体的有氧工作能力,改善氧化磷酸化功能,运动状态下肌肉细胞线粒体膜电位的变化及是否诱发凋亡,目前报道的不多。本研究通过观测线粒体功能的改变,DNA倍体分析及原位末端标记技术,建立了1套细胞凋亡的检测方法,可用于探讨不同运动量与细胞凋亡间的关系。
1 材料与方法
1.1 材料:雄性SD种大鼠40只,体质量(200±10) g,随机分为对照组和运动组,运动组分为运动后第1周、2周、3周共3组,每组10只,进行游泳训练,水温(26±1) ℃,水深55 cm,每周游泳6 d,30 min/d,每组训练后立即断头处死,迅速取出后肢骨骼肌,参照文献[1]制备成单细胞悬液,部分采用常规石蜡包埋。
, 百拇医药
1.2 试剂与仪器:Rhodamine 123 购自美国Bioteam laboratories;PI,蛋白酶K,Sigina公司;TUNEL试剂盒为德国Boehringer Mannheim公司产品;FACS Vantage流式细胞仪,美国BD公司;超高倍多媒体显微镜,清华同方。
1.3 方法
1.3.1 线粒体膜电位检测:取肌细胞悬液2×109/L,加入等体积的亲脂性的阳离子荧光染料Rhodamine 123,使其最终浓度为25 μmol/L,37 ℃避光孵育30 min,PBS洗2次,1 000 r/min离心10 min,FCM检测,488 nm激光激发,发射波长为534 nm,每份样本获取10 000个细胞,Cell Quest软件分析。
1.3.2 DNA倍体分析:取肌细胞悬液2×109/L,70 %冷乙醇固定-20 ℃留置2 h,将固定液弃去,PBS洗涤2次,用PI一步染色法4 ℃避光染色30 min,上机,FCM检测,488 nm激光激发,获取前用2 μm beads 调仪器的CV值小于2,每份样本获取10 000个细胞。
, 百拇医药
1.3.3 TUNEL染色:石蜡切片脱蜡水化,采用蛋白酶K 20 mg/L消化15 min,2 % H2O2溶液灭活内源性过氧化物酶活性,PBS洗3次,加入末端脱氧核苷酸转移酶(terminal deoxynucleotodyl transfase,TdT)缓冲液,湿盒37 ℃孵育1 h,PBS洗3次,加入过氧化物酶标记的抗地高辛抗体,湿盒37 ℃孵育30 min,PBS洗3次,DAB显色,甲绿复染,树胶封片,光镜下每张切片计数1 000个细胞,计算阳性凋亡细胞的百分数,上述步骤中以不加TdT酶为阴性对照,DNAseI诱导的组织为阳性对照,光镜下可见正常的骨骼肌细胞为蓝绿色,凋亡细胞显示出特异性的棕黄色。
2 结 果
2.1 肌细胞线粒体膜电位:游泳运动后第1周线粒体膜电位较对照组减低,第2周最高,与对照组相比有显著性差异。运动后第2周、第3周与运动第1周组比较P<0.05,运动第3周与对照组和运动第2周组比较,差异不显著P>0.05,见表1。
, 百拇医药
表1 大鼠运动训练前后线粒体膜电位变化
Table 1 Mitochondrial membrane potential changes
after exercise
(n=10,
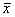 ±s,CB/μmol.L-1)
±s,CB/μmol.L-1)Groups
Mitochondrial membrane potential(μmol/L)
Control
34.74±4.08
, 百拇医药
One week
23.04±7.46
Two weeks
85.58±11.86*△
Three weeks
57.95 ±10.87△○
P<0.05 vs control by t test ○ P<0.05 vs two weeks by t test
△ P<0.05 vs one week by t test2.2 DNA倍体分析:游泳运动训练组在DNA二倍体G0/G1期前均可看到亚“G1”峰,证实有细胞凋亡出现,而对照组没有凋亡峰(图1)。

, 百拇医药
图1 DAN倍体分析
Figure 1 DNA double analysis
2.3 TUNEL染色:游泳运动训练后大鼠骨骼肌细胞中呈棕黄色的凋亡细胞明显增加,运动后第1周比例最高,运动后第2周开始下降,但运动后第2、3周组与对照组比仍有显著性差异,见表2。
表2 大鼠运动训练前后骨骼肌凋亡细胞的数量
Table 2 Apoptosis muscular cells after exercise
(n=10,
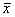 ±s,%) Groups
±s,%) GroupsApoptosis
, 百拇医药
Control
11.07±1.14
One week
37.75±3.5*
Two weeks
24.60±3.85*△
Three weeks
23.46±3.97*△
*P<0.05 vs control by t test △ P<0.05 vs one week by t test
3 讨 论
, 百拇医药
细胞凋亡可以被多种生理性、病理性刺激诱发,是细胞对所处环境中某些特定信息的1种应答反应,是保证个体发育成熟所必需的,贯穿于全部生命周期中。线粒体是促进能量转换,参与细胞凋亡的重要细胞器,由于细胞膜上各种生物泵的作用,使细胞膜内外维持着不同梯度的离子浓度,产生细胞膜电位。
Rhodamine 123对线粒体膜电位非常敏感,其荧光增强说明线粒体数量的增多和线粒体内电负性的增强。运动后第1周线粒体膜电位降低,说明开始过量运动会引起心肌、骨骼肌线粒体磷脂含量下降及膜的流动性下降,运动后第2周线粒体膜电位明显升高,第3周逐渐降低,但仍高于对照组,说明有规律的运动训练达到一定程度后,不仅使肌细胞氧化磷酸化功能增强,还可使有氧代谢功能储备增加。长期的有氧运动训练可使线粒体产生适应性改变,有报道大鼠在运动训练8周后肌细胞线粒体密度及肌原纤维比值明显高于对照组[2]。在线粒体中ADP磷酸化转为ATP,而ATP降低到一定量时,细胞将发生凋亡。近几年的资料已从多方面证明线粒体参与对凋亡的调控[3,4],正常的膜电位是细胞生存所必需的,膜电位下降的细胞将不可避免的发生凋亡。因为在凋亡的早期阶段,电子从线粒体膜的漏出靠NADH流入增加,使细胞膜保持完整,而在凋亡的后期,NADH流入的增加已无法维持线粒体膜电位[5],使胞浆内大量以底物形式存在的NADH不能进入呼吸链而堆积,导致线粒体氧化利用能力降低,ATP缺失而细胞死亡,这种死亡不同于病理性的细胞坏死。本研究通过TUNEL也证实了运动后第1周凋亡细胞比例最高,而伴随着膜电位的下降,第2周后明显升高,第3周后逐渐下降,但仍高于对照组。说明运动引起膜电位的改变而导致细胞凋亡。
, http://www.100md.com
本实验中,应用流式细胞仪测定线粒体膜电位及进行DNA倍体分析,可在短时间内对大量细胞进行定性、定量分析,FACS Vantage具有分析细胞数量多,敏感性高,速度快的优点,加之应用了Ansari等[6]发展的细胞凋亡原位末端脱氧核糖核酸转移酶法,用TdT酶使标记的核苷酸在DNA双链的断端延伸,并且不需要膜板的存在[7,8],可以在切片上原位直观地检测细胞凋亡,更增强了它的特异性和灵敏度,既能对细胞是否发生凋亡提供客观依据,也能对凋亡的影响因素及其作用机制的临床基础研究提供可靠的方法。■
参考文献
[1]Diamond LW, Braylon RC. Flow analysis of DNA content and cell size in non-Hodgkin's lymphoma. Cancer Res, 1980, 40(9): 703
, 百拇医药 [2]常芸,林福美,陈子同,等.运动心脏可复性的研究.中国运动医学杂志,1999,18(3):202
[3]Fall C, Bennetl JJ. Visualization of cyclosporion A and Ca2+ sensitive cyclical mitochondrial depolarization in cell culture. Biochim Biophys Acta, 1999, 1410(1):77
[4]Cai J, Wu M , Nelson KC, et al. Oxidant-induced apoptosis in cultured human retinal pigment epithelial cells. Inves Ophthalmol Vis Sci,1999,40(5):959
[5]Martin P, Robert HP. Destection of change in mitochondrial function during apoptosis by simultaneous staining with multiple fluorescent dyes and correlateel multiparameter flow cytometry.Cytomety,1999,35(4):311
, 百拇医药
[6]Ansair B, Coates P, Greenstein B,et al.In situ end labelling detects DNA strand break in apoptosis and other physiological and pathological states.J Pathol, 1993,170(1):1
[7]Gold R,Schmied M,Giegerich G,et al. Differentiation between cellular apoptosis and necrosis by the combined use of in situ tailing and nick translation techniques.Lab Invest,1994,71(2):219
[8]Gavrieli Y,Sherman Y,Ben-Sasson SA,et al. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J Cell Biol,1992,119(3):493
收稿日期:1999-10-15, 百拇医药