大肠癌细胞凋亡模型的建立及凋亡细胞内质网膜系统的变化
作者:高丰 宋今丹
单位:高丰(中国医科大学基础医学院细胞生物学教研室,沈阳 110001);宋今丹 (中国医科大学基础医学院细胞生物学教研室,沈阳 110001)
关键词:细胞凋亡;大肠癌细胞;内质网
中国医科大学学报000602 摘要 目的:建立全反式维甲酸(ATRA)诱导人大肠癌细胞凋亡的体外模型,观察凋亡细胞内质网膜系统的变化。方法:应用光镜、透射及扫描电镜、DNA凝胶电泳、流式细胞术及末端脱氧核苷酰转移酶原位标记(TUNEL法),观察维甲酸诱导的人大肠癌CCL229细胞凋亡特征。结果:维甲酸诱导CCL229细胞凋亡,产生典型的形态学改变,在琼脂糖凝胶电泳上呈现特征性的 DNA ladder, DNA直方图上显示亚二倍体峰,具有时间和剂量依赖性。CCL229细胞在被维甲酸诱导成熟分化后发生凋亡。凋亡过程中内质网膜系统的结构与分布变化为:内质网逐渐减少,向核周聚集,部分呈扩张状态,形成大小不等的小泡状或短管状结构。结论:维甲酸诱导细胞凋亡过程中内质网膜系统结构与分布的变化可能与凋亡时内质网蛋白合成的改变有关。
, http://www.100md.com
Colorectal Carcinoma Cell Apoptosis and Morphological Changes of Endoplasmic Reticulum Induced by Retinoic Acid
Gao Feng Song Jindan
(Department of Cell Biology, College of Basic Medical Sciences,China Medical University, Shenyang,110001)
ABSTRACT Objective:We wanted to explain the mode and mechanisms of cell death in human colorectal carcinoma cells induced by treatment with all-trans retinoic acid (ATRA). Methods: In vitro, a model of apoptosis was developed. Apoptosis induced by retinoic acid (RA) in cell line CCL229 was studied by fluorescence microscopy, electron microscopy, agarose gel electrophoresis, flow cytometry, and TdT-mediated dUTP-biotin in situ nick end labeling (TUNEL).Results: ATRA was found to induce apoptosis and extensive DNA fragmentation in the CCL229 cell line as early as 12 hours after treatment. Degradation of the nuclear DNA of apoptotic cells was demonstrated by visualization of “DNA ladders” on gel electrophoresis. DNA flow cyto-fluorimetric analysis showed the appearance of a discrete population of cells containing hypodiploid DNA. A concentrations between 10-5mol/L and 10-8mol/L, RA-treated 229 cells were induced to apoptosis in a dose-and time-dependent manner. During RA-induced apoptosis, there was a gradually decrease and dilatation of ER in the cytoplasm, and dilated vesicular or tubular cisternae of endoplasmic reticulum (ER) were found either in the cytoplasm or in the apoptotic bodies.Conclusion:ATRA induced apoptosis in colorectal carcinoma cells at pharmacologically relevant doses. The changes of structure and distribution of ER induced by RA were probably related to the changes of protein synthesis in ER.
, 百拇医药
KEY WORDS apoptosis; colorectal carcinoma cell; endoplasmic reticulum
细胞凋亡(apoptosis)是具有特殊形态和生化改变的生理性细胞死亡,区别于病理性细胞死亡——坏死(necrosis)[1]。迄今已发现许多抗肿瘤药物能够诱导肿瘤细胞凋亡。全反式维甲酸(all-trans retinoic acid, ATRA)是维生素A的代谢衍生物,能抑制多种肿瘤细胞增殖并具有诱导分化作用。近来研究表明,维甲酸(RA)除可诱导细胞终末分化外,还可以在肿瘤细胞中诱导凋亡[2,3]。本研究应用ATRA在体外诱导人大肠癌CCL229细胞凋亡,建立人大肠癌细胞的凋亡模型,探讨RA诱导细胞分化与凋亡的相关性,并观察了细胞凋亡过程中内质网膜系统的结构及分布变化。
1 材料与方法
1.1 细胞培养与加药处理
, http://www.100md.com
人大肠高分化腺癌细胞系CCL229,单层培养于含10%小牛血清的RPMI1640培养基中。以105/ml浓度接种细胞,培养24 h后给药。全反式维甲酸(Sigma公司产品)以无水乙醇配成10-2mol/L储存液,使用终浓度分别为10-5,10-6,10-7,10-8 mol/L。对照组加等体积无水乙醇(<0.1%,V/V)。实验组每48 h换培养液及RA。药物处理不同时间后收集实验及对照组细胞。
1.2 凋亡细胞形态观察
1.2.1 凋亡细胞荧光染色:将细胞接种于盖片上,用0.025% 丫啶橙(AO)-醋酸溶液染色,荧光显微镜观察。
1.2.2 末端脱氧核苷酰转移酶(TdT)原位标记法(TUNEL):参考 Gavrieli 等的 TdT 原位标记法[4]。
, 百拇医药
1.3 透射电镜观察凋亡细胞超微结构
1.4 细胞DNA提取及琼脂糖凝胶电泳
收集贴壁及悬浮细胞,常规方法提取细胞DNA于1.5%琼脂糖凝胶中电泳。
1.5 凋亡细胞的流式细胞仪检测
按文献[5]方法收集细胞样品,70%冷乙醇4℃固定1 h,RNA酶37℃作用30 min,50 μg/ml碘化丙啶 (PI)4℃染色1 h,FACScan流式细胞仪进行细胞周期DNA含量分析,低于G1期二倍体DNA含量的细胞为凋亡细胞。
2 结果
2.1 RA诱导CCL229细胞凋亡的细胞形态变化
经10-6mol/L RA作用后,荧光显微镜下见CCL229细胞固缩,染色质浓缩凝聚形成凋亡小体(apoptotic body)。TUNEL染色可见凋亡细胞胞核呈棕色或棕褐色着染,表明RA诱导CCL229细胞出现凋亡的形态改变。
, http://www.100md.com
2.2 透射电镜下凋亡细胞内质网膜系统的变化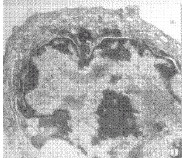
图1 RA 处理24 h,核染色质边集,核周片层状内质网较多,可见轻微扩张 TEM ×14 000
Fig.1 24 h after 10-6 mol/L RA treatment, marginated chromatin and slightly dilated laminar ER were found TEM ×14 000
图2 RA处理72 h,凋亡细胞出泡,其中可见大量明显扩张的内质网形成许多小泡状或短管状结构 TEM ×18 000
Fig.2 72 h after 10-6 mol/L RA treatment, dilated vesicular or tubular cisternae of ER were found either in the cytoplasm or in the
, http://www.100md.com
apoptotic bodies TEM ×18 000
图3 正常培养CCL229细胞为梭形, 有许多微绒毛和小的泡状突起 SEM ×2 400
Fig 3. Microvilli of shuttle-shaped CCL229 cells in culture SEM ×2400
图4 凋亡小体脱离凋亡细胞 SEM ×5 200 Fig.4 Apoptotic body blebbing from apoptotic cell SEM ×5 200
, 百拇医药
图5 凋亡细胞出泡后形成多个大小不等的凋亡小体 SEM ×6 600 Fig.5 Apoptotic bodies blebbing from apoptotic cell SEM ×6 600
透射电镜下,CCL229细胞经10-6mol/L RA处理后,可观察到一系列凋亡特征性的形态学改变。RA诱导初期(12 h),细胞形态向正常分化:细胞变圆,表面微绒毛明显减少。内质网数量增多,形态趋向正常,排列规则形成连续片层状,广泛铺展于整个胞质,附着核糖体增多。可见许多成熟的线粒体。随RA诱导时间的推移,细胞开始表现出凋亡的形态特征:RA作用24 h,核内染色质边集,沿核膜内侧分布,核膜皱褶内陷。核周片层状内质网较多,可见轻微扩张(图1)。RA诱导48 h ,核染色质更加致密,浓缩分块,胞质中有空泡形成。内质网数量逐渐减少,向核周聚集,可见囊泡状扩张的内质网。线粒体形态正常,结构完整,细胞表面微绒毛消失。凋亡后期,细胞表面出泡(blebbing),脱落形成膜包裹的凋亡小体,有些含有固缩的核碎片。在胞质中及凋亡小体中含有内质网,部分形态正常、排列规则,另有相当一部分明显扩张,形成许多大小不等的小泡状或短管状结构(图2),结构仍保持完整。在上述全过程中细胞膜结构也始终保持完整。
, http://www.100md.com
扫描电镜下正常培养CCL229细胞为梭形,有许多微绒毛和丝状伪足(图3)。RA诱导后细胞收缩变圆,表面突起出泡,与正在凋亡的细胞分离(图4),最后形成多个凋亡小体(图5)。
2.3 DNA琼脂糖凝胶电泳
10-8mol/L RA作用CCL229细胞24 h,DNA降解不明显;10-7,10-6,10-5mol/L可诱导产生清晰的 DNA ladder,大小呈约180 bp整数倍递增;且随药物浓度增高,DNA条带的亮度增加,说明RA诱导凋亡的作用呈剂量依赖性增强。另外,10-6mol/L RA处理12~96 h,引起的DNA 断裂程度也随作用时间延长而逐渐增强。
2.4 凋亡细胞的流式细胞仪检测
10-6mol/L RA处理12~96 h,DNA histogram上均出现低于G1期二倍体DNA含量的亚二倍体峰(hypodiploid peak, Ap峰),随时间推移,凋亡峰显著升高。此外流式细胞仪检测也提示不同浓度RA对CCL229细胞凋亡的诱导作用具有剂量反应关系。
, 百拇医药
3 讨论
目前研究凋亡普遍应用的模型是糖皮质激素诱导的胸腺细胞凋亡模型。本研究应用ATRA在体外诱导人大肠癌CCL229细胞凋亡,建立人大肠癌细胞的凋亡模型,以期利用此模型了解RA的作用机制并研究凋亡细胞的结构及功能变化。维甲酸是公认的肿瘤分化诱导剂,对多种肿瘤细胞都有诱导分化作用。本实验结果表明:10-6mol/L ATRA 能显著抑制人大肠癌CCL229细胞生长增殖,同时引起细胞终末分化与凋亡的形态改变。RA作用初期,表现出细胞向成熟分化的趋势。随RA作用时间推移,逐渐表现出凋亡的一系列形态学特征。由此推测,肿瘤细胞在被诱导向终末阶段分化后则将趋向最后死亡,凋亡很可能就是细胞被诱导分化成熟以后的死亡形式,是诱导分化的结局。另外,DNA凝胶电泳、FACS DNA含量分析也提示RA诱导凋亡表现出时间和剂量依赖性。
细胞凋亡能被RNA或蛋白质合成的抑制剂如放线菌素D或放线菌酮所阻止或延迟,提示凋亡过程需要新合成的蛋白质的参与才能完成。内质网膜系统是细胞进行蛋白质合成、脂类合成和物质运输的重要细胞器[6]。在RA诱导CCL229细胞凋亡过程中观察到的内质网膜系统结构及分布变化的重要特征为:内质网逐渐减少,向核周聚集,部分呈扩张状态,形成大小不等的小泡状或短管状结构。内质网的这些变化是否与某些启动或完成凋亡过程所需的新的蛋白质的合成有关,尚需今后在分子水平的深入研究。
, http://www.100md.com
参考文献
1,Kerr JFR,Wyllie AH,Currie AR. Apoptosis: a basic biological phenomenon with wide ranging implications in tissue kinetics. Br J Cancer, 1972, 26:239-257
2,Martin SJ, Bradley JG, Cotter TG. HL-60 cells induced to differentiate towards neutrophils subsequently die via apoptosis. Clin Exp Immunol, 1990, 79:448-453
3,Atenica R, Garcia SM, Unda F, et al. Apoptosis during retinoic acid-induced differentiation of F9 embryonal carcinoma cells. Exp Cell Res, 1994, 204:663-667
, 百拇医药
4,Gavrieli Y, Sherman Y, Ben-Sasson SA. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J Cell Biol, 1992, 119 (3):493-501
5,Nicoletti I, Migliorati G, Pagliacci MC, et al. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods, 1991, 139:271-279
6,Terasaki M, Song JD, Wang JR, et al. Localization of endoplasmic reticulum in living and glutaldehyde-fixed cell with fluorescent dyes. Cell, 1984, 38:101-105
收稿日期:1999-04-19, 百拇医药
单位:高丰(中国医科大学基础医学院细胞生物学教研室,沈阳 110001);宋今丹 (中国医科大学基础医学院细胞生物学教研室,沈阳 110001)
关键词:细胞凋亡;大肠癌细胞;内质网
中国医科大学学报000602 摘要 目的:建立全反式维甲酸(ATRA)诱导人大肠癌细胞凋亡的体外模型,观察凋亡细胞内质网膜系统的变化。方法:应用光镜、透射及扫描电镜、DNA凝胶电泳、流式细胞术及末端脱氧核苷酰转移酶原位标记(TUNEL法),观察维甲酸诱导的人大肠癌CCL229细胞凋亡特征。结果:维甲酸诱导CCL229细胞凋亡,产生典型的形态学改变,在琼脂糖凝胶电泳上呈现特征性的 DNA ladder, DNA直方图上显示亚二倍体峰,具有时间和剂量依赖性。CCL229细胞在被维甲酸诱导成熟分化后发生凋亡。凋亡过程中内质网膜系统的结构与分布变化为:内质网逐渐减少,向核周聚集,部分呈扩张状态,形成大小不等的小泡状或短管状结构。结论:维甲酸诱导细胞凋亡过程中内质网膜系统结构与分布的变化可能与凋亡时内质网蛋白合成的改变有关。
, http://www.100md.com
Colorectal Carcinoma Cell Apoptosis and Morphological Changes of Endoplasmic Reticulum Induced by Retinoic Acid
Gao Feng Song Jindan
(Department of Cell Biology, College of Basic Medical Sciences,China Medical University, Shenyang,110001)
ABSTRACT Objective:We wanted to explain the mode and mechanisms of cell death in human colorectal carcinoma cells induced by treatment with all-trans retinoic acid (ATRA). Methods: In vitro, a model of apoptosis was developed. Apoptosis induced by retinoic acid (RA) in cell line CCL229 was studied by fluorescence microscopy, electron microscopy, agarose gel electrophoresis, flow cytometry, and TdT-mediated dUTP-biotin in situ nick end labeling (TUNEL).Results: ATRA was found to induce apoptosis and extensive DNA fragmentation in the CCL229 cell line as early as 12 hours after treatment. Degradation of the nuclear DNA of apoptotic cells was demonstrated by visualization of “DNA ladders” on gel electrophoresis. DNA flow cyto-fluorimetric analysis showed the appearance of a discrete population of cells containing hypodiploid DNA. A concentrations between 10-5mol/L and 10-8mol/L, RA-treated 229 cells were induced to apoptosis in a dose-and time-dependent manner. During RA-induced apoptosis, there was a gradually decrease and dilatation of ER in the cytoplasm, and dilated vesicular or tubular cisternae of endoplasmic reticulum (ER) were found either in the cytoplasm or in the apoptotic bodies.Conclusion:ATRA induced apoptosis in colorectal carcinoma cells at pharmacologically relevant doses. The changes of structure and distribution of ER induced by RA were probably related to the changes of protein synthesis in ER.
, 百拇医药
KEY WORDS apoptosis; colorectal carcinoma cell; endoplasmic reticulum
细胞凋亡(apoptosis)是具有特殊形态和生化改变的生理性细胞死亡,区别于病理性细胞死亡——坏死(necrosis)[1]。迄今已发现许多抗肿瘤药物能够诱导肿瘤细胞凋亡。全反式维甲酸(all-trans retinoic acid, ATRA)是维生素A的代谢衍生物,能抑制多种肿瘤细胞增殖并具有诱导分化作用。近来研究表明,维甲酸(RA)除可诱导细胞终末分化外,还可以在肿瘤细胞中诱导凋亡[2,3]。本研究应用ATRA在体外诱导人大肠癌CCL229细胞凋亡,建立人大肠癌细胞的凋亡模型,探讨RA诱导细胞分化与凋亡的相关性,并观察了细胞凋亡过程中内质网膜系统的结构及分布变化。
1 材料与方法
1.1 细胞培养与加药处理
, http://www.100md.com
人大肠高分化腺癌细胞系CCL229,单层培养于含10%小牛血清的RPMI1640培养基中。以105/ml浓度接种细胞,培养24 h后给药。全反式维甲酸(Sigma公司产品)以无水乙醇配成10-2mol/L储存液,使用终浓度分别为10-5,10-6,10-7,10-8 mol/L。对照组加等体积无水乙醇(<0.1%,V/V)。实验组每48 h换培养液及RA。药物处理不同时间后收集实验及对照组细胞。
1.2 凋亡细胞形态观察
1.2.1 凋亡细胞荧光染色:将细胞接种于盖片上,用0.025% 丫啶橙(AO)-醋酸溶液染色,荧光显微镜观察。
1.2.2 末端脱氧核苷酰转移酶(TdT)原位标记法(TUNEL):参考 Gavrieli 等的 TdT 原位标记法[4]。
, 百拇医药
1.3 透射电镜观察凋亡细胞超微结构
1.4 细胞DNA提取及琼脂糖凝胶电泳
收集贴壁及悬浮细胞,常规方法提取细胞DNA于1.5%琼脂糖凝胶中电泳。
1.5 凋亡细胞的流式细胞仪检测
按文献[5]方法收集细胞样品,70%冷乙醇4℃固定1 h,RNA酶37℃作用30 min,50 μg/ml碘化丙啶 (PI)4℃染色1 h,FACScan流式细胞仪进行细胞周期DNA含量分析,低于G1期二倍体DNA含量的细胞为凋亡细胞。
2 结果
2.1 RA诱导CCL229细胞凋亡的细胞形态变化
经10-6mol/L RA作用后,荧光显微镜下见CCL229细胞固缩,染色质浓缩凝聚形成凋亡小体(apoptotic body)。TUNEL染色可见凋亡细胞胞核呈棕色或棕褐色着染,表明RA诱导CCL229细胞出现凋亡的形态改变。
, http://www.100md.com
2.2 透射电镜下凋亡细胞内质网膜系统的变化

图1 RA 处理24 h,核染色质边集,核周片层状内质网较多,可见轻微扩张 TEM ×14 000
Fig.1 24 h after 10-6 mol/L RA treatment, marginated chromatin and slightly dilated laminar ER were found TEM ×14 000

图2 RA处理72 h,凋亡细胞出泡,其中可见大量明显扩张的内质网形成许多小泡状或短管状结构 TEM ×18 000
Fig.2 72 h after 10-6 mol/L RA treatment, dilated vesicular or tubular cisternae of ER were found either in the cytoplasm or in the
, http://www.100md.com
apoptotic bodies TEM ×18 000

图3 正常培养CCL229细胞为梭形, 有许多微绒毛和小的泡状突起 SEM ×2 400
Fig 3. Microvilli of shuttle-shaped CCL229 cells in culture SEM ×2400

图4 凋亡小体脱离凋亡细胞 SEM ×5 200 Fig.4 Apoptotic body blebbing from apoptotic cell SEM ×5 200

, 百拇医药
图5 凋亡细胞出泡后形成多个大小不等的凋亡小体 SEM ×6 600 Fig.5 Apoptotic bodies blebbing from apoptotic cell SEM ×6 600
透射电镜下,CCL229细胞经10-6mol/L RA处理后,可观察到一系列凋亡特征性的形态学改变。RA诱导初期(12 h),细胞形态向正常分化:细胞变圆,表面微绒毛明显减少。内质网数量增多,形态趋向正常,排列规则形成连续片层状,广泛铺展于整个胞质,附着核糖体增多。可见许多成熟的线粒体。随RA诱导时间的推移,细胞开始表现出凋亡的形态特征:RA作用24 h,核内染色质边集,沿核膜内侧分布,核膜皱褶内陷。核周片层状内质网较多,可见轻微扩张(图1)。RA诱导48 h ,核染色质更加致密,浓缩分块,胞质中有空泡形成。内质网数量逐渐减少,向核周聚集,可见囊泡状扩张的内质网。线粒体形态正常,结构完整,细胞表面微绒毛消失。凋亡后期,细胞表面出泡(blebbing),脱落形成膜包裹的凋亡小体,有些含有固缩的核碎片。在胞质中及凋亡小体中含有内质网,部分形态正常、排列规则,另有相当一部分明显扩张,形成许多大小不等的小泡状或短管状结构(图2),结构仍保持完整。在上述全过程中细胞膜结构也始终保持完整。
, http://www.100md.com
扫描电镜下正常培养CCL229细胞为梭形,有许多微绒毛和丝状伪足(图3)。RA诱导后细胞收缩变圆,表面突起出泡,与正在凋亡的细胞分离(图4),最后形成多个凋亡小体(图5)。
2.3 DNA琼脂糖凝胶电泳
10-8mol/L RA作用CCL229细胞24 h,DNA降解不明显;10-7,10-6,10-5mol/L可诱导产生清晰的 DNA ladder,大小呈约180 bp整数倍递增;且随药物浓度增高,DNA条带的亮度增加,说明RA诱导凋亡的作用呈剂量依赖性增强。另外,10-6mol/L RA处理12~96 h,引起的DNA 断裂程度也随作用时间延长而逐渐增强。
2.4 凋亡细胞的流式细胞仪检测
10-6mol/L RA处理12~96 h,DNA histogram上均出现低于G1期二倍体DNA含量的亚二倍体峰(hypodiploid peak, Ap峰),随时间推移,凋亡峰显著升高。此外流式细胞仪检测也提示不同浓度RA对CCL229细胞凋亡的诱导作用具有剂量反应关系。
, 百拇医药
3 讨论
目前研究凋亡普遍应用的模型是糖皮质激素诱导的胸腺细胞凋亡模型。本研究应用ATRA在体外诱导人大肠癌CCL229细胞凋亡,建立人大肠癌细胞的凋亡模型,以期利用此模型了解RA的作用机制并研究凋亡细胞的结构及功能变化。维甲酸是公认的肿瘤分化诱导剂,对多种肿瘤细胞都有诱导分化作用。本实验结果表明:10-6mol/L ATRA 能显著抑制人大肠癌CCL229细胞生长增殖,同时引起细胞终末分化与凋亡的形态改变。RA作用初期,表现出细胞向成熟分化的趋势。随RA作用时间推移,逐渐表现出凋亡的一系列形态学特征。由此推测,肿瘤细胞在被诱导向终末阶段分化后则将趋向最后死亡,凋亡很可能就是细胞被诱导分化成熟以后的死亡形式,是诱导分化的结局。另外,DNA凝胶电泳、FACS DNA含量分析也提示RA诱导凋亡表现出时间和剂量依赖性。
细胞凋亡能被RNA或蛋白质合成的抑制剂如放线菌素D或放线菌酮所阻止或延迟,提示凋亡过程需要新合成的蛋白质的参与才能完成。内质网膜系统是细胞进行蛋白质合成、脂类合成和物质运输的重要细胞器[6]。在RA诱导CCL229细胞凋亡过程中观察到的内质网膜系统结构及分布变化的重要特征为:内质网逐渐减少,向核周聚集,部分呈扩张状态,形成大小不等的小泡状或短管状结构。内质网的这些变化是否与某些启动或完成凋亡过程所需的新的蛋白质的合成有关,尚需今后在分子水平的深入研究。
, http://www.100md.com
参考文献
1,Kerr JFR,Wyllie AH,Currie AR. Apoptosis: a basic biological phenomenon with wide ranging implications in tissue kinetics. Br J Cancer, 1972, 26:239-257
2,Martin SJ, Bradley JG, Cotter TG. HL-60 cells induced to differentiate towards neutrophils subsequently die via apoptosis. Clin Exp Immunol, 1990, 79:448-453
3,Atenica R, Garcia SM, Unda F, et al. Apoptosis during retinoic acid-induced differentiation of F9 embryonal carcinoma cells. Exp Cell Res, 1994, 204:663-667
, 百拇医药
4,Gavrieli Y, Sherman Y, Ben-Sasson SA. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J Cell Biol, 1992, 119 (3):493-501
5,Nicoletti I, Migliorati G, Pagliacci MC, et al. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods, 1991, 139:271-279
6,Terasaki M, Song JD, Wang JR, et al. Localization of endoplasmic reticulum in living and glutaldehyde-fixed cell with fluorescent dyes. Cell, 1984, 38:101-105
收稿日期:1999-04-19, 百拇医药