L-精氨酸干预低氧性肺血管结构重构机制的研究
作者:齐建光 杜军保 赵斌
单位:齐建光 杜军保(北京医科大学第一医院儿科 100034);赵斌(北京积水潭医院内科)
关键词:精氨酸;肺动脉;低氧
中华医学杂志000325 摘 要:目的 探讨L-精氨酸(L-Arg)干预低氧性肺血管结构重构的机制。方法 将18只Wistar大鼠采用区组随机法分为对照组、低氧组和低氧+L-Arg组(共6个配伍组)。以右心导管法测定肺动脉压力,并对大鼠肺组织标本进行显微结构观测和超微结构观察,同时以分光光度法间接测定血浆一氧化氮(NO)含量,并对肺组织以内皮素-1(ET-1) cRNA探针进行原位杂交,研究肺动脉内皮细胞ET-1 mRNA的表达。结果 低氧组大鼠肺动脉平均压(mPAP)为2.71 kPa±0.29 kPa,对照组为2.05 kPa±0.14 kPa,两者比较P<0.05。低氧组大鼠肺血管显微及超微结构发生明显改变,有肺血管结构重构形成。同时低氧组大鼠血浆NO间接含量为3.54 μmol/L±0.47 μmol/L,对照组为4.79 μmol/L±0.17 μmol/L,两者比较P<0.05。低氧后肺动脉内皮细胞ET-1 mRNA表达明显增强。然而,低氧+L-Arg组大鼠mPAP为2.23 kPa±0.18 kPa,低氧组为2.71 kPa±0.29 kPa,两者比较P<0.05。L-Arg缓解了低氧性肺血管结构重构的形成。同时低氧+L-Arg组大鼠血浆NO间接含量明显高于低氧组(P<0.05)。L-Arg使低氧大鼠肺动脉内皮细胞ET-1 mRNA表达明显受抑制。结论 L-Arg通过促进低氧大鼠体内NO生成,从而抑制肺动脉内皮细胞ET-1 mRNA表达,对低氧性肺血管结构重构以及低氧性肺动脉高压的形成有重要的调节作用。
, 百拇医药
The mechanism responsible for alleviation of hypoxic pulmonary vascular structural remodeling by L-arginine
QI Jianguang DU Junbao ZHAO Bin.
(Department of Pediatrics, First Hospital, Beijing Medical University, Beijing 100034, China)
Abstract:Objective To explore the mechanism of the therapeutic effect of L-arginine on hypoxic pulmonary vascular structural remodeling. Methods Eighteen age- and body weight-matched Wistar rats were randomly divided into hypoxic group, hypoxic with L-arginine group or control group. Pulmonary artery mean pressure ( mPAP ) of each rat was evaluated using right cardiac catheterization. Pulmonary vascular microstructure was measured and the ultrastructural changes in intra-acinar pulmonary muscularized arteries were observed. Meanwhile, indirect plasma concentration of nitric oxide ( NO ) was measured via spectrophotometry, and endothelin-1(ET-1) mRNA expression in pulmonary artery endothelial cells was detected using in situ hybridization with a cRNA probe for ET-1. Results mPAP was significantly increased in hypoxic rats (2.71 kPa±0.29 kPa) as compared with that of normal controls (2.05 kPa±0.14 kPa)(P<0.05). Microstructure and ultrastructure of pulmonary arteries changed obviously in hypoxic rats with the development of hypoxic pulmonary vascular structural remodeling. Meanwhile, indirect plasma NO concentration in hypoxic rats (3.54 μmol/L±0.47 μmol/L ) was markedly decreased compared with controls (4.79 μmol/L±0.17 μmol/L)(P<0.05). The expression of ET-1 mRNA of hypoxic rats strengthened obviously. However, mPAP was significantly decreased in hypoxic rats treated with L-arginine (2.23 kPa±0.18 kPa ) as compared with that of hypoxic rats (2.71 kPa±0.29 kPa) (P<0.05). L-arginine ameliorated pulmonary vascular structural remodeling of hypoxic rats in association with an increase in indirect plasma NO concentration (P<0.05)and an inhibited ET-1 mRNA expression. Conclusion L-arginine plays an important role in the regulation of development of hypoxic pulmonary vascular remodeling and hypoxic pulmonary hypertension, promoting NO production and inhibiting ET-1 mRNA expression in hypoxic rats.
, 百拇医药
Key words:Arginine; Pulmonary artery; Anoxia
低氧性肺血管结构重构与临床众多心肺血管疾病的发生发展有极为密切的关系[1,2]。L-精氨酸(L-Arg)和(或)一氧化氮(NO)可以缓解低氧性肺血管结构重构以及低氧性肺动脉高压的形成[3-5],但其机制尚未完全清楚[6-8]。本研究旨在探讨L-Arg干预低氧性肺血管结构重构的作用机制,为临床进一步应用L-Arg防治低氧性肺动脉高压提供实验基础。
材料与方法
1.动物分组:雄性Wistar大鼠共18只,体重210~300 g。采用区组随机法将窝别相同、体重接近的每3只大鼠配成1个配伍组,并将每个配伍组的大鼠随机分为对照组、低氧组和低氧+L-Arg组,每组6只。将低氧组及低氧+L-Arg组大鼠置于常压低氧舱(中国医学科学院基础医学研究所提供)内,控制舱内氧浓度在10.0%±0.5%,每天连续低氧6 h,共低氧两周。低氧+L-Arg组大鼠每天低氧前即刻腹腔内注射L-Arg 500 mg/kg,对照组及低氧组大鼠每天腹腔内注射相同容积的生理盐水。3组大鼠的常规饲养与饮食条件相同。
, 百拇医药
2.大鼠肺动脉压力的测定:大鼠饲养两周后,腹腔注射10%乌拉坦(1 ml/100 mg)麻醉,固定于手术台上,采用右心导管法测定大鼠肺动脉压力。将聚乙烯导管从右颈外静脉插入右心室及肺动脉,导管的另一端经P50压力传感器与RM-6000型多导生理仪相连,描记肺动脉压力曲线,测定肺动脉平均压(mPAP)。
3.肺组织标本的取材和制备:测定肺动脉压力后,打开胸腔,取大鼠一侧肺叶予液氮冷冻后,-70 ℃保存。从冰冻肺组织标本外周部位切取数个1 mm×1 mm×1 mm的组织块,经戊二醛和四氧化锇双固定,系列丙酮脱水,Epon812包埋。半薄切片后半定位,选取外径为15~150 μm的肺中、小肌型动脉行超薄切片,醋酸双氧铀-枸橼酸铅双染色,100CX-II透射电子显微镜观察。另一侧肺叶以10%甲醛缓冲液固定,梯度酒精顺序脱水,二甲苯透明后石蜡包埋,切片(厚5 μm)。部分切片以Weight弹力纤维染色,Van Gieson复染。另部分切片用于原位杂交。
4.三型肺小血管百分比的测定:在40倍光镜下,观察并计数整个切片肺小血管(外径>15 μm,≤50 μm)中肌型动脉、部分肌型动脉及非肌型血管的数目,分别计算它们各占肺小血管总数的百分比。肌型动脉在光镜下具有完整的内外两层弹力层;部分肌型动脉在光镜下具有完整的外弹力层,但内弹力层不完整;非肌型血管在光镜下仅有一层弹力层。
, 百拇医药
5.肺中、小肌型动脉相对中膜厚度及面积的测定:应用Q550 LW图像处理与分析系统对整个切片中内弹力层清晰、形状较规则的肺中、小肌型动脉进行分析。运用Leica Qwin软件测量每个血管的如下指标:经过血管轴心的外弹力层之间的最长外径和最短外径;内弹力层长度;内弹力层包围的面积;外弹力层包围的面积。根据Barth等[9]的方法计算不同切面角度及处于不同舒缩状态的血管之相对中膜厚度(RMT)及相对中膜面积(RMA)。每只大鼠测量5~10个肺中、小肌型动脉,分别测算肺中等肌型动脉(外径>50 μm,≤150 μm)和肺小肌型动脉(外径>15 μm,≤50 μm)RMT及RMA,并求其均值。
6.血浆NO间接含量测定:大鼠处死前,自颈总动脉取血2 ml,离心后吸取血浆0.1 ml,加9.3 mmol/L硫酸锌0.6 ml及双氧水0.4 ml,加入1 mol/L氢氧化钠0.1 ml后冰上孵育1 h。离心后取上清液0.6 ml加入双氧水及3 g/L磺胺,与6 mmol/L聚乙烯二胺盐酸盐反应1 h,以545 nm比色,读光密度值,按标准曲线计算NO间接含量。
, 百拇医药
7.原位杂交:将内皮素-1(ET-1) cDNA(长度1.1 Kb)经体外转录的方法获得以生物素标记的ET-1 cRNA探针,对各组大鼠肺组织标本做原位杂交。标本经二甲苯脱蜡及梯度乙醇处理后入水。以磷酸缓冲盐液(PBS)洗涤1 min后,于室温下以0.2 mol/L盐酸处理10 min。经PBS洗涤2 min×2次后以蛋白酶K(50 μg/ml),20 min,37℃处理,以40 g/L多聚甲醛于室温下固定10 min。每片滴加杂交液25 μl,用石蜡封口膜覆盖,于42℃保温24 h。系列标准柠檬酸盐-氯化钠液(SSC)洗涤,以1∶100马血清蛋白封闭。将以生物素标记cRNA探针原位杂交切片中加1∶100 ABC复合液,室温1 h。以过氧化物酶-联苯胺(DAB)显色体系,光学显微镜下检测原位杂交阳性信号,并采用半定量方法[10],对ET-1mRNA含量进行分析。棕黄色沉淀为杂交阳性信号。任一肺动脉内皮细胞无阳性信号者为阴性(-);1%~50%呈现阳性信号者为阳性(+);51%~100%呈现阳性信号者为强阳性(++)。对每只动物肺组织切片观察15~20只肺动脉。阴性对照片杂交时不加ET-1cRNA探针,其他操作程序完全相同。
, 百拇医药
8.统计学处理:组间差异显著性检验采用双因素方差分析及q检验。
结果
1.肺动脉压力(表1):mPAP在3组大鼠间差异有显著意义(P<0.05)。低氧组大鼠mPAP明显高于对照组(q=5.12, P<0.05)。低氧+L-Arg组大鼠mPAP明显低于低氧组(q=3.72, P<0.05),与 对照组相比差异无显著意义(q=1.41, P>0.05)。
表1 3组大鼠肺动脉平均压、肺动脉显微结构和血浆一氧化氮间接含量的变化(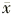 ±
±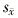 ) 组别
) 组别
鼠数(只)
mPAP
, 百拇医药
(kPa)
三型肺小血管百分比(%)
相对中膜厚度(%)
相对中膜面积(%)
血浆NO间接
含量(μmol/L)
MA
PMA
NMV
肺中等MA
肺小MA
肺中等MA
, http://www.100md.com
肺小MA
对照组
6
2.05±
0.14
9.33±
0.53
7.07±
0.25
83.59±
0.56
7.70±
0.41
, 百拇医药
10.12±
0.60
14.76±
0.75
19.18±
1.08
4.79±
0.17
低氧组
6
2.71±
0.29*
16.04±
, http://www.100md.com
0.74**
10.32±
0.35**
73.64±
0.73**
9.94±
0.30**
15.15±
0.21**
18.87±
0.54**
, 百拇医药
27.99±
0.36**
3.54±
0.47
低氧+
L-Arg组
6
2.23±
0.18△
11.81±
0.24▲
9.30±
, http://www.100md.com
0.18
78.50±
0.25**▲
8.28±
0.12▲
11.86±
0.53▲
15.84±
0.22▲
22.26±
0.93*▲
, 百拇医药
5.21±
0.26△
F值
6.90
54.25
33.35
80.39
15.69
39.57
15.88
38.05
7.65
P值
, 百拇医药
<0.05
<0.001
<0.001
<0.001
<0.001
<0.001
<0.001
<0.001
<0.01
注:(1)mPAP:肺动脉平均压;MA:肌型动脉;PMA:部分肌型动脉;NMV:非肌型血管;(2)与对照组比较*P<0.05,**P<0.01;与低氧组比较,△P<0.05,▲P<0.01;(3)F值及P值为组间比较
, 百拇医药
2.三型肺小血管百分比(表1):三型肺小血管百分比在3组大鼠之间差异均有显著意义(P均<0.001)。低氧组大鼠肺小血管肌型动脉百分比明显高于对照组(q=14.57, P<0.01),低氧+L-Arg组大鼠肺小血管肌型动脉百分比明显低于低氧组(q=9.19, P<0.01),但仍高于对照组(q=5.38, P<0.01)。低氧组大鼠肺小血管非肌型血管百分比明显低于对照组(q=17.99,P<0.01), 低氧+L-Arg组大鼠肺小血管非肌型血管百分比明显高于低氧组(q=8.74,P<0.01),但仍低于对照组(q=9.19, P<0.01)。
3.肺中、小肌型动脉相对中膜厚度及面积(表1):肺中、小肌型动脉相对中膜厚度及面积在3组大鼠之间差异均有显著意义(P均<0.001)。低氧组大鼠肺中等肌型动脉RMT及RMA明显高于对照组(q=7.63,7.69, P均<0.01),肺小肌型动脉RMT及RMA也明显高于对照组(q=12.39,12.16, P均<0.01)。低氧+L-Arg组大鼠肺中等肌型动脉RMT及RMA明显低于低氧组(q=5.65, 5.65,P均<0.01),但与对照组相比差异无显著意义(q=1.98,2.04, P均>0.05)。肺小肌型动脉RMT及RMA明显低于低氧组(q=8.09, 7.9, P均<0.01),但仍高于对照组(q=4.3, 4.25, P均<0.05)。
, 百拇医药
4.肺中、小肌型动脉内皮细胞超微结构:对照组大鼠肺中、小肌型动脉内皮细胞胞体扁平,内衬血管内壁,结构正常;平滑肌细胞胞体小,呈收缩表型,胞浆被大量肌丝占据,并见许多致密斑(图1)。低氧组大鼠肺动脉内皮细胞呈立方型,部分突入管腔,呈阅兵式样,内皮细胞肿胀,胞浆内可见大量空泡,线粒体肿胀,内质网扩张;平滑肌细胞胞体肥大,不同程度向合成表型转化,胞浆中肌丝和致密斑减少,粗面内质网和游离核糖体等细胞器增多(图2)。低氧+L-Arg组大鼠肺动脉内皮细胞胞体扁平,内衬血管内壁,其肿胀程度较低氧组减轻,空泡明显减少;多数平滑肌细胞处于收缩表型,但少数仍处于过渡表型(图3)。
图1 对照组大鼠肺肌型动脉。内皮细胞扁平,结构正常。平滑肌细胞呈收缩表型,胞浆被大量肌丝和致密斑所占据 ×10 000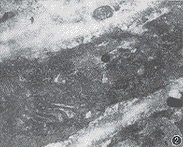
, http://www.100md.com
图2 低氧组大鼠肺肌型动脉。内皮细胞肿胀,胞浆内见大量空泡。平滑肌细胞呈合成表型,胞浆内可见大量游离核糖体,线粒体和内质网 ×20 000
图3 低氧+L-Arg组大鼠肺肌型动脉。内皮细胞扁平,空泡明显减少。平滑肌细胞呈收缩表型 ×20 000
5.血浆NO的间接含量(表1):血浆NO间接含量在3组大鼠之间差异有显著意义(P<0.001)。低氧组大鼠血浆NO间接含量明显低于对照组(q=3.94, P<0.05)。低氧+L-Arg组大鼠血浆NO间接含量明显高于低氧组(q=5.22, P<0.05), 但与对照组比较差异无显著意义(q=1.33,P>0.05)。
6.肺动脉内皮细胞ET-1 mRNA表达:低氧组大鼠大部分肺动脉(77%±7%)内皮细胞ET-1 mRNA表达呈阳性信号(+)(图4),但对照组(14%±7%)及低氧+L-Arg组(4%±4%)大鼠仅少数肺动脉内皮细胞显示ET-1 mRNA表达阳性信号(+),其差异有非常显著意义(q=9.32,10.86,P均<0.01),而对照组及低氧+L-Arg组大鼠肺动脉内皮细胞ET-1 mRNA表达差异无显著意义(q=1.54,P>0.05)。对照组(86%±7%)及低氧+L-Arg组(96%±4%)大鼠大部分肺动脉内皮细胞无ET-1 mRNA表达(图5),而低氧组大鼠仅少数肺动脉(23%±7%)内皮细胞无ET-1 mRNA表达,其差异有非常显著意义(q=9.32, q=10.86,P均<0.01),而对照组及低氧+L-Arg组大鼠肺动脉内皮细胞ET-1 mRNA表达差异无显著意义(q =1.54,P>0.05)。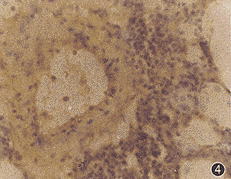
, 百拇医药
图4 低氧大鼠肺动脉有1%~50%内皮细胞显示ET-1 mRNA杂交阳性信号 DAB显色,×250
图5 低氧+L-Arg组大鼠肺动脉内皮细胞ET-1 mRNA表达明显受到抑制 DAB显色,×400
讨论
低氧性肺动脉高压是临床众多心肺疾病发生发展过程中重要的病理生理环节[1]。低氧性肺血管结构重构是慢性低氧性肺动脉高压的重要病理基础,其主要特征是肺动脉平滑肌细胞增生、肥厚,中膜增厚,外周小血管肌化,以及细胞外基质的增多[2]。本研究发现,常压低氧2周大鼠肺动脉压力明显增高,肺血管结构重构,光镜下肺小血管中肌化程度明显增强;肺中、小肌型动脉RMT和RMA明显增加;电镜下肺动脉内皮细胞增生、肥厚、肿胀;中膜平滑肌细胞增生、肥大,并不同程度地向合成表型转化。同时低氧2周后大鼠血浆NO间接含量明显降低,而ET-1 mRNA表达明显增强。提示低氧后NO水平的降低和ET-1基因表达的增强可能参与了低氧性肺血管结构重构及低氧性肺动脉高压的形成。由此设想如能将NO水平升高和/或将ET-1水平降低可以防治低氧性肺血管结构重构,为临床治疗低氧性肺动脉高压提供了一条思路。
, 百拇医药
研究表明,外源性给予L-Arg和(或)NO可以缓解低氧性肺血管结构重构以及低氧性肺动脉高压的形成[3-5]。临床上已开始应用NO吸入的方法来治疗持续胎儿循环和胎粪吸入综合征等疾病,并已取得初步疗效[11]。但NO吸入费用高,仪器操作复杂,并有一定的毒副作用,因此限制了其临床应用。
L-Arg为NO合成的前体,它进入体内后经NO合酶催化生成NO。近年关于应用L-Arg干预低氧性肺血管结构重构的研究得到越来越多的重视,但其机制尚未完全清楚。体外实验证实,NO对血管平滑肌细胞的增殖有直接抑制作用[12],提示L-Arg干预低氧性肺血管结构重构的机制之一可能是通过NO的直接作用。另一方面体外实验还显示,NO可抑制脐静脉内皮细胞ET-1的合成与分泌,并可降低血浆ET-1水平[6]。我们以往的研究结果也提示,NO 对慢性低氧大鼠肺动脉ET-1基因表达有抑制作用[7]。而ET-1是目前发现的体内最强的缩血管活性多肽,并且具有强烈的促血管平滑肌增殖的作用[8]。由此间接提示L-Arg干预低氧性肺血管结构重构的另一可能机制是通过促进NO合成,从而对促进血管平滑肌细胞增殖因子ET-1的抑制作用。
, 百拇医药
为明确后一调节机制的可能性,我们将L-Arg对慢性低氧性肺动脉高压大鼠肺血管显微和超微结构、血浆NO的间接含量以及肺动脉内皮细胞ET-1 mRNA表达的影响进行了同步研究。结果表明,L-Arg使低氧性肺动脉高压大鼠肺动脉压力明显降低,肺小血管肌化程度明显减轻,肺中、小肌型动脉RMT和RMA明显降低,肺动脉超微结构的改变明显缓解;同时L-Arg使低氧大鼠血浆NO间接含量明显升高并且使低氧大鼠肺动脉内皮细胞ET-1 mRMA表达明显受抑制。提示L-Arg通过促进体内NO生成,从而抑制肺动脉内皮细胞ET-1 mRMA表达,对低氧性肺血管结构重构以及低氧性肺动脉高压的形成有重要的调节作用。
基金项目:国家自然科学基金资助项目(39470735, 39870844)
参考文献:
1 杜军保, 主编. 缺氧性肺动脉高压. 北京:北京医科大学、中国协和医科大学联合出版社, 1994. 79.
, http://www.100md.com
2 Vender RL. Chronic hypoxic pulmonary hypertension: cell biology to pathophysiology. Chest, 1994, 106: 236-243.
3 齐建光,杜军保. 内源性一氧化氮调节大鼠低氧性肺血管结构重构. 中华儿科杂志,1999,37:104-106.
4 林红, 蔡英年, 宋为, 等. L-精氨酸和硝普钠对缺氧大鼠肺动脉压及血管结构变化的影响 . 中国医学科学院学报 , 1997 , 19 : 179-184.
5 Mitani Y, Maruyama K, Sakurai M. Prolonged administration of L-Arginine ameliorates chronic pulmonary hypertension and pulmonary vascular remodeling in rats. Circulation, 1997, 96: 689-697.
, 百拇医药
6 Kourembanas S, Mcquillan LP, Leung GK. et al. Nitric oxide regulates the expression of vasoconstrictors and growth factors by vascular endothelium under both normoxia and hypoxia. J Clin Invest, 1993, 92: 99-104.
7 杜军保, 李万镇, 赵斌, 等. 一氧化氮对慢性缺氧大鼠肺动脉内皮素基因表达的影响 . 中华医学杂志 , 1997 , 77 : 263-265.
8 Janakidevi K, Fisher MA, Del Vecchio PJ, et al. Endothelin-1 stimulates DNA synthesis and proliferation of pulmonary artery smooth muscle cells. Am J Physiol, 1992, 263: C1295-C1301.
, http://www.100md.com
9 Barth PJ, Kimpel C, Roy S, et al. An improved mathematical approach for the assessment of the medial thickness of pulmonary arteries. Path Res Pract, 1993, 189: 567-576.
10 Hislop AA, Springall DR, Buttery LDK, et al. Abundance of endothelial nitric oxide synthase in newborn intrapulmonary arteries. Arch Dis Child, 1995, 73: F17-F21.
11 Roberts JD, Polaner DM, Lang P, et al. Inhaled nitric oxide reverses hypoxemia in persistent pulmonary hypertension of the newborns. Lancet, 1992, 340: 818-819.
12 Garg UC, Hassid A. Nitric oxide-generating vasodilators and 8-bromo-cyclic guanosine monophosphate inhibit mitogenesis and proferation of cultured rat vascular smooth muscle cells. J Clin Invest, 1989, 83: 1774-1777.
收稿日期:1999-08-24, http://www.100md.com
单位:齐建光 杜军保(北京医科大学第一医院儿科 100034);赵斌(北京积水潭医院内科)
关键词:精氨酸;肺动脉;低氧
中华医学杂志000325 摘 要:目的 探讨L-精氨酸(L-Arg)干预低氧性肺血管结构重构的机制。方法 将18只Wistar大鼠采用区组随机法分为对照组、低氧组和低氧+L-Arg组(共6个配伍组)。以右心导管法测定肺动脉压力,并对大鼠肺组织标本进行显微结构观测和超微结构观察,同时以分光光度法间接测定血浆一氧化氮(NO)含量,并对肺组织以内皮素-1(ET-1) cRNA探针进行原位杂交,研究肺动脉内皮细胞ET-1 mRNA的表达。结果 低氧组大鼠肺动脉平均压(mPAP)为2.71 kPa±0.29 kPa,对照组为2.05 kPa±0.14 kPa,两者比较P<0.05。低氧组大鼠肺血管显微及超微结构发生明显改变,有肺血管结构重构形成。同时低氧组大鼠血浆NO间接含量为3.54 μmol/L±0.47 μmol/L,对照组为4.79 μmol/L±0.17 μmol/L,两者比较P<0.05。低氧后肺动脉内皮细胞ET-1 mRNA表达明显增强。然而,低氧+L-Arg组大鼠mPAP为2.23 kPa±0.18 kPa,低氧组为2.71 kPa±0.29 kPa,两者比较P<0.05。L-Arg缓解了低氧性肺血管结构重构的形成。同时低氧+L-Arg组大鼠血浆NO间接含量明显高于低氧组(P<0.05)。L-Arg使低氧大鼠肺动脉内皮细胞ET-1 mRNA表达明显受抑制。结论 L-Arg通过促进低氧大鼠体内NO生成,从而抑制肺动脉内皮细胞ET-1 mRNA表达,对低氧性肺血管结构重构以及低氧性肺动脉高压的形成有重要的调节作用。
, 百拇医药
The mechanism responsible for alleviation of hypoxic pulmonary vascular structural remodeling by L-arginine
QI Jianguang DU Junbao ZHAO Bin.
(Department of Pediatrics, First Hospital, Beijing Medical University, Beijing 100034, China)
Abstract:Objective To explore the mechanism of the therapeutic effect of L-arginine on hypoxic pulmonary vascular structural remodeling. Methods Eighteen age- and body weight-matched Wistar rats were randomly divided into hypoxic group, hypoxic with L-arginine group or control group. Pulmonary artery mean pressure ( mPAP ) of each rat was evaluated using right cardiac catheterization. Pulmonary vascular microstructure was measured and the ultrastructural changes in intra-acinar pulmonary muscularized arteries were observed. Meanwhile, indirect plasma concentration of nitric oxide ( NO ) was measured via spectrophotometry, and endothelin-1(ET-1) mRNA expression in pulmonary artery endothelial cells was detected using in situ hybridization with a cRNA probe for ET-1. Results mPAP was significantly increased in hypoxic rats (2.71 kPa±0.29 kPa) as compared with that of normal controls (2.05 kPa±0.14 kPa)(P<0.05). Microstructure and ultrastructure of pulmonary arteries changed obviously in hypoxic rats with the development of hypoxic pulmonary vascular structural remodeling. Meanwhile, indirect plasma NO concentration in hypoxic rats (3.54 μmol/L±0.47 μmol/L ) was markedly decreased compared with controls (4.79 μmol/L±0.17 μmol/L)(P<0.05). The expression of ET-1 mRNA of hypoxic rats strengthened obviously. However, mPAP was significantly decreased in hypoxic rats treated with L-arginine (2.23 kPa±0.18 kPa ) as compared with that of hypoxic rats (2.71 kPa±0.29 kPa) (P<0.05). L-arginine ameliorated pulmonary vascular structural remodeling of hypoxic rats in association with an increase in indirect plasma NO concentration (P<0.05)and an inhibited ET-1 mRNA expression. Conclusion L-arginine plays an important role in the regulation of development of hypoxic pulmonary vascular remodeling and hypoxic pulmonary hypertension, promoting NO production and inhibiting ET-1 mRNA expression in hypoxic rats.
, 百拇医药
Key words:Arginine; Pulmonary artery; Anoxia
低氧性肺血管结构重构与临床众多心肺血管疾病的发生发展有极为密切的关系[1,2]。L-精氨酸(L-Arg)和(或)一氧化氮(NO)可以缓解低氧性肺血管结构重构以及低氧性肺动脉高压的形成[3-5],但其机制尚未完全清楚[6-8]。本研究旨在探讨L-Arg干预低氧性肺血管结构重构的作用机制,为临床进一步应用L-Arg防治低氧性肺动脉高压提供实验基础。
材料与方法
1.动物分组:雄性Wistar大鼠共18只,体重210~300 g。采用区组随机法将窝别相同、体重接近的每3只大鼠配成1个配伍组,并将每个配伍组的大鼠随机分为对照组、低氧组和低氧+L-Arg组,每组6只。将低氧组及低氧+L-Arg组大鼠置于常压低氧舱(中国医学科学院基础医学研究所提供)内,控制舱内氧浓度在10.0%±0.5%,每天连续低氧6 h,共低氧两周。低氧+L-Arg组大鼠每天低氧前即刻腹腔内注射L-Arg 500 mg/kg,对照组及低氧组大鼠每天腹腔内注射相同容积的生理盐水。3组大鼠的常规饲养与饮食条件相同。
, 百拇医药
2.大鼠肺动脉压力的测定:大鼠饲养两周后,腹腔注射10%乌拉坦(1 ml/100 mg)麻醉,固定于手术台上,采用右心导管法测定大鼠肺动脉压力。将聚乙烯导管从右颈外静脉插入右心室及肺动脉,导管的另一端经P50压力传感器与RM-6000型多导生理仪相连,描记肺动脉压力曲线,测定肺动脉平均压(mPAP)。
3.肺组织标本的取材和制备:测定肺动脉压力后,打开胸腔,取大鼠一侧肺叶予液氮冷冻后,-70 ℃保存。从冰冻肺组织标本外周部位切取数个1 mm×1 mm×1 mm的组织块,经戊二醛和四氧化锇双固定,系列丙酮脱水,Epon812包埋。半薄切片后半定位,选取外径为15~150 μm的肺中、小肌型动脉行超薄切片,醋酸双氧铀-枸橼酸铅双染色,100CX-II透射电子显微镜观察。另一侧肺叶以10%甲醛缓冲液固定,梯度酒精顺序脱水,二甲苯透明后石蜡包埋,切片(厚5 μm)。部分切片以Weight弹力纤维染色,Van Gieson复染。另部分切片用于原位杂交。
4.三型肺小血管百分比的测定:在40倍光镜下,观察并计数整个切片肺小血管(外径>15 μm,≤50 μm)中肌型动脉、部分肌型动脉及非肌型血管的数目,分别计算它们各占肺小血管总数的百分比。肌型动脉在光镜下具有完整的内外两层弹力层;部分肌型动脉在光镜下具有完整的外弹力层,但内弹力层不完整;非肌型血管在光镜下仅有一层弹力层。
, 百拇医药
5.肺中、小肌型动脉相对中膜厚度及面积的测定:应用Q550 LW图像处理与分析系统对整个切片中内弹力层清晰、形状较规则的肺中、小肌型动脉进行分析。运用Leica Qwin软件测量每个血管的如下指标:经过血管轴心的外弹力层之间的最长外径和最短外径;内弹力层长度;内弹力层包围的面积;外弹力层包围的面积。根据Barth等[9]的方法计算不同切面角度及处于不同舒缩状态的血管之相对中膜厚度(RMT)及相对中膜面积(RMA)。每只大鼠测量5~10个肺中、小肌型动脉,分别测算肺中等肌型动脉(外径>50 μm,≤150 μm)和肺小肌型动脉(外径>15 μm,≤50 μm)RMT及RMA,并求其均值。
6.血浆NO间接含量测定:大鼠处死前,自颈总动脉取血2 ml,离心后吸取血浆0.1 ml,加9.3 mmol/L硫酸锌0.6 ml及双氧水0.4 ml,加入1 mol/L氢氧化钠0.1 ml后冰上孵育1 h。离心后取上清液0.6 ml加入双氧水及3 g/L磺胺,与6 mmol/L聚乙烯二胺盐酸盐反应1 h,以545 nm比色,读光密度值,按标准曲线计算NO间接含量。
, 百拇医药
7.原位杂交:将内皮素-1(ET-1) cDNA(长度1.1 Kb)经体外转录的方法获得以生物素标记的ET-1 cRNA探针,对各组大鼠肺组织标本做原位杂交。标本经二甲苯脱蜡及梯度乙醇处理后入水。以磷酸缓冲盐液(PBS)洗涤1 min后,于室温下以0.2 mol/L盐酸处理10 min。经PBS洗涤2 min×2次后以蛋白酶K(50 μg/ml),20 min,37℃处理,以40 g/L多聚甲醛于室温下固定10 min。每片滴加杂交液25 μl,用石蜡封口膜覆盖,于42℃保温24 h。系列标准柠檬酸盐-氯化钠液(SSC)洗涤,以1∶100马血清蛋白封闭。将以生物素标记cRNA探针原位杂交切片中加1∶100 ABC复合液,室温1 h。以过氧化物酶-联苯胺(DAB)显色体系,光学显微镜下检测原位杂交阳性信号,并采用半定量方法[10],对ET-1mRNA含量进行分析。棕黄色沉淀为杂交阳性信号。任一肺动脉内皮细胞无阳性信号者为阴性(-);1%~50%呈现阳性信号者为阳性(+);51%~100%呈现阳性信号者为强阳性(++)。对每只动物肺组织切片观察15~20只肺动脉。阴性对照片杂交时不加ET-1cRNA探针,其他操作程序完全相同。
, 百拇医药
8.统计学处理:组间差异显著性检验采用双因素方差分析及q检验。
结果
1.肺动脉压力(表1):mPAP在3组大鼠间差异有显著意义(P<0.05)。低氧组大鼠mPAP明显高于对照组(q=5.12, P<0.05)。低氧+L-Arg组大鼠mPAP明显低于低氧组(q=3.72, P<0.05),与 对照组相比差异无显著意义(q=1.41, P>0.05)。
表1 3组大鼠肺动脉平均压、肺动脉显微结构和血浆一氧化氮间接含量的变化(
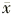 ±
±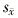 ) 组别
) 组别鼠数(只)
mPAP
, 百拇医药
(kPa)
三型肺小血管百分比(%)
相对中膜厚度(%)
相对中膜面积(%)
血浆NO间接
含量(μmol/L)
MA
PMA
NMV
肺中等MA
肺小MA
肺中等MA
, http://www.100md.com
肺小MA
对照组
6
2.05±
0.14
9.33±
0.53
7.07±
0.25
83.59±
0.56
7.70±
0.41
, 百拇医药
10.12±
0.60
14.76±
0.75
19.18±
1.08
4.79±
0.17
低氧组
6
2.71±
0.29*
16.04±
, http://www.100md.com
0.74**
10.32±
0.35**
73.64±
0.73**
9.94±
0.30**
15.15±
0.21**
18.87±
0.54**
, 百拇医药
27.99±
0.36**
3.54±
0.47
低氧+
L-Arg组
6
2.23±
0.18△
11.81±
0.24▲
9.30±
, http://www.100md.com
0.18
78.50±
0.25**▲
8.28±
0.12▲
11.86±
0.53▲
15.84±
0.22▲
22.26±
0.93*▲
, 百拇医药
5.21±
0.26△
F值
6.90
54.25
33.35
80.39
15.69
39.57
15.88
38.05
7.65
P值
, 百拇医药
<0.05
<0.001
<0.001
<0.001
<0.001
<0.001
<0.001
<0.001
<0.01
注:(1)mPAP:肺动脉平均压;MA:肌型动脉;PMA:部分肌型动脉;NMV:非肌型血管;(2)与对照组比较*P<0.05,**P<0.01;与低氧组比较,△P<0.05,▲P<0.01;(3)F值及P值为组间比较
, 百拇医药
2.三型肺小血管百分比(表1):三型肺小血管百分比在3组大鼠之间差异均有显著意义(P均<0.001)。低氧组大鼠肺小血管肌型动脉百分比明显高于对照组(q=14.57, P<0.01),低氧+L-Arg组大鼠肺小血管肌型动脉百分比明显低于低氧组(q=9.19, P<0.01),但仍高于对照组(q=5.38, P<0.01)。低氧组大鼠肺小血管非肌型血管百分比明显低于对照组(q=17.99,P<0.01), 低氧+L-Arg组大鼠肺小血管非肌型血管百分比明显高于低氧组(q=8.74,P<0.01),但仍低于对照组(q=9.19, P<0.01)。
3.肺中、小肌型动脉相对中膜厚度及面积(表1):肺中、小肌型动脉相对中膜厚度及面积在3组大鼠之间差异均有显著意义(P均<0.001)。低氧组大鼠肺中等肌型动脉RMT及RMA明显高于对照组(q=7.63,7.69, P均<0.01),肺小肌型动脉RMT及RMA也明显高于对照组(q=12.39,12.16, P均<0.01)。低氧+L-Arg组大鼠肺中等肌型动脉RMT及RMA明显低于低氧组(q=5.65, 5.65,P均<0.01),但与对照组相比差异无显著意义(q=1.98,2.04, P均>0.05)。肺小肌型动脉RMT及RMA明显低于低氧组(q=8.09, 7.9, P均<0.01),但仍高于对照组(q=4.3, 4.25, P均<0.05)。
, 百拇医药
4.肺中、小肌型动脉内皮细胞超微结构:对照组大鼠肺中、小肌型动脉内皮细胞胞体扁平,内衬血管内壁,结构正常;平滑肌细胞胞体小,呈收缩表型,胞浆被大量肌丝占据,并见许多致密斑(图1)。低氧组大鼠肺动脉内皮细胞呈立方型,部分突入管腔,呈阅兵式样,内皮细胞肿胀,胞浆内可见大量空泡,线粒体肿胀,内质网扩张;平滑肌细胞胞体肥大,不同程度向合成表型转化,胞浆中肌丝和致密斑减少,粗面内质网和游离核糖体等细胞器增多(图2)。低氧+L-Arg组大鼠肺动脉内皮细胞胞体扁平,内衬血管内壁,其肿胀程度较低氧组减轻,空泡明显减少;多数平滑肌细胞处于收缩表型,但少数仍处于过渡表型(图3)。

图1 对照组大鼠肺肌型动脉。内皮细胞扁平,结构正常。平滑肌细胞呈收缩表型,胞浆被大量肌丝和致密斑所占据 ×10 000

, http://www.100md.com
图2 低氧组大鼠肺肌型动脉。内皮细胞肿胀,胞浆内见大量空泡。平滑肌细胞呈合成表型,胞浆内可见大量游离核糖体,线粒体和内质网 ×20 000

图3 低氧+L-Arg组大鼠肺肌型动脉。内皮细胞扁平,空泡明显减少。平滑肌细胞呈收缩表型 ×20 000
5.血浆NO的间接含量(表1):血浆NO间接含量在3组大鼠之间差异有显著意义(P<0.001)。低氧组大鼠血浆NO间接含量明显低于对照组(q=3.94, P<0.05)。低氧+L-Arg组大鼠血浆NO间接含量明显高于低氧组(q=5.22, P<0.05), 但与对照组比较差异无显著意义(q=1.33,P>0.05)。
6.肺动脉内皮细胞ET-1 mRNA表达:低氧组大鼠大部分肺动脉(77%±7%)内皮细胞ET-1 mRNA表达呈阳性信号(+)(图4),但对照组(14%±7%)及低氧+L-Arg组(4%±4%)大鼠仅少数肺动脉内皮细胞显示ET-1 mRNA表达阳性信号(+),其差异有非常显著意义(q=9.32,10.86,P均<0.01),而对照组及低氧+L-Arg组大鼠肺动脉内皮细胞ET-1 mRNA表达差异无显著意义(q=1.54,P>0.05)。对照组(86%±7%)及低氧+L-Arg组(96%±4%)大鼠大部分肺动脉内皮细胞无ET-1 mRNA表达(图5),而低氧组大鼠仅少数肺动脉(23%±7%)内皮细胞无ET-1 mRNA表达,其差异有非常显著意义(q=9.32, q=10.86,P均<0.01),而对照组及低氧+L-Arg组大鼠肺动脉内皮细胞ET-1 mRNA表达差异无显著意义(q =1.54,P>0.05)。

, 百拇医药
图4 低氧大鼠肺动脉有1%~50%内皮细胞显示ET-1 mRNA杂交阳性信号 DAB显色,×250

图5 低氧+L-Arg组大鼠肺动脉内皮细胞ET-1 mRNA表达明显受到抑制 DAB显色,×400
讨论
低氧性肺动脉高压是临床众多心肺疾病发生发展过程中重要的病理生理环节[1]。低氧性肺血管结构重构是慢性低氧性肺动脉高压的重要病理基础,其主要特征是肺动脉平滑肌细胞增生、肥厚,中膜增厚,外周小血管肌化,以及细胞外基质的增多[2]。本研究发现,常压低氧2周大鼠肺动脉压力明显增高,肺血管结构重构,光镜下肺小血管中肌化程度明显增强;肺中、小肌型动脉RMT和RMA明显增加;电镜下肺动脉内皮细胞增生、肥厚、肿胀;中膜平滑肌细胞增生、肥大,并不同程度地向合成表型转化。同时低氧2周后大鼠血浆NO间接含量明显降低,而ET-1 mRNA表达明显增强。提示低氧后NO水平的降低和ET-1基因表达的增强可能参与了低氧性肺血管结构重构及低氧性肺动脉高压的形成。由此设想如能将NO水平升高和/或将ET-1水平降低可以防治低氧性肺血管结构重构,为临床治疗低氧性肺动脉高压提供了一条思路。
, 百拇医药
研究表明,外源性给予L-Arg和(或)NO可以缓解低氧性肺血管结构重构以及低氧性肺动脉高压的形成[3-5]。临床上已开始应用NO吸入的方法来治疗持续胎儿循环和胎粪吸入综合征等疾病,并已取得初步疗效[11]。但NO吸入费用高,仪器操作复杂,并有一定的毒副作用,因此限制了其临床应用。
L-Arg为NO合成的前体,它进入体内后经NO合酶催化生成NO。近年关于应用L-Arg干预低氧性肺血管结构重构的研究得到越来越多的重视,但其机制尚未完全清楚。体外实验证实,NO对血管平滑肌细胞的增殖有直接抑制作用[12],提示L-Arg干预低氧性肺血管结构重构的机制之一可能是通过NO的直接作用。另一方面体外实验还显示,NO可抑制脐静脉内皮细胞ET-1的合成与分泌,并可降低血浆ET-1水平[6]。我们以往的研究结果也提示,NO 对慢性低氧大鼠肺动脉ET-1基因表达有抑制作用[7]。而ET-1是目前发现的体内最强的缩血管活性多肽,并且具有强烈的促血管平滑肌增殖的作用[8]。由此间接提示L-Arg干预低氧性肺血管结构重构的另一可能机制是通过促进NO合成,从而对促进血管平滑肌细胞增殖因子ET-1的抑制作用。
, 百拇医药
为明确后一调节机制的可能性,我们将L-Arg对慢性低氧性肺动脉高压大鼠肺血管显微和超微结构、血浆NO的间接含量以及肺动脉内皮细胞ET-1 mRNA表达的影响进行了同步研究。结果表明,L-Arg使低氧性肺动脉高压大鼠肺动脉压力明显降低,肺小血管肌化程度明显减轻,肺中、小肌型动脉RMT和RMA明显降低,肺动脉超微结构的改变明显缓解;同时L-Arg使低氧大鼠血浆NO间接含量明显升高并且使低氧大鼠肺动脉内皮细胞ET-1 mRMA表达明显受抑制。提示L-Arg通过促进体内NO生成,从而抑制肺动脉内皮细胞ET-1 mRMA表达,对低氧性肺血管结构重构以及低氧性肺动脉高压的形成有重要的调节作用。
基金项目:国家自然科学基金资助项目(39470735, 39870844)
参考文献:
1 杜军保, 主编. 缺氧性肺动脉高压. 北京:北京医科大学、中国协和医科大学联合出版社, 1994. 79.
, http://www.100md.com
2 Vender RL. Chronic hypoxic pulmonary hypertension: cell biology to pathophysiology. Chest, 1994, 106: 236-243.
3 齐建光,杜军保. 内源性一氧化氮调节大鼠低氧性肺血管结构重构. 中华儿科杂志,1999,37:104-106.
4 林红, 蔡英年, 宋为, 等. L-精氨酸和硝普钠对缺氧大鼠肺动脉压及血管结构变化的影响 . 中国医学科学院学报 , 1997 , 19 : 179-184.
5 Mitani Y, Maruyama K, Sakurai M. Prolonged administration of L-Arginine ameliorates chronic pulmonary hypertension and pulmonary vascular remodeling in rats. Circulation, 1997, 96: 689-697.
, 百拇医药
6 Kourembanas S, Mcquillan LP, Leung GK. et al. Nitric oxide regulates the expression of vasoconstrictors and growth factors by vascular endothelium under both normoxia and hypoxia. J Clin Invest, 1993, 92: 99-104.
7 杜军保, 李万镇, 赵斌, 等. 一氧化氮对慢性缺氧大鼠肺动脉内皮素基因表达的影响 . 中华医学杂志 , 1997 , 77 : 263-265.
8 Janakidevi K, Fisher MA, Del Vecchio PJ, et al. Endothelin-1 stimulates DNA synthesis and proliferation of pulmonary artery smooth muscle cells. Am J Physiol, 1992, 263: C1295-C1301.
, http://www.100md.com
9 Barth PJ, Kimpel C, Roy S, et al. An improved mathematical approach for the assessment of the medial thickness of pulmonary arteries. Path Res Pract, 1993, 189: 567-576.
10 Hislop AA, Springall DR, Buttery LDK, et al. Abundance of endothelial nitric oxide synthase in newborn intrapulmonary arteries. Arch Dis Child, 1995, 73: F17-F21.
11 Roberts JD, Polaner DM, Lang P, et al. Inhaled nitric oxide reverses hypoxemia in persistent pulmonary hypertension of the newborns. Lancet, 1992, 340: 818-819.
12 Garg UC, Hassid A. Nitric oxide-generating vasodilators and 8-bromo-cyclic guanosine monophosphate inhibit mitogenesis and proferation of cultured rat vascular smooth muscle cells. J Clin Invest, 1989, 83: 1774-1777.
收稿日期:1999-08-24, http://www.100md.com