汉防己甲素延缓肾小球硬化机理的实验研究
作者:董兴刚 卢明 朱冬胜 叶传基 徐敏华 杨海春 曹和欣
单位:董兴刚 卢明 朱冬胜 叶传基 徐敏华(上海市第二人民医院肾内科,上海 200011)杨海春(复旦大学医学院华山医院肾内科);曹和欣(上海中医药大学曙光医院)
关键词:汉防己甲素转化生长因子-β1肾小球硬化
中国临床药理学与治疗学000304
目的 探讨汉防己甲素对肾小球硬化大鼠肾脏转化生长因子(TGF-β1)基因表达的影响。方法 27只雄性Wistar大鼠随机分为正常对照组、肾小球硬化模型组、汉防己甲素组和氨氯地平组,用单侧肾切除加2次注射阿霉素制备肾小球硬化动物模型,用Northern印迹杂交,观察肾皮质TGF-β1mRNA表达。结果 汉防己甲素使肾小球硬化大鼠肾皮质TGF-β1mRNA表达较模型组明显下调,肾小球细胞外基质较模型组明显减少。结论汉防己甲素通过下调TGF-β1表达而减少肾小球ECM沉积,从而延缓肾小球硬化。
, 百拇医药
中图分类号 R969.4
Study tetrandrine defer extraceller matrix mechanism DONG Xing-Gang LU Ming YANG Hai-Chun CAO He-Xing
ZHU Dong-Sheng YE Chuan-Ji XU Ming-Hua
(Department of Nephrology, Shanghai Second People's Hospital, Shanghai 200011)
Aim The effect of tetrandrine on TGF-β 1 mRNA expression in glomerulosclerosis rat was observed. Methods The rats were randomly divided into four groups, such as the normal control group (sham operative rat), glomerulosclerosis model group,tetrandrine group and amlodipine group. The expression of TGF-β 1 mRNA was analyzed by Northern blot hybridization. Results The expressions of TGF-β 1 mRNA in two treating groups were much lower than untreated model group. There were no difference between these two treating groups. Conclusion Tetrandrine can decrease the expression of TGF-β 1 mRNA in glomerulosclerosis rat induced by unilateral renctomy plus adriamycin.
, 百拇医药
Key Words tetrandrine; transforming growth factor-β 1; glomerulosclerosis
肾小球硬化,即肾小球细胞外基质(extracellarmatrix,ECM)增多[1]。目前对肾小球硬化的研究是国内外肾脏病研究的重要课题之一。汉防已甲素又名粉防已碱,近年的研究显示,汉防已甲素有延缓肾小球硬化的作用[7],但作用机理尚未明了。转化生长因子-β1(transforminggrowthfactorβ1,TGF-β1)是一种多功能、双向调节的细胞因子,它可导致并能反映肾小球硬化程度[2]。本研究以TGF-β1为指标,观察汉防己甲素对肾小球硬化的作用。
1材料和方法
1.1实验分组雄性Wistar大鼠,体重200~250g,8~10周龄,购自上海医科大学实验动物中心。随机分为4组,(1)正常对照组(n=9):等量蒸馏水灌胃;(2)肾小球硬化模型组(n=5):等量蒸馏水灌胃;(3)汉防己甲素组(n=8):汉防己甲素(浙江金华制药厂)10mg·kg-1·d-1灌胃;(4)氨氯地平组(n=5):氨氯地平(辉瑞制药有限公司)30mg·kg-1·d-1灌胃。以上各组用药自肾切除日开始到处死共12wk。
, 百拇医药
1.2肾小球硬化动物模型制备首先左肾切除,术后第1wk、4wk分别2次注射阿霉素5mg·kg-1。于12wk处死大鼠,处死前一天取血、尿标本。处死日摘右肾,行肾病理和分子生物学检测。
1.3尿蛋白定量用Coomassie亮蓝法。
1.4肾组织病理学检查肾皮质经10%中性福尔马林缓冲液固定后,浸蜡、包埋,切片约3μm,行PAS和HE染色。
1.5肾小球细胞外基质测定(1)肾小球面积:在高倍镜下顺序观察每张切片皮质部分5个肾小球,每组观察5张切片,运用Leica5001型定量图象分析仪(美国Leica仪器有限公司)测量每一个肾小球面积,包括肾小球毛细血管、系膜及上皮细胞足突等。(2)肾小球ECM面积,在上述定量图象分析仪上直接测定。
1.6Northernblot杂交肾皮质总RNA的抽提用异硫氰酸胍-苯酚-氯仿一步法[3],总RNA在紫外分光光度计上确定其量及纯度,所用总RNA的A260/A280值在1.80~2.00之间。1%琼脂糖甲醛变性电泳转至尼龙膜,预杂交、杂交、洗膜、放射自显影。用随机引物法标记探针,用α-32P-dCTP标记大鼠TGF-β1cDNA探针(复旦大学医学院肾脏病研究中心李新波博士赠)和GAPDH探针同时杂交。
, http://www.100md.com
1.7统计学处理数据以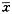 ±s表示,在SAS(6.04)版本统计软件包上进行统计学处理。
±s表示,在SAS(6.04)版本统计软件包上进行统计学处理。
2结果
2.1尿蛋白定量首次注射阿霉素后1wk,模型组和治疗组尿蛋白均超过150mg/24h,并随病程逐渐增多。
2.2肾小球ECM与肾小球面积之比(ECM/GA)正常组为0.26±0.01,模型组为0.39±0.02,两组相比,有显著性差异(P<0.01);汉防己甲素处理组为0.29±0.01,与模型对照组相比,有显著性差异(P<0.05),氨氯地平处理组为0.24±0.02,与模型组相比,也有显著性差异(P<0.05)。
2.3肾脏病理学改变PAS染色,光镜下模型组肾小球球囊粘连,系膜区扩张,汉防己甲素及氨氯地平两组球囊粘连均明显减轻。
, 百拇医药
2.4肾皮质TGF-β1mRNA表达与肾病理变化相对应,根据杂交带积分光密度(TJTY-300型医用图象处理系统,同济太阳电子科技公司)测定,各组结果见表1。
表1各组GAPDH/TGF-β1光密度比值比较(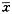 ±s) 组别
±s) 组别
n
GAPDH/TGF-β1
正常对照组
9
2.10±0.37
模型组
, 百拇医药
5
0.98±0.23△
汉防已甲素组
8
1.45±0.669*△
氨氯地平组
5
1.35±0.41*△
与正常组相比△P<0.05,与模型组相比*P<0.05
3讨论
单侧肾切除后,大鼠肾小球硬化区主要为Ⅲ型胶原沉积[4],两次注射阿霉素诱发的肾病综合征鼠肾脏可见局灶性节段性肾小球硬化[5]。单侧肾切除加两次注射阿霉素则诱发加速性肾小球硬化模型[6]。我们以往的研究[7]也表明,单侧肾切除加两次注射阿霉素为一病变稳定的研究ECM变化的肾小球硬化动物模型。
, 百拇医药
Takemura[8]在体外培养细胞的研究中发现,汉防己甲素为钙通道阻滞剂。
TGF-β1的基因为100kb,在肾小球疾病时,由于肾小球内皮细胞肿胀,肾小球毛细血管内径减少,则毛细血管壁的内切应力增高,由此激活NF-κB/Rel,促进TGF-β1mRNA的表达和TGF-β1的合成和释放[8],TGF-β1通过受体信号转导促进细胞合成胶原蛋白、纤连蛋白等细胞外基质,Yang[10]用原位杂交测定TGF-β1mRNA水平,结果肾小球硬化组TGF-β1/β-actinmRNA比值水平显著增高,并可有效地反映肾小球硬化程度,Isaka[2]将TGF-β1cDNA经脂质体由正常鼠一侧肾动脉导入,则该侧肾小球硬化,而对侧肾小球正常。Border[9]用抗TGF-β抗体治疗肾小球肾炎模型,结果发现肾小球ECM减少80%。以上实验和临床研究都提示TGF-β1过度表达,可导致肾小球硬化。
, 百拇医药
实验结果表明,汉防己甲素延缓肾小球硬化机理是通过下调肾皮质TGF-β1mRNA表达,减少肾小球ECM沉积,从而减轻了肾小球硬化。
(致谢:复旦大学医学院图像分析室李间教授在杂交带光密度测定提供帮助)
上海市跨世纪人才基金资助(№19980409)
黄兴刚,男,37岁,医学硕士,副主任医师,从事中医中药防治肾小球硬化及其机理的研究。
参考文献
1,董兴刚.肾小球基膜Ⅳ型胶原研究进展.国外医学泌尿系统分册,1996;16(4):150
2,Isaka Y,Fujiwara Y.Glomerulosclerosis induced by in vivo transfection of TGF-β 1 gene into the rat kidney.J Clin Invest,1993;92:2597
, 百拇医药
3,Chomczynski P,Sacchi N.Single-step method of RNA isolation by acidguanidium thiocyanate-phenol-chlo- roform extraction. Anal Biochem,1987;162:156
4,Adler S, Striker LJ.Studies of progressive glomerular sclerosis in the rat. Am J Pathol,1986;123:553
5,Bertani T, Rocchi G,Arends A, et al. Adriamycin induced chronic proteiuria: a new model of glomeru-lar focal scleroesis. Kidney Int,1983;23:211
, 百拇医药 6,魏林,王海燕,张友康,等.肾小球硬化过程中细胞外基质的动态变化.中华肾脏病杂志,1995;11:512
7,董兴刚,安增梅,杨海春,等.汉防己甲素对肾病综合征大鼠肾小球细胞外基质的作用.中华肾脏病杂志,2000;16(2):151
8,Takemura H,Imoto K,Ohshika H,et al. Tetrandrine as a calcium antagonist. Clin Exp Pharmacol,1996;23:715
9,Border WA.Extracellular matrix and glomerular dis-ease. Semin Nephrol,1989;9(4):301
10,Yang CW, Mai YS, Wu MS,et al. Extracellar matrix protein synthesis through induction of trans-forming growth factor β 1 expression in glomerular disease. Nephron,1997;77:29
2000-03-12收稿,2000-05-17修回, http://www.100md.com
单位:董兴刚 卢明 朱冬胜 叶传基 徐敏华(上海市第二人民医院肾内科,上海 200011)杨海春(复旦大学医学院华山医院肾内科);曹和欣(上海中医药大学曙光医院)
关键词:汉防己甲素转化生长因子-β1肾小球硬化
中国临床药理学与治疗学000304
目的 探讨汉防己甲素对肾小球硬化大鼠肾脏转化生长因子(TGF-β1)基因表达的影响。方法 27只雄性Wistar大鼠随机分为正常对照组、肾小球硬化模型组、汉防己甲素组和氨氯地平组,用单侧肾切除加2次注射阿霉素制备肾小球硬化动物模型,用Northern印迹杂交,观察肾皮质TGF-β1mRNA表达。结果 汉防己甲素使肾小球硬化大鼠肾皮质TGF-β1mRNA表达较模型组明显下调,肾小球细胞外基质较模型组明显减少。结论汉防己甲素通过下调TGF-β1表达而减少肾小球ECM沉积,从而延缓肾小球硬化。
, 百拇医药
中图分类号 R969.4
Study tetrandrine defer extraceller matrix mechanism DONG Xing-Gang LU Ming YANG Hai-Chun CAO He-Xing
ZHU Dong-Sheng YE Chuan-Ji XU Ming-Hua
(Department of Nephrology, Shanghai Second People's Hospital, Shanghai 200011)
Aim The effect of tetrandrine on TGF-β 1 mRNA expression in glomerulosclerosis rat was observed. Methods The rats were randomly divided into four groups, such as the normal control group (sham operative rat), glomerulosclerosis model group,tetrandrine group and amlodipine group. The expression of TGF-β 1 mRNA was analyzed by Northern blot hybridization. Results The expressions of TGF-β 1 mRNA in two treating groups were much lower than untreated model group. There were no difference between these two treating groups. Conclusion Tetrandrine can decrease the expression of TGF-β 1 mRNA in glomerulosclerosis rat induced by unilateral renctomy plus adriamycin.
, 百拇医药
Key Words tetrandrine; transforming growth factor-β 1; glomerulosclerosis
肾小球硬化,即肾小球细胞外基质(extracellarmatrix,ECM)增多[1]。目前对肾小球硬化的研究是国内外肾脏病研究的重要课题之一。汉防已甲素又名粉防已碱,近年的研究显示,汉防已甲素有延缓肾小球硬化的作用[7],但作用机理尚未明了。转化生长因子-β1(transforminggrowthfactorβ1,TGF-β1)是一种多功能、双向调节的细胞因子,它可导致并能反映肾小球硬化程度[2]。本研究以TGF-β1为指标,观察汉防己甲素对肾小球硬化的作用。
1材料和方法
1.1实验分组雄性Wistar大鼠,体重200~250g,8~10周龄,购自上海医科大学实验动物中心。随机分为4组,(1)正常对照组(n=9):等量蒸馏水灌胃;(2)肾小球硬化模型组(n=5):等量蒸馏水灌胃;(3)汉防己甲素组(n=8):汉防己甲素(浙江金华制药厂)10mg·kg-1·d-1灌胃;(4)氨氯地平组(n=5):氨氯地平(辉瑞制药有限公司)30mg·kg-1·d-1灌胃。以上各组用药自肾切除日开始到处死共12wk。
, 百拇医药
1.2肾小球硬化动物模型制备首先左肾切除,术后第1wk、4wk分别2次注射阿霉素5mg·kg-1。于12wk处死大鼠,处死前一天取血、尿标本。处死日摘右肾,行肾病理和分子生物学检测。
1.3尿蛋白定量用Coomassie亮蓝法。
1.4肾组织病理学检查肾皮质经10%中性福尔马林缓冲液固定后,浸蜡、包埋,切片约3μm,行PAS和HE染色。
1.5肾小球细胞外基质测定(1)肾小球面积:在高倍镜下顺序观察每张切片皮质部分5个肾小球,每组观察5张切片,运用Leica5001型定量图象分析仪(美国Leica仪器有限公司)测量每一个肾小球面积,包括肾小球毛细血管、系膜及上皮细胞足突等。(2)肾小球ECM面积,在上述定量图象分析仪上直接测定。
1.6Northernblot杂交肾皮质总RNA的抽提用异硫氰酸胍-苯酚-氯仿一步法[3],总RNA在紫外分光光度计上确定其量及纯度,所用总RNA的A260/A280值在1.80~2.00之间。1%琼脂糖甲醛变性电泳转至尼龙膜,预杂交、杂交、洗膜、放射自显影。用随机引物法标记探针,用α-32P-dCTP标记大鼠TGF-β1cDNA探针(复旦大学医学院肾脏病研究中心李新波博士赠)和GAPDH探针同时杂交。
, http://www.100md.com
1.7统计学处理数据以
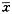 ±s表示,在SAS(6.04)版本统计软件包上进行统计学处理。
±s表示,在SAS(6.04)版本统计软件包上进行统计学处理。2结果
2.1尿蛋白定量首次注射阿霉素后1wk,模型组和治疗组尿蛋白均超过150mg/24h,并随病程逐渐增多。
2.2肾小球ECM与肾小球面积之比(ECM/GA)正常组为0.26±0.01,模型组为0.39±0.02,两组相比,有显著性差异(P<0.01);汉防己甲素处理组为0.29±0.01,与模型对照组相比,有显著性差异(P<0.05),氨氯地平处理组为0.24±0.02,与模型组相比,也有显著性差异(P<0.05)。
2.3肾脏病理学改变PAS染色,光镜下模型组肾小球球囊粘连,系膜区扩张,汉防己甲素及氨氯地平两组球囊粘连均明显减轻。
, 百拇医药
2.4肾皮质TGF-β1mRNA表达与肾病理变化相对应,根据杂交带积分光密度(TJTY-300型医用图象处理系统,同济太阳电子科技公司)测定,各组结果见表1。
表1各组GAPDH/TGF-β1光密度比值比较(
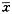 ±s) 组别
±s) 组别n
GAPDH/TGF-β1
正常对照组
9
2.10±0.37
模型组
, 百拇医药
5
0.98±0.23△
汉防已甲素组
8
1.45±0.669*△
氨氯地平组
5
1.35±0.41*△
与正常组相比△P<0.05,与模型组相比*P<0.05
3讨论
单侧肾切除后,大鼠肾小球硬化区主要为Ⅲ型胶原沉积[4],两次注射阿霉素诱发的肾病综合征鼠肾脏可见局灶性节段性肾小球硬化[5]。单侧肾切除加两次注射阿霉素则诱发加速性肾小球硬化模型[6]。我们以往的研究[7]也表明,单侧肾切除加两次注射阿霉素为一病变稳定的研究ECM变化的肾小球硬化动物模型。
, 百拇医药
Takemura[8]在体外培养细胞的研究中发现,汉防己甲素为钙通道阻滞剂。
TGF-β1的基因为100kb,在肾小球疾病时,由于肾小球内皮细胞肿胀,肾小球毛细血管内径减少,则毛细血管壁的内切应力增高,由此激活NF-κB/Rel,促进TGF-β1mRNA的表达和TGF-β1的合成和释放[8],TGF-β1通过受体信号转导促进细胞合成胶原蛋白、纤连蛋白等细胞外基质,Yang[10]用原位杂交测定TGF-β1mRNA水平,结果肾小球硬化组TGF-β1/β-actinmRNA比值水平显著增高,并可有效地反映肾小球硬化程度,Isaka[2]将TGF-β1cDNA经脂质体由正常鼠一侧肾动脉导入,则该侧肾小球硬化,而对侧肾小球正常。Border[9]用抗TGF-β抗体治疗肾小球肾炎模型,结果发现肾小球ECM减少80%。以上实验和临床研究都提示TGF-β1过度表达,可导致肾小球硬化。
, 百拇医药
实验结果表明,汉防己甲素延缓肾小球硬化机理是通过下调肾皮质TGF-β1mRNA表达,减少肾小球ECM沉积,从而减轻了肾小球硬化。
(致谢:复旦大学医学院图像分析室李间教授在杂交带光密度测定提供帮助)
上海市跨世纪人才基金资助(№19980409)
黄兴刚,男,37岁,医学硕士,副主任医师,从事中医中药防治肾小球硬化及其机理的研究。
参考文献
1,董兴刚.肾小球基膜Ⅳ型胶原研究进展.国外医学泌尿系统分册,1996;16(4):150
2,Isaka Y,Fujiwara Y.Glomerulosclerosis induced by in vivo transfection of TGF-β 1 gene into the rat kidney.J Clin Invest,1993;92:2597
, 百拇医药
3,Chomczynski P,Sacchi N.Single-step method of RNA isolation by acidguanidium thiocyanate-phenol-chlo- roform extraction. Anal Biochem,1987;162:156
4,Adler S, Striker LJ.Studies of progressive glomerular sclerosis in the rat. Am J Pathol,1986;123:553
5,Bertani T, Rocchi G,Arends A, et al. Adriamycin induced chronic proteiuria: a new model of glomeru-lar focal scleroesis. Kidney Int,1983;23:211
, 百拇医药 6,魏林,王海燕,张友康,等.肾小球硬化过程中细胞外基质的动态变化.中华肾脏病杂志,1995;11:512
7,董兴刚,安增梅,杨海春,等.汉防己甲素对肾病综合征大鼠肾小球细胞外基质的作用.中华肾脏病杂志,2000;16(2):151
8,Takemura H,Imoto K,Ohshika H,et al. Tetrandrine as a calcium antagonist. Clin Exp Pharmacol,1996;23:715
9,Border WA.Extracellular matrix and glomerular dis-ease. Semin Nephrol,1989;9(4):301
10,Yang CW, Mai YS, Wu MS,et al. Extracellar matrix protein synthesis through induction of trans-forming growth factor β 1 expression in glomerular disease. Nephron,1997;77:29
2000-03-12收稿,2000-05-17修回, http://www.100md.com