高温诱导BcaCD885颊癌细胞凋亡及检测
作者:王升志 何永文 毛祖彝 刘流 童昕 洪晓军
单位:王升志(汕头大学医学院一附院515041);洪晓军(汕头大学医学院一附院515041);何永文(昆明医学院口腔系);刘流(昆明医学院口腔系);毛祖彝(华西医科大学口腔医学院);童昕(华西医科大学口腔医学院)
关键词:高温;BcaCD885细胞;凋亡;原位末端标记
口腔颌面外科杂志000316 摘 要:目的 探讨热诱导BcaCD885颊癌细胞凋亡的动力学改变及热杀伤肿瘤细胞的机理。方法 水浴加温诱导BcaCD885细胞产生凋亡。通过细胞形态观察、原位末端标记、DNA电泳及流式细胞术DNA测定,从形态学、生物化学、分子生物学以及细胞学水平确定凋亡细胞特征。结果 BcaCD885细胞经43°C 40min加热,呈现细胞凋亡形态改变,TUNEL标记见明显的凋亡小体,DNA电泳呈现有一定间隔的梯状条带。同时细胞周期发生了明显的特异性改变:G0/G1期百分比增加,S期百分比下降,G2/M期百分比在加热后3h时也发生了明显的下降。45°C 40min加热则出现明显的坏死改变。结论 高温杀伤BcaCD885细胞存在细胞坏死和细胞凋亡两种方式,治癌温度是通过诱导细胞凋亡发挥作用。高温诱导BcaCD885细胞的凋亡具细胞周期特异性。
, http://www.100md.com
中图分类号:R739.8 文献标识码:A 文章编号:1005-4979(2000)03-0239-04
APOPTOSIS INDUCED BY HYPERTHERMIA IN BCACD885 CELLS
WANG Seng-zhi,(The First Affilicated Hospital,SUMC. Shantou 515041)
HE Yong-wen,(Stomatological Department of Kunming Medical College,Kunming,650000)
MAO Zu-yi,et al.
(College of Stomatology,WCUMS,Chengdu,610041)
, 百拇医药
Abstract:Objective Apoptosis is an active process of cell suicide induced by external signals and is a major mode of cell death under physilogical conditions. Treating cancers with hyperthermia may act through induction of apoptosis. So we study the apoptosis induced by hyperthermia in BcaCD885 cells,and to study the characteristics of apoptosis cells on molecular biological levels. It is possible that hyperthemia combine with gene therapeutics can be used in clinic. Method After inducing apoptosis through hyperthermia (different temperature 37°C,43°C,45°C and 40 min) 12 hrs,we studied the characteristics of apoptostic BcaCD885 cells on morpholgical,biochemicial,molecular biological and cellular levels with morphological observative,DNA gel electrophoresis,TUNEL staining and flow cytometry analysis. Results 1. The morphological characters of BcaCD885 cells were tested by microscopy and electron microscopy. The group of 37°C,cells growth well,the organelle in cytoplasm is intact. The goup of 43°C,cells shrink and apoptotic boby appears,endoplasm concentrain,nucleus disappear. The group of 45°C,cytonecrosis,cellorgan rupture,cytomembrance destruction. 2. TUNEL staining and DNA gel eletrophoresis. The group of 37°C,only little cell can be stained and DNA spectrum is not clear. There are a lot of staining cells and many apoptotic body in the group of 43°C. In 43°C groupp,DNA typical ladder type line spectrum was appeared. In the group of 45°C,can see mass undertint staining cells. The character is cytonecrosis. DNA spectrum is widerspreadd and patchy. 3. Flow cytometry analysis. DAN content was determined after 43°C,40 min in 0 h,3 h,6 h,12 h,24 h,48 h. 37°C、 40 min group was control group. By t test we found that in 0 h group DNA content was close to control group (P>0.05),and we found there were statistical significance (P<0.05) between others groups and control group. The population in the G0/G1 phase of the cell cycle significantly increased and the population in the S phase significantly decreased with a concomitant increase in apoptotic cells. Conclusion Necrosis and apoptosis are two manners to kill BcaCD885 cells. In 43°C cells dided by apoptosis mode and in 45°C by necrosis model. It is interesting that the temperature in clinic local hypoerthermic treatment cancer is 43°C. So we think that hypperthemia kill cancinoma cells by apoptotic manner. In this experment,DNA content analysis indicate that it is active death progress of carcinoma cells in hyperthermic treatment at 43°C.
, 百拇医药
Key words:Hyperthermia; BcaCD885 cells; Apoptosis; TUNEL
Vidai和Dewey报道热诱导细胞调亡有两个独特的模型:慢死亡和快死亡。慢死亡是指细胞受热后,在失去再生能力之前能够维持生理活动几天,分裂与染色体畸变,多核细胞形成以及有丝分裂异常有关。快死亡是指细胞受热后几天内发生的死亡,其特征是细胞脱离其培养表面。关于快死亡的机制可能与热诱导细胞凋亡有关[1]。本研究以水浴加温诱导颊癌细胞产生凋亡,通过细胞形态观察、原位末端标记、DNA电泳及流式细胞术DNA测定,从形态学、生物化学、分子生物学以及细胞学水平确定凋亡细胞特征,探讨热诱导BcaCD885颊癌细胞凋亡的动力学改变及热杀伤肿瘤细胞的机理。
1 材料与方法
1.1 主要仪器设备
Shellab Model 2300型自控式CO2孵箱(Shellab公司);YJ-450型超净工作台(苏州净化设备厂);倒置显微镜(日本Olympus公司);JEM-100SX型透射电镜(日本电子公司);低温高速台式离心机(德国5403型);Elite ESP型流式细胞仪(FCM)(美国Coulter公司);BS2型电热恒温水浴箱(北京医疗设备厂)。
, 百拇医药
1.2 主要试剂
RPMI 1640培养基(美国GIBCO BRL公司产品);2%苔盼蓝染液;Giemsa染液;TUNEL原位末端标记试剂盒(德国Boehringer Mannheim公司产品);TRIzol试剂(美国GIBCO BRL公司产品);碘化丙啶(PI)(美国Sigma公司产品)。
1.3 细胞来源
人颊癌细胞系Bca CD885由华西医科大学口腔医学院提供
1.4 实验方法
1.4.1 细胞培养 BcaCD885颊癌细胞解冻复苏,于含10%小牛血清的RPMI 1640培养基、37°C、5% CO2条件下培养。取处于对数生长期的细胞,调整细胞浓度为1×106/ml,按实验分组,接种等量细胞于50ml培养瓶内或放置有盖玻片的60mm培养皿内,使细胞单层生长于盖玻片上,形成细胞爬片,24h后用于实验。
, http://www.100md.com
1.4.2 细胞加热 37°C、43°C、45°C水浴40min后,再置37°C、5%CO2孵箱中培养12h;43°C水浴40min后,再置37°C、5%CO2孵箱中培养0h、3h、6h、12h、24h、48h。
1.4.3 活细胞计数 培养细胞弃培养液,0.25%胰蛋白酶1ml消化10min,弃消化液,加Hank's液终止消化,吹打制成细胞悬液,取20μl细胞悬液,加20μl 2%苔盼蓝染液,混匀后行活细胞计数,拒染细胞为活细胞,蓝色细胞为死亡细胞。
1.4.4 细胞形态学检测
(1) 倒置显微镜观察细胞的生长情况及形态变化。
(2) Giemsa染色:培养细胞弃培养液,Hank's液漂洗3次,取出细胞爬片,4%多聚甲醛(以pH 7.4 0.01mol/L PBS配制)室温下固定30min,Giemsa染色10min,自来水冲洗,室温下风干,光镜下观察。
, http://www.100md.com
(3) 透射电镜观察:收集细胞,2.5%戊二醛4°C固定24h,1%四氧化锇后固定,丙酮梯度脱水,经包埋剂浸透后环氧树脂包埋,超薄切片,醋酸铀和枸橼酸铅双重染色,透射电镜观察。
1.4.5 TUNEL原位末端标记 同上固定爬片细胞,PBS洗,0.1% Triton-X-100(0.1%柠檬酸配制)4°C打孔5min,PBS洗,加50μl TUNEL反应混合液(由末端脱氧核苷酸转移酶液和荧光素标记液按1∶1配成),37°C孵60min,PBS洗,加50μl碱性磷酸酶抗荧光素抗体,37°C孵30min,室温下50μl快红显色10min,PBS洗后封片,光镜下观察。以PBS代替末端脱氧核苷酸转移酶液为阴性对照。
1.4.6 DNA电泳 培养细胞,充培养液,TRIzol试剂法提取细胞总DNA,加样于含0.5μg/ml溴化乙锭(EB)的1.8%琼脂糖凝胶中,60V电泳2h,紫外灯下观察并照相。
, 百拇医药 1.4.7 FCM-DNA检测 培养细胞,弃培养液,0.25%胰蛋白酶1ml消化10min,充消化液,加Hank's液终止消化,2000r/min离心3min,弃上清,75%冷乙醇悬浮细胞,4°C固定过夜,PBS洗去乙醇,加PI至终浓度为50μg/ml,混匀,4°C避光30min,Coulter公司Elite ESP型流式细胞仪上检测,激光光源为氩离子激光,波长为488nm。检测前以标准微球校准仪器使其变异系数(CV)<2%,并以正常人外周血淋巴细胞为DNA含量标准样品,测出各组细胞DNA含量及各细胞周期所占百分比,以G0/G1前期亚二倍体峰为凋亡峰。
1.5 统计分析处理
组间差异分析采用t检验。
2 结果
2.1 细胞形态学特征
, http://www.100md.com
37°C水浴40min后12h组(对照组),倒置显微镜下观察,BcaCD885颊癌细胞贴壁生长良好,呈圆形、多角形、大小不一;Giemsa染色,光镜下见细胞形态完整,细胞核大,核仁明显;透射电镜见典型的恶性病理改变,胞质内细胞器完整。
43°C水浴40min后12h组,倒置显微镜下观察,细胞皱缩、变圆,呈浮起状,核凝集,胞浆浓缩呈泡状;Giemsa染色见细胞浆浓缩,胞核致密浓染或裂解形成凋亡小体,核仁消失,包膜完整;透射电镜下,见细胞染色质固缩聚集于核膜下,核仁消失,细胞浆浓缩,细胞器退变,胞膜突起或皱缩,但胞膜连续性存在。这些形态改变表明颊癌细胞呈现细胞凋亡现象。
45°C水浴40min后12h组,细胞出现明显的坏死改变,细胞肿胀、胞膜破坏、连续性中断、细胞器破裂。
2.2 细胞DNA断裂表现
用TUNEL法标记,快红显色可见,43°C水浴40min后12h组,大量细胞红染,散在分布,并可见明显的凋亡小体;45°C水浴40min后12h组也可见阳性染色细胞,但着色浅,成片状分布,具细胞坏死的形态特征;而37°C对照组,仅见个别细胞阳性着色。在琼脂糖凝胶电脉上,对照组仅在近电泳点样处出现基因组条带,43°C水浴40min后12h组,呈现有一定间隔的梯状条带,而45°C水浴40min后12h组,则呈模糊的无间隔的片状条带。
, http://www.100md.com
2.3 细胞周期分析
43°C水浴40min后,细胞周期发生明显改变,并在G1峰前出现“亚G1峰”,即凋亡峰。其凋亡率在加热结束时,与对照组无明显差别(P>0.05),但37°C孵育后,凋亡率快速升高,6h时高达73.75%,与对照组相比,有显著的差异性(P<0.05),而此时苔盼蓝拒染实验证实相应的活细胞数为88.25%。之后,凋亡率缓慢恢复,48h后降至27.97%。同时,细胞各周期所占百分比也发生相应变化,G0/G1期细胞随凋亡率升高而增多,S期细胞则减少,G2/M期细胞百分比在加热后3h也发生了明显下降(P<0.05)(表1)。
表1 43°C 40min加热后不同时间BcaCD885细胞DNA含量变化(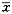 ±s)(n=4) 组别
±s)(n=4) 组别
, 百拇医药
活细胞(%)
凋亡细胞(%)
细胞周期分布(%)
G0/G1
S
G2/M
对照组
93.3750±1.523
3.7750±0.670
37.2500±2.198
44.1250±3.015
, 百拇医药
17.6250±4.301
0h
97.6500±3.414
5.9750±1.497
35.2250±3.377
45.8750±4.525
18.9000±7.708
3h
90.7550±8.321
52.2000±5.307*
61.0000±2.708*
, 百拇医药
31.3750±1.580*
7.6000±4.078*
6h
88.2500±7.950
73.7500±8.180*
53.4500±4.930*
37.7000±1.865*
8.8500±3.214
12h
87.4650±3.563
, 百拇医药
65.5000±7.601*
49.2500±2.946*
37.1250±5.480*
13.6500±8.296
24h
92.3450±4.347
58.7500±2.589*
46.9500±6.238
30.8750±9.365
22.1750±5.164
, http://www.100md.com
48h
90.6340±9.377
27.9750±5.417*
37.5750±4.208
38.7750±3.632
22.5750±3.439
* 与对照组相比P<0.05
3 讨论
细胞凋亡这一概念首先由英国Kerr在1972年提出。凋亡与坏死不同,其发生具有积极的生物学意义,它为维持机体内环境稳定所必需,在肿瘤发生与消退及治疗中,凋亡也起着重要作用。细胞在受到外界不利因素影响时,细胞的生理代谢与调节过程发生变化,结果有可能出现DNA断裂和形态改变,产生细胞凋亡。
, http://www.100md.com
形态学上,细胞凋亡与坏死具有明显的差异[2,3]。本实验将BcaCD885颊癌细胞43°C加热40min后,发现细胞发生典型的凋亡形态学改变,细胞皱缩、变圆,呈浮起状,核染色质凝聚浓染,核仁消失,核裂解,胞浆浓缩,胞膜出泡,凋亡小体形成。表明加温能诱导颊癌细胞的凋亡。但45°C加热处理,细胞则出现明显的坏死形态学改变。
凋亡细胞DNA在核小体间的断裂是其特征性变化,这一变化是由于内源性核酸内切酶基因的活动和表达而造成的结果。其DNA的断片大小是有规律的,为核小体DNA长度的整倍数,即180~200bp的整倍数。因此,进行琼脂糖凝胶电泳时可见到特征性的梯形现象(DNA ladder)。在鼠胸腺细胞,地塞米松处理90min就可检测到DNA ladder,而细胞活力性在4~6h后才消失,说明DNA的断裂发生于细胞活力消失之前[4]。同时,细胞凋亡时,DNA双链或单链断裂出现缺口,即产生一系列3′-OH末端,外源性脱氧核糖核苷酸末端转移酶(TdT)能够催化外源性荧光素或酶标记的dUTP连接到DNA的3′-OH末端,在荧光显微镜或光镜下检测细胞的荧光或酶与底物作用的显色强度或量,就能在单细胞水平对细胞凋亡进行定性定量研究。此法即为缺口末端标记法(TUNEL)。本实验BcaCD885细胞经43°C 40min加热后,DNA电泳呈现典型梯状现象,TUNEL原位末端标记显示大量凋亡细胞出现。45°C加热组却呈现细胞坏死特征。这一结果与Onezawa等对鼠恶性成纤维组织细胞瘤的体外加温治疗研究结果相似[5]。
, 百拇医药
综上所述,高温杀伤颊癌细胞的途径包括凋亡和坏死两种43°C加热处理,细胞出现凋亡,而45°C加热处理,则发生坏死。43°C正是临床采用的局部高温治癌温度,同时,在癌肿消退过程中,并未见肿瘤坏死脱落。因而我们认为,热疗是通过凋亡途径杀死肿瘤细胞。
流式细胞术(FCM)是在单细胞水平上检测凋亡细胞的一种简便、快速的方法,并可同时进行细胞周期分析,研究凋亡与细胞周期的关系。在凋亡发生过程中,限制性内切酶被激活,DNA链断裂,当用乙醇固定或使用含去污剂染色液进行DNA荧光标记时,胞膜通透性增加,使断裂的DNA从细胞漏出,因此,FCM测定凋亡细胞的DNA含量低于正常细胞,在DNA直方图上表现为G0/G1期峰前有一亚峰(“亚G1”峰)[6]。坏死细胞因DNA无序断裂,胞膜破坏,DNA含量亦减少,同时凋亡峰的形成受到细胞碎片的干扰。本实验在收集细胞时,低速短时离心以洗去细胞碎片,并行苔盼蓝染色,活细胞计数拒染率在87%以上,故所测得低DNA含量细胞即为凋亡细胞。本实验经43°C加热BcaCD885细胞40min后细胞G1峰前出现了凋亡峰,从另一方面证实了DNA断裂的存在。43°C 40min加热后0h BcaCD885细胞凋亡率无明显变化,而3h后,凋亡率开始明显升高,6h达高峰,之后开始缓慢下降,说明43°C加热后,需再经37°C诱导细胞才能出现凋亡,提示43°C高温治癌是肿瘤细胞的一主动死亡过程。
, 百拇医药
细胞动态平衡依赖于细胞增殖、分化和死亡的正确关系,细胞的凋亡和增殖通过细胞周期调节因子相连系。凋亡诱导因素影响着细胞的增殖和死亡。Takasu等的研究结果表明,热诱导HL-60细胞凋亡过程中,凋亡率的升高伴发G1期细胞及S期细胞数量减少,随着S期细胞数量的增加,G1期细胞也增加。同时热疗后G2-M期细胞数量增加,作者认为这可能与p53缺乏有关,也可能与细胞周期素及周期激酶活性改变有关,当细胞内存在突变型p53或缺乏野生型p53时,细胞对各种毒性刺激后,发生G2期休止[7]。Ikenaya等的研究则表明,热诱导直肠癌细胞后,发生G0/G1期休止,与p16表达存在相关性,而与p53无关[8]。本实验43°C加热BcaCD885细胞40min后,细胞周期发生了明显的特异性改变。G0/G1期百分比增加,S期百分比下降,G2/M期百分比在3h时也发生了明显下降。
, http://www.100md.com
基金项目:本课题由国家自然科学基金资助(39670788)云南省自然科学基金资助(1999.C0007)
作者简介:王升志(1965-),男,山东烟台,博士.
参考文献:
[1] Vidai C & Dewey WC. Two distinct modes of hyperthermic cell death [J]. Radiat Res,1988;116(1):157-171.
[2] Kroemer G,Dallaporta B & Resche-Rigon M. The mitochondrial death/life regulator in apoptosis and necrosis[J]. Annu Rev Physiol,1998;60:619-642.
, 百拇医药
[3] 石运伯,王若翔,时玉舫.细胞凋亡的分子机理[J].生命科学,1996;8(3):8-12.
[4] Wyllie AH. Glucocorticoid-induced thymocytes apoptosis is associated with endonuclease activation[J]. Nature,1980;284:555-556.
[5] Yonezawa M,Otsuka T,Matsui N,et al. Hyperthermia induces apaptosis in malignant fibrous histocytoma cells in vitro[J]. Int J Cancer,1996;66(3):347-351.
[6] Darzynkiewicz Z,Bruno S,Del Bino G,et al. Features of apoptotic cells measured by flow cytometry[J]. Cytometry,1992;13:795.
, 百拇医药
[7] Takasu T,Lyons JC,Park HJ,et al. Apoptosis and perturbation of cell cycle progression in an acidic enviroment after hyperthermia[J]. Cancer Res,1998;58(12):2504-2508.
[8] Ikenaya M,Takano Y,Saegusa M,et al. Apoptosis of colon cancers assessed by in situ DNA nick end labeling method[J]. Pathol Int,1996;46(1):33-37.
收稿日期:2000-01-22, 百拇医药
单位:王升志(汕头大学医学院一附院515041);洪晓军(汕头大学医学院一附院515041);何永文(昆明医学院口腔系);刘流(昆明医学院口腔系);毛祖彝(华西医科大学口腔医学院);童昕(华西医科大学口腔医学院)
关键词:高温;BcaCD885细胞;凋亡;原位末端标记
口腔颌面外科杂志000316 摘 要:目的 探讨热诱导BcaCD885颊癌细胞凋亡的动力学改变及热杀伤肿瘤细胞的机理。方法 水浴加温诱导BcaCD885细胞产生凋亡。通过细胞形态观察、原位末端标记、DNA电泳及流式细胞术DNA测定,从形态学、生物化学、分子生物学以及细胞学水平确定凋亡细胞特征。结果 BcaCD885细胞经43°C 40min加热,呈现细胞凋亡形态改变,TUNEL标记见明显的凋亡小体,DNA电泳呈现有一定间隔的梯状条带。同时细胞周期发生了明显的特异性改变:G0/G1期百分比增加,S期百分比下降,G2/M期百分比在加热后3h时也发生了明显的下降。45°C 40min加热则出现明显的坏死改变。结论 高温杀伤BcaCD885细胞存在细胞坏死和细胞凋亡两种方式,治癌温度是通过诱导细胞凋亡发挥作用。高温诱导BcaCD885细胞的凋亡具细胞周期特异性。
, http://www.100md.com
中图分类号:R739.8 文献标识码:A 文章编号:1005-4979(2000)03-0239-04
APOPTOSIS INDUCED BY HYPERTHERMIA IN BCACD885 CELLS
WANG Seng-zhi,(The First Affilicated Hospital,SUMC. Shantou 515041)
HE Yong-wen,(Stomatological Department of Kunming Medical College,Kunming,650000)
MAO Zu-yi,et al.
(College of Stomatology,WCUMS,Chengdu,610041)
, 百拇医药
Abstract:Objective Apoptosis is an active process of cell suicide induced by external signals and is a major mode of cell death under physilogical conditions. Treating cancers with hyperthermia may act through induction of apoptosis. So we study the apoptosis induced by hyperthermia in BcaCD885 cells,and to study the characteristics of apoptosis cells on molecular biological levels. It is possible that hyperthemia combine with gene therapeutics can be used in clinic. Method After inducing apoptosis through hyperthermia (different temperature 37°C,43°C,45°C and 40 min) 12 hrs,we studied the characteristics of apoptostic BcaCD885 cells on morpholgical,biochemicial,molecular biological and cellular levels with morphological observative,DNA gel electrophoresis,TUNEL staining and flow cytometry analysis. Results 1. The morphological characters of BcaCD885 cells were tested by microscopy and electron microscopy. The group of 37°C,cells growth well,the organelle in cytoplasm is intact. The goup of 43°C,cells shrink and apoptotic boby appears,endoplasm concentrain,nucleus disappear. The group of 45°C,cytonecrosis,cellorgan rupture,cytomembrance destruction. 2. TUNEL staining and DNA gel eletrophoresis. The group of 37°C,only little cell can be stained and DNA spectrum is not clear. There are a lot of staining cells and many apoptotic body in the group of 43°C. In 43°C groupp,DNA typical ladder type line spectrum was appeared. In the group of 45°C,can see mass undertint staining cells. The character is cytonecrosis. DNA spectrum is widerspreadd and patchy. 3. Flow cytometry analysis. DAN content was determined after 43°C,40 min in 0 h,3 h,6 h,12 h,24 h,48 h. 37°C、 40 min group was control group. By t test we found that in 0 h group DNA content was close to control group (P>0.05),and we found there were statistical significance (P<0.05) between others groups and control group. The population in the G0/G1 phase of the cell cycle significantly increased and the population in the S phase significantly decreased with a concomitant increase in apoptotic cells. Conclusion Necrosis and apoptosis are two manners to kill BcaCD885 cells. In 43°C cells dided by apoptosis mode and in 45°C by necrosis model. It is interesting that the temperature in clinic local hypoerthermic treatment cancer is 43°C. So we think that hypperthemia kill cancinoma cells by apoptotic manner. In this experment,DNA content analysis indicate that it is active death progress of carcinoma cells in hyperthermic treatment at 43°C.
, 百拇医药
Key words:Hyperthermia; BcaCD885 cells; Apoptosis; TUNEL
Vidai和Dewey报道热诱导细胞调亡有两个独特的模型:慢死亡和快死亡。慢死亡是指细胞受热后,在失去再生能力之前能够维持生理活动几天,分裂与染色体畸变,多核细胞形成以及有丝分裂异常有关。快死亡是指细胞受热后几天内发生的死亡,其特征是细胞脱离其培养表面。关于快死亡的机制可能与热诱导细胞凋亡有关[1]。本研究以水浴加温诱导颊癌细胞产生凋亡,通过细胞形态观察、原位末端标记、DNA电泳及流式细胞术DNA测定,从形态学、生物化学、分子生物学以及细胞学水平确定凋亡细胞特征,探讨热诱导BcaCD885颊癌细胞凋亡的动力学改变及热杀伤肿瘤细胞的机理。
1 材料与方法
1.1 主要仪器设备
Shellab Model 2300型自控式CO2孵箱(Shellab公司);YJ-450型超净工作台(苏州净化设备厂);倒置显微镜(日本Olympus公司);JEM-100SX型透射电镜(日本电子公司);低温高速台式离心机(德国5403型);Elite ESP型流式细胞仪(FCM)(美国Coulter公司);BS2型电热恒温水浴箱(北京医疗设备厂)。
, 百拇医药
1.2 主要试剂
RPMI 1640培养基(美国GIBCO BRL公司产品);2%苔盼蓝染液;Giemsa染液;TUNEL原位末端标记试剂盒(德国Boehringer Mannheim公司产品);TRIzol试剂(美国GIBCO BRL公司产品);碘化丙啶(PI)(美国Sigma公司产品)。
1.3 细胞来源
人颊癌细胞系Bca CD885由华西医科大学口腔医学院提供
1.4 实验方法
1.4.1 细胞培养 BcaCD885颊癌细胞解冻复苏,于含10%小牛血清的RPMI 1640培养基、37°C、5% CO2条件下培养。取处于对数生长期的细胞,调整细胞浓度为1×106/ml,按实验分组,接种等量细胞于50ml培养瓶内或放置有盖玻片的60mm培养皿内,使细胞单层生长于盖玻片上,形成细胞爬片,24h后用于实验。
, http://www.100md.com
1.4.2 细胞加热 37°C、43°C、45°C水浴40min后,再置37°C、5%CO2孵箱中培养12h;43°C水浴40min后,再置37°C、5%CO2孵箱中培养0h、3h、6h、12h、24h、48h。
1.4.3 活细胞计数 培养细胞弃培养液,0.25%胰蛋白酶1ml消化10min,弃消化液,加Hank's液终止消化,吹打制成细胞悬液,取20μl细胞悬液,加20μl 2%苔盼蓝染液,混匀后行活细胞计数,拒染细胞为活细胞,蓝色细胞为死亡细胞。
1.4.4 细胞形态学检测
(1) 倒置显微镜观察细胞的生长情况及形态变化。
(2) Giemsa染色:培养细胞弃培养液,Hank's液漂洗3次,取出细胞爬片,4%多聚甲醛(以pH 7.4 0.01mol/L PBS配制)室温下固定30min,Giemsa染色10min,自来水冲洗,室温下风干,光镜下观察。
, http://www.100md.com
(3) 透射电镜观察:收集细胞,2.5%戊二醛4°C固定24h,1%四氧化锇后固定,丙酮梯度脱水,经包埋剂浸透后环氧树脂包埋,超薄切片,醋酸铀和枸橼酸铅双重染色,透射电镜观察。
1.4.5 TUNEL原位末端标记 同上固定爬片细胞,PBS洗,0.1% Triton-X-100(0.1%柠檬酸配制)4°C打孔5min,PBS洗,加50μl TUNEL反应混合液(由末端脱氧核苷酸转移酶液和荧光素标记液按1∶1配成),37°C孵60min,PBS洗,加50μl碱性磷酸酶抗荧光素抗体,37°C孵30min,室温下50μl快红显色10min,PBS洗后封片,光镜下观察。以PBS代替末端脱氧核苷酸转移酶液为阴性对照。
1.4.6 DNA电泳 培养细胞,充培养液,TRIzol试剂法提取细胞总DNA,加样于含0.5μg/ml溴化乙锭(EB)的1.8%琼脂糖凝胶中,60V电泳2h,紫外灯下观察并照相。
, 百拇医药 1.4.7 FCM-DNA检测 培养细胞,弃培养液,0.25%胰蛋白酶1ml消化10min,充消化液,加Hank's液终止消化,2000r/min离心3min,弃上清,75%冷乙醇悬浮细胞,4°C固定过夜,PBS洗去乙醇,加PI至终浓度为50μg/ml,混匀,4°C避光30min,Coulter公司Elite ESP型流式细胞仪上检测,激光光源为氩离子激光,波长为488nm。检测前以标准微球校准仪器使其变异系数(CV)<2%,并以正常人外周血淋巴细胞为DNA含量标准样品,测出各组细胞DNA含量及各细胞周期所占百分比,以G0/G1前期亚二倍体峰为凋亡峰。
1.5 统计分析处理
组间差异分析采用t检验。
2 结果
2.1 细胞形态学特征
, http://www.100md.com
37°C水浴40min后12h组(对照组),倒置显微镜下观察,BcaCD885颊癌细胞贴壁生长良好,呈圆形、多角形、大小不一;Giemsa染色,光镜下见细胞形态完整,细胞核大,核仁明显;透射电镜见典型的恶性病理改变,胞质内细胞器完整。
43°C水浴40min后12h组,倒置显微镜下观察,细胞皱缩、变圆,呈浮起状,核凝集,胞浆浓缩呈泡状;Giemsa染色见细胞浆浓缩,胞核致密浓染或裂解形成凋亡小体,核仁消失,包膜完整;透射电镜下,见细胞染色质固缩聚集于核膜下,核仁消失,细胞浆浓缩,细胞器退变,胞膜突起或皱缩,但胞膜连续性存在。这些形态改变表明颊癌细胞呈现细胞凋亡现象。
45°C水浴40min后12h组,细胞出现明显的坏死改变,细胞肿胀、胞膜破坏、连续性中断、细胞器破裂。
2.2 细胞DNA断裂表现
用TUNEL法标记,快红显色可见,43°C水浴40min后12h组,大量细胞红染,散在分布,并可见明显的凋亡小体;45°C水浴40min后12h组也可见阳性染色细胞,但着色浅,成片状分布,具细胞坏死的形态特征;而37°C对照组,仅见个别细胞阳性着色。在琼脂糖凝胶电脉上,对照组仅在近电泳点样处出现基因组条带,43°C水浴40min后12h组,呈现有一定间隔的梯状条带,而45°C水浴40min后12h组,则呈模糊的无间隔的片状条带。
, http://www.100md.com
2.3 细胞周期分析
43°C水浴40min后,细胞周期发生明显改变,并在G1峰前出现“亚G1峰”,即凋亡峰。其凋亡率在加热结束时,与对照组无明显差别(P>0.05),但37°C孵育后,凋亡率快速升高,6h时高达73.75%,与对照组相比,有显著的差异性(P<0.05),而此时苔盼蓝拒染实验证实相应的活细胞数为88.25%。之后,凋亡率缓慢恢复,48h后降至27.97%。同时,细胞各周期所占百分比也发生相应变化,G0/G1期细胞随凋亡率升高而增多,S期细胞则减少,G2/M期细胞百分比在加热后3h也发生了明显下降(P<0.05)(表1)。
表1 43°C 40min加热后不同时间BcaCD885细胞DNA含量变化(
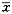 ±s)(n=4) 组别
±s)(n=4) 组别, 百拇医药
活细胞(%)
凋亡细胞(%)
细胞周期分布(%)
G0/G1
S
G2/M
对照组
93.3750±1.523
3.7750±0.670
37.2500±2.198
44.1250±3.015
, 百拇医药
17.6250±4.301
0h
97.6500±3.414
5.9750±1.497
35.2250±3.377
45.8750±4.525
18.9000±7.708
3h
90.7550±8.321
52.2000±5.307*
61.0000±2.708*
, 百拇医药
31.3750±1.580*
7.6000±4.078*
6h
88.2500±7.950
73.7500±8.180*
53.4500±4.930*
37.7000±1.865*
8.8500±3.214
12h
87.4650±3.563
, 百拇医药
65.5000±7.601*
49.2500±2.946*
37.1250±5.480*
13.6500±8.296
24h
92.3450±4.347
58.7500±2.589*
46.9500±6.238
30.8750±9.365
22.1750±5.164
, http://www.100md.com
48h
90.6340±9.377
27.9750±5.417*
37.5750±4.208
38.7750±3.632
22.5750±3.439
* 与对照组相比P<0.05
3 讨论
细胞凋亡这一概念首先由英国Kerr在1972年提出。凋亡与坏死不同,其发生具有积极的生物学意义,它为维持机体内环境稳定所必需,在肿瘤发生与消退及治疗中,凋亡也起着重要作用。细胞在受到外界不利因素影响时,细胞的生理代谢与调节过程发生变化,结果有可能出现DNA断裂和形态改变,产生细胞凋亡。
, http://www.100md.com
形态学上,细胞凋亡与坏死具有明显的差异[2,3]。本实验将BcaCD885颊癌细胞43°C加热40min后,发现细胞发生典型的凋亡形态学改变,细胞皱缩、变圆,呈浮起状,核染色质凝聚浓染,核仁消失,核裂解,胞浆浓缩,胞膜出泡,凋亡小体形成。表明加温能诱导颊癌细胞的凋亡。但45°C加热处理,细胞则出现明显的坏死形态学改变。
凋亡细胞DNA在核小体间的断裂是其特征性变化,这一变化是由于内源性核酸内切酶基因的活动和表达而造成的结果。其DNA的断片大小是有规律的,为核小体DNA长度的整倍数,即180~200bp的整倍数。因此,进行琼脂糖凝胶电泳时可见到特征性的梯形现象(DNA ladder)。在鼠胸腺细胞,地塞米松处理90min就可检测到DNA ladder,而细胞活力性在4~6h后才消失,说明DNA的断裂发生于细胞活力消失之前[4]。同时,细胞凋亡时,DNA双链或单链断裂出现缺口,即产生一系列3′-OH末端,外源性脱氧核糖核苷酸末端转移酶(TdT)能够催化外源性荧光素或酶标记的dUTP连接到DNA的3′-OH末端,在荧光显微镜或光镜下检测细胞的荧光或酶与底物作用的显色强度或量,就能在单细胞水平对细胞凋亡进行定性定量研究。此法即为缺口末端标记法(TUNEL)。本实验BcaCD885细胞经43°C 40min加热后,DNA电泳呈现典型梯状现象,TUNEL原位末端标记显示大量凋亡细胞出现。45°C加热组却呈现细胞坏死特征。这一结果与Onezawa等对鼠恶性成纤维组织细胞瘤的体外加温治疗研究结果相似[5]。
, 百拇医药
综上所述,高温杀伤颊癌细胞的途径包括凋亡和坏死两种43°C加热处理,细胞出现凋亡,而45°C加热处理,则发生坏死。43°C正是临床采用的局部高温治癌温度,同时,在癌肿消退过程中,并未见肿瘤坏死脱落。因而我们认为,热疗是通过凋亡途径杀死肿瘤细胞。
流式细胞术(FCM)是在单细胞水平上检测凋亡细胞的一种简便、快速的方法,并可同时进行细胞周期分析,研究凋亡与细胞周期的关系。在凋亡发生过程中,限制性内切酶被激活,DNA链断裂,当用乙醇固定或使用含去污剂染色液进行DNA荧光标记时,胞膜通透性增加,使断裂的DNA从细胞漏出,因此,FCM测定凋亡细胞的DNA含量低于正常细胞,在DNA直方图上表现为G0/G1期峰前有一亚峰(“亚G1”峰)[6]。坏死细胞因DNA无序断裂,胞膜破坏,DNA含量亦减少,同时凋亡峰的形成受到细胞碎片的干扰。本实验在收集细胞时,低速短时离心以洗去细胞碎片,并行苔盼蓝染色,活细胞计数拒染率在87%以上,故所测得低DNA含量细胞即为凋亡细胞。本实验经43°C加热BcaCD885细胞40min后细胞G1峰前出现了凋亡峰,从另一方面证实了DNA断裂的存在。43°C 40min加热后0h BcaCD885细胞凋亡率无明显变化,而3h后,凋亡率开始明显升高,6h达高峰,之后开始缓慢下降,说明43°C加热后,需再经37°C诱导细胞才能出现凋亡,提示43°C高温治癌是肿瘤细胞的一主动死亡过程。
, 百拇医药
细胞动态平衡依赖于细胞增殖、分化和死亡的正确关系,细胞的凋亡和增殖通过细胞周期调节因子相连系。凋亡诱导因素影响着细胞的增殖和死亡。Takasu等的研究结果表明,热诱导HL-60细胞凋亡过程中,凋亡率的升高伴发G1期细胞及S期细胞数量减少,随着S期细胞数量的增加,G1期细胞也增加。同时热疗后G2-M期细胞数量增加,作者认为这可能与p53缺乏有关,也可能与细胞周期素及周期激酶活性改变有关,当细胞内存在突变型p53或缺乏野生型p53时,细胞对各种毒性刺激后,发生G2期休止[7]。Ikenaya等的研究则表明,热诱导直肠癌细胞后,发生G0/G1期休止,与p16表达存在相关性,而与p53无关[8]。本实验43°C加热BcaCD885细胞40min后,细胞周期发生了明显的特异性改变。G0/G1期百分比增加,S期百分比下降,G2/M期百分比在3h时也发生了明显下降。
, http://www.100md.com
基金项目:本课题由国家自然科学基金资助(39670788)云南省自然科学基金资助(1999.C0007)
作者简介:王升志(1965-),男,山东烟台,博士.
参考文献:
[1] Vidai C & Dewey WC. Two distinct modes of hyperthermic cell death [J]. Radiat Res,1988;116(1):157-171.
[2] Kroemer G,Dallaporta B & Resche-Rigon M. The mitochondrial death/life regulator in apoptosis and necrosis[J]. Annu Rev Physiol,1998;60:619-642.
, 百拇医药
[3] 石运伯,王若翔,时玉舫.细胞凋亡的分子机理[J].生命科学,1996;8(3):8-12.
[4] Wyllie AH. Glucocorticoid-induced thymocytes apoptosis is associated with endonuclease activation[J]. Nature,1980;284:555-556.
[5] Yonezawa M,Otsuka T,Matsui N,et al. Hyperthermia induces apaptosis in malignant fibrous histocytoma cells in vitro[J]. Int J Cancer,1996;66(3):347-351.
[6] Darzynkiewicz Z,Bruno S,Del Bino G,et al. Features of apoptotic cells measured by flow cytometry[J]. Cytometry,1992;13:795.
, 百拇医药
[7] Takasu T,Lyons JC,Park HJ,et al. Apoptosis and perturbation of cell cycle progression in an acidic enviroment after hyperthermia[J]. Cancer Res,1998;58(12):2504-2508.
[8] Ikenaya M,Takano Y,Saegusa M,et al. Apoptosis of colon cancers assessed by in situ DNA nick end labeling method[J]. Pathol Int,1996;46(1):33-37.
收稿日期:2000-01-22, 百拇医药