PI染色流式细胞仪检测细胞凋亡的影响因素
作者:谭晓华 张亚历 姜泊 周殿元
单位:谭晓华(第一军医大学南方医院全军消化病研究所,广东 广州 510515);张亚历(第一军医大学南方医院全军消化病研究所,广东 广州 510515);姜泊(第一军医大学南方医院全军消化病研究所,广东 广州 510515);周殿元(第一军医大学南方医院全军消化病研究所,广东 广州 510515)
关键词:流式细胞仪;PI染色;细胞凋亡
第一军医大学学报000410 摘要:目的 利用PI染色流式细胞仪检测细胞凋亡时影响亚二倍体峰位置的因素。方法 用地塞米松诱导SD大鼠胸腺淋巴细胞凋亡,采用不同的固定剂、固定温度和时间,在悬浮缓冲液洗涤细胞时悬浮不同的时间,然后进行PI染色流式细胞仪分析。结果 4种不同的固定剂中,只有70%乙醇固定的胸腺淋巴细胞出现亚二倍体峰,而其它3种固定方法无亚二倍体峰出现;乙醇固定的温度以及细胞在悬浮缓冲液悬浮的时间对亚二倍体峰的位置有明显的影响,而固定时间的长短对其影响较小。结论 不同的固定剂、固定温度和时间以及细胞在悬浮缓冲液悬浮的时间对PI染色流式细胞仪检测细胞凋亡的结果均有影响,但如条件掌握得当,PI染色是一种检测细胞凋亡的较好方法,具有简单、直观和可以定量的特点。
, 百拇医药
中图分类号:R329.2; R446 文献标识码:A
文章编号:1000-2588(2000)04-0344-03
Investigation of the influence factors in cell apoptosis by using flow cytometry with PI staining
TAN Xiao-hua, ZHANG Ya-li, JIANG Bo, ZHOU Dian-yuan
(Institute of Digestive Diseases of PLA, Nanfang Hospital, First Military Medical University, Guangzhou 510515, China)
, http://www.100md.com
Abstract: Objective To investigate the factors that may influence the position of hypodiploid peak in the histogram describing cell apoptosis using flow cytometry with PI staining. Methods Cellular apoptosis was induced by dexamethasone in the thymus lymphocytes of SD rats, which were fixed in different fixatives (70% ethanol, 4% formaldehyde, 4% paraformaldehyde, 1% paraformaldehyde and 70% ethanol in sequence) for 1 to 24 h at different temperatures (4℃, - 20℃and 37℃) and suspended in suspension buffer for 1 to 24 h. The cells subjected to the above treatments were studied using flow cytometry with PI staining. Results The hypodiploid peak appeared in the histogram only when apoptotic thymus lymphocytes were fixed by 70% ethanol alone. The temperature for fixation and time period of suspension had an obvious influence on the position of hypodiploid peak, but time period of fixation had little effect. Conclusion The detection of cell apoptosis by flow cytometry with PI staining is influenced by fixatives, time period and temperature for fixation and time period of suspension. PI staining, however, is a simple, perceptible method for quantitatively detecting apoptotic cells in culture so long as the conditions are appropriately controlled.
, http://www.100md.com
Key words: flow cytometry; PI staining; apoptosis
细胞凋亡是受基因控制的一种主动性细胞自杀过程[1、2],在形态和生化学方面与细胞坏死有明显的区别。目前,研究细胞凋亡的方法很多,其中PI染色流式细胞仪分析可以对细胞凋亡进行定量检测,且方法简单、直观,但影响因素较多。我们对固定剂、固定的时间和温度、细胞悬浮在悬浮缓冲液中的时间等影响因素进行了探讨。
1 材料与方法
1.1 试剂和配制
所用试剂除特别注明外,均为国产分析纯。
所用试剂除特别注明外,均为国产分析纯。70%乙醇、4%甲醛(PBS配)、1%和4%多聚甲醛(PBS配);地塞米松用生理盐水配成10-3 mol/L的储存液浓度,4 ℃保存;PI(Sigma产品)染色液:PI溶于PBS中,终浓度为100 g/L,含100 g/L RNase(购自华美公司),4 ℃避光保存。
, 百拇医药
1.2 凋亡模型
取4周龄的雄性SD大鼠,扭颈处死,无菌下取出胸腺,Hanks液洗2次,尽量洗尽红细胞。然后用眼科剪将胸腺剪碎,过400目筛并用玻璃离心管的钝性尖端在筛上碾磨胸腺碎块组织,通过400目筛的细胞即为单细胞悬液。用Hanks液洗1次,离心除去Hanks液,加RPMI-1640(Gibco)培养液(内含15%小牛血清、2 mmol/L谷氨酰胺及100 U/ml青链霉素),调整细胞数为5×108个/L,加地塞米松终浓度为10-5 mol/L,置5% CO2孵箱中培养4~ 6 h,收集细胞。
1.3 坏死模型
大鼠胸腺细胞制备同上,胸腺细胞60 ℃、30 min水浴后,继续培养4 h,收集细胞。
1.4 细胞处理
, http://www.100md.com
1.4.1细胞的固定 细胞收集后,用70%乙醇、4%甲醛、4%多聚甲醛以及1%多聚甲醛和70%乙醇依次固定。
1.4.2 固定时间 70%乙醇细胞固定后,固定时间取2个时间点,分别为1 h和24 h。
1.4.3 固定温度 70%乙醇细胞固定后,分别置4 ℃、- 20 ℃和37 ℃保存细胞。
1.4.4 细胞在悬浮缓冲液的悬浮时间 染色前,离心除去固定液,用PBS重悬细胞,悬浮时间5~ 30 min。
1.5 方法
1.5.1 PI染色法 按文献[3]介绍的方法进行PI染色。采用美国Coulter公司的流式细胞仪分析细胞数对DNA含量(线性)的直方图,通过门技术排除碎屑和成双或聚集的细胞。
, 百拇医药
1.5.2 琼脂糖凝胶电泳 按文献[3]介绍的方法进行。
2 结果
2.1 地塞米松诱导鼠胸腺细胞凋亡
10-5 mol/L地塞米松处理胸腺细胞4~ 6 h,可诱导其凋亡,表现为琼脂糖凝胶电泳上出现典型的“梯状”带(图1 B)和流式细胞仪PI染色直方图上出现亚二倍体峰(图2 A、B)。胸腺细胞在4 h的凋亡率为35.5%,6 h凋亡率为52.9%,表明地塞米松诱导胸腺细胞具有时间效应关系。
图1 地塞米松和热处理对SD大鼠胸腺细胞的影响
Fig.1 Effect of dexamethasone and heat treatment on thymus
, 百拇医药
lymphocytes in SD rat demanstrated by agarose gel electrophoresis
图2 固定剂对亚二倍体峰的影响
Fig. 2 Influence of fixatives on hypodiploid peak
A: Treated with 10-5mol/l dexamethasone for 4 h,and fixed with 70% ethanol fixation at 4 ℃ for 24 h;
B: Treated with 10-5mol/L dexamethasone for 6 h,70% ethanol fixation at 4 ℃ for 24 h;
, 百拇医药
C: Treated with 10-5mol/L dexamethasone for 4 h,and fixed with 4% formaldehyde at 4 ℃for 24 h;
D: Treated with 10-5mol/L dexamethasone for 4 h,and fixed with 4% paraformaldehyde fixation at 4 ℃for 24 h.
2.2 各种实验条件对亚二倍体峰的影响
2.2.1 固定剂 分别用70%乙醇、4%甲醛、4%多聚甲醛以及1%多聚甲醛和70%乙醇固定地塞米松处理4 h的鼠胸腺细胞,4 ℃保存24 h后染色,在流式细胞仪上,只有用70%乙醇固定的细胞出现一明显的亚二倍体峰,而经后3种固定处理的细胞无亚二倍体峰出现,但细胞周期各峰(G1、S和G2峰)却往左侧漂移(图2C、D)。
, http://www.100md.com
2.2.2 细胞在悬浮缓冲液的悬浮时间 用70%乙醇在4 ℃下固定胸腺细胞24 h后,离心除去固定液。在室温下用PBS重悬细胞分别为5 min和30 min,然后离心除去PBS并完成后续染色过程。在流式细胞仪上,两者均有亚二倍体峰,但重悬30 min的样本,其亚二倍体峰明显向左漂移,即离G1峰更远(图3 A、B),说明细胞在悬浮缓冲液中悬浮时间对亚二倍体峰位置有明显的影响。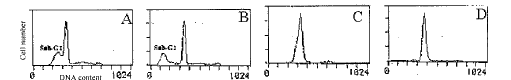
图3 悬浮时间、固定温度对亚二倍体峰的影响和坏死的表现
Fig. 3 Influence of suspended time and temperature
for fixation on hypodiploid peak and on the manifestations
, http://www.100md.com
of the necrosis (on flow cytometry)
A: Treated with 10-5mol/L dexamethasone for 4 h,70% ethanol fixation at 4 ℃ for 24 h, and suspended for 5 min in PBS;
B: Treated with 10-5mol/L dexamethasone for 4 h,70% ethanol fixation at 4 ℃for 24 h, and suspended for 30 min in PBS;
C: Treated with 10-5mol/L dexamethasone for 4 h,70% ethanol fixation at 37 ℃ for 24 h;
, 百拇医药
D: Treated at 60 ℃ for 30 min and cultured for 4 h.
2.2.3 固定温度 用70%乙醇固定胸腺细胞后,分别在4 ℃、- 20 ℃和37 ℃固定24 h,然后进行染色,流式细胞仪上,不同的温度对亚二倍体峰位置的影响有所不同。4 ℃和- 20℃固定时,亚二倍体峰在G1期的左侧清晰可见,两者位置无明显区别;而在37 ℃时亚二倍体峰与G1期有部分重叠,看似G1期变宽(图3 C)。
2.2.4 固定时间 地塞米松处理胸腺细胞4 h,用70%乙醇 4 ℃下分别固定1和24 h后染色,在流式细胞仪上,亚二倍体峰在G1期的左侧清晰可见,两者位置无明显区别。
2.3 细胞坏死在PI染色中的表现
用60 ℃处理30 min后继续培养4 h,可引起胸腺细胞坏死(图1 C)。收集细胞行PI染色,在流式细胞仪上,没有亚二倍体峰的出现,主要表现为细胞的PI可染性增强,即各个细胞周期峰往右侧漂移(图3 D)。
, 百拇医药
3 讨论
在排除细胞碎屑(通过门技术)和掌握好染色条件时,流式细胞仪直方图上出现亚二倍体峰,可以判定被检测的细胞中发生了凋亡。PI染色检测凋亡的原理主要是通过PI与细胞核DNA结合,测定细胞内DNA含量。亚二倍体峰的出现,实际上是由于细胞凋亡时DNA含量低于正常细胞,使其在直方图上表现为一个荧光强度比正常细胞要小的峰(亚二倍体峰),即凋亡细胞DNA对PI可染性(DNA stainability)降低。为什么细胞凋亡时PI可染性降低?这也是上述实验条件影响亚二倍体峰的出现和位置的关键所在。凋亡细胞中DNA可染性降低主要是固定剂和缓冲液对低分子量DNA有抽提作用所致[4]。细胞凋亡时,内源性核酸酶激活,导致细胞核染色体从核小体间断裂成由180~ 200 bp组成的寡核小体片段[5]。这些片段从核中或大的核片段中(染色体颗粒)弥散到细胞浆中,此时由于细胞膜仍然是完整的,这些小片段尚不能离开细胞。但随后的乙醇固定,可使细胞膜的通透性增加,这些片段即可弥散到细胞外,造成凋亡细胞的染色体含量降低[5]。如果用PBS等缓冲液抽提,则小片段的DNA更容易弥散到细胞外[6],并随抽提时间的延长,小片段DNA丢失得更多,使凋亡细胞的PI可染性更低,即亚二倍体峰的位置愈向左漂移。经过增加通透性处理和缓冲液清洗后仍然留在凋亡细胞内的DNA可能是附着在核基质上DNA螺旋环中的DNA片段和大分子量DNA片段,这些片段不能被抽提。正是这一部分不能被抽提的DNA片段在直方图上表现为亚二倍体峰[4]。
, 百拇医药
在用甲醛和多聚甲醛固定细胞时不出现亚二倍体峰,可能是因为用甲醛或多聚甲醛固定时,可使细胞内的蛋白或染色体发生交联致使小分子量DNA不能从细胞中释放出来所致[7]。也正是因为交联,使细胞的DNA结构发生改变,致使PI与DNA的结合降低,表现在直方图上为整个细胞周期峰向左侧漂移。固定温度对亚二倍体峰的影响原因不明,用分子或颗粒的布朗运动难以解释,因为温度升高时,亚二倍体峰的位置反而与G1期峰发生重叠。固定时间可能对亚二倍体峰的位置产生影响[6],因乙醇固定使通透性增加的凋亡细胞内小片段DNA更有机会弥散到细胞外,但从我们的实验结果看,这种影响并不很大。
细胞坏死时不出现亚二倍体峰,DNA的可染性并不下降,甚至还会增加。我们的实验证实了这一点(至少在地塞米松诱导的鼠胸腺淋巴细胞凋亡中如此)。其原因可能是由于细胞坏死时DNA的部分变性引起更多的结合位点暴露所致[8、9]。
, 百拇医药 综上所述,在进行培养细胞的PI染色流式细胞仪检测时,建议用70%乙醇作固定剂,固定的温度在4 ℃或- 20 ℃,固定的时间在1~ 24 h或更长(特别是在- 20 ℃时),固定后PBS悬浮的时间在5~ 10 min左右,不宜过长,否则容易与细胞碎屑混淆。
作者简介:谭晓华(1962-),男,湖南祁东人,1999年毕业于第一军医大学,博士,现为北京军区总医院全军肝病研究所主治医师。
参考文献:
[1] Kerr JFR, Wyllie AH, Currie AR. Apoptosis: a basic biological pheno-menon with wide ranging implications in tissue kinetics[J]. Br J Cancer, 1972, 26: 239-42.
[2] Kerr JF, Winterford CM, Harmon BV. Apoptosis. Its significance in cancer and cancer therapy[J]. Cancer, 1994, 73(8):2013-6.
, http://www.100md.com
[3] 姜 泊. 细胞凋亡基础与临床[M]. 北京:人民军医出版社, 1999.255-7.
[4] Darzynkiewicz Z, Bruno S, Del Bino G, et al. Features of apoptotic cells measured by flow cytometry[J]. Cytometry, 1992, 13(8):795-808.
[5] Arends MJ, Morris RG, Wyllie AH. Apoptosis. The role of the endonuclease[J]. Am J Pathol, 1990, 136(3):593-608.
[6] Afanasyev VN, Korol BA, Matylevich NP, et al. The use of flow cytometry for the investigation of cell death[J]. Cytometry, 1993, 14(6):603-9.
, http://www.100md.com
[7] Telford WG, King LE, Fraker PJ. Rapid quantitation of apoptosis in pure and heterogeneous cell populations using flow cytometry[J]. J Immunol Methods, 1994, 172(1):1-16.
[8] Huschtscha LI, Jeitner TM, Andersson CE, et al. Identification of apoptotic and necrotic human leukemic cells by flow cytometry[J]. Exp Cell Res, 1994, 212(1):161-5.
[9] Hotz MA, Traganos F, Darzynkiewicz Z. Changes in nuclear chromatin related to apoptosis or necrosis induced by the DNA topoisomerase II inhibitor fostriecin in MOLT-4 and HL-60 cells are revealed by altered DNA sensitivity to denaturation[J]. Exp Cell Res, 1992, 201(1):184-91.
收稿日期:1999-09-02, http://www.100md.com
单位:谭晓华(第一军医大学南方医院全军消化病研究所,广东 广州 510515);张亚历(第一军医大学南方医院全军消化病研究所,广东 广州 510515);姜泊(第一军医大学南方医院全军消化病研究所,广东 广州 510515);周殿元(第一军医大学南方医院全军消化病研究所,广东 广州 510515)
关键词:流式细胞仪;PI染色;细胞凋亡
第一军医大学学报000410 摘要:目的 利用PI染色流式细胞仪检测细胞凋亡时影响亚二倍体峰位置的因素。方法 用地塞米松诱导SD大鼠胸腺淋巴细胞凋亡,采用不同的固定剂、固定温度和时间,在悬浮缓冲液洗涤细胞时悬浮不同的时间,然后进行PI染色流式细胞仪分析。结果 4种不同的固定剂中,只有70%乙醇固定的胸腺淋巴细胞出现亚二倍体峰,而其它3种固定方法无亚二倍体峰出现;乙醇固定的温度以及细胞在悬浮缓冲液悬浮的时间对亚二倍体峰的位置有明显的影响,而固定时间的长短对其影响较小。结论 不同的固定剂、固定温度和时间以及细胞在悬浮缓冲液悬浮的时间对PI染色流式细胞仪检测细胞凋亡的结果均有影响,但如条件掌握得当,PI染色是一种检测细胞凋亡的较好方法,具有简单、直观和可以定量的特点。
, 百拇医药
中图分类号:R329.2; R446 文献标识码:A
文章编号:1000-2588(2000)04-0344-03
Investigation of the influence factors in cell apoptosis by using flow cytometry with PI staining
TAN Xiao-hua, ZHANG Ya-li, JIANG Bo, ZHOU Dian-yuan
(Institute of Digestive Diseases of PLA, Nanfang Hospital, First Military Medical University, Guangzhou 510515, China)
, http://www.100md.com
Abstract: Objective To investigate the factors that may influence the position of hypodiploid peak in the histogram describing cell apoptosis using flow cytometry with PI staining. Methods Cellular apoptosis was induced by dexamethasone in the thymus lymphocytes of SD rats, which were fixed in different fixatives (70% ethanol, 4% formaldehyde, 4% paraformaldehyde, 1% paraformaldehyde and 70% ethanol in sequence) for 1 to 24 h at different temperatures (4℃, - 20℃and 37℃) and suspended in suspension buffer for 1 to 24 h. The cells subjected to the above treatments were studied using flow cytometry with PI staining. Results The hypodiploid peak appeared in the histogram only when apoptotic thymus lymphocytes were fixed by 70% ethanol alone. The temperature for fixation and time period of suspension had an obvious influence on the position of hypodiploid peak, but time period of fixation had little effect. Conclusion The detection of cell apoptosis by flow cytometry with PI staining is influenced by fixatives, time period and temperature for fixation and time period of suspension. PI staining, however, is a simple, perceptible method for quantitatively detecting apoptotic cells in culture so long as the conditions are appropriately controlled.
, http://www.100md.com
Key words: flow cytometry; PI staining; apoptosis
细胞凋亡是受基因控制的一种主动性细胞自杀过程[1、2],在形态和生化学方面与细胞坏死有明显的区别。目前,研究细胞凋亡的方法很多,其中PI染色流式细胞仪分析可以对细胞凋亡进行定量检测,且方法简单、直观,但影响因素较多。我们对固定剂、固定的时间和温度、细胞悬浮在悬浮缓冲液中的时间等影响因素进行了探讨。
1 材料与方法
1.1 试剂和配制
所用试剂除特别注明外,均为国产分析纯。
所用试剂除特别注明外,均为国产分析纯。70%乙醇、4%甲醛(PBS配)、1%和4%多聚甲醛(PBS配);地塞米松用生理盐水配成10-3 mol/L的储存液浓度,4 ℃保存;PI(Sigma产品)染色液:PI溶于PBS中,终浓度为100 g/L,含100 g/L RNase(购自华美公司),4 ℃避光保存。
, 百拇医药
1.2 凋亡模型
取4周龄的雄性SD大鼠,扭颈处死,无菌下取出胸腺,Hanks液洗2次,尽量洗尽红细胞。然后用眼科剪将胸腺剪碎,过400目筛并用玻璃离心管的钝性尖端在筛上碾磨胸腺碎块组织,通过400目筛的细胞即为单细胞悬液。用Hanks液洗1次,离心除去Hanks液,加RPMI-1640(Gibco)培养液(内含15%小牛血清、2 mmol/L谷氨酰胺及100 U/ml青链霉素),调整细胞数为5×108个/L,加地塞米松终浓度为10-5 mol/L,置5% CO2孵箱中培养4~ 6 h,收集细胞。
1.3 坏死模型
大鼠胸腺细胞制备同上,胸腺细胞60 ℃、30 min水浴后,继续培养4 h,收集细胞。
1.4 细胞处理
, http://www.100md.com
1.4.1细胞的固定 细胞收集后,用70%乙醇、4%甲醛、4%多聚甲醛以及1%多聚甲醛和70%乙醇依次固定。
1.4.2 固定时间 70%乙醇细胞固定后,固定时间取2个时间点,分别为1 h和24 h。
1.4.3 固定温度 70%乙醇细胞固定后,分别置4 ℃、- 20 ℃和37 ℃保存细胞。
1.4.4 细胞在悬浮缓冲液的悬浮时间 染色前,离心除去固定液,用PBS重悬细胞,悬浮时间5~ 30 min。
1.5 方法
1.5.1 PI染色法 按文献[3]介绍的方法进行PI染色。采用美国Coulter公司的流式细胞仪分析细胞数对DNA含量(线性)的直方图,通过门技术排除碎屑和成双或聚集的细胞。
, 百拇医药
1.5.2 琼脂糖凝胶电泳 按文献[3]介绍的方法进行。
2 结果
2.1 地塞米松诱导鼠胸腺细胞凋亡
10-5 mol/L地塞米松处理胸腺细胞4~ 6 h,可诱导其凋亡,表现为琼脂糖凝胶电泳上出现典型的“梯状”带(图1 B)和流式细胞仪PI染色直方图上出现亚二倍体峰(图2 A、B)。胸腺细胞在4 h的凋亡率为35.5%,6 h凋亡率为52.9%,表明地塞米松诱导胸腺细胞具有时间效应关系。

图1 地塞米松和热处理对SD大鼠胸腺细胞的影响
Fig.1 Effect of dexamethasone and heat treatment on thymus
, 百拇医药
lymphocytes in SD rat demanstrated by agarose gel electrophoresis

图2 固定剂对亚二倍体峰的影响
Fig. 2 Influence of fixatives on hypodiploid peak
A: Treated with 10-5mol/l dexamethasone for 4 h,and fixed with 70% ethanol fixation at 4 ℃ for 24 h;
B: Treated with 10-5mol/L dexamethasone for 6 h,70% ethanol fixation at 4 ℃ for 24 h;
, 百拇医药
C: Treated with 10-5mol/L dexamethasone for 4 h,and fixed with 4% formaldehyde at 4 ℃for 24 h;
D: Treated with 10-5mol/L dexamethasone for 4 h,and fixed with 4% paraformaldehyde fixation at 4 ℃for 24 h.
2.2 各种实验条件对亚二倍体峰的影响
2.2.1 固定剂 分别用70%乙醇、4%甲醛、4%多聚甲醛以及1%多聚甲醛和70%乙醇固定地塞米松处理4 h的鼠胸腺细胞,4 ℃保存24 h后染色,在流式细胞仪上,只有用70%乙醇固定的细胞出现一明显的亚二倍体峰,而经后3种固定处理的细胞无亚二倍体峰出现,但细胞周期各峰(G1、S和G2峰)却往左侧漂移(图2C、D)。
, http://www.100md.com
2.2.2 细胞在悬浮缓冲液的悬浮时间 用70%乙醇在4 ℃下固定胸腺细胞24 h后,离心除去固定液。在室温下用PBS重悬细胞分别为5 min和30 min,然后离心除去PBS并完成后续染色过程。在流式细胞仪上,两者均有亚二倍体峰,但重悬30 min的样本,其亚二倍体峰明显向左漂移,即离G1峰更远(图3 A、B),说明细胞在悬浮缓冲液中悬浮时间对亚二倍体峰位置有明显的影响。

图3 悬浮时间、固定温度对亚二倍体峰的影响和坏死的表现
Fig. 3 Influence of suspended time and temperature
for fixation on hypodiploid peak and on the manifestations
, http://www.100md.com
of the necrosis (on flow cytometry)
A: Treated with 10-5mol/L dexamethasone for 4 h,70% ethanol fixation at 4 ℃ for 24 h, and suspended for 5 min in PBS;
B: Treated with 10-5mol/L dexamethasone for 4 h,70% ethanol fixation at 4 ℃for 24 h, and suspended for 30 min in PBS;
C: Treated with 10-5mol/L dexamethasone for 4 h,70% ethanol fixation at 37 ℃ for 24 h;
, 百拇医药
D: Treated at 60 ℃ for 30 min and cultured for 4 h.
2.2.3 固定温度 用70%乙醇固定胸腺细胞后,分别在4 ℃、- 20 ℃和37 ℃固定24 h,然后进行染色,流式细胞仪上,不同的温度对亚二倍体峰位置的影响有所不同。4 ℃和- 20℃固定时,亚二倍体峰在G1期的左侧清晰可见,两者位置无明显区别;而在37 ℃时亚二倍体峰与G1期有部分重叠,看似G1期变宽(图3 C)。
2.2.4 固定时间 地塞米松处理胸腺细胞4 h,用70%乙醇 4 ℃下分别固定1和24 h后染色,在流式细胞仪上,亚二倍体峰在G1期的左侧清晰可见,两者位置无明显区别。
2.3 细胞坏死在PI染色中的表现
用60 ℃处理30 min后继续培养4 h,可引起胸腺细胞坏死(图1 C)。收集细胞行PI染色,在流式细胞仪上,没有亚二倍体峰的出现,主要表现为细胞的PI可染性增强,即各个细胞周期峰往右侧漂移(图3 D)。
, 百拇医药
3 讨论
在排除细胞碎屑(通过门技术)和掌握好染色条件时,流式细胞仪直方图上出现亚二倍体峰,可以判定被检测的细胞中发生了凋亡。PI染色检测凋亡的原理主要是通过PI与细胞核DNA结合,测定细胞内DNA含量。亚二倍体峰的出现,实际上是由于细胞凋亡时DNA含量低于正常细胞,使其在直方图上表现为一个荧光强度比正常细胞要小的峰(亚二倍体峰),即凋亡细胞DNA对PI可染性(DNA stainability)降低。为什么细胞凋亡时PI可染性降低?这也是上述实验条件影响亚二倍体峰的出现和位置的关键所在。凋亡细胞中DNA可染性降低主要是固定剂和缓冲液对低分子量DNA有抽提作用所致[4]。细胞凋亡时,内源性核酸酶激活,导致细胞核染色体从核小体间断裂成由180~ 200 bp组成的寡核小体片段[5]。这些片段从核中或大的核片段中(染色体颗粒)弥散到细胞浆中,此时由于细胞膜仍然是完整的,这些小片段尚不能离开细胞。但随后的乙醇固定,可使细胞膜的通透性增加,这些片段即可弥散到细胞外,造成凋亡细胞的染色体含量降低[5]。如果用PBS等缓冲液抽提,则小片段的DNA更容易弥散到细胞外[6],并随抽提时间的延长,小片段DNA丢失得更多,使凋亡细胞的PI可染性更低,即亚二倍体峰的位置愈向左漂移。经过增加通透性处理和缓冲液清洗后仍然留在凋亡细胞内的DNA可能是附着在核基质上DNA螺旋环中的DNA片段和大分子量DNA片段,这些片段不能被抽提。正是这一部分不能被抽提的DNA片段在直方图上表现为亚二倍体峰[4]。
, 百拇医药
在用甲醛和多聚甲醛固定细胞时不出现亚二倍体峰,可能是因为用甲醛或多聚甲醛固定时,可使细胞内的蛋白或染色体发生交联致使小分子量DNA不能从细胞中释放出来所致[7]。也正是因为交联,使细胞的DNA结构发生改变,致使PI与DNA的结合降低,表现在直方图上为整个细胞周期峰向左侧漂移。固定温度对亚二倍体峰的影响原因不明,用分子或颗粒的布朗运动难以解释,因为温度升高时,亚二倍体峰的位置反而与G1期峰发生重叠。固定时间可能对亚二倍体峰的位置产生影响[6],因乙醇固定使通透性增加的凋亡细胞内小片段DNA更有机会弥散到细胞外,但从我们的实验结果看,这种影响并不很大。
细胞坏死时不出现亚二倍体峰,DNA的可染性并不下降,甚至还会增加。我们的实验证实了这一点(至少在地塞米松诱导的鼠胸腺淋巴细胞凋亡中如此)。其原因可能是由于细胞坏死时DNA的部分变性引起更多的结合位点暴露所致[8、9]。
, 百拇医药 综上所述,在进行培养细胞的PI染色流式细胞仪检测时,建议用70%乙醇作固定剂,固定的温度在4 ℃或- 20 ℃,固定的时间在1~ 24 h或更长(特别是在- 20 ℃时),固定后PBS悬浮的时间在5~ 10 min左右,不宜过长,否则容易与细胞碎屑混淆。
作者简介:谭晓华(1962-),男,湖南祁东人,1999年毕业于第一军医大学,博士,现为北京军区总医院全军肝病研究所主治医师。
参考文献:
[1] Kerr JFR, Wyllie AH, Currie AR. Apoptosis: a basic biological pheno-menon with wide ranging implications in tissue kinetics[J]. Br J Cancer, 1972, 26: 239-42.
[2] Kerr JF, Winterford CM, Harmon BV. Apoptosis. Its significance in cancer and cancer therapy[J]. Cancer, 1994, 73(8):2013-6.
, http://www.100md.com
[3] 姜 泊. 细胞凋亡基础与临床[M]. 北京:人民军医出版社, 1999.255-7.
[4] Darzynkiewicz Z, Bruno S, Del Bino G, et al. Features of apoptotic cells measured by flow cytometry[J]. Cytometry, 1992, 13(8):795-808.
[5] Arends MJ, Morris RG, Wyllie AH. Apoptosis. The role of the endonuclease[J]. Am J Pathol, 1990, 136(3):593-608.
[6] Afanasyev VN, Korol BA, Matylevich NP, et al. The use of flow cytometry for the investigation of cell death[J]. Cytometry, 1993, 14(6):603-9.
, http://www.100md.com
[7] Telford WG, King LE, Fraker PJ. Rapid quantitation of apoptosis in pure and heterogeneous cell populations using flow cytometry[J]. J Immunol Methods, 1994, 172(1):1-16.
[8] Huschtscha LI, Jeitner TM, Andersson CE, et al. Identification of apoptotic and necrotic human leukemic cells by flow cytometry[J]. Exp Cell Res, 1994, 212(1):161-5.
[9] Hotz MA, Traganos F, Darzynkiewicz Z. Changes in nuclear chromatin related to apoptosis or necrosis induced by the DNA topoisomerase II inhibitor fostriecin in MOLT-4 and HL-60 cells are revealed by altered DNA sensitivity to denaturation[J]. Exp Cell Res, 1992, 201(1):184-91.
收稿日期:1999-09-02, http://www.100md.com