低氧预处理对大鼠海马神经元缺氧耐受性和IL-1β表达 的影响
作者:丁爱石 王福庄 于鸣 范明
单位:军事医学科学院基础医学研究所,神经生物学研究室,北京 100850
关键词:低氧预处理;缺氧;人重组白细胞介素-1β;海马神经元;免疫组织化学
中国应用生理学杂志000402
摘要 目的:观察低氧预处理对大鼠海马神经元缺氧耐受性和白细胞介素- 1β(IL-1β)表达的影响。方法:取培养12 d的两组(对照组和低氧预处理 组)培养神经元,同时置于缺氧环境(0.9L/LN2,0.1L/LCO2)中培养2、4、8和12 h。 分别观察它们的形态变化和神经元存活数,并用抗rhIL-1β单克隆抗体进行免疫组织化学 染色,观察缺氧对大鼠海马培养神经元IL-1β表达的影响。结果:经低氧 预处理的海马神经元缺氧后IL-1β表达较对照组减弱,神经元损伤程度减轻,神经元存活 数明显高于对照组。结论:低氧预处理可使海马培养神经元对缺氧产生耐受 ,其中IL-1β表达降低可能是海马神经元对缺氧的一种适应性变化。
, http://www.100md.com
中图分类号: Q28;R364.4文献标识码:A
文章编号: 1000-6834(2000)04-0294-04
EFFECTS OF HYPOXIC PRECONDITIONING ON ANOXIC
TOLERANCE AND IL-1β EXPRESSION IN CULTURED
RAT HIPPOCAMPAL NEURONS
DING Ai-shi WANG Fu-zhuang YU Ming FAN Ming
(Department of Neurobiology, Institute of Basic Medical Sciences, Academy of Military Medical Sciences, Beijing 100850)
, http://www.100md.com
ABSTRACT Aim: To study the effects of hypoxic-preconditioning on anoxia-tolerance and IL- 1β expression in cultured rat hippocampal neurons after anoxia. Methods : 12 day cultured hippocampal neurons in control and hypoxic-precond itioning group were exposed to ano-xic environment(0.9 L/LN2+0.1 L/LCO2 ) for 2,4,8 and 12 h. The neurons were immunocytochemically stained using the antise rum against rhIL-1β,The number of survival neurons and the mean optical densit y (OD) of IL-1β expression were investigated. Resutls: The mor phological changes and IL-1β expression induced by acute anoxia in hypoxic-pr econditioning neurons were significantly less than those in control. The number of survival neurons was higher in the hypoxia-preconditioning group than that i n control group after acute hypoxia. Conclusion: Hypoxia-precon ditioning can induce the development of anoxia-tolerance in cultured hippocampa l neurons. The decreased IL-1β in hippocampal neurons may be an adaptive reac tion to acute anoxia.
, http://www.100md.com
KEY WORDS: hypoxic preconditioning; anoxia; recomb inant human interleukin-1β; hippocampal neurons; immunohistochemistry
反复短暂低氧处理可使组织耐受长时间缺氧的现象称之为低氧预处理(Hypoxic precond itioning)。预处理是机体抗缺氧或缺血的一种内源性保护现象。近来的研究表明,低氧预 处理产生的内源性保护现象不仅存在于多种属动物心脏,而且存在于肝、肾和脑等多种组织 、器官和细胞[1]。据报道[2],作为细胞因子之一的IL-1在中枢神经系 统的损伤修复、生长发育和生理功能的调控中起重要作用。我们以前的工作证实[3] 海马脑区存在IL-1β表达细胞,缺氧条件下IL-1β表达增强,但低氧预处理产生的内源 性保护机制与IL-1β表达有无关联以及IL-1β表达如何改变均不清楚。为此,本实验观察 了低氧预处理对海马培养神经元缺氧耐受性的影响及IL-1β表达的变化。
, http://www.100md.com
1 材料和方法
1.1 海马神经元培养
按已有的细胞培养方法进行海马神经元培养[3]。取初生的Wistar大鼠,在无 菌条件下分离出双侧海马,用1.25g/L胰蛋白酶消化(37℃、30 min)分散并制成5×108/L 密度的细胞悬液,接种于涂有小牛皮胶的35 mm塑料培养皿中,每皿2 ml。置于36℃、含0.1 0 /LCO2的培养箱(美国FORMA)内进行培养。培养液由9.4 g/L Eagle's MEM,0.05 L/ L马血清,0.01 L/L N3组合液[3]和谷氨酰胺0.10 g/L组成。于培养第3 d,在培 养液中分别加入细胞分裂抑制剂阿糖胞苷3 mg/L以抑制非神经细胞的过度增殖,作用48 h后 更换新鲜培养液,以后每周换液2次,每次更换一半新鲜培养液。
1.2 低氧预处理
, 百拇医药
取培养4 d的海马神经元,按实验分为对照和低氧预处理两组。低氧预处理组从培养第4 d起每天定时将神经元移至2 000 cm3的恒温(36℃)密闭容器内,连续充以低氧气体(0.8 9 L/LN2,0.01 L/L O2和0.10 L/L CO2),在此低氧条件下20 min后取出,再恢 复常氧培养。此后每天低氧预处理1次,每次20 min,如此反复低氧预处理8次。对照组细胞 在常氧条件下持续培养至12 d,用于对照观察。
1.3 缺氧实验
将上述两组培龄12 d海马神经元细胞同时放置2 000 cm3的恒温(36℃)密闭容器内, 连 续充以无氧气体(0.90 L/L N2、0.10L/L CO2),在此条件下持续缺氧2 h、4 h、8 h、和12 h。
, http://www.100md.com
1.4 形态学观察
用倒置相差显微镜分别观察两组细胞缺氧2 h、4 h、8 h和12 h时神经元的形态变化, 并在倒置相差显微镜(200X)下随机观察并计数150个相邻视野(0.16 mm2/视野)的存活神 经元数作比较。每皿细胞观察25个视野,每个实验观察2皿细胞,实验重复3次。
1.5 培养神经元的IL-1β免疫组化观察
取两组缺氧培养2 h、4 h、8 h和12 h的海马神经细胞,经40 g/L多聚甲醛固定后,用r hIL-1β单克隆抗体(鼠抗人,1∶1 000;本所制备)按ABC法进行免疫组织化学染色。同时 设空白对照(用PBS缓冲液替代第一抗体)和替代对照(用同种未免疫动物血清替代第一抗体) 。对观察结果作显微照相,并用CMlAS图像分析仪(北京航天大学与空军总医院共同研制)的 光密度计组件对IL-1β表达神经元作平均光密度(OD)分析。每皿细胞观察10个视野,每个 实验观察2皿细胞,实验重复3次。
, http://www.100md.com
1.6 统计学处理
数据以平均值±标准差(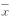 ±s)表示,按Student 氏法进行t检验。
±s)表示,按Student 氏法进行t检验。
2 结果
2.1 低氧预处理对海马神经元形态,神经元存活数和IL-1β表达的影响
新生大鼠海马神经元经分散培养12 d,神经元胞体增大,多数呈锥体状或多极形,胞体有明显的折光性,立体感强,神经突起互相联络成网。观察结果可见,缺氧前对照组和低氧预处理组神经元的形态和神经元存活数均无明显差异(表1)。IL-1β免疫组织化学显示,对照组和低氧预处理组缺氧前海马神经元中有IL-1β表达,IL-1β蛋白分布于神经元胞体内 ,染色为浅棕色(图A,B)。图像分析的结果表明,缺氧前两组神经元IL-1β表达的平均光 密度无明显差异(表1)。
, 百拇医药
Tab.1 Effects of hypoxic preconditioning on survival
of hi ppocampal neurons after acute anoxia(number of
neurons/field)(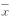 ±s,n=150 fields) Group
±s,n=150 fields) Group
Before anoxia
After anoxia (h)
2
4
8
, 百拇医药
12
Control
23.55±4.92
20.65±3.04
17.67±2.81
11.04±2.01
3.73±0.96
Preconditioning
23.14±4.45
22.24±3.45
20.35±2.18**
, 百拇医药
15.12±2.44**
6.22±1.27**
** P<0.01 compared with control
2.2 缺氧对海马神经元形态,神经元存活数和IL-1β表达的影响
海马神经元在缺氧条件下持续培养2~4 h,部分神经元胞体开始出现轻度肿胀,神经元存活 数较缺氧前明显减少。缺氧8 h,大部分神经细胞胞体出现肿胀,体积增大,失去折光性, 部分神经元的细胞膜发生破裂。神经元存活数较缺氧前减少越来越明显。缺氧12 h,大部分 神经元细胞膜破裂,神经突起断裂崩解,神经元存活数较缺氧前显著减少(表1)。经IL-1β 免疫组织化学显示,缺氧2~8 h时海马神经元对IL-1β的表达较缺氧前明显增强,神经元 被染成深棕色,(图1 D,F),但缺氧12 h时海马神经元对IL-1β的表达又逐渐减弱(图1 H) 。图像分析的结果同样显示,缺氧2~8h时IL-1β表达神经元的平均光密度均较缺氧前明显 增加。缺氧12h时IL-1β表达神经元的平均光密度又逐渐减小,但仍然明显高于缺氧前(表2 )。2.3 低氧预处理对海马培养神经元急性缺氧损伤的保护作用
, http://www.100md.com
Tab.2 Effects of hypoxic preconditioning on the
mean optic al density (OD) of rhlL-1β expression
in hippocampal neurons after acu te anoxia(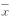 ±s),n=60 fields) Group
±s),n=60 fields) Group
Before anoxia
After anoxia (h)
2
4
8
, http://www.100md.com
12
Control
0.11±0.03
9.29±0.04
0.28±0.04
0.27±0.04
0.15±0.03
Preconditioning
0.11±0.03
0.24±0.04**
0.21±0.04**
, 百拇医药
0.20±0.03**
0.14±0.03
**P<0.01 compared with control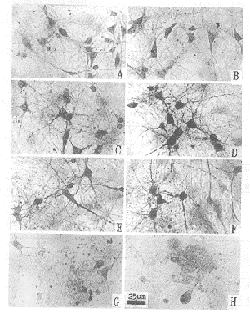
Fig.1 Effects of hypoxic-preconditioning on IL-1β
expression in rat hippocampal neurons after anoxia (×400)
A,B: IL-1β expression in cultured rat hippocampal neurons
from both of hypoxi c-preconditioning and control group respectively
, 百拇医药
C,E,G: IL-1β expression in cultured rat hippocampal neurons of
hypoxic-precon ditioning group after anoxia forz、8 and 12 h.respectively
D,F,H: IL-1β expression in cultured rat hippocampal neurons
of control group a fter anoxia for 2,8 and 12 h,respectively
与对照组相比,经低氧预处理的海马神经元急性缺氧后神经元损伤程度较轻,神经元存 活数明显高于对照组(表1)。经IL-1β免疫组织化学显示,低氧预处理组海马神经元缺氧 2 ~8h时IL-1β表达亦较缺氧前明显增强,但明显低于对照组(图1 C,E)。缺氧12 h时海马 神经元对IL-1β的表达又逐渐减弱(图1 G)。图像分析的结果同样显示,低氧预处理组海马 神经元缺氧后2~8 h,IL-1β表达神经元的平均光密度均明显低于对照组(表2)。
, http://www.100md.com
3 讨论
近年来的研究表明,体内许多组织及脑细胞经受了一次或多次短暂非致死性缺血或缺氧 刺激后可获得对更严重甚至致死性缺血或缺氧的耐受。Liu等[4]将大鼠颈总动脉夹 闭3 min,经3 d再灌注后,再次夹闭同侧颈总动脉6 min、8 min和10 min,测定同侧海马C Al区神经元密度,对照组显著低于预处理组。Kato等[5]对沙土鼠的研究表明,短 暂全脑缺血所致的缺血耐受可保护以后更长时间的全脑缺血,缺血2 min能产生耐受,但需 要24 h间歇使耐受得以诱导。耐受产生后至少可持续2d,多次短时的缺血比单次诱导作用更强。Tokunaga等报道[6]沙土鼠经短暂全脑缺预处理后, 取其海马脑片在体外 再次缺氧时即产生缺氧耐受,使低氧下海马脑片突触后群峰电位消失时间后延,缺氧20 min 再复氧后脑片突触后群峰电位恢复率增加。在我们的实验中也同样观察到,经低氧预处理的 海马神经元缺氧后形态学变化轻微,神经元存活数明显高于对照组,结果表明,低氧预处理 可使体外培养的海马神经元对缺氧产生耐受。目前,越来越多的证据表明,脑内IL-1局部 浓度的升高直接与脑组织病理损伤的发生和发展有关,在实验性脑损伤时,损伤处的IL-1 浓度升高[7]。大鼠前脑短暂脑缺血后可引起海马脑区IL-1β mRNA表达明显增加 ,维持数小时后又逐渐降至正常[8],在我们的实验结果中也看到了类似的现象, 即缺氧2~8 h时海马神经元对IL-1β的表达较缺氧前明显增强。缺氧12 h时又逐渐下降, 推侧在这种病理生理条件下海马神经元IL-1β表达增加可能是对缺氧的应激反应。而后IL -1β表达迅速降低可能与海马神经元因缺氧而严重受损或特异性细胞因子抑制物的产生有 关。确切机制尚有待进一步研究。本实验还观察到,经低氧预处理的海马神经元缺氧后对IL -1β的表达均明显低于对照组。据报道,脑缺血缺氧后脑内IL-1增加可能又具损伤和修复 的双重作用,在缺氧初期IL-1浓度的适量增加可刺激神经细胞分泌神经营养因子,并能诱 导神经元对缺氧损伤的耐受性,具有增强神经元抗损伤和促进修复作用[9]。但脑 缺血.缺氧后脑内IL-1浓度持续明显增高亦可直接介导脑损伤与神经元死亡,现证实,高 浓度的IL-1在体内外均可促进神经元释放谷氨酸和自由游离基团,并可引起或加重脑细胞 损伤[10]。因此,由本实验观察到的低氧预处理可使缺氧后海马神经元对IL-1β 的表达减少,这可能是海马神经元对缺氧的一种适应性变化。
, 百拇医药
基金项目:国家自然科学基金重点资助课题(39730190)
作者简介:丁爱石(1948-),男,江苏无锡人,高级实验师,从事神经细 胞培养及电生理研究。
4 参考文献
[1] Riepe M W, Kasischke K, Gericke C A, et al. Increase of hy poxic tolerance in rat hippocampal slices following 3-nitropropionic acid is no t mediated by endogenus nerve growth factor [J]. Neurosci Lett, 1996,211:9 -12.
[2] 要 航,王福庄.细胞因子对中枢神经系统海马脑区的作用[J].生理科学 进展,1995,26(2):132-136.
, 百拇医药
[3] 丁爱石,王福庄,黄燕华,等.体外培养大鼠海马细胞白细胞介素-1的表达 及缺氧的影响[J].中国应用生理学杂志,1996,12(2):157-161.
[4] Liu Y, Kato H, Nakata N, et al. Protection of rat hi-ppocampu s against ischemic neuronal damage by pretreatment with sublethal ischemia[J ]. Brain Res,1994,74:998-1004.
[5] Kato H, Liu Y, Arakik K, et al. Temporal profile of the effects of pretreatment with brief cerebral ischemia insult in the gerbil: cumulative da mage and protective effects[J]. Brain Res, 1991,553:238-242.
, 百拇医药
[6] Tokunaga H, Hiramatsu K. Sakaki T. Effect of prece-ding in vivo suble thal ischemia on the evoked potentials during secondary in vitro hypoxia evaluat ed with gerbil hippocampal slices[J]. Brain Res,1998,784:316-320.
[7] Woodroofe M N, Sarna G S, Wadhwa M, et al. Detection of interleu kin-1 and interleukin-6 in adult rat brain, following mechanical injury, by in vivo microdialysis: evidence of a role for microglia in cytokine production[J ].J Neuroimmunol,1991,33:227-236.
, http://www.100md.com
[8] Minami A, Kuraishi Y, Yabuuchi K, et al. lnduction of interleuki n-1 βmRNA in rat brain after transient forebrain ischemia[J]. J Neurochem ,1992,58:390-392.
[9] Ohtsuki T, Ruetzler C A, Tasski K, et al. Interleukin-1 mediate s induction of tolerance to global ischemia in gerbil hippocampal CA1 neurons[ J]. J Cereb Blood Flow Metab,1996,16:1137-1142.
[10] Chao C C, Hu S, Eerhlich l, et al. Interleukin-1 and tumor necrosis factor-α synergistically mediate neurotoxicity: involvement of nitric oxide an d of N-methyl-D-aspartate receptors[J]. Behav Immun,1995,9:355-365.
收稿日期:1999-04-22
修回日期:2000-06-26, http://www.100md.com
单位:军事医学科学院基础医学研究所,神经生物学研究室,北京 100850
关键词:低氧预处理;缺氧;人重组白细胞介素-1β;海马神经元;免疫组织化学
中国应用生理学杂志000402
摘要 目的:观察低氧预处理对大鼠海马神经元缺氧耐受性和白细胞介素- 1β(IL-1β)表达的影响。方法:取培养12 d的两组(对照组和低氧预处理 组)培养神经元,同时置于缺氧环境(0.9L/LN2,0.1L/LCO2)中培养2、4、8和12 h。 分别观察它们的形态变化和神经元存活数,并用抗rhIL-1β单克隆抗体进行免疫组织化学 染色,观察缺氧对大鼠海马培养神经元IL-1β表达的影响。结果:经低氧 预处理的海马神经元缺氧后IL-1β表达较对照组减弱,神经元损伤程度减轻,神经元存活 数明显高于对照组。结论:低氧预处理可使海马培养神经元对缺氧产生耐受 ,其中IL-1β表达降低可能是海马神经元对缺氧的一种适应性变化。
, http://www.100md.com
中图分类号: Q28;R364.4文献标识码:A
文章编号: 1000-6834(2000)04-0294-04
EFFECTS OF HYPOXIC PRECONDITIONING ON ANOXIC
TOLERANCE AND IL-1β EXPRESSION IN CULTURED
RAT HIPPOCAMPAL NEURONS
DING Ai-shi WANG Fu-zhuang YU Ming FAN Ming
(Department of Neurobiology, Institute of Basic Medical Sciences, Academy of Military Medical Sciences, Beijing 100850)
, http://www.100md.com
ABSTRACT Aim: To study the effects of hypoxic-preconditioning on anoxia-tolerance and IL- 1β expression in cultured rat hippocampal neurons after anoxia. Methods : 12 day cultured hippocampal neurons in control and hypoxic-precond itioning group were exposed to ano-xic environment(0.9 L/LN2+0.1 L/LCO2 ) for 2,4,8 and 12 h. The neurons were immunocytochemically stained using the antise rum against rhIL-1β,The number of survival neurons and the mean optical densit y (OD) of IL-1β expression were investigated. Resutls: The mor phological changes and IL-1β expression induced by acute anoxia in hypoxic-pr econditioning neurons were significantly less than those in control. The number of survival neurons was higher in the hypoxia-preconditioning group than that i n control group after acute hypoxia. Conclusion: Hypoxia-precon ditioning can induce the development of anoxia-tolerance in cultured hippocampa l neurons. The decreased IL-1β in hippocampal neurons may be an adaptive reac tion to acute anoxia.
, http://www.100md.com
KEY WORDS: hypoxic preconditioning; anoxia; recomb inant human interleukin-1β; hippocampal neurons; immunohistochemistry
反复短暂低氧处理可使组织耐受长时间缺氧的现象称之为低氧预处理(Hypoxic precond itioning)。预处理是机体抗缺氧或缺血的一种内源性保护现象。近来的研究表明,低氧预 处理产生的内源性保护现象不仅存在于多种属动物心脏,而且存在于肝、肾和脑等多种组织 、器官和细胞[1]。据报道[2],作为细胞因子之一的IL-1在中枢神经系 统的损伤修复、生长发育和生理功能的调控中起重要作用。我们以前的工作证实[3] 海马脑区存在IL-1β表达细胞,缺氧条件下IL-1β表达增强,但低氧预处理产生的内源 性保护机制与IL-1β表达有无关联以及IL-1β表达如何改变均不清楚。为此,本实验观察 了低氧预处理对海马培养神经元缺氧耐受性的影响及IL-1β表达的变化。
, http://www.100md.com
1 材料和方法
1.1 海马神经元培养
按已有的细胞培养方法进行海马神经元培养[3]。取初生的Wistar大鼠,在无 菌条件下分离出双侧海马,用1.25g/L胰蛋白酶消化(37℃、30 min)分散并制成5×108/L 密度的细胞悬液,接种于涂有小牛皮胶的35 mm塑料培养皿中,每皿2 ml。置于36℃、含0.1 0 /LCO2的培养箱(美国FORMA)内进行培养。培养液由9.4 g/L Eagle's MEM,0.05 L/ L马血清,0.01 L/L N3组合液[3]和谷氨酰胺0.10 g/L组成。于培养第3 d,在培 养液中分别加入细胞分裂抑制剂阿糖胞苷3 mg/L以抑制非神经细胞的过度增殖,作用48 h后 更换新鲜培养液,以后每周换液2次,每次更换一半新鲜培养液。
1.2 低氧预处理
, 百拇医药
取培养4 d的海马神经元,按实验分为对照和低氧预处理两组。低氧预处理组从培养第4 d起每天定时将神经元移至2 000 cm3的恒温(36℃)密闭容器内,连续充以低氧气体(0.8 9 L/LN2,0.01 L/L O2和0.10 L/L CO2),在此低氧条件下20 min后取出,再恢 复常氧培养。此后每天低氧预处理1次,每次20 min,如此反复低氧预处理8次。对照组细胞 在常氧条件下持续培养至12 d,用于对照观察。
1.3 缺氧实验
将上述两组培龄12 d海马神经元细胞同时放置2 000 cm3的恒温(36℃)密闭容器内, 连 续充以无氧气体(0.90 L/L N2、0.10L/L CO2),在此条件下持续缺氧2 h、4 h、8 h、和12 h。
, http://www.100md.com
1.4 形态学观察
用倒置相差显微镜分别观察两组细胞缺氧2 h、4 h、8 h和12 h时神经元的形态变化, 并在倒置相差显微镜(200X)下随机观察并计数150个相邻视野(0.16 mm2/视野)的存活神 经元数作比较。每皿细胞观察25个视野,每个实验观察2皿细胞,实验重复3次。
1.5 培养神经元的IL-1β免疫组化观察
取两组缺氧培养2 h、4 h、8 h和12 h的海马神经细胞,经40 g/L多聚甲醛固定后,用r hIL-1β单克隆抗体(鼠抗人,1∶1 000;本所制备)按ABC法进行免疫组织化学染色。同时 设空白对照(用PBS缓冲液替代第一抗体)和替代对照(用同种未免疫动物血清替代第一抗体) 。对观察结果作显微照相,并用CMlAS图像分析仪(北京航天大学与空军总医院共同研制)的 光密度计组件对IL-1β表达神经元作平均光密度(OD)分析。每皿细胞观察10个视野,每个 实验观察2皿细胞,实验重复3次。
, http://www.100md.com
1.6 统计学处理
数据以平均值±标准差(
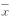 ±s)表示,按Student 氏法进行t检验。
±s)表示,按Student 氏法进行t检验。2 结果
2.1 低氧预处理对海马神经元形态,神经元存活数和IL-1β表达的影响
新生大鼠海马神经元经分散培养12 d,神经元胞体增大,多数呈锥体状或多极形,胞体有明显的折光性,立体感强,神经突起互相联络成网。观察结果可见,缺氧前对照组和低氧预处理组神经元的形态和神经元存活数均无明显差异(表1)。IL-1β免疫组织化学显示,对照组和低氧预处理组缺氧前海马神经元中有IL-1β表达,IL-1β蛋白分布于神经元胞体内 ,染色为浅棕色(图A,B)。图像分析的结果表明,缺氧前两组神经元IL-1β表达的平均光 密度无明显差异(表1)。
, 百拇医药
Tab.1 Effects of hypoxic preconditioning on survival
of hi ppocampal neurons after acute anoxia(number of
neurons/field)(
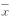 ±s,n=150 fields) Group
±s,n=150 fields) GroupBefore anoxia
After anoxia (h)
2
4
8
, 百拇医药
12
Control
23.55±4.92
20.65±3.04
17.67±2.81
11.04±2.01
3.73±0.96
Preconditioning
23.14±4.45
22.24±3.45
20.35±2.18**
, 百拇医药
15.12±2.44**
6.22±1.27**
** P<0.01 compared with control
2.2 缺氧对海马神经元形态,神经元存活数和IL-1β表达的影响
海马神经元在缺氧条件下持续培养2~4 h,部分神经元胞体开始出现轻度肿胀,神经元存活 数较缺氧前明显减少。缺氧8 h,大部分神经细胞胞体出现肿胀,体积增大,失去折光性, 部分神经元的细胞膜发生破裂。神经元存活数较缺氧前减少越来越明显。缺氧12 h,大部分 神经元细胞膜破裂,神经突起断裂崩解,神经元存活数较缺氧前显著减少(表1)。经IL-1β 免疫组织化学显示,缺氧2~8 h时海马神经元对IL-1β的表达较缺氧前明显增强,神经元 被染成深棕色,(图1 D,F),但缺氧12 h时海马神经元对IL-1β的表达又逐渐减弱(图1 H) 。图像分析的结果同样显示,缺氧2~8h时IL-1β表达神经元的平均光密度均较缺氧前明显 增加。缺氧12h时IL-1β表达神经元的平均光密度又逐渐减小,但仍然明显高于缺氧前(表2 )。2.3 低氧预处理对海马培养神经元急性缺氧损伤的保护作用
, http://www.100md.com
Tab.2 Effects of hypoxic preconditioning on the
mean optic al density (OD) of rhlL-1β expression
in hippocampal neurons after acu te anoxia(
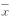 ±s),n=60 fields) Group
±s),n=60 fields) GroupBefore anoxia
After anoxia (h)
2
4
8
, http://www.100md.com
12
Control
0.11±0.03
9.29±0.04
0.28±0.04
0.27±0.04
0.15±0.03
Preconditioning
0.11±0.03
0.24±0.04**
0.21±0.04**
, 百拇医药
0.20±0.03**
0.14±0.03
**P<0.01 compared with control

Fig.1 Effects of hypoxic-preconditioning on IL-1β
expression in rat hippocampal neurons after anoxia (×400)
A,B: IL-1β expression in cultured rat hippocampal neurons
from both of hypoxi c-preconditioning and control group respectively
, 百拇医药
C,E,G: IL-1β expression in cultured rat hippocampal neurons of
hypoxic-precon ditioning group after anoxia forz、8 and 12 h.respectively
D,F,H: IL-1β expression in cultured rat hippocampal neurons
of control group a fter anoxia for 2,8 and 12 h,respectively
与对照组相比,经低氧预处理的海马神经元急性缺氧后神经元损伤程度较轻,神经元存 活数明显高于对照组(表1)。经IL-1β免疫组织化学显示,低氧预处理组海马神经元缺氧 2 ~8h时IL-1β表达亦较缺氧前明显增强,但明显低于对照组(图1 C,E)。缺氧12 h时海马 神经元对IL-1β的表达又逐渐减弱(图1 G)。图像分析的结果同样显示,低氧预处理组海马 神经元缺氧后2~8 h,IL-1β表达神经元的平均光密度均明显低于对照组(表2)。
, http://www.100md.com
3 讨论
近年来的研究表明,体内许多组织及脑细胞经受了一次或多次短暂非致死性缺血或缺氧 刺激后可获得对更严重甚至致死性缺血或缺氧的耐受。Liu等[4]将大鼠颈总动脉夹 闭3 min,经3 d再灌注后,再次夹闭同侧颈总动脉6 min、8 min和10 min,测定同侧海马C Al区神经元密度,对照组显著低于预处理组。Kato等[5]对沙土鼠的研究表明,短 暂全脑缺血所致的缺血耐受可保护以后更长时间的全脑缺血,缺血2 min能产生耐受,但需 要24 h间歇使耐受得以诱导。耐受产生后至少可持续2d,多次短时的缺血比单次诱导作用更强。Tokunaga等报道[6]沙土鼠经短暂全脑缺预处理后, 取其海马脑片在体外 再次缺氧时即产生缺氧耐受,使低氧下海马脑片突触后群峰电位消失时间后延,缺氧20 min 再复氧后脑片突触后群峰电位恢复率增加。在我们的实验中也同样观察到,经低氧预处理的 海马神经元缺氧后形态学变化轻微,神经元存活数明显高于对照组,结果表明,低氧预处理 可使体外培养的海马神经元对缺氧产生耐受。目前,越来越多的证据表明,脑内IL-1局部 浓度的升高直接与脑组织病理损伤的发生和发展有关,在实验性脑损伤时,损伤处的IL-1 浓度升高[7]。大鼠前脑短暂脑缺血后可引起海马脑区IL-1β mRNA表达明显增加 ,维持数小时后又逐渐降至正常[8],在我们的实验结果中也看到了类似的现象, 即缺氧2~8 h时海马神经元对IL-1β的表达较缺氧前明显增强。缺氧12 h时又逐渐下降, 推侧在这种病理生理条件下海马神经元IL-1β表达增加可能是对缺氧的应激反应。而后IL -1β表达迅速降低可能与海马神经元因缺氧而严重受损或特异性细胞因子抑制物的产生有 关。确切机制尚有待进一步研究。本实验还观察到,经低氧预处理的海马神经元缺氧后对IL -1β的表达均明显低于对照组。据报道,脑缺血缺氧后脑内IL-1增加可能又具损伤和修复 的双重作用,在缺氧初期IL-1浓度的适量增加可刺激神经细胞分泌神经营养因子,并能诱 导神经元对缺氧损伤的耐受性,具有增强神经元抗损伤和促进修复作用[9]。但脑 缺血.缺氧后脑内IL-1浓度持续明显增高亦可直接介导脑损伤与神经元死亡,现证实,高 浓度的IL-1在体内外均可促进神经元释放谷氨酸和自由游离基团,并可引起或加重脑细胞 损伤[10]。因此,由本实验观察到的低氧预处理可使缺氧后海马神经元对IL-1β 的表达减少,这可能是海马神经元对缺氧的一种适应性变化。
, 百拇医药
基金项目:国家自然科学基金重点资助课题(39730190)
作者简介:丁爱石(1948-),男,江苏无锡人,高级实验师,从事神经细 胞培养及电生理研究。
4 参考文献
[1] Riepe M W, Kasischke K, Gericke C A, et al. Increase of hy poxic tolerance in rat hippocampal slices following 3-nitropropionic acid is no t mediated by endogenus nerve growth factor [J]. Neurosci Lett, 1996,211:9 -12.
[2] 要 航,王福庄.细胞因子对中枢神经系统海马脑区的作用[J].生理科学 进展,1995,26(2):132-136.
, 百拇医药
[3] 丁爱石,王福庄,黄燕华,等.体外培养大鼠海马细胞白细胞介素-1的表达 及缺氧的影响[J].中国应用生理学杂志,1996,12(2):157-161.
[4] Liu Y, Kato H, Nakata N, et al. Protection of rat hi-ppocampu s against ischemic neuronal damage by pretreatment with sublethal ischemia[J ]. Brain Res,1994,74:998-1004.
[5] Kato H, Liu Y, Arakik K, et al. Temporal profile of the effects of pretreatment with brief cerebral ischemia insult in the gerbil: cumulative da mage and protective effects[J]. Brain Res, 1991,553:238-242.
, 百拇医药
[6] Tokunaga H, Hiramatsu K. Sakaki T. Effect of prece-ding in vivo suble thal ischemia on the evoked potentials during secondary in vitro hypoxia evaluat ed with gerbil hippocampal slices[J]. Brain Res,1998,784:316-320.
[7] Woodroofe M N, Sarna G S, Wadhwa M, et al. Detection of interleu kin-1 and interleukin-6 in adult rat brain, following mechanical injury, by in vivo microdialysis: evidence of a role for microglia in cytokine production[J ].J Neuroimmunol,1991,33:227-236.
, http://www.100md.com
[8] Minami A, Kuraishi Y, Yabuuchi K, et al. lnduction of interleuki n-1 βmRNA in rat brain after transient forebrain ischemia[J]. J Neurochem ,1992,58:390-392.
[9] Ohtsuki T, Ruetzler C A, Tasski K, et al. Interleukin-1 mediate s induction of tolerance to global ischemia in gerbil hippocampal CA1 neurons[ J]. J Cereb Blood Flow Metab,1996,16:1137-1142.
[10] Chao C C, Hu S, Eerhlich l, et al. Interleukin-1 and tumor necrosis factor-α synergistically mediate neurotoxicity: involvement of nitric oxide an d of N-methyl-D-aspartate receptors[J]. Behav Immun,1995,9:355-365.
收稿日期:1999-04-22
修回日期:2000-06-26, http://www.100md.com