HBV中片段表面抗原及E抗原真核表达质粒的构建与体外表达
http://www.100md.com
南京医科大学学报 2000年第4期第20卷 论著
作者:蔡洁 郭人花 周惠英 刘宁 黄祖瑚
单位:蔡洁 郭人花 刘宁 黄祖瑚(南京医科大学第一附属医院传染病科);周惠英(中心实验室,南京 210029)
关键词:乙型;肝炎E抗原;乙型;肝炎表面抗原;乙型;核酸疫苗
南京医科大学学报000406 摘 要 目的 构建乙型肝炎病毒(HBV)中片段表面抗原真核表达质粒和E抗原真核表达质粒。方法 将编码HBV中片段表面抗原(preS2+S)的基因片段和E抗原(HBeAg)的基因片段分别插入真核细胞表达载体(pJW4303)中。构建成的重组体经筛选鉴定后,再转染哺乳动物细胞,检测表达产物。结果 电泳鉴定显示目的基因片段正确插入了表达载体。经筛选、纯化的阳性克隆转染哺乳动物细胞后可表达preS2+S和HBeAg。结论 HBV中片段表面抗原真核表达质粒(pJW4303/HBV-S2.S)和E抗原真核表达质粒(pJW4303/HBe)构建成功。肝炎病毒,中图号 R512.6+2; R392.11
, http://www.100md.com
Construction and in Vitro Expression of Eukaryotic Expression Plasmids of HBV Middle Envelope Protein and HBV E Antigen
Cai Jie, Guo Renhua, Zhou Huiying, et al.
(Department of Infectious Disease, the First Affiliated Hospital of Nanjing Medical University, Nanjing 210029)
Abstract Objective To construct the eukaryotic expression plasmids of HBV middle envelope protein and HBV E antigen. Methods Two recombinant plasmids were constructed by inserting HBV middle envelope protein gene fragment or E antigen gene fragment into the reading frame of plasmid pJW4303. The positive clones were screened and identified by restrictive endonuclease digestion. Transient expressions were performed by transfection of 293T cells with purified recombinants. The expressive products were detected by ELISA. Results The electrophoresis of products with the endonuclease digestion showed that the target gene fragments have been inserted into pJW4303. The expression of HBV middle envelope protein and HBeAg were demonstrated by ELISA in cell culture supernatant and/or cell lysis of 293T cells. Conclusion The results showed that the eukaryotic expression plasmids of pJW4303/HBV-S2.S and pJW4303/HBe were constructed successfully.
, 百拇医药
Key words hepatitis B virus; hepatitis B E antigens; hepatitis B surface antigens; nuclic acid vaccine
慢性乙型肝炎患者和乙肝病毒慢性携带者特异性细胞毒性T淋巴细胞(CTL)反应低下,与病毒持续感染密切相关[1]。核酸疫苗可通过主要组织相容性复合物Ⅰ类(MHC-Ⅰ类)途径,激发机体特异性CTL应答,有利于机体清除慢性病毒感染[2]。我们已成功构建了HBcAg真核表达质粒作为核酸疫苗,经小鼠免疫证实具有良好的细胞和体液免疫原性[3]。在此基础上又构建了HBV中片段表面抗原(preS2+S)、E抗原(HBeAg)两种真核表达质粒,现将结果报告如下。
1 材料与方法
1.1 材料
, 百拇医药
1.1.1 质粒
pJW4303系真核表达质粒,含巨细胞病毒(CMV)即刻早期启动子,由美国马萨诸塞大学医学中心Robinson教授惠赠。PTK系含有ayw亚型HBV全基因组的原核表达质粒。adw2亚型HBV全基因组由澳大利亚VIDRL Locarnini博士惠赠。
1.1.2 PCR引物
根据目的基因片段的已知序列设计PCR引物(中国科学院上海植物生理研究所),在上、下游引物5′末端分别引入Hind Ⅲ和BamHI识别序列。preS2+S区片段上游引物5′CCGGAAGCTTGCGATGCAG-
TGGAAGCG3′,下游引物5′CGGGATCCGGTTTAAA-TGTATACCCAG3′,PCR产物长度为867bp;HBeAg编码基因片段上游引物5′CCGGAAGCTTACCATGC-AACTTTTTCAC3′,下游引物5′CCGGGGATCCATACTAACATTGAGATTC3′,PCR产物长度为658 bp。
, 百拇医药
1.1.3 其他
限制性内切酶Hind Ⅲ(11 U/ml), Progen公司。限制性内切酶BamHI(20 U/ml), New England Biolabs公司。Alkaline Phosphatase Calf intestinal (1 U/ml), Promega公司。T4 DNA Ligase (5 U/ml), Boehringer Mannheim公司。1kb DNA Ladder, Promega公司。Lambda DNA/Hind Ⅲ Markers (0.54 g/L),华美公司。基因扩增仪,HYBAID公司。电泳槽,Sub-Cell GT-MINI, BIO-RAD公司。电泳仪,PowderPac 300,BIO-RAD公司。紫外透射分析仪,ZF-AI型,上海长明光学电子仪器厂。QIAEX-Ⅱ Gel Extraction Kit, QIAGEN公司。Promega Midi preps DNA Purifucation System, Promega公司。Mammalian Transfection System-Calcium Phosphate, Promage公司。HBsAg和HBeAg ELISA检测试剂盒,上海传染病院研究所。HBsAg和HBeAg IMx检测系统,Abbott Laboratories。PreS2 ELISA检测试剂盒,华美公司。
, 百拇医药
Low TE(10 mmol/L Tris, 0.1 mmol/L EDTA, pH 8.0)。哺乳动物细胞裂解剂:Mammalian cell lysate Buffer (50 mmol/L Tris-Cl, pH 7.6; 150 mmol/L NaCl; 1% Triton-X 100),使用前以此Buffer将PMSF(phenymethyl sulfonyl fluoride, Sigma)稀释至10 mmol/L。293T细胞(一种用于瞬间转染的人胚肾细胞系)为本研究室保存细胞系。大肠杆菌HB101为本研究室保存菌种。
1.2 方法
1.2.1 PCR
分别以adw2亚型HBV全基因组与质粒PTK为模板,用相应引物分别扩增preS2+S基因片段和HBeAg编码基因片段,PCR条件为:94℃ 1 min,55℃ 1 min, 72℃ 1 min;重复35个循环。
, 百拇医药
1.2.2 质粒DNA的构建
目的基因片段的准备 PCR产物经限制性核酸内切酶Hind Ⅲ、BamHI在37℃水浴条件下作用2 h双酶切后,0.8%琼脂糖凝胶电泳鉴定,并切下含目的基因片段的电泳带,用QIAEX-Ⅱ Gel Extraction Kit从琼脂糖凝胶中回收纯化HBV-preS2.S及HBeAg编码基因片段,重悬于Low TE溶液中。
载体的准备 将真核细胞表达载体(pJW4303)质粒以HindⅢ和BamHI双酶切,然后用Alkaline Phosphatase Calf Intestinal (CIP)对酶切后的载体末端作去磷酸化处理。通过0.8%琼脂糖凝胶电泳鉴定,切下含线性载体的电泳带,用QIAEX-Ⅱ Gel Extraction Kit回收纯化,重悬于Low TE溶液中。
重组质粒的连接 将酶切回收的目的基因片段和线性pJW4303用T4DNA连接酶连接(4℃, 24 h);将酶切回收的线性pJW4303也在同等条件下自环连接作为阴性对照。
, 百拇医药
1.2.3 重组质粒阳性克隆的筛选、鉴定
重组质粒转化大肠杆菌 以冰冻氯化钙法制备感受态大肠杆菌HB101。用热休克法将重组质粒和阴性对照空载质粒分别转化感受态大肠杆菌HB101,接种于含氨苄青霉素(Amp)的LB(Luria Bertani)培养板(第1次接种),37℃恒温箱过夜。次日可见重组质粒转化菌接种板有数十个单菌落生长,CIP后连接的阴性对照pJW4303转化菌接种板只有十余个单菌落生长。
阳性克隆的筛选和鉴定 随机挑取LB培养板上的单菌落,每个单菌落的一半再次接种含Amp的LB培养板(第2次接种),另一半置4 ml LB培养液37℃振摇过夜。用碱裂解法快速小量提取重组质粒DNA再进行电泳,与空载质粒pJW4303作比较,电泳迁移慢者作为阳性克隆选出,用HindⅢ、BamHI 37℃水浴2 h双酶切后,进一步电泳鉴定有5 kb和0.8 kb,或5 kb和0.6 kb两条带者即可初步确定为表面抗原真核表达质粒(pJW4303/HBV-S2.S)或E抗原真核表达质粒(pJW4303/HBe)的阳性克隆。然后,将第2次接种的阳性克隆菌落进行第3次接种,挑取单菌落,增菌、提取、酶切鉴定同前。经此反复3次筛选后,将选出的阳性克隆菌种70℃保存。
, 百拇医药
1.2.4 重组质粒提取、纯化
挑取70℃保存的阳性克隆菌种置于100 ml含Amp的LB培养液,37℃振摇过夜,用DNA提纯试剂盒提取、纯化300 ml Low TE重悬,紫外分光光度计测产物浓度约0.8~0.9 μg/ml(每100 ml LB培养液可获约24~27 μg重组质粒DNA),70℃保存。
重组质粒提纯后的再鉴定 将提取的重组质粒用HindⅢ、BamHI 37℃双酶切,以及用HindⅢ单酶切后电泳,与空载质粒pJW4303以HindⅢ单酶切后的产物进行比较。
1.2.5 重组质粒体外表达产物的鉴定
重组质粒转染293T细胞 将生长期293T细胞铺于100 mm培养皿,分别取提纯的pJW4303/HBV-S2.S、pJW4303/HBe及pJW4303(空载对照质粒)约20 μg,用磷酸钙沉淀法转染293T细胞(一种用于瞬间转染的人胚肾细胞系),培养72 h(37℃,5% CO2)。
, http://www.100md.com
表达产物的回收 将培养皿中的细胞培养液以800 r/min,离心5 min后收集上清待测。同时收集细胞,用裂解剂裂解,4℃条件下12 000 r/min,离心1 h后取上清待测。
表达产物的检测 用ELISA法检测细胞培养液上清和细胞裂解产物上清中的HBsAg和HBeAg,测定值以450 nm的吸光度A值表示。用Abbott试剂检测细胞培养液上清中的HBsAg和HBeAg,以速率比(S/N)反映结果。用ELISA法定性检测含有HBsAg细胞培养液上清中的preS2。
2 结 果
2.1 重组质粒的构建
pJW4303/HBV-S2.S和pJW4303/HBe重组质粒的构建图谱见图1和图2。如图所示,编码preS2+S和HBeAg的基因片段均以5′Hind Ⅲ→3′BamHI方向定向插入pJW4303中。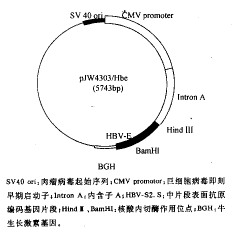
, http://www.100md.com
图1 pJW4303/HBV-S2.S
图2 pJW4303/HBe
2.2 重组质粒电泳鉴定
将两个重组质粒各自用Hind Ⅲ、BamHI双酶切,可获得5 kb和867 bp(pJW4303/HBV-S2.S),或5 kb和658 bp(pJW4303/HBe)两条带,而空载质粒pJW4303单酶切后仅见5 kb一条线性带。未经内切酶消化的完整质粒带,pJW4303则较前两者小,证明867 bp或658 bp的目的基因已经插入pJW4303(图3、4)。经3次筛选后,各获得两株阳性克隆菌种,分别提纯。
2.3 重组质粒体外表达产物的鉴定
(1)重组质粒转染293T细胞后的培养液上清及细胞裂解产物上清以ELISA法检测(表1、2)。
, 百拇医药
表1 ELISA检测HBV中片段表面抗原重组质粒体外表达的HBsAg
pJW4303/HBV-S2.S
阴性对照
阳性对照
阳性克隆1
阳性克隆2
培养上清
裂解产物
培养上清
裂解产物
1
2
, 百拇医药
A值
0.24
0.05
1.26
0.79
0.02
0.14
1.12
P/N
2.53
0.53
13.26
8.31
, 百拇医药
14.00
表2 ELISA检测HBeAg重组质粒体外表达的HBeAg
pJW4303/HBe
阴性对照
阳性对照
阳性克隆1
阳性克隆2
培养上清
裂解产物
培养上清
裂解产物
1
, http://www.100md.com
2
A值
0.68
0.31
0.43
0.15
0.01
0.00
0.44
P/N
13.60
6.20
8.60
, 百拇医药
3.00
8.80
阴性对照A值低于0.05以0.05计,高于0.05按实际值计。P/N≥2.1判为阳性。 (2)细胞培养上清以Abbott试剂检测(S/N>2.100为阳性,表3、4)。
图3 pJW4303/HBV-S2.S酶切电泳鉴定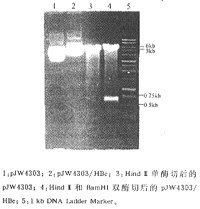
图4 pJW4303/HBe酶切电泳鉴定
表3 Abbott检测pJW4303/HBV-S2.S细胞培养上清
pJW4303/HBs
, 百拇医药
pJW4303
阳性克隆1
阳性克隆2
S/N
185.39
284.14
2.70
表4 Abbott检测pJW4303/HBe细胞培养上清
pJW4303/HBe
pJW4303
阳性克隆1
阳性克隆2
, 百拇医药
S/N
143.619
173.631
1.357
(3)pJW4303/HBV-S2.S转染的细胞培养上清以ELISA法检测preS2:阳性克隆1为阴性,阳性克隆2为阳性;对照pJW4303为阴性。
3 讨 论
1993年Ulmer等[4]首次报道了流感病毒核酸疫苗的研究结果,随后HBV、HCV等核酸疫苗的研制工作也逐步展开[5]。已有研究证实HBsAg核酸疫苗在动物实验中能激发特异性免疫反应,且前S蛋白有很高的免疫原性,可强化对同存的S蛋白的免疫应答,其中中片段表面抗原的免疫原性较大片段表面抗原更强[6],可进一步作为核酸疫苗的组成成分进行研究。基于此,本实验选择我国HBV主要流行株adw2的preS2+S区基因为目的基因,构建成真核表达重组质粒。而HBcAg和HBeAg是机体针对HBV CTL应答的主要靶抗原,我们以自行构建的pJW4303/HBc核酸疫苗免疫小鼠后,观察到了良好的细胞免疫和体液免疫反应[3],现再将HBV ayw亚型的HBeAg编码基因作为目的基因构建成核酸疫苗,为HBV发病机理的有关研究作准备。
, 百拇医药
本实验中所用真核表达载体pJW4303,带有巨细胞病毒即刻早期启动子(CMV immediate early promoter)、SV40起始序列、polyA信号、氨苄青霉素抗性基因(Ampr),以及多克隆酶切位点等成分,可保证插入基因用自身起始密码在多种哺乳动物细胞内高效表达。我们以往的研究已表明,pJW4303/HBc能在横纹肌内高效、稳定地表达。本实验中插入的preS2+S、E编码基因的PCR产物在其5′端和3′端已分别引入Hind Ⅲ、BamHI酶切位点,连接反应前PCR产物和载体皆以这两种酶进行双酶切,故连结后目的基因即定向克隆于pJW4303的CMV启动子下游,构建成pJW4303/HBV-S2.S、pJW4303/HBe。
重组质粒酶切后的电泳图显示,双切后有5 085 bp和867 bp,或5 085 bp和658 bp两条带。pJW4303单切后为5 085 bp一条带,与重组质粒双切后的大带(5 085 bp)位置相同。而未经酶切的完整质粒环状
, http://www.100md.com
带pJW4303/HBV-S2.S及pJW4303/HBe较pJW
4303位置偏大。这说明重组质粒的碱基对数与理论相符,目的基因片段已插入pJW4303中。
重组质粒体外表达结果显示,pJW4303/HBV-S2.S阳性克隆株1号的细胞培养液上清中含有HBsAg,但并无preS2,裂解产物上清甚至未能检测出HBsAg;阳性克隆株2号的细胞培养液上清中含有HBsAg及preS2,裂解产物上清中HBsAg也为阳性。pJW4303/HBe阳性克隆株1、2号培养液、裂解产物上清ELISA检测皆含有HBeAg,Abbott检测培养液上清中HBeAg也为阳性。ELISA结果还反映培养液的吸光度A值均高于裂解液。以上结果说明:①重组质粒转染293T细胞成功,能在哺乳动物细胞内表达。pJW4303/HBV-S2.S 2号克隆表达了HBV中片段表面抗原,1号克隆只表达了HBsAg;pJW4303/HBe则两个克隆都表达了HBeAg。②目的基因编码产生的HBsAg和HBeAg是分泌性的,故培养液中含量较裂解液高。
, http://www.100md.com
核酸疫苗pJW4303/HBV-S2.S和pJW4303/HBe已构建成功,为进一步观察其特异性体液免疫和细胞免疫反应原性奠定了基础。HBVpreS2+S核酸疫苗2号克隆和HBeAg核酸疫苗1号克隆免疫小鼠的实验观察正在进行中。
参考文献
1,Chisari FV, Ferrari C. Hepatiltis B virus immunopathogenesis. Ann Rev Immunol, 1995,13:29
2,Martins LP, Lau LL, Asano MS, et al. DNA vaccination against persistent viral infection. Journal of Virology, 1995,69(4):2574
3,黄祖瑚,卢 山,刘 宁,等.乙型肝炎病毒核心抗原基因疫苗对小鼠的体液和细胞免疫原性观察.中华医学杂志,1999,17(9):104
, 百拇医药
4,Ulmer JB, Donnelly JJ, Parder SE, et al. Heterologous protection against influenza by injection of DNA encoding a viral protein. Science, 1993,259:1745
5,Margaret JK, Jack TL. DNA vaccines and viral hepatitis B: are we going around in circles? Gastroenterology, 1997,112:1410
6,Geissler M, Tokushige K, Wands JR. Cellular and humoral immune response to hepatitis B virus structural proteins in mice following DNA-based immunization. Gastroenterology, 1997,112:1307
(1999-11-17收稿), 百拇医药
单位:蔡洁 郭人花 刘宁 黄祖瑚(南京医科大学第一附属医院传染病科);周惠英(中心实验室,南京 210029)
关键词:乙型;肝炎E抗原;乙型;肝炎表面抗原;乙型;核酸疫苗
南京医科大学学报000406 摘 要 目的 构建乙型肝炎病毒(HBV)中片段表面抗原真核表达质粒和E抗原真核表达质粒。方法 将编码HBV中片段表面抗原(preS2+S)的基因片段和E抗原(HBeAg)的基因片段分别插入真核细胞表达载体(pJW4303)中。构建成的重组体经筛选鉴定后,再转染哺乳动物细胞,检测表达产物。结果 电泳鉴定显示目的基因片段正确插入了表达载体。经筛选、纯化的阳性克隆转染哺乳动物细胞后可表达preS2+S和HBeAg。结论 HBV中片段表面抗原真核表达质粒(pJW4303/HBV-S2.S)和E抗原真核表达质粒(pJW4303/HBe)构建成功。肝炎病毒,中图号 R512.6+2; R392.11
, http://www.100md.com
Construction and in Vitro Expression of Eukaryotic Expression Plasmids of HBV Middle Envelope Protein and HBV E Antigen
Cai Jie, Guo Renhua, Zhou Huiying, et al.
(Department of Infectious Disease, the First Affiliated Hospital of Nanjing Medical University, Nanjing 210029)
Abstract Objective To construct the eukaryotic expression plasmids of HBV middle envelope protein and HBV E antigen. Methods Two recombinant plasmids were constructed by inserting HBV middle envelope protein gene fragment or E antigen gene fragment into the reading frame of plasmid pJW4303. The positive clones were screened and identified by restrictive endonuclease digestion. Transient expressions were performed by transfection of 293T cells with purified recombinants. The expressive products were detected by ELISA. Results The electrophoresis of products with the endonuclease digestion showed that the target gene fragments have been inserted into pJW4303. The expression of HBV middle envelope protein and HBeAg were demonstrated by ELISA in cell culture supernatant and/or cell lysis of 293T cells. Conclusion The results showed that the eukaryotic expression plasmids of pJW4303/HBV-S2.S and pJW4303/HBe were constructed successfully.
, 百拇医药
Key words hepatitis B virus; hepatitis B E antigens; hepatitis B surface antigens; nuclic acid vaccine
慢性乙型肝炎患者和乙肝病毒慢性携带者特异性细胞毒性T淋巴细胞(CTL)反应低下,与病毒持续感染密切相关[1]。核酸疫苗可通过主要组织相容性复合物Ⅰ类(MHC-Ⅰ类)途径,激发机体特异性CTL应答,有利于机体清除慢性病毒感染[2]。我们已成功构建了HBcAg真核表达质粒作为核酸疫苗,经小鼠免疫证实具有良好的细胞和体液免疫原性[3]。在此基础上又构建了HBV中片段表面抗原(preS2+S)、E抗原(HBeAg)两种真核表达质粒,现将结果报告如下。
1 材料与方法
1.1 材料
, 百拇医药
1.1.1 质粒
pJW4303系真核表达质粒,含巨细胞病毒(CMV)即刻早期启动子,由美国马萨诸塞大学医学中心Robinson教授惠赠。PTK系含有ayw亚型HBV全基因组的原核表达质粒。adw2亚型HBV全基因组由澳大利亚VIDRL Locarnini博士惠赠。
1.1.2 PCR引物
根据目的基因片段的已知序列设计PCR引物(中国科学院上海植物生理研究所),在上、下游引物5′末端分别引入Hind Ⅲ和BamHI识别序列。preS2+S区片段上游引物5′CCGGAAGCTTGCGATGCAG-
TGGAAGCG3′,下游引物5′CGGGATCCGGTTTAAA-TGTATACCCAG3′,PCR产物长度为867bp;HBeAg编码基因片段上游引物5′CCGGAAGCTTACCATGC-AACTTTTTCAC3′,下游引物5′CCGGGGATCCATACTAACATTGAGATTC3′,PCR产物长度为658 bp。
, 百拇医药
1.1.3 其他
限制性内切酶Hind Ⅲ(11 U/ml), Progen公司。限制性内切酶BamHI(20 U/ml), New England Biolabs公司。Alkaline Phosphatase Calf intestinal (1 U/ml), Promega公司。T4 DNA Ligase (5 U/ml), Boehringer Mannheim公司。1kb DNA Ladder, Promega公司。Lambda DNA/Hind Ⅲ Markers (0.54 g/L),华美公司。基因扩增仪,HYBAID公司。电泳槽,Sub-Cell GT-MINI, BIO-RAD公司。电泳仪,PowderPac 300,BIO-RAD公司。紫外透射分析仪,ZF-AI型,上海长明光学电子仪器厂。QIAEX-Ⅱ Gel Extraction Kit, QIAGEN公司。Promega Midi preps DNA Purifucation System, Promega公司。Mammalian Transfection System-Calcium Phosphate, Promage公司。HBsAg和HBeAg ELISA检测试剂盒,上海传染病院研究所。HBsAg和HBeAg IMx检测系统,Abbott Laboratories。PreS2 ELISA检测试剂盒,华美公司。
, 百拇医药
Low TE(10 mmol/L Tris, 0.1 mmol/L EDTA, pH 8.0)。哺乳动物细胞裂解剂:Mammalian cell lysate Buffer (50 mmol/L Tris-Cl, pH 7.6; 150 mmol/L NaCl; 1% Triton-X 100),使用前以此Buffer将PMSF(phenymethyl sulfonyl fluoride, Sigma)稀释至10 mmol/L。293T细胞(一种用于瞬间转染的人胚肾细胞系)为本研究室保存细胞系。大肠杆菌HB101为本研究室保存菌种。
1.2 方法
1.2.1 PCR
分别以adw2亚型HBV全基因组与质粒PTK为模板,用相应引物分别扩增preS2+S基因片段和HBeAg编码基因片段,PCR条件为:94℃ 1 min,55℃ 1 min, 72℃ 1 min;重复35个循环。
, 百拇医药
1.2.2 质粒DNA的构建
目的基因片段的准备 PCR产物经限制性核酸内切酶Hind Ⅲ、BamHI在37℃水浴条件下作用2 h双酶切后,0.8%琼脂糖凝胶电泳鉴定,并切下含目的基因片段的电泳带,用QIAEX-Ⅱ Gel Extraction Kit从琼脂糖凝胶中回收纯化HBV-preS2.S及HBeAg编码基因片段,重悬于Low TE溶液中。
载体的准备 将真核细胞表达载体(pJW4303)质粒以HindⅢ和BamHI双酶切,然后用Alkaline Phosphatase Calf Intestinal (CIP)对酶切后的载体末端作去磷酸化处理。通过0.8%琼脂糖凝胶电泳鉴定,切下含线性载体的电泳带,用QIAEX-Ⅱ Gel Extraction Kit回收纯化,重悬于Low TE溶液中。
重组质粒的连接 将酶切回收的目的基因片段和线性pJW4303用T4DNA连接酶连接(4℃, 24 h);将酶切回收的线性pJW4303也在同等条件下自环连接作为阴性对照。
, 百拇医药
1.2.3 重组质粒阳性克隆的筛选、鉴定
重组质粒转化大肠杆菌 以冰冻氯化钙法制备感受态大肠杆菌HB101。用热休克法将重组质粒和阴性对照空载质粒分别转化感受态大肠杆菌HB101,接种于含氨苄青霉素(Amp)的LB(Luria Bertani)培养板(第1次接种),37℃恒温箱过夜。次日可见重组质粒转化菌接种板有数十个单菌落生长,CIP后连接的阴性对照pJW4303转化菌接种板只有十余个单菌落生长。
阳性克隆的筛选和鉴定 随机挑取LB培养板上的单菌落,每个单菌落的一半再次接种含Amp的LB培养板(第2次接种),另一半置4 ml LB培养液37℃振摇过夜。用碱裂解法快速小量提取重组质粒DNA再进行电泳,与空载质粒pJW4303作比较,电泳迁移慢者作为阳性克隆选出,用HindⅢ、BamHI 37℃水浴2 h双酶切后,进一步电泳鉴定有5 kb和0.8 kb,或5 kb和0.6 kb两条带者即可初步确定为表面抗原真核表达质粒(pJW4303/HBV-S2.S)或E抗原真核表达质粒(pJW4303/HBe)的阳性克隆。然后,将第2次接种的阳性克隆菌落进行第3次接种,挑取单菌落,增菌、提取、酶切鉴定同前。经此反复3次筛选后,将选出的阳性克隆菌种70℃保存。
, 百拇医药
1.2.4 重组质粒提取、纯化
挑取70℃保存的阳性克隆菌种置于100 ml含Amp的LB培养液,37℃振摇过夜,用DNA提纯试剂盒提取、纯化300 ml Low TE重悬,紫外分光光度计测产物浓度约0.8~0.9 μg/ml(每100 ml LB培养液可获约24~27 μg重组质粒DNA),70℃保存。
重组质粒提纯后的再鉴定 将提取的重组质粒用HindⅢ、BamHI 37℃双酶切,以及用HindⅢ单酶切后电泳,与空载质粒pJW4303以HindⅢ单酶切后的产物进行比较。
1.2.5 重组质粒体外表达产物的鉴定
重组质粒转染293T细胞 将生长期293T细胞铺于100 mm培养皿,分别取提纯的pJW4303/HBV-S2.S、pJW4303/HBe及pJW4303(空载对照质粒)约20 μg,用磷酸钙沉淀法转染293T细胞(一种用于瞬间转染的人胚肾细胞系),培养72 h(37℃,5% CO2)。
, http://www.100md.com
表达产物的回收 将培养皿中的细胞培养液以800 r/min,离心5 min后收集上清待测。同时收集细胞,用裂解剂裂解,4℃条件下12 000 r/min,离心1 h后取上清待测。
表达产物的检测 用ELISA法检测细胞培养液上清和细胞裂解产物上清中的HBsAg和HBeAg,测定值以450 nm的吸光度A值表示。用Abbott试剂检测细胞培养液上清中的HBsAg和HBeAg,以速率比(S/N)反映结果。用ELISA法定性检测含有HBsAg细胞培养液上清中的preS2。
2 结 果
2.1 重组质粒的构建
pJW4303/HBV-S2.S和pJW4303/HBe重组质粒的构建图谱见图1和图2。如图所示,编码preS2+S和HBeAg的基因片段均以5′Hind Ⅲ→3′BamHI方向定向插入pJW4303中。

, http://www.100md.com
图1 pJW4303/HBV-S2.S

图2 pJW4303/HBe
2.2 重组质粒电泳鉴定
将两个重组质粒各自用Hind Ⅲ、BamHI双酶切,可获得5 kb和867 bp(pJW4303/HBV-S2.S),或5 kb和658 bp(pJW4303/HBe)两条带,而空载质粒pJW4303单酶切后仅见5 kb一条线性带。未经内切酶消化的完整质粒带,pJW4303则较前两者小,证明867 bp或658 bp的目的基因已经插入pJW4303(图3、4)。经3次筛选后,各获得两株阳性克隆菌种,分别提纯。
2.3 重组质粒体外表达产物的鉴定
(1)重组质粒转染293T细胞后的培养液上清及细胞裂解产物上清以ELISA法检测(表1、2)。
, 百拇医药
表1 ELISA检测HBV中片段表面抗原重组质粒体外表达的HBsAg
pJW4303/HBV-S2.S
阴性对照
阳性对照
阳性克隆1
阳性克隆2
培养上清
裂解产物
培养上清
裂解产物
1
2
, 百拇医药
A值
0.24
0.05
1.26
0.79
0.02
0.14
1.12
P/N
2.53
0.53
13.26
8.31
, 百拇医药
14.00
表2 ELISA检测HBeAg重组质粒体外表达的HBeAg
pJW4303/HBe
阴性对照
阳性对照
阳性克隆1
阳性克隆2
培养上清
裂解产物
培养上清
裂解产物
1
, http://www.100md.com
2
A值
0.68
0.31
0.43
0.15
0.01
0.00
0.44
P/N
13.60
6.20
8.60
, 百拇医药
3.00
8.80
阴性对照A值低于0.05以0.05计,高于0.05按实际值计。P/N≥2.1判为阳性。 (2)细胞培养上清以Abbott试剂检测(S/N>2.100为阳性,表3、4)。

图3 pJW4303/HBV-S2.S酶切电泳鉴定

图4 pJW4303/HBe酶切电泳鉴定
表3 Abbott检测pJW4303/HBV-S2.S细胞培养上清
pJW4303/HBs
, 百拇医药
pJW4303
阳性克隆1
阳性克隆2
S/N
185.39
284.14
2.70
表4 Abbott检测pJW4303/HBe细胞培养上清
pJW4303/HBe
pJW4303
阳性克隆1
阳性克隆2
, 百拇医药
S/N
143.619
173.631
1.357
(3)pJW4303/HBV-S2.S转染的细胞培养上清以ELISA法检测preS2:阳性克隆1为阴性,阳性克隆2为阳性;对照pJW4303为阴性。
3 讨 论
1993年Ulmer等[4]首次报道了流感病毒核酸疫苗的研究结果,随后HBV、HCV等核酸疫苗的研制工作也逐步展开[5]。已有研究证实HBsAg核酸疫苗在动物实验中能激发特异性免疫反应,且前S蛋白有很高的免疫原性,可强化对同存的S蛋白的免疫应答,其中中片段表面抗原的免疫原性较大片段表面抗原更强[6],可进一步作为核酸疫苗的组成成分进行研究。基于此,本实验选择我国HBV主要流行株adw2的preS2+S区基因为目的基因,构建成真核表达重组质粒。而HBcAg和HBeAg是机体针对HBV CTL应答的主要靶抗原,我们以自行构建的pJW4303/HBc核酸疫苗免疫小鼠后,观察到了良好的细胞免疫和体液免疫反应[3],现再将HBV ayw亚型的HBeAg编码基因作为目的基因构建成核酸疫苗,为HBV发病机理的有关研究作准备。
, 百拇医药
本实验中所用真核表达载体pJW4303,带有巨细胞病毒即刻早期启动子(CMV immediate early promoter)、SV40起始序列、polyA信号、氨苄青霉素抗性基因(Ampr),以及多克隆酶切位点等成分,可保证插入基因用自身起始密码在多种哺乳动物细胞内高效表达。我们以往的研究已表明,pJW4303/HBc能在横纹肌内高效、稳定地表达。本实验中插入的preS2+S、E编码基因的PCR产物在其5′端和3′端已分别引入Hind Ⅲ、BamHI酶切位点,连接反应前PCR产物和载体皆以这两种酶进行双酶切,故连结后目的基因即定向克隆于pJW4303的CMV启动子下游,构建成pJW4303/HBV-S2.S、pJW4303/HBe。
重组质粒酶切后的电泳图显示,双切后有5 085 bp和867 bp,或5 085 bp和658 bp两条带。pJW4303单切后为5 085 bp一条带,与重组质粒双切后的大带(5 085 bp)位置相同。而未经酶切的完整质粒环状
, http://www.100md.com
带pJW4303/HBV-S2.S及pJW4303/HBe较pJW
4303位置偏大。这说明重组质粒的碱基对数与理论相符,目的基因片段已插入pJW4303中。
重组质粒体外表达结果显示,pJW4303/HBV-S2.S阳性克隆株1号的细胞培养液上清中含有HBsAg,但并无preS2,裂解产物上清甚至未能检测出HBsAg;阳性克隆株2号的细胞培养液上清中含有HBsAg及preS2,裂解产物上清中HBsAg也为阳性。pJW4303/HBe阳性克隆株1、2号培养液、裂解产物上清ELISA检测皆含有HBeAg,Abbott检测培养液上清中HBeAg也为阳性。ELISA结果还反映培养液的吸光度A值均高于裂解液。以上结果说明:①重组质粒转染293T细胞成功,能在哺乳动物细胞内表达。pJW4303/HBV-S2.S 2号克隆表达了HBV中片段表面抗原,1号克隆只表达了HBsAg;pJW4303/HBe则两个克隆都表达了HBeAg。②目的基因编码产生的HBsAg和HBeAg是分泌性的,故培养液中含量较裂解液高。
, http://www.100md.com
核酸疫苗pJW4303/HBV-S2.S和pJW4303/HBe已构建成功,为进一步观察其特异性体液免疫和细胞免疫反应原性奠定了基础。HBVpreS2+S核酸疫苗2号克隆和HBeAg核酸疫苗1号克隆免疫小鼠的实验观察正在进行中。
参考文献
1,Chisari FV, Ferrari C. Hepatiltis B virus immunopathogenesis. Ann Rev Immunol, 1995,13:29
2,Martins LP, Lau LL, Asano MS, et al. DNA vaccination against persistent viral infection. Journal of Virology, 1995,69(4):2574
3,黄祖瑚,卢 山,刘 宁,等.乙型肝炎病毒核心抗原基因疫苗对小鼠的体液和细胞免疫原性观察.中华医学杂志,1999,17(9):104
, 百拇医药
4,Ulmer JB, Donnelly JJ, Parder SE, et al. Heterologous protection against influenza by injection of DNA encoding a viral protein. Science, 1993,259:1745
5,Margaret JK, Jack TL. DNA vaccines and viral hepatitis B: are we going around in circles? Gastroenterology, 1997,112:1410
6,Geissler M, Tokushige K, Wands JR. Cellular and humoral immune response to hepatitis B virus structural proteins in mice following DNA-based immunization. Gastroenterology, 1997,112:1307
(1999-11-17收稿), 百拇医药