心肌特异性表达腺病毒载体的构建及鉴定
作者:高文谦 李小鹰 李梁 裴雪涛
单位:高文谦 李小鹰(解放军总医院老年心内科,北京 100853);李梁 裴雪涛(北京放射医学研究所、国家生物医学分析中心,北京 100850)
关键词:腺病毒载体;mlc-2v;GFP基因;心肌细胞特异性表达
军医进修学院学报000413 [摘要] 目的:构建心肌特异性表达的腺病毒载体,使外源基因在心肌细胞中特异性表达。方法:将心肌特异性肌凝蛋白轻链蛋白-2(mlc-2v)启动子克隆至腺病毒穿梭质粒,并将绿色荧光蛋白(GFP)基因克隆至此质粒中,同源重组含GFP基因的缺陷型腺病毒(AdmlcGFP),转染心肌细胞及非心肌细胞。结果:经RT-PCR分析,转染的心肌细胞有GFP mRNA的表达,而转染的非心肌细胞无GFP mRNA的表达;荧光显微镜下观察,可见转染的心肌细胞表达GFP,而转染的的非心肌细胞不表达GFP。结论:构建的心肌特异性表达腺病毒载体可使外源基因在心肌细胞内特异性表达。
, http://www.100md.com
中图号:R394 文献标识码:A
文章编号:1005-1139(2000)04-0279-03
The construction and identification of cardic specific expression adenovirus vector
GAO Wen-qian, LI Xiao-ying, LI Liang, PEI Xue-tao
(Department of Cardiology, PLA General Hospital, Beijing 100853, China)
[Abstract] Objective:to establish a adenovirus vector that make foreign gene express in cardiomyocytes.Methods:we constructed a recombinant adenovirus (AdmlcGFP) in which contain the GFP gene was under the control of the ventricle-specific myosin light chain-2 (mlc-2v).Results:Our data demonstrated GFP was expressed in transfected neonate rat ventricular myocytes in vitro but not in transfected cell lines. Conclusion:the established viral vector AdmlcGFP allows heart-specific expression of a foreign gene.
, 百拇医药
Key words:adenovirus vector; mlc-2v; GFP gene; ventricular myocytes specific exprssion
在动物模型实验中,重组腺病毒载体已证明是转染心肌细胞最有效的载体。由于腺病毒具有广泛的宿主,在转染心肌细胞的同时,非心肌组织细胞也同时受到了转染并表达外源基因,出现相应的副作用。在基因治疗研究中,心肌特异性肌凝蛋白轻链-2(mlc-2v)被证明为是心肌特异性表达的启动子[1]。笔者以mlc-2v为启动子,构建了含绿色荧光蛋白(GFP)的腺病毒载体AdmlcGFP并转染心肌细胞和非心肌细胞,检验构建的腺病毒载体是否使GFP基因在心肌细胞中特异性表达,为心肌细胞的靶向性基因治疗提供依据。
1 材料和方法
1.1 主要试剂 ①质粒及细胞株:PACCMV、PJM17(病毒所基因室提供),含mlc-2v的质粒pmlcSOVA(阜外医院生物化学研究室提供),含GFP的质粒pGEM7Zf; HEK293细胞,HFCL细胞,3T3 细胞,Hela细胞(本室保存)。②酶:DNA限制性内切酶(Promega USA),DNA T4连接酶(Gibco/BRL USA)。③试剂盒:质粒DNA提取试剂盒(Promega USA),Wizard genomic DNA purification system(Promega USA), Plasmid Mini Kit(QIAGEN Germany)。TRIZOL试剂盒(Gibco/BRL, USA)。
, 百拇医药
1.2 含心肌特异性启动子穿梭质粒 pAdmlc 的构建 用限制性内切酶 HindⅡ和XbaI分别将质粒PAdE、PSOVA酶切完全后,分别回收PAdE大片段和PSOVA的小片段mlc-2v,用DNA T4连接酶将mlc-2v克隆至PAdE。用限制性内切酶NotI、XbaI将PAdE(mlc-2v)酶切完全后,回收含mlc-2v的小片段;采用限制性内切酶XbaI完全酶切、NotI不完全酶切质粒PACCMV的方法,回收切除启动子CMV的腺病毒穿梭质粒的大片段,T4连接酶将mlc-2v克隆至PAC使其成为含mlc启动子的穿梭质粒pAdmlc。
1.3 含GFP基因心肌特异性表达腺病毒载体的构建 用限制性内切酶 EcoRI、BamHI将pAdmlc、pGEM7Zf(GFP)完全酶切,回收pAdmlc的大片段和GFP基因片段,用T4连接酶将 GFP 基因克隆至 pAdmlc。用脂质体法将上述腺病毒穿梭质粒 pAdmlcGFP 和包装质粒 PJM17 共转染 293细胞,通过同源重组的方式产生含 GFP 基因的阳性缺陷型重组腺病毒(简称AdmlcGFP)。
, 百拇医药
1.4 重组腺病毒的纯化和制备 将 AdmlcGFP 再次感染 293 细胞,当出现细胞病理效应(cytopathic effect, CPE)时(90%以上的细胞变圆,20%左右的细胞飘浮),反复冻融至细胞完全破裂,4℃,4 000 g离心 5 min,收取上清,用氯化铯密度梯度方法超速离心 2 h,抽取重组腺病毒,并进行纯化。重组腺病毒滴度的检测采用 293 细胞变性方法进行。
1.5 大鼠心脏心肌细胞及非心肌细胞的培养 将出生 1~2 d 的 Wistar 大鼠的乳鼠用 75% 的酒精消毒,取出心脏,剪取心室,PBS洗 3 遍。将心室肌剪成 1~3 mm3大小的颗粒,用适量的 0.1% 组织胶原酶和 0.2% 胰蛋白酶的混合液反复消化成单个细胞,4℃,1500 g离心 5 min,弃去上清,反复用心肌培养基(67% DMEM+18%M199+10%马血清+5%胎牛血清+0.6 U%胰岛素)洗 3 遍。单个细胞经心肌培养基适量稀释后接种于培养瓶,5% CO2、37℃ 培养箱培养 90 min 进行预贴壁。吸取未贴壁的细胞,即可获得纯度较高的心肌细胞。细胞计数后,按实验目的,以一定的密度接种 6 孔培养板。HFCL 细胞,3T3 细胞,Hela细胞以一定的密度分别接种六孔板,用DMEM+10% 胎牛血清进行培养。
, http://www.100md.com
1.6 心肌细胞及非心肌细胞的转染 细胞培养至 70%~80% 融合时,更换新鲜的培养基,按感染复数值(病毒与细胞比值)50 加入重组的 AdmlcGFP,37℃ 孵育 1 h,弃去培养基,PBS 洗 2 遍后加入新鲜的心肌培养基,5% CO2、37℃培养。
1.7 RT-PCR 分析 用RNA提取试剂盒提取细胞的总RNA,分别取每个样品的 1 μg的总 RNA,在 20 μl 的反应体系中,用逆转录酶进行 cDNA合成。取 2 μl 体积的 cDNA,在 50 μl反应体系中进行 PCR 扩增。反应缓冲液首先加热至 94℃, 5 min变性,然后进行 30 个 PCR 循环(94℃ 30 s;58℃ 45s;72℃ 30s。),72℃ 7 min。分析 GFP cDNA 引物:5′-AGGGCGAGGAGCTGTTCA-3′,5′-GGTCACGAACTCCAGCAG-3′。三磷酸甘油醛脱氢酶(GAPDH)cDNA 检测使用引物:5′-AATGCATCCTGCACCACCAA-3′,5′-GTAGCCATATTCATTGTCATA-3′。
, http://www.100md.com
1.8 转基因细胞对 GFP 的表达 转基因细胞培养 72 h后,在荧光显微镜下观察转染的细胞是否表达 GFP。
2 结 果
2.1 质粒 pAdmlc 的酶切鉴定结果 用限制性内切酶 HindⅢ、BamHI 将重组质粒酶切完全后,经 1% 琼脂糖凝胶电泳,紫外线下观察,可见约 250bp 和 8.1 kb 大小的两条带,即为重组正确的质粒 pAdmlc(见图 1)。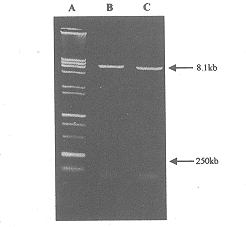
图 1 质粒 pAdmlc 的酶切鉴定
A.Marker(15000bp+2000bp);
B.HindⅢ酶切;C.HindⅢ、BamHI酶切
, 百拇医药
2.2 含 GFP 的质粒 pAdmlcGFP 的酶切鉴定结果 用限制性内切酶 EcoRI、BamHI 将重组质粒 PACmlcGFP 酶切完全后,经 1% 琼脂糖凝胶电泳,紫外线下观察,可见约 750bp 和 8.35kb 大小的两条带,即为重组正确的质粒 pAdmlcGFP(见图 2)。
2.3 细胞 GFPmRNA 的表达 用 AdmlcGFP 转染体外培养的鼠乳心肌细胞、HFCL细胞、3T3 细胞及 Hela 细胞,用 RNA 提取试剂盒提取细胞的总 RNA,进行 RT-PCR,1% 琼脂糖凝胶电泳,在紫外线下可观察到转染的心肌细胞有一 670bp 的特异性带,而转染的 HFCL 细胞、3T3 细胞、Hela细胞未检测到。可见 AdmlcGFP 转染的乳鼠心肌细胞表达 GFPmRNA,说明构建的腺病毒载体 AdmlcGFP 使 GFPmRNA 在心肌细胞特异性表达。
2.4 细胞 GFP 的表达 用重组的腺病毒转染乳鼠的心肌细胞和非心肌细胞 HFCL 细胞、3T3 细胞、Hela 细胞,培养 72 h。荧光显微镜下观察,结果发现只有乳鼠的心肌细胞表达 GFP。而其它非心肌细胞却不表达 GFP。由此说明构建的含 mlc-2v 启动子的腺病毒载体可使外源基因 GFP 在心肌细胞中特异性表达。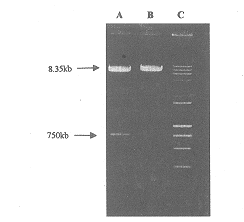
, http://www.100md.com
图 2 质粒 pAdmlcGFP 的酶切鉴定
A.EcoRI、BamHI 酶切;B.EcoRI 酶切;
C.Marker (15000bp-2000bp)
3 讨 论
转基因的方法很多,研究表明腺病毒载体是体内转染心肌细胞非常有效的载体[2]。由于缺乏靶向性,腺病毒载体在转染心肌细胞的同时,体内的非心肌细胞也不可避免地受到了转染并表达外源基因,会出现相应的副作用,是心脏疾病基因治疗面临着十分重要的安全问题[3,4]。笔者构建了心肌细胞特异性表达的腺病毒载体(Admlc),使外源基因在心肌细胞内特异性表达。
在腺病毒载体系统中,使外源基因具有靶向性,主要通过两条途径来实现:即通过改变腺病毒载体的嗜性[5]、利用细胞的特异性启动子调节外源基因的转录[6]。我们将心肌特异性启动子 mlc-2v 克隆至腺病毒载体穿梭质粒,获得了含 mlc-2v 启动子的质粒 pAdmlc。将 GFP 基因克隆至 pAdmlc,脂质体法将其与包装质粒 PJM17 共转染 293 细胞,获得了含 GFP 基因重组缺陷型腺病毒 AdmlcGFP。用 AdmlcGFP 转染心肌细胞、HFCL 细胞、3T3 细胞、HeLa 细胞。RT-PCR 分析表明转染的心肌细胞表达 GFP mRNA,而转染的 HFCL 细胞、3T3 细胞、HeLa 细胞却不表达;在荧光显微镜下观察,发现只有转染的心肌细胞表达 GFP。由此说明我们构建的腺病毒载体 AdmlcGFP 使 GFP 基因在心肌细胞内进行特异性表达。AdmlcGFP 转染的 HFCL 细胞、3T3 细胞、HeLa细胞不表达 GFP,可能与上述细胞不具有心肌细胞特性有关。实验结果说明构建的含 mlc-2v 启动子的腺病毒载体可使外源基因在心肌细胞内特异性表达,提高了心脏疾病基因治疗的安全性,使心脏疾病的基因治疗有新的突破。
, http://www.100md.com
作者简介:高文谦(1966-),男,山东潍坊人,军医进修学院97级老年心内科博士生,导师李小鹰教授;发表论文10篇。电话:(010)66937588
[参考文献]
[1]Franz WM, Rothmann T, Frey N, et al. Analysis of tissuespecific gene delivery by recombinant adenoviruses containing cardiacspecific promoters[J]. Cardiovasc Res, 1997,35(3):560-566.
[2]Maurice JP, Hata JA, Shah AS, et al. Enhancement of cardiac function after adenoviralmediated in vivo intracoronary beta2adrenergic receptor gene delivery[J]. J Clin Invest, 1999,104(1):21-29.
, 百拇医药
[3]Huard J, Lochmuller H, Acsadi G, et al. The route of administration is a major determitant of transduction efficency of rat tissues by adenoviral recombiants[J]. Gene Therapy, 1995,2:107-115.
[4]KassEisler A, FalckPedersen E, Elfenbein DH, et al. The impact of development stage, route of administration and the immune system on adenovirus mediated gene transfer[J]. Gene Therapy, 1994,1:395-402.
[5]Douglas JT, Rogers BE, Rosenfeld ME, et al Targeted gene delivery by tropismmodified adenoviral vectors[J]. Biotechnol, 1996,14:1574-1578.
[6]Inesi G, Lewis D, Sumbilla C. Cellspecific promoter in adenovirus vector for transgenic expression of SERCA1 ATPase in cardiac myocytes[J]. Am J Physiol, 1998,27:C645-653.
收稿日期:2000-05-18; 修回日期:2000-06-08, 百拇医药
单位:高文谦 李小鹰(解放军总医院老年心内科,北京 100853);李梁 裴雪涛(北京放射医学研究所、国家生物医学分析中心,北京 100850)
关键词:腺病毒载体;mlc-2v;GFP基因;心肌细胞特异性表达
军医进修学院学报000413 [摘要] 目的:构建心肌特异性表达的腺病毒载体,使外源基因在心肌细胞中特异性表达。方法:将心肌特异性肌凝蛋白轻链蛋白-2(mlc-2v)启动子克隆至腺病毒穿梭质粒,并将绿色荧光蛋白(GFP)基因克隆至此质粒中,同源重组含GFP基因的缺陷型腺病毒(AdmlcGFP),转染心肌细胞及非心肌细胞。结果:经RT-PCR分析,转染的心肌细胞有GFP mRNA的表达,而转染的非心肌细胞无GFP mRNA的表达;荧光显微镜下观察,可见转染的心肌细胞表达GFP,而转染的的非心肌细胞不表达GFP。结论:构建的心肌特异性表达腺病毒载体可使外源基因在心肌细胞内特异性表达。
, http://www.100md.com
中图号:R394 文献标识码:A
文章编号:1005-1139(2000)04-0279-03
The construction and identification of cardic specific expression adenovirus vector
GAO Wen-qian, LI Xiao-ying, LI Liang, PEI Xue-tao
(Department of Cardiology, PLA General Hospital, Beijing 100853, China)
[Abstract] Objective:to establish a adenovirus vector that make foreign gene express in cardiomyocytes.Methods:we constructed a recombinant adenovirus (AdmlcGFP) in which contain the GFP gene was under the control of the ventricle-specific myosin light chain-2 (mlc-2v).Results:Our data demonstrated GFP was expressed in transfected neonate rat ventricular myocytes in vitro but not in transfected cell lines. Conclusion:the established viral vector AdmlcGFP allows heart-specific expression of a foreign gene.
, 百拇医药
Key words:adenovirus vector; mlc-2v; GFP gene; ventricular myocytes specific exprssion
在动物模型实验中,重组腺病毒载体已证明是转染心肌细胞最有效的载体。由于腺病毒具有广泛的宿主,在转染心肌细胞的同时,非心肌组织细胞也同时受到了转染并表达外源基因,出现相应的副作用。在基因治疗研究中,心肌特异性肌凝蛋白轻链-2(mlc-2v)被证明为是心肌特异性表达的启动子[1]。笔者以mlc-2v为启动子,构建了含绿色荧光蛋白(GFP)的腺病毒载体AdmlcGFP并转染心肌细胞和非心肌细胞,检验构建的腺病毒载体是否使GFP基因在心肌细胞中特异性表达,为心肌细胞的靶向性基因治疗提供依据。
1 材料和方法
1.1 主要试剂 ①质粒及细胞株:PACCMV、PJM17(病毒所基因室提供),含mlc-2v的质粒pmlcSOVA(阜外医院生物化学研究室提供),含GFP的质粒pGEM7Zf; HEK293细胞,HFCL细胞,3T3 细胞,Hela细胞(本室保存)。②酶:DNA限制性内切酶(Promega USA),DNA T4连接酶(Gibco/BRL USA)。③试剂盒:质粒DNA提取试剂盒(Promega USA),Wizard genomic DNA purification system(Promega USA), Plasmid Mini Kit(QIAGEN Germany)。TRIZOL试剂盒(Gibco/BRL, USA)。
, 百拇医药
1.2 含心肌特异性启动子穿梭质粒 pAdmlc 的构建 用限制性内切酶 HindⅡ和XbaI分别将质粒PAdE、PSOVA酶切完全后,分别回收PAdE大片段和PSOVA的小片段mlc-2v,用DNA T4连接酶将mlc-2v克隆至PAdE。用限制性内切酶NotI、XbaI将PAdE(mlc-2v)酶切完全后,回收含mlc-2v的小片段;采用限制性内切酶XbaI完全酶切、NotI不完全酶切质粒PACCMV的方法,回收切除启动子CMV的腺病毒穿梭质粒的大片段,T4连接酶将mlc-2v克隆至PAC使其成为含mlc启动子的穿梭质粒pAdmlc。
1.3 含GFP基因心肌特异性表达腺病毒载体的构建 用限制性内切酶 EcoRI、BamHI将pAdmlc、pGEM7Zf(GFP)完全酶切,回收pAdmlc的大片段和GFP基因片段,用T4连接酶将 GFP 基因克隆至 pAdmlc。用脂质体法将上述腺病毒穿梭质粒 pAdmlcGFP 和包装质粒 PJM17 共转染 293细胞,通过同源重组的方式产生含 GFP 基因的阳性缺陷型重组腺病毒(简称AdmlcGFP)。
, 百拇医药
1.4 重组腺病毒的纯化和制备 将 AdmlcGFP 再次感染 293 细胞,当出现细胞病理效应(cytopathic effect, CPE)时(90%以上的细胞变圆,20%左右的细胞飘浮),反复冻融至细胞完全破裂,4℃,4 000 g离心 5 min,收取上清,用氯化铯密度梯度方法超速离心 2 h,抽取重组腺病毒,并进行纯化。重组腺病毒滴度的检测采用 293 细胞变性方法进行。
1.5 大鼠心脏心肌细胞及非心肌细胞的培养 将出生 1~2 d 的 Wistar 大鼠的乳鼠用 75% 的酒精消毒,取出心脏,剪取心室,PBS洗 3 遍。将心室肌剪成 1~3 mm3大小的颗粒,用适量的 0.1% 组织胶原酶和 0.2% 胰蛋白酶的混合液反复消化成单个细胞,4℃,1500 g离心 5 min,弃去上清,反复用心肌培养基(67% DMEM+18%M199+10%马血清+5%胎牛血清+0.6 U%胰岛素)洗 3 遍。单个细胞经心肌培养基适量稀释后接种于培养瓶,5% CO2、37℃ 培养箱培养 90 min 进行预贴壁。吸取未贴壁的细胞,即可获得纯度较高的心肌细胞。细胞计数后,按实验目的,以一定的密度接种 6 孔培养板。HFCL 细胞,3T3 细胞,Hela细胞以一定的密度分别接种六孔板,用DMEM+10% 胎牛血清进行培养。
, http://www.100md.com
1.6 心肌细胞及非心肌细胞的转染 细胞培养至 70%~80% 融合时,更换新鲜的培养基,按感染复数值(病毒与细胞比值)50 加入重组的 AdmlcGFP,37℃ 孵育 1 h,弃去培养基,PBS 洗 2 遍后加入新鲜的心肌培养基,5% CO2、37℃培养。
1.7 RT-PCR 分析 用RNA提取试剂盒提取细胞的总RNA,分别取每个样品的 1 μg的总 RNA,在 20 μl 的反应体系中,用逆转录酶进行 cDNA合成。取 2 μl 体积的 cDNA,在 50 μl反应体系中进行 PCR 扩增。反应缓冲液首先加热至 94℃, 5 min变性,然后进行 30 个 PCR 循环(94℃ 30 s;58℃ 45s;72℃ 30s。),72℃ 7 min。分析 GFP cDNA 引物:5′-AGGGCGAGGAGCTGTTCA-3′,5′-GGTCACGAACTCCAGCAG-3′。三磷酸甘油醛脱氢酶(GAPDH)cDNA 检测使用引物:5′-AATGCATCCTGCACCACCAA-3′,5′-GTAGCCATATTCATTGTCATA-3′。
, http://www.100md.com
1.8 转基因细胞对 GFP 的表达 转基因细胞培养 72 h后,在荧光显微镜下观察转染的细胞是否表达 GFP。
2 结 果
2.1 质粒 pAdmlc 的酶切鉴定结果 用限制性内切酶 HindⅢ、BamHI 将重组质粒酶切完全后,经 1% 琼脂糖凝胶电泳,紫外线下观察,可见约 250bp 和 8.1 kb 大小的两条带,即为重组正确的质粒 pAdmlc(见图 1)。

图 1 质粒 pAdmlc 的酶切鉴定
A.Marker(15000bp+2000bp);
B.HindⅢ酶切;C.HindⅢ、BamHI酶切
, 百拇医药
2.2 含 GFP 的质粒 pAdmlcGFP 的酶切鉴定结果 用限制性内切酶 EcoRI、BamHI 将重组质粒 PACmlcGFP 酶切完全后,经 1% 琼脂糖凝胶电泳,紫外线下观察,可见约 750bp 和 8.35kb 大小的两条带,即为重组正确的质粒 pAdmlcGFP(见图 2)。
2.3 细胞 GFPmRNA 的表达 用 AdmlcGFP 转染体外培养的鼠乳心肌细胞、HFCL细胞、3T3 细胞及 Hela 细胞,用 RNA 提取试剂盒提取细胞的总 RNA,进行 RT-PCR,1% 琼脂糖凝胶电泳,在紫外线下可观察到转染的心肌细胞有一 670bp 的特异性带,而转染的 HFCL 细胞、3T3 细胞、Hela细胞未检测到。可见 AdmlcGFP 转染的乳鼠心肌细胞表达 GFPmRNA,说明构建的腺病毒载体 AdmlcGFP 使 GFPmRNA 在心肌细胞特异性表达。
2.4 细胞 GFP 的表达 用重组的腺病毒转染乳鼠的心肌细胞和非心肌细胞 HFCL 细胞、3T3 细胞、Hela 细胞,培养 72 h。荧光显微镜下观察,结果发现只有乳鼠的心肌细胞表达 GFP。而其它非心肌细胞却不表达 GFP。由此说明构建的含 mlc-2v 启动子的腺病毒载体可使外源基因 GFP 在心肌细胞中特异性表达。

, http://www.100md.com
图 2 质粒 pAdmlcGFP 的酶切鉴定
A.EcoRI、BamHI 酶切;B.EcoRI 酶切;
C.Marker (15000bp-2000bp)
3 讨 论
转基因的方法很多,研究表明腺病毒载体是体内转染心肌细胞非常有效的载体[2]。由于缺乏靶向性,腺病毒载体在转染心肌细胞的同时,体内的非心肌细胞也不可避免地受到了转染并表达外源基因,会出现相应的副作用,是心脏疾病基因治疗面临着十分重要的安全问题[3,4]。笔者构建了心肌细胞特异性表达的腺病毒载体(Admlc),使外源基因在心肌细胞内特异性表达。
在腺病毒载体系统中,使外源基因具有靶向性,主要通过两条途径来实现:即通过改变腺病毒载体的嗜性[5]、利用细胞的特异性启动子调节外源基因的转录[6]。我们将心肌特异性启动子 mlc-2v 克隆至腺病毒载体穿梭质粒,获得了含 mlc-2v 启动子的质粒 pAdmlc。将 GFP 基因克隆至 pAdmlc,脂质体法将其与包装质粒 PJM17 共转染 293 细胞,获得了含 GFP 基因重组缺陷型腺病毒 AdmlcGFP。用 AdmlcGFP 转染心肌细胞、HFCL 细胞、3T3 细胞、HeLa 细胞。RT-PCR 分析表明转染的心肌细胞表达 GFP mRNA,而转染的 HFCL 细胞、3T3 细胞、HeLa 细胞却不表达;在荧光显微镜下观察,发现只有转染的心肌细胞表达 GFP。由此说明我们构建的腺病毒载体 AdmlcGFP 使 GFP 基因在心肌细胞内进行特异性表达。AdmlcGFP 转染的 HFCL 细胞、3T3 细胞、HeLa细胞不表达 GFP,可能与上述细胞不具有心肌细胞特性有关。实验结果说明构建的含 mlc-2v 启动子的腺病毒载体可使外源基因在心肌细胞内特异性表达,提高了心脏疾病基因治疗的安全性,使心脏疾病的基因治疗有新的突破。
, http://www.100md.com
作者简介:高文谦(1966-),男,山东潍坊人,军医进修学院97级老年心内科博士生,导师李小鹰教授;发表论文10篇。电话:(010)66937588
[参考文献]
[1]Franz WM, Rothmann T, Frey N, et al. Analysis of tissuespecific gene delivery by recombinant adenoviruses containing cardiacspecific promoters[J]. Cardiovasc Res, 1997,35(3):560-566.
[2]Maurice JP, Hata JA, Shah AS, et al. Enhancement of cardiac function after adenoviralmediated in vivo intracoronary beta2adrenergic receptor gene delivery[J]. J Clin Invest, 1999,104(1):21-29.
, 百拇医药
[3]Huard J, Lochmuller H, Acsadi G, et al. The route of administration is a major determitant of transduction efficency of rat tissues by adenoviral recombiants[J]. Gene Therapy, 1995,2:107-115.
[4]KassEisler A, FalckPedersen E, Elfenbein DH, et al. The impact of development stage, route of administration and the immune system on adenovirus mediated gene transfer[J]. Gene Therapy, 1994,1:395-402.
[5]Douglas JT, Rogers BE, Rosenfeld ME, et al Targeted gene delivery by tropismmodified adenoviral vectors[J]. Biotechnol, 1996,14:1574-1578.
[6]Inesi G, Lewis D, Sumbilla C. Cellspecific promoter in adenovirus vector for transgenic expression of SERCA1 ATPase in cardiac myocytes[J]. Am J Physiol, 1998,27:C645-653.
收稿日期:2000-05-18; 修回日期:2000-06-08, 百拇医药