甲状旁腺激素对体外培养的大鼠牙胚分化的影响
作者:陈新梅 肖明振 倪龙兴 刘军
单位:陈新梅(第四军医大学口腔医学院,陕西 西安 710032);肖明振(第四军医大学口腔医学院,陕西 西安 710032);倪龙兴(第四军医大学口腔医学院,陕西 西安 710032);刘军(第四军医大学口腔医学院,陕西 西安 710032)
关键词:甲状旁腺激素;牙胚;成牙本质细胞;器官培养
牙体牙髓牙周病学杂志000402 [摘 要]目的:观察甲状旁腺激素(parathyroid hormone,PTH)对体外培养17d的胎鼠下颌第一磨牙牙胚分化发育的影响,探讨PTH在成牙本质细胞分化和牙本质形成中的作用。方法:器官培养、组织学观察和透射电镜观察。结果:体外培养的牙胚可出现成牙本质细胞分化和牙本质形成。PTH可促进成牙本质细胞的分化,细胞分化的程度和速度均高于对照组;在PTH的作用下,细胞的超微结构观察发现细胞分化良好,明显处于功能活跃状态。结论:牙胚培养在观察生长因子对牙齿发育的作用研究是有效的,PTH在牙齿发育中具有一定的促进作用。
, http://www.100md.com
[中图号]R780.2 [文献标识码]A
[文章编号]1005-2593(2000)04-0194-04
The effects of parathyroid hormone on differentiation of cultured rat tooth germs
CHEN Xin-mei,XIAO Ming-zhen,NI Long-xing,et al
(School of Stomatology,The Fourth Military Medical University,Xi'an,710032,China)
[Abstract]AIM:To examine the effects of parathy roid hormone(PTH) on odontogenesis and dental papilla mesenchymes from 17d first mandibular rat molars.METHODS:Organ culture,light microscopy and electronic microscopy.RESULTS:The tooth germs in PTH group demonstrated rapid and well-defined odontoblasts and secreted more predentin matrix after 9 days in culture than those in control group.CONCLUSION:These results suggested that PTH might be involved in regulating tooth development during its morphogenesis and dent inogenesis and tooth germs were good example in such study.
, 百拇医药
[Key words]parathyroid hormone(PTH);tooth germ;odon toblast;organ culture
牙胚的发育和细胞的分化是通过釉上皮-牙乳头间充质细胞之间的一系 列相互作用引起 的,并受多种因素的调节[1]。将处于牙齿发育阶段的胚胎性上皮组织和间充质细 胞(牙胚)在体外进行培养,是观察组织诱导作用的主要方法之一。体外牙胚的培养成功, 为研究体外成牙本质细胞分化提供了非常理想的实验模型。
甲状旁腺激素(parathyroid hormone,PTH)等亲钙激素是维持全身钙、磷水平的重要因子, 牙齿是全身矿化组织之一,它们在牙齿形成和维持中的作用已开始引起学者的广泛重视。本 文观察PTH对体外培养牙胚发育的影响,探讨PTH在成牙本质细胞分化和牙本质形成中的作用 。
1 材料和方法
, http://www.100md.com
1.1 材料
纯系SD大鼠(本校实验动物中心);
甲状旁腺激素(Bachem,Japan);
DMEM培养基(Gibco,USA)。
1.2 方法
1.2.1 鼠牙胚的获取
将未怀孕的母鼠和公鼠同笼,第2天取出公鼠,选择怀孕母鼠并计算孕期。将怀孕17 d的SD母 鼠拉颈处死。取出鼠胚胎,置750ml/L乙醇中消毒10s,从颈部横断,鼠胚头端用DMEM培养液 冲洗,无菌条件下用挖匙取出鼠胚下颌第一磨牙牙胚,置含100ml/L?FCS的DMEM培养液中 保存。
1.2.2 牙胚的体外培养
, 百拇医药
在24孔细胞培养板中进行培养,每孔培养液1ml,将0.45μm孔径的微孔滤膜用不锈钢支 架置气-液界面,将分离完整的牙胚置于微孔滤膜上,在标准环境下培养,培养液每3天换1 次,培养时间为3、6、9d。
1.2.3 实验分组
对照组:培养液为含150ml/L?FCS、10mmol/L β-磷酸甘油和50mg/L抗坏血酸的DMEM培养 液。
实验组:用对照组培养液将PTH稀释,浓度为33.3nmol/L。
每组每个时间点2孔,每孔5个牙胚。
1.2.4 取材和观察
培养的牙胚分别于3、6、9d终止培养,每孔取3个(每时间点6个)牙胚。40g/L多聚甲醛(pH7.3)固定,常规包埋切片,部分切片进行HE染色,光镜观察。每孔的另外2个牙胚与培养 前的2个鼠牙胚用30ml/L戊二醛固定2h,丙酮系列脱水,真空干燥,以Epon812环氧树脂包埋 ,超薄切片,染色后透射电镜下观察。
, http://www.100md.com
2 结果
2.1 光镜观察
在牙胚培养开始时,磨牙牙胚发育处于帽状期,内釉上皮由立方状或柱状细胞构成,牙 乳头间充质细胞尚未分化为成牙本质细胞,在内釉上皮和邻近的间充质细胞之间也未出现牙 本质或牙本质样基质(图1)。
图1 大鼠牙胚开始培养时的组织像 (HE,10×)
培养3d标本:对照组内釉上皮呈柱状,但还不是前期成釉细胞;部分与之邻近的牙乳头 间充质细胞变为立方状,细胞核开始偏极,分化为前成牙本质细胞,未发现牙本质基质分泌 或牙本质形成(图2)。实验组与对照组基本相似,但大部分与内釉上皮邻近的牙乳头间充质 细胞变为立方状,细胞核发生偏极,分化为前期成牙本质样细胞,内釉上皮和间充质细胞 间开始有少量牙本质基质出现(图3)。
, http://www.100md.com
图2 对照组大鼠牙胚培养3d时的组织像 (HE,10×)
图3 实验组大鼠牙胚培养3d时的组织像(HE,40×)
培养6d标本:对照组内釉上皮已分化为前期成釉细胞,细胞核位于近端;上皮-间质出现少 许牙本质基质,与这些基质对应的间质侧出现紧密排列、呈高柱状的成牙本质细胞(图4)。实验组成釉细胞分化良好,上皮-间质出现明显牙本质基质,成牙本质细胞呈高柱状,紧密 排列于与基质对应的间质侧,细胞偏向远中端,个别成牙本质细胞突起伸入基质(图5)。
图4 对照组大鼠牙胚培养6d时的组织像 (HE,10×)
, http://www.100md.com
图5 实验组大鼠牙胚培养6d时的组织像(HE,40×)
培养9d标本:对照组有较多的牙本质基质形成,部分成牙本质细胞突起埋入牙本质基质 中,但牙乳头细胞开始出现退变(图6)。实验组有更多的牙本质基质形成,且有较多成牙本 质细胞突起伸入基质中,成牙本质细胞排列更为紧密,呈典型的高柱状分泌细胞形态,细胞 核偏远中,牙乳头中央部分组织发生退变(图7)。
图6 对照组大鼠牙胚培养9d时的组织像 (HE,10×)
图7 实验组大鼠牙胚培养9d时的组织像(HE,20×)
2.2 TEM观察
, 百拇医药
培养前细胞呈长梭形,核卵圆,核内染色质分布均匀,核周有粗面内质网,线粒体呈长 条形,双层膜结构完整清晰,排列规则(图8)。实验组和对照组细胞的超微结构基本相似, 细胞的胞浆内可见大量高尔基氏器位于中央区,其成熟面有密度不等的泡状结构;有时可见 细胞呈长柱状,有大量的粗面内质网和线粒体沿细胞长轴分布;还可见极化的细胞核;胞间 基质中可见胶原纤维呈束排列,并有致密小体的泡状结构,类似于基质小泡。但在这些结构 出现的时间和数量上,两组存在差异,实验组明显早于并多于对照组(图9、10)。提示在 PTH的作用下,细胞分化良好,明显处于功能活跃状态。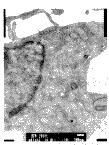
图8 大鼠牙胚培养前时的超微结构(TEM,20K×)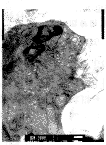
图9 对照组大鼠牙胚培养6d时的超微结构(TEM, 25K×)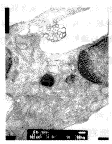
, http://www.100md.com
图10 实验组大鼠牙胚培养6d时的超微结构像(TEM,20K×)
3 讨论
牙胚是发育生物学研究领域最完整最有意义的实验模型之一。它易于培养,可进行细胞学和 分子生物学研究。体外牙胚的培养为研究外、中胚层相互作用和诱导分化提供了理想的模型 。目前,已成功地培养了多种动物的牙胚、牙乳头细胞和牙囊细胞。牙胚的体外培养已广泛 地用于不同因子对牙齿发育和硬组织矿化影响的研究,培养的牙胚也成为研究影响细胞分化 因子的有效模型[2]。
在牙胚的发育过程中,中胚层与外胚层相互作用,首先形成牙板,经过蕾状期、帽状期 、钟状期、硬组织形成期,最后萌出,发挥咀嚼功能。中胚层的牙乳头间充质细胞分化为成 牙本质细胞。为了能够观察牙乳头间充质细胞分化的关键过程,确定各种动物牙胚的发育时 序非常重要。目前,小鼠、大鼠、豚鼠、和人等的牙胚发育时序已较为明确。其中大鼠牙 胚是常用的实验模型之一,大鼠牙胚在孕12.5d形成牙板,14d处于蕾状期,17d为钟状期,2 0d 为萌出前及前期牙本质形成期,出生后2d为牙釉质和牙本质形成期。但牙胚在体外培养时, 其 发生发育过程不同于体内。Bronckers[3]等经过较系统地观察证实:体外培养的牙 胚,其组织细胞的分化程度、形态的发育速度约为体内时的一半,只有成釉器才能诱导 间充质细胞向成牙本质细胞的分化,而前期牙本质可以维持成牙本质细胞处于极化状态。
, 百拇医药
牙胚培养常采用Trowell型培养支架[2],即将微孔滤膜置于不锈钢金属网架上 ,牙胚在滤膜上培养,培养液液面与滤膜平齐或略高,但以不浸没牙胚为宜,以使牙胚 获得较高的氧分压。培养液主要由培养基(DMEM或MEM等)、血清和维生素组成。
Lesot[4]等发现肝素能延迟体外培养的鼠牙胚成牙本质细胞的分化。Chai等[5]观察PDGF-A、PDGF受体在胎鼠下颌骨发育的效应和表达,认为内源性PDGF-A和P DGF受体能够调节牙齿发育的大小和速度。同时,外源性aFGF对离体牙胚作用的实验结果与P DGF-A相似[6],也可调节牙齿发育。Mayo等[7]报道表皮生长因子和TGF- β均明显使牙胚发育的体积减小。有人[8~9]将BMP2和bFGF蛋白的凝胶与牙齿外胚 间充质共同培养24h,发现两种生长因子的作用与牙齿外胚层的作用相似,能诱导外胚间充 质细胞的增殖和形态的发生。郝建军[10]发现外源性的bFGF可以促进大鼠牙胚的 发育和细胞分化,加快牙齿发育的速度。这些结果提示牙胚培养在观察生长因子对牙齿发育 的作用研究是有效的,牙齿的生长发育受到多种因子的调节。
, 百拇医药
陈新梅[11]在研究PTH对培养人牙乳头间充质细胞的影响时发现:体外培养人牙乳 头间充质细胞对PTH的反应具有某些成骨细胞的特性,认为PTH可能是成牙本质细胞分 化和矿化的重要介质。
体外牙胚的培养为研究PTH在成牙本质细胞诱导分化中的作用提供了直观、可靠 的研究手段。牙胚培养一般采用孕期17~19d的鼠胚胎下颌第一磨牙作为实验材料,17d鼠胚 的下颌第一磨牙出现正在分化的前期成牙本质细胞,但还未出现极化;18、19d鼠胚的下颌 第一磨牙有少许极化成牙本质细胞出现,此时是观察细胞分化、 极化及其影响因素的最佳 时期 。本文发现,PTH可促进成牙本质细胞的分化,细胞分化的程度和速度均高于对照组;在PTH 的作用下,细胞的超微结构观察发现细胞分化良好,明显处于功能活跃状态。提示PTH在牙 齿发育中具有一定的促进作用。
而Sakakura[12]在观察不同浓度PTH对孕17d大鼠下颌第一磨牙牙胚牙本质形成的影 响时发现:PTH不影响间质细胞分化为前成牙本质细胞,但抑制前成牙本质细胞分化为成牙 本质细胞,从而影响牙本质形成,且无PTH浓度的差异;内釉上皮完成细胞终末分化,成为 分泌型成釉细胞,这些细胞在牙本质缺乏情况下形成牙釉质。结果提示PTH影响间质来源细 胞,不仅阻止成牙本质细胞分化,同时也阻止前期牙本质和牙本质形成。降钙素(CT)刺激 牙本质形成,并能拮抗PTH抑制牙胚牙本质形成的作用[13]。本组实验结果与Sakak ura观察结果不一致,具体机制有待进一步研究。
, 百拇医药
参考文献:
[1]Slavkin HC.Molecular determinants during dental morphogenesis and cytodifferentiation:A reveiw[J].J Craniofac Genet Dev Biol,1991,11:338
[2]Thesleff I,Partanen AM,Vainio S.Epithelial -mesenchymal intera ctions in tooth morphogenesis:the roles of exracellular matrix,growth factors and cell surface receptors[J].J Craniofac Genet Dev Biol,1991,11:229
[3]Bronckers A,Bervoets T,Woltgens J.Effect of developmental stage of explants on further in vitro development of hamster molars[J].Arch Oral Biol,1983,28:69
, 百拇医药
[4]Lesot H,Fausser JL,Akiyama SK,et al.The carboxy -terminal extension of the collagen binding domain of fibronectin with a 165KDs membrane protein involved in odontoblast differentiation[J].Differentiation,1992,49:109
[5]Chai Y,Robbins K,Slavkin HC.Suggested of PDGF-A and cognate receptor in regulating tooth formation[J].J Dent Res,1994,73:179
[6]Mayo ML,Bringas P,Chen LJR,et al.Morphogenic effects of a cidic fibroblast growth factor on mouse molars[J].J Dent Res,1993,72:110
, http://www.100md.com
[7]Mayo ML,Akiyama N,Shum L,et al.Effects of TGF on tooth development[J].J Dent Res,1994,73:179
[8]Jernvall J,Kettunen P,Karavanova I,et al.Evidence for the role of the enamal knot as a control center in mammalian cusp formation:non-dividing cells express growth stimulating FGF-4 gene[J].Int J Dev Biol,1994,38:463
[9]Vainio S,Karavanova I,Jowett A,et al.Identification of BM P-4 as a signal mediating secondary induction between epithelial and mesenchymal tissues during early tooth development[J].Cell,1993,75:45
, 百拇医药
[10]郝建军.激素和生长因子与牙乳头细胞、牙髓细胞、牙胚分化和矿化关系的体外实验研究:[学位论文][D].西安:第四军医大学口腔医学院,1997,46
[11]陈新梅,肖明振,倪龙兴.甲状旁腺激素对培养的人牙乳头间充质细胞碱性磷酸酶活性的影响[J].牙体牙髓牙周病学杂志,1999,9(3):227
[12]Sakakura Y.Effects of parathyroid hormone on odontogenesis of the mouse embryonic molar tooth in vitro[J].Clacified Tissue Int,1987,40:49
[13]Sakakura Y,Fujiwara N,Sugauoara M,et al.In vitro effects of calcitonin and /or parathyroid hormone on odontogenesis of mouse embryonic molar[J].J Dent Res,1989,68(8):1279
收稿日期:1999-07-02
修回日期:2000-03-29, http://www.100md.com
单位:陈新梅(第四军医大学口腔医学院,陕西 西安 710032);肖明振(第四军医大学口腔医学院,陕西 西安 710032);倪龙兴(第四军医大学口腔医学院,陕西 西安 710032);刘军(第四军医大学口腔医学院,陕西 西安 710032)
关键词:甲状旁腺激素;牙胚;成牙本质细胞;器官培养
牙体牙髓牙周病学杂志000402 [摘 要]目的:观察甲状旁腺激素(parathyroid hormone,PTH)对体外培养17d的胎鼠下颌第一磨牙牙胚分化发育的影响,探讨PTH在成牙本质细胞分化和牙本质形成中的作用。方法:器官培养、组织学观察和透射电镜观察。结果:体外培养的牙胚可出现成牙本质细胞分化和牙本质形成。PTH可促进成牙本质细胞的分化,细胞分化的程度和速度均高于对照组;在PTH的作用下,细胞的超微结构观察发现细胞分化良好,明显处于功能活跃状态。结论:牙胚培养在观察生长因子对牙齿发育的作用研究是有效的,PTH在牙齿发育中具有一定的促进作用。
, http://www.100md.com
[中图号]R780.2 [文献标识码]A
[文章编号]1005-2593(2000)04-0194-04
The effects of parathyroid hormone on differentiation of cultured rat tooth germs
CHEN Xin-mei,XIAO Ming-zhen,NI Long-xing,et al
(School of Stomatology,The Fourth Military Medical University,Xi'an,710032,China)
[Abstract]AIM:To examine the effects of parathy roid hormone(PTH) on odontogenesis and dental papilla mesenchymes from 17d first mandibular rat molars.METHODS:Organ culture,light microscopy and electronic microscopy.RESULTS:The tooth germs in PTH group demonstrated rapid and well-defined odontoblasts and secreted more predentin matrix after 9 days in culture than those in control group.CONCLUSION:These results suggested that PTH might be involved in regulating tooth development during its morphogenesis and dent inogenesis and tooth germs were good example in such study.
, 百拇医药
[Key words]parathyroid hormone(PTH);tooth germ;odon toblast;organ culture
牙胚的发育和细胞的分化是通过釉上皮-牙乳头间充质细胞之间的一系 列相互作用引起 的,并受多种因素的调节[1]。将处于牙齿发育阶段的胚胎性上皮组织和间充质细 胞(牙胚)在体外进行培养,是观察组织诱导作用的主要方法之一。体外牙胚的培养成功, 为研究体外成牙本质细胞分化提供了非常理想的实验模型。
甲状旁腺激素(parathyroid hormone,PTH)等亲钙激素是维持全身钙、磷水平的重要因子, 牙齿是全身矿化组织之一,它们在牙齿形成和维持中的作用已开始引起学者的广泛重视。本 文观察PTH对体外培养牙胚发育的影响,探讨PTH在成牙本质细胞分化和牙本质形成中的作用 。
1 材料和方法
, http://www.100md.com
1.1 材料
纯系SD大鼠(本校实验动物中心);
甲状旁腺激素(Bachem,Japan);
DMEM培养基(Gibco,USA)。
1.2 方法
1.2.1 鼠牙胚的获取
将未怀孕的母鼠和公鼠同笼,第2天取出公鼠,选择怀孕母鼠并计算孕期。将怀孕17 d的SD母 鼠拉颈处死。取出鼠胚胎,置750ml/L乙醇中消毒10s,从颈部横断,鼠胚头端用DMEM培养液 冲洗,无菌条件下用挖匙取出鼠胚下颌第一磨牙牙胚,置含100ml/L?FCS的DMEM培养液中 保存。
1.2.2 牙胚的体外培养
, 百拇医药
在24孔细胞培养板中进行培养,每孔培养液1ml,将0.45μm孔径的微孔滤膜用不锈钢支 架置气-液界面,将分离完整的牙胚置于微孔滤膜上,在标准环境下培养,培养液每3天换1 次,培养时间为3、6、9d。
1.2.3 实验分组
对照组:培养液为含150ml/L?FCS、10mmol/L β-磷酸甘油和50mg/L抗坏血酸的DMEM培养 液。
实验组:用对照组培养液将PTH稀释,浓度为33.3nmol/L。
每组每个时间点2孔,每孔5个牙胚。
1.2.4 取材和观察
培养的牙胚分别于3、6、9d终止培养,每孔取3个(每时间点6个)牙胚。40g/L多聚甲醛(pH7.3)固定,常规包埋切片,部分切片进行HE染色,光镜观察。每孔的另外2个牙胚与培养 前的2个鼠牙胚用30ml/L戊二醛固定2h,丙酮系列脱水,真空干燥,以Epon812环氧树脂包埋 ,超薄切片,染色后透射电镜下观察。
, http://www.100md.com
2 结果
2.1 光镜观察
在牙胚培养开始时,磨牙牙胚发育处于帽状期,内釉上皮由立方状或柱状细胞构成,牙 乳头间充质细胞尚未分化为成牙本质细胞,在内釉上皮和邻近的间充质细胞之间也未出现牙 本质或牙本质样基质(图1)。

图1 大鼠牙胚开始培养时的组织像 (HE,10×)
培养3d标本:对照组内釉上皮呈柱状,但还不是前期成釉细胞;部分与之邻近的牙乳头 间充质细胞变为立方状,细胞核开始偏极,分化为前成牙本质细胞,未发现牙本质基质分泌 或牙本质形成(图2)。实验组与对照组基本相似,但大部分与内釉上皮邻近的牙乳头间充质 细胞变为立方状,细胞核发生偏极,分化为前期成牙本质样细胞,内釉上皮和间充质细胞 间开始有少量牙本质基质出现(图3)。

, http://www.100md.com
图2 对照组大鼠牙胚培养3d时的组织像 (HE,10×)

图3 实验组大鼠牙胚培养3d时的组织像(HE,40×)
培养6d标本:对照组内釉上皮已分化为前期成釉细胞,细胞核位于近端;上皮-间质出现少 许牙本质基质,与这些基质对应的间质侧出现紧密排列、呈高柱状的成牙本质细胞(图4)。实验组成釉细胞分化良好,上皮-间质出现明显牙本质基质,成牙本质细胞呈高柱状,紧密 排列于与基质对应的间质侧,细胞偏向远中端,个别成牙本质细胞突起伸入基质(图5)。

图4 对照组大鼠牙胚培养6d时的组织像 (HE,10×)

, http://www.100md.com
图5 实验组大鼠牙胚培养6d时的组织像(HE,40×)
培养9d标本:对照组有较多的牙本质基质形成,部分成牙本质细胞突起埋入牙本质基质 中,但牙乳头细胞开始出现退变(图6)。实验组有更多的牙本质基质形成,且有较多成牙本 质细胞突起伸入基质中,成牙本质细胞排列更为紧密,呈典型的高柱状分泌细胞形态,细胞 核偏远中,牙乳头中央部分组织发生退变(图7)。

图6 对照组大鼠牙胚培养9d时的组织像 (HE,10×)

图7 实验组大鼠牙胚培养9d时的组织像(HE,20×)
2.2 TEM观察
, 百拇医药
培养前细胞呈长梭形,核卵圆,核内染色质分布均匀,核周有粗面内质网,线粒体呈长 条形,双层膜结构完整清晰,排列规则(图8)。实验组和对照组细胞的超微结构基本相似, 细胞的胞浆内可见大量高尔基氏器位于中央区,其成熟面有密度不等的泡状结构;有时可见 细胞呈长柱状,有大量的粗面内质网和线粒体沿细胞长轴分布;还可见极化的细胞核;胞间 基质中可见胶原纤维呈束排列,并有致密小体的泡状结构,类似于基质小泡。但在这些结构 出现的时间和数量上,两组存在差异,实验组明显早于并多于对照组(图9、10)。提示在 PTH的作用下,细胞分化良好,明显处于功能活跃状态。

图8 大鼠牙胚培养前时的超微结构(TEM,20K×)

图9 对照组大鼠牙胚培养6d时的超微结构(TEM, 25K×)

, http://www.100md.com
图10 实验组大鼠牙胚培养6d时的超微结构像(TEM,20K×)
3 讨论
牙胚是发育生物学研究领域最完整最有意义的实验模型之一。它易于培养,可进行细胞学和 分子生物学研究。体外牙胚的培养为研究外、中胚层相互作用和诱导分化提供了理想的模型 。目前,已成功地培养了多种动物的牙胚、牙乳头细胞和牙囊细胞。牙胚的体外培养已广泛 地用于不同因子对牙齿发育和硬组织矿化影响的研究,培养的牙胚也成为研究影响细胞分化 因子的有效模型[2]。
在牙胚的发育过程中,中胚层与外胚层相互作用,首先形成牙板,经过蕾状期、帽状期 、钟状期、硬组织形成期,最后萌出,发挥咀嚼功能。中胚层的牙乳头间充质细胞分化为成 牙本质细胞。为了能够观察牙乳头间充质细胞分化的关键过程,确定各种动物牙胚的发育时 序非常重要。目前,小鼠、大鼠、豚鼠、和人等的牙胚发育时序已较为明确。其中大鼠牙 胚是常用的实验模型之一,大鼠牙胚在孕12.5d形成牙板,14d处于蕾状期,17d为钟状期,2 0d 为萌出前及前期牙本质形成期,出生后2d为牙釉质和牙本质形成期。但牙胚在体外培养时, 其 发生发育过程不同于体内。Bronckers[3]等经过较系统地观察证实:体外培养的牙 胚,其组织细胞的分化程度、形态的发育速度约为体内时的一半,只有成釉器才能诱导 间充质细胞向成牙本质细胞的分化,而前期牙本质可以维持成牙本质细胞处于极化状态。
, 百拇医药
牙胚培养常采用Trowell型培养支架[2],即将微孔滤膜置于不锈钢金属网架上 ,牙胚在滤膜上培养,培养液液面与滤膜平齐或略高,但以不浸没牙胚为宜,以使牙胚 获得较高的氧分压。培养液主要由培养基(DMEM或MEM等)、血清和维生素组成。
Lesot[4]等发现肝素能延迟体外培养的鼠牙胚成牙本质细胞的分化。Chai等[5]观察PDGF-A、PDGF受体在胎鼠下颌骨发育的效应和表达,认为内源性PDGF-A和P DGF受体能够调节牙齿发育的大小和速度。同时,外源性aFGF对离体牙胚作用的实验结果与P DGF-A相似[6],也可调节牙齿发育。Mayo等[7]报道表皮生长因子和TGF- β均明显使牙胚发育的体积减小。有人[8~9]将BMP2和bFGF蛋白的凝胶与牙齿外胚 间充质共同培养24h,发现两种生长因子的作用与牙齿外胚层的作用相似,能诱导外胚间充 质细胞的增殖和形态的发生。郝建军[10]发现外源性的bFGF可以促进大鼠牙胚的 发育和细胞分化,加快牙齿发育的速度。这些结果提示牙胚培养在观察生长因子对牙齿发育 的作用研究是有效的,牙齿的生长发育受到多种因子的调节。
, 百拇医药
陈新梅[11]在研究PTH对培养人牙乳头间充质细胞的影响时发现:体外培养人牙乳 头间充质细胞对PTH的反应具有某些成骨细胞的特性,认为PTH可能是成牙本质细胞分 化和矿化的重要介质。
体外牙胚的培养为研究PTH在成牙本质细胞诱导分化中的作用提供了直观、可靠 的研究手段。牙胚培养一般采用孕期17~19d的鼠胚胎下颌第一磨牙作为实验材料,17d鼠胚 的下颌第一磨牙出现正在分化的前期成牙本质细胞,但还未出现极化;18、19d鼠胚的下颌 第一磨牙有少许极化成牙本质细胞出现,此时是观察细胞分化、 极化及其影响因素的最佳 时期 。本文发现,PTH可促进成牙本质细胞的分化,细胞分化的程度和速度均高于对照组;在PTH 的作用下,细胞的超微结构观察发现细胞分化良好,明显处于功能活跃状态。提示PTH在牙 齿发育中具有一定的促进作用。
而Sakakura[12]在观察不同浓度PTH对孕17d大鼠下颌第一磨牙牙胚牙本质形成的影 响时发现:PTH不影响间质细胞分化为前成牙本质细胞,但抑制前成牙本质细胞分化为成牙 本质细胞,从而影响牙本质形成,且无PTH浓度的差异;内釉上皮完成细胞终末分化,成为 分泌型成釉细胞,这些细胞在牙本质缺乏情况下形成牙釉质。结果提示PTH影响间质来源细 胞,不仅阻止成牙本质细胞分化,同时也阻止前期牙本质和牙本质形成。降钙素(CT)刺激 牙本质形成,并能拮抗PTH抑制牙胚牙本质形成的作用[13]。本组实验结果与Sakak ura观察结果不一致,具体机制有待进一步研究。
, 百拇医药
参考文献:
[1]Slavkin HC.Molecular determinants during dental morphogenesis and cytodifferentiation:A reveiw[J].J Craniofac Genet Dev Biol,1991,11:338
[2]Thesleff I,Partanen AM,Vainio S.Epithelial -mesenchymal intera ctions in tooth morphogenesis:the roles of exracellular matrix,growth factors and cell surface receptors[J].J Craniofac Genet Dev Biol,1991,11:229
[3]Bronckers A,Bervoets T,Woltgens J.Effect of developmental stage of explants on further in vitro development of hamster molars[J].Arch Oral Biol,1983,28:69
, 百拇医药
[4]Lesot H,Fausser JL,Akiyama SK,et al.The carboxy -terminal extension of the collagen binding domain of fibronectin with a 165KDs membrane protein involved in odontoblast differentiation[J].Differentiation,1992,49:109
[5]Chai Y,Robbins K,Slavkin HC.Suggested of PDGF-A and cognate receptor in regulating tooth formation[J].J Dent Res,1994,73:179
[6]Mayo ML,Bringas P,Chen LJR,et al.Morphogenic effects of a cidic fibroblast growth factor on mouse molars[J].J Dent Res,1993,72:110
, http://www.100md.com
[7]Mayo ML,Akiyama N,Shum L,et al.Effects of TGF on tooth development[J].J Dent Res,1994,73:179
[8]Jernvall J,Kettunen P,Karavanova I,et al.Evidence for the role of the enamal knot as a control center in mammalian cusp formation:non-dividing cells express growth stimulating FGF-4 gene[J].Int J Dev Biol,1994,38:463
[9]Vainio S,Karavanova I,Jowett A,et al.Identification of BM P-4 as a signal mediating secondary induction between epithelial and mesenchymal tissues during early tooth development[J].Cell,1993,75:45
, 百拇医药
[10]郝建军.激素和生长因子与牙乳头细胞、牙髓细胞、牙胚分化和矿化关系的体外实验研究:[学位论文][D].西安:第四军医大学口腔医学院,1997,46
[11]陈新梅,肖明振,倪龙兴.甲状旁腺激素对培养的人牙乳头间充质细胞碱性磷酸酶活性的影响[J].牙体牙髓牙周病学杂志,1999,9(3):227
[12]Sakakura Y.Effects of parathyroid hormone on odontogenesis of the mouse embryonic molar tooth in vitro[J].Clacified Tissue Int,1987,40:49
[13]Sakakura Y,Fujiwara N,Sugauoara M,et al.In vitro effects of calcitonin and /or parathyroid hormone on odontogenesis of mouse embryonic molar[J].J Dent Res,1989,68(8):1279
收稿日期:1999-07-02
修回日期:2000-03-29, http://www.100md.com