不同部位大鼠胰岛同种移植实验研究
作者:鲁正 杨永康 王朝夫 陈治文 姜从桥 张龙云
单位:鲁正(蚌埠医学院附属医院普外科,安徽 蚌埠 233004;蚌埠医学院);杨永康(蚌埠医学院附属医院普外科,安徽 蚌埠 233004;蚌埠医学院);王朝夫(蚌埠医学院附属医院病理学教研室);陈治文(蚌埠医学院附属医院生物化学教研室);姜从桥(蚌埠医学院附属医院普外科,安徽 蚌埠 233004;蚌埠医学院);张龙云(蚌埠医学院附属医院内分泌研究室,安徽 蚌埠 233003)
关键词:糖尿病,实验性;移植,同种;胰岛;脾脏;大鼠
蚌埠医学院学报000506 [摘要] 目的:探讨大鼠同种胰岛移植的适宜部位。方法:将同种胰岛分别移植于大鼠脾髓内、肝实质内和经门静脉注入肝内,通过观察比较移植后大鼠空腹血糖、血清胰岛素的变化、术后肝功能、排斥反应发生时间以及组织学检查来评定三个移植部位的效果。结果:肝实质内移植组其移植物存活期为5.83±2.48天,短于门静脉内移植组9.25±3.06天和脾髓内移植组10.22±2.95天(P<0.05),肝功能损害重,移植效果差。门静脉内移植组,胰岛对外周血糖变化敏感,移植物存活时间长;而脾髓内移植组,不但移植效果良好,且对受体无不良影响。结论:脾脏是大鼠同种胰岛移植的适宜部位。
, 百拇医药
[中国图书资料分类法分类号] R 587.1;R 617 [文献标识码] A
[文章编号] 1000-2200(2000)05-0323-03
Experimental study on the different sites for the rat islet allotransplant
LU Zheng,YANG Yong-kang,WANG Chao-fu,CHEN Zhi-wen,JIANG Cong-qiao,ZHANG Long-yun
(Department of General Surgery,Affiliated Hospital of Bengbu Medical College,Anhui 233004,China)
, 百拇医药 [Abstract] Objective:To search the suitable site for the islet allografts in the diabetic rats.Methods:The isolated islets were allotransplanted into the splenic pulp,hepatic parenchyma and portal vein respectively.These sites were evaluated with four sides:histologic examination;the time of rejection;the different values of fasting blood glucose and levels of plasma insulin before and after operation;the liver function.Results:In these three transplanted sites,the median survive time(MST) of intrahepatic allografts were 5.83±2.48 days,shorter than that of allografts implanted into portal vein(MST,9.25±3.06) and splenic pulp(MST,10.22±2.95)(P<0.05),the liver function was injuried specifically,so the fate of allografts into hepatic parenchyma was inferior.Allografts into portal vein were sensitive to the level of peripheral plasma glucose,the median survive time was longer,the result of allotransplantation was superior.In this study,the significant result was that the fate of allografts to spleen was not only better,but also the allotransplantation had not influence over the recipiency.Conclusions:It suggests that spleen is a favorable site for islet allografts.
, 百拇医药
[Key words] diabetes mellitus,experimental;transplantation,homologous;islands of Langerhans;spleen;rats
近年来,同种胰岛移植已取得可喜的进步,但仍缺乏理想的移植部位。为保证移植后胰岛持续有效地发挥功能,笔者对同种胰岛移植的适宜部位进行了研究,希望通过本次实验,能为今后的临床胰岛移植提供可借鉴的经验。
1 材料与方法
1.1 大鼠糖尿病模型的制备与分组 雌性SD大鼠39只(安徽医科大学实验动物中心提供),体重200~250 g。禁食12 h后,每天给四氧嘧啶(alloxan)150 mg/kg皮下注射,连续2天。动态监测血糖,凡空腹血糖>16.6 mmol/L并持续3周以上者,定为成功的糖尿病模型[1]。实验动物随机分成四组:Ⅰ组:糖尿病对照组(n=6);Ⅱ组:异体胰岛脾髓内移植组(n=11);Ⅲ组:异体胰岛肝实质内移植组(n=11);Ⅳ组:异体胰岛经门静脉肝内移植组(n=11)。1.2 胰岛的制备 采用机械法分离胰岛[2,3],Hinshaw法纯化[4]。供体为SD大鼠,体重为250~300 g,胰岛的收获量为610.66±160.30个胰岛/胰腺,纯度在85%以上,台盼蓝染色示胰岛的存活率为(74.17±8.92)%。肝素化生理盐水制成胰岛悬液,510~720个胰岛/毫升,每只糖尿病大鼠接受500~800个胰岛。
, 百拇医药
1.3 胰岛的植入 成模大鼠在戊巴比妥(30 mg/kg)腹腔内注射麻醉后,取正中切口。直接植入脾髓者,以41/2针从脾上极刺入下极,边退针,边缓慢注射;直接植入肝实质者,以41/2针直接刺入肝实质内缓慢输注;经门静脉植入肝内者,显露门静脉主干,而后寻找并游离一段门静脉小分支,远端结扎,近端套线备用,以41/2针经小分支缓慢输注,输毕结扎小分支近端。从移植当天起,顿服硫唑嘌呤(agathioprine),每天5 mg/kg,连服1周。
1.4 移植效果评定 移植后,禁食12 h血糖低于11.11 mmol/L并持续1天以上为完全缓解;血糖与移植前相比下降50%以上,但仍高于11.11 mmol/L为部分缓解(完全缓解与部分缓解均判为移植有效)。血糖降低不明显或升高者为无效。移植有效者在缓解期中空腹血糖连续2次升高>13.8 mmol/L为移植物排斥,以出现第1次升高的时间为排斥时间。
1.5 观察指标 (1)移植有效率的比较;(2)移植有效鼠血糖开始明显下降时间的比较;(3)移植有效鼠移植前、后空腹血糖及血清胰岛素的比较;(4)移植后1周肝功能的变化情况;(5)胰岛移植后发生排斥反应时间的比较;(6)胰岛移植后,移植部位组织形态学的变化。
, http://www.100md.com
1.6 统计学方法 采用方差分析和q检验、配对t检验或秩和检验。
2 结果
糖尿病对照组在本次实验期间无1例自行缓解,其中3例因血糖过高,救治不及死亡。
2.1 移植有效率和血糖开始下降时间的比较 三个移植组,移植效果差异无显著性(P>0.05)(见表1),可能由于样本例数较少造成的。移植有效鼠血糖开始下降时间,差异也无显著性(P>0.05)(见表2)。
表1 移植组移植结果比较(n) 组别
有效
无效
合计
完全缓解
, 百拇医药
部分缓解
Ⅱ
7
2
2
11
Ⅲ
4
2
5
11
Ⅳ
5
3
, 百拇医药
3
11
合计
16
7
10
33
多个样本比较的秩和检验:Hc=2.06,P>0.052.2 移植后空腹血糖、胰岛素的变化 三个移植组移植有效鼠移植前后血糖、胰岛素比较差异有显著性(P<0.01)(见表3)。提示胰岛移植后,能使大鼠的高血糖状态迅速纠正。移植后三组间血糖、胰岛素比较,差异无显著性(P>0.05),说明三个移植组,移植有效鼠在高血糖改善程度上无差异。
表2 移植有效鼠血糖开始下降时间比较(d) 组别
, 百拇医药
n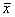 ±s
±s
F
P
MS组内
Ⅱ
9
2.22±0.97
Ⅲ
6
1.67±0.82
2.10
>0.05
, http://www.100md.com
0.736
Ⅳ
8
1.38±0.74
表3 移植有效鼠移植前后空腹血糖和胰岛素含量比较(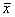 ±s) 组别
±s) 组别
n
血糖(mmol/L)
胰岛素(pmol/L)
移植前
移植后(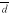 ±sd)
±sd)
, http://www.100md.com
移植前
移植后(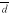 ±sd)
±sd)
Ⅱ
9
24.29±1.61
14.50±2.42**
54.64±19.44
41.21±22.62**
Ⅲ
6
, 百拇医药 23.01±2.38
12.78±1.77**
54.16±22.45
29.55±15.83**
Ⅳ
8
23.48±1.99
12.99±1.16**
53.31±20.42
29.17±22.96**
F
, 百拇医药
—
0.83
1.97
0.01
0.86
P
—
>0.05
>0.05
>0.05
>0.05
MS组内
—
, 百拇医药
3.839
3.597
423.108
451.820
各组移植前后配对t检验:**P<0.012.3 移植后肝功能变化 三组移植有效鼠在术后1周测定丙氨酸转氨酶(ALT)、碱性磷酸酶(AKP)和乳酸脱氢酶(LDH)。它们与正常大鼠相比较,直接肝实质内胰岛移植有明显的肝功能损害,其中LDH达正常鼠二倍以上,经门静脉肝内移植也有程度不等的肝功能损害,而脾髓内移植基本无肝功能损害,LDH的轻度升高考虑可能由手术创伤引起(见表4)。
表4 正常大鼠与移植有效鼠肝功能比较(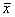 ±s;u/L) 组别
±s;u/L) 组别
, 百拇医药 n
ALT(金氏法)
AKP(卡门氏法)
LDH(金氏法)
Ⅰ
11
9.73±8.17
25.91±5.87
138.19±85.54
Ⅱ
9
15.67±9.19
28.56±9.42
, http://www.100md.com
257.78±106.14*
Ⅲ
6
27.83±9.06**
47.83±13.93**
303.33±116.73*
Ⅳ
8
20.25±12.89
35.50±9.62
293.75±109.80**
, http://www.100md.com
F
—
4.75
7.85
5.17
P
—
<0.01
<0.01
<0.01
MS组内
—
97.221
, 百拇医药
89.083
10 527.275
q检验:与正常大鼠比较*P<0.05,**P<0.012.4 移植后排斥反应时间的比较 胰岛移植后,三组间相比较以直接肝实质内胰岛移植发生排斥反应最早(P<0.05),而其它二组间差异无显著性(P>0.05)(见表5)。此结果提示,胰岛在肝实质内存活时间最短,说明肝实质不是胰岛移植的理想部位。
表5 三组移植后排斥反应时间比较(d) 组别
n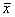 ±s
±s
F
P
MS组内
, 百拇医药
Ⅱ
9
10.22±2.95
Ⅲ
6
5.83±2.48
4.38
<0.05
8.296
Ⅳ
8
9.25±3.06
, 百拇医药 q检验:与Ⅲ组比较*P<0.052.5 组织学观察 胰岛移植于脾脏后组织学检查可见脾髓内有成团胰岛细胞与周围组织紧密结合,并有少量淋巴细胞浸润,在移植后期,移植区域则有大量淋巴细胞浸润和出现成团胰岛细胞离散的现象。胰岛移植于肝实质内除成团存活的胰岛细胞外,更可见移植区域大片坏死灶,间质内有炎性细胞浸润。经门静脉肝内胰岛移植,胰岛主要居留于门静脉小分支内,肝实质内可见有梗死灶,部分血管有血栓形成;且肝细胞形态、肝小叶结构均正常。
3 讨论
目前,胰岛移植的疗效还较差,除尚无理想的胰岛制备方法[5]和难以解决的排斥反应外[6],缺乏理想的移植部位也是影响胰岛移植的重要因素[7]。移植部位的选择应该:(1)有利于发挥其生理功能;(2)耐受胰腺外分泌能力强;(3)移植后无并发症发生;(4)对移植部位损伤小。本文采用的三个移植部位,均具有血供丰富、胰岛素首先回肝内代谢再入体循环、手术操作简单、可反复多次输注等优点。但它们又各有特点,因此,移植效果大相径庭。
, http://www.100md.com
通过实验笔者发现,胰岛移植于肝实质内效果最差。移植物早期无功能与肝实质内空间狭小,限制胰岛再生,注射后包膜撕裂,移植物渗漏,造成胰岛数量减少有关,可能亦与植入时损伤肝内小胆管,造成胆汁渗漏而对胰岛产生不良影响有关。组织学检查不仅可见移植区域有大片坏死区,而且间质内有炎性细胞浸润。这种移植区域的非特异性炎性反应,可能是早期移植物无功能的另一原因。因此,肝实质并不是胰岛移植的适宜部位。
在近几年的胰岛移植中,多数经门静脉植入肝内[8]。因为肝脏是胰岛素的作用部位,门脉内移植易于诱导免疫耐受或免疫无反应性,肝窦及小静脉结构有利于胰岛的居留和生长。亦有文献报道,在胰岛经门静脉植入过程中,会有如门脉高压等严重并发症[9]。本实验过程中,笔者提高胰岛纯度,胰岛悬液肝素化以及缓慢的输注速度,使严重并发症的发生得到有效控制。笔者还发现,胰岛移植于门静脉内对外周血糖变化敏感,有利于胰岛发挥其生理功能。从病理结果看,受体肝间质有小片坏死,部分血管有血栓形成。这表明倘若多次反复输注大量胰岛,仍会对受体肝造成明显损害。
, http://www.100md.com
脾脏是人体最大的外周淋巴器官,参与机体的细胞免疫、体液免疫和非特异性免疫反应,似乎不适合作为移植部位。但又因脾脏血供丰富,可以稀释和消除胰酶活力;植入时不致引起任何门脉高压;耐受胰腺外分泌能力强,符合胰岛移植的生理环境,因此笔者试把同种胰岛移植于脾髓内。结果表明,胰岛移植效果良好,未对受体脾造成任何不良影响,无并发症发生,移植物存活时间与门脉内移植组相比差异无显著性。组织学检查提示,在移植早、中期,可见有成团的胰岛细胞与周围组织结合紧密,未有大量淋巴细胞浸润的早期排斥反应现象。正是由于这些特点,同种胰岛脾内移植,不必担心脾脏是一免疫器官,有加速排斥之虞,它仍是一个可实用的部位。
对于同种胰岛移植,排斥反应仍是影响移植物长期存活的主要因素。在实验中,笔者采用硫唑嘌呤抑制排斥反应,结果三个移植组均未能明显延长移植物存活时间,这说明硫唑嘌呤对同种胰岛移植的免疫抑制作用不理想。因此,寻找更为理想的抗排斥反应的方法,仍需进一步研究。
作者简介:鲁 正(1971-),男,安徽亳州人,硕士,主治医师.
, http://www.100md.com
[参考文献]
[1]张洪德,张 洪,胡远峰,等.不同预处理新生猪胰岛异种移植实验研究[J].中华器官移植杂志,1996,17(3)∶111.
[2]张伟杰,姜汉英,陈金枝,等.猪胰岛移植物的大量制备[J].中华器官移植杂志,1993,14(4)∶151.
[3]董锡钧,刘亚辉,张学春,等.采用新式机械法分离成年猪胰岛[J].中华实验外科杂志,1995,13(Suppl)∶80.
[4]Hinshaw DB,Jolley WB.Islet autotransplantation after pancreatectomy for chronic pancreatitis with a new method of islet preparation[J].Am J Surg,1981,142(7)∶118.
, 百拇医药
[5]Farney AC,Najarian JS,Nakhleh RE,et al.Autotransplantation of dispersed pancreatic islet tissue combined with total or near-total pancreatectomy for treatment of chronic pancreatitis[J].Surgery,1991,110(2)∶427.
[6]张学春,刘亚辉,谭毓铨,等.关于胰岛移植的几点探讨[J].普外临床,1997,12(1)∶24.
[7]Alejandro R,Cutfield RG,Shienvold FL,et al.Natural history of intrahepatic canine islet cell autografts[J].J Clin Invest,1986,78(12)∶1 339.
, http://www.100md.com
[8]Goss JA,Flye MW,Lacy PE,et al.Induction of allogenic islet survival by intrahepatic islet preimmunization and transient immunosuppresion[J].Diabetes,1996,459(8)∶144.
[9]Walsh TJ,Eggleston JC,Cameron JL,et al.Portal hypertension,hepatic infarction,and liver failure complicating pancreatic islet autotransplantation[J].Surgery,1982,91(4)∶485.
收稿日期:1999-09-07, http://www.100md.com
单位:鲁正(蚌埠医学院附属医院普外科,安徽 蚌埠 233004;蚌埠医学院);杨永康(蚌埠医学院附属医院普外科,安徽 蚌埠 233004;蚌埠医学院);王朝夫(蚌埠医学院附属医院病理学教研室);陈治文(蚌埠医学院附属医院生物化学教研室);姜从桥(蚌埠医学院附属医院普外科,安徽 蚌埠 233004;蚌埠医学院);张龙云(蚌埠医学院附属医院内分泌研究室,安徽 蚌埠 233003)
关键词:糖尿病,实验性;移植,同种;胰岛;脾脏;大鼠
蚌埠医学院学报000506 [摘要] 目的:探讨大鼠同种胰岛移植的适宜部位。方法:将同种胰岛分别移植于大鼠脾髓内、肝实质内和经门静脉注入肝内,通过观察比较移植后大鼠空腹血糖、血清胰岛素的变化、术后肝功能、排斥反应发生时间以及组织学检查来评定三个移植部位的效果。结果:肝实质内移植组其移植物存活期为5.83±2.48天,短于门静脉内移植组9.25±3.06天和脾髓内移植组10.22±2.95天(P<0.05),肝功能损害重,移植效果差。门静脉内移植组,胰岛对外周血糖变化敏感,移植物存活时间长;而脾髓内移植组,不但移植效果良好,且对受体无不良影响。结论:脾脏是大鼠同种胰岛移植的适宜部位。
, 百拇医药
[中国图书资料分类法分类号] R 587.1;R 617 [文献标识码] A
[文章编号] 1000-2200(2000)05-0323-03
Experimental study on the different sites for the rat islet allotransplant
LU Zheng,YANG Yong-kang,WANG Chao-fu,CHEN Zhi-wen,JIANG Cong-qiao,ZHANG Long-yun
(Department of General Surgery,Affiliated Hospital of Bengbu Medical College,Anhui 233004,China)
, 百拇医药 [Abstract] Objective:To search the suitable site for the islet allografts in the diabetic rats.Methods:The isolated islets were allotransplanted into the splenic pulp,hepatic parenchyma and portal vein respectively.These sites were evaluated with four sides:histologic examination;the time of rejection;the different values of fasting blood glucose and levels of plasma insulin before and after operation;the liver function.Results:In these three transplanted sites,the median survive time(MST) of intrahepatic allografts were 5.83±2.48 days,shorter than that of allografts implanted into portal vein(MST,9.25±3.06) and splenic pulp(MST,10.22±2.95)(P<0.05),the liver function was injuried specifically,so the fate of allografts into hepatic parenchyma was inferior.Allografts into portal vein were sensitive to the level of peripheral plasma glucose,the median survive time was longer,the result of allotransplantation was superior.In this study,the significant result was that the fate of allografts to spleen was not only better,but also the allotransplantation had not influence over the recipiency.Conclusions:It suggests that spleen is a favorable site for islet allografts.
, 百拇医药
[Key words] diabetes mellitus,experimental;transplantation,homologous;islands of Langerhans;spleen;rats
近年来,同种胰岛移植已取得可喜的进步,但仍缺乏理想的移植部位。为保证移植后胰岛持续有效地发挥功能,笔者对同种胰岛移植的适宜部位进行了研究,希望通过本次实验,能为今后的临床胰岛移植提供可借鉴的经验。
1 材料与方法
1.1 大鼠糖尿病模型的制备与分组 雌性SD大鼠39只(安徽医科大学实验动物中心提供),体重200~250 g。禁食12 h后,每天给四氧嘧啶(alloxan)150 mg/kg皮下注射,连续2天。动态监测血糖,凡空腹血糖>16.6 mmol/L并持续3周以上者,定为成功的糖尿病模型[1]。实验动物随机分成四组:Ⅰ组:糖尿病对照组(n=6);Ⅱ组:异体胰岛脾髓内移植组(n=11);Ⅲ组:异体胰岛肝实质内移植组(n=11);Ⅳ组:异体胰岛经门静脉肝内移植组(n=11)。1.2 胰岛的制备 采用机械法分离胰岛[2,3],Hinshaw法纯化[4]。供体为SD大鼠,体重为250~300 g,胰岛的收获量为610.66±160.30个胰岛/胰腺,纯度在85%以上,台盼蓝染色示胰岛的存活率为(74.17±8.92)%。肝素化生理盐水制成胰岛悬液,510~720个胰岛/毫升,每只糖尿病大鼠接受500~800个胰岛。
, 百拇医药
1.3 胰岛的植入 成模大鼠在戊巴比妥(30 mg/kg)腹腔内注射麻醉后,取正中切口。直接植入脾髓者,以41/2针从脾上极刺入下极,边退针,边缓慢注射;直接植入肝实质者,以41/2针直接刺入肝实质内缓慢输注;经门静脉植入肝内者,显露门静脉主干,而后寻找并游离一段门静脉小分支,远端结扎,近端套线备用,以41/2针经小分支缓慢输注,输毕结扎小分支近端。从移植当天起,顿服硫唑嘌呤(agathioprine),每天5 mg/kg,连服1周。
1.4 移植效果评定 移植后,禁食12 h血糖低于11.11 mmol/L并持续1天以上为完全缓解;血糖与移植前相比下降50%以上,但仍高于11.11 mmol/L为部分缓解(完全缓解与部分缓解均判为移植有效)。血糖降低不明显或升高者为无效。移植有效者在缓解期中空腹血糖连续2次升高>13.8 mmol/L为移植物排斥,以出现第1次升高的时间为排斥时间。
1.5 观察指标 (1)移植有效率的比较;(2)移植有效鼠血糖开始明显下降时间的比较;(3)移植有效鼠移植前、后空腹血糖及血清胰岛素的比较;(4)移植后1周肝功能的变化情况;(5)胰岛移植后发生排斥反应时间的比较;(6)胰岛移植后,移植部位组织形态学的变化。
, http://www.100md.com
1.6 统计学方法 采用方差分析和q检验、配对t检验或秩和检验。
2 结果
糖尿病对照组在本次实验期间无1例自行缓解,其中3例因血糖过高,救治不及死亡。
2.1 移植有效率和血糖开始下降时间的比较 三个移植组,移植效果差异无显著性(P>0.05)(见表1),可能由于样本例数较少造成的。移植有效鼠血糖开始下降时间,差异也无显著性(P>0.05)(见表2)。
表1 移植组移植结果比较(n) 组别
有效
无效
合计
完全缓解
, 百拇医药
部分缓解
Ⅱ
7
2
2
11
Ⅲ
4
2
5
11
Ⅳ
5
3
, 百拇医药
3
11
合计
16
7
10
33
多个样本比较的秩和检验:Hc=2.06,P>0.052.2 移植后空腹血糖、胰岛素的变化 三个移植组移植有效鼠移植前后血糖、胰岛素比较差异有显著性(P<0.01)(见表3)。提示胰岛移植后,能使大鼠的高血糖状态迅速纠正。移植后三组间血糖、胰岛素比较,差异无显著性(P>0.05),说明三个移植组,移植有效鼠在高血糖改善程度上无差异。
表2 移植有效鼠血糖开始下降时间比较(d) 组别
, 百拇医药
n
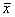 ±s
±sF
P
MS组内
Ⅱ
9
2.22±0.97
Ⅲ
6
1.67±0.82
2.10
>0.05
, http://www.100md.com
0.736
Ⅳ
8
1.38±0.74
表3 移植有效鼠移植前后空腹血糖和胰岛素含量比较(
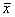 ±s) 组别
±s) 组别n
血糖(mmol/L)
胰岛素(pmol/L)
移植前
移植后(
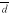 ±sd)
±sd), http://www.100md.com
移植前
移植后(
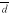 ±sd)
±sd)Ⅱ
9
24.29±1.61
14.50±2.42**
54.64±19.44
41.21±22.62**
Ⅲ
6
, 百拇医药 23.01±2.38
12.78±1.77**
54.16±22.45
29.55±15.83**
Ⅳ
8
23.48±1.99
12.99±1.16**
53.31±20.42
29.17±22.96**
F
, 百拇医药
—
0.83
1.97
0.01
0.86
P
—
>0.05
>0.05
>0.05
>0.05
MS组内
—
, 百拇医药
3.839
3.597
423.108
451.820
各组移植前后配对t检验:**P<0.012.3 移植后肝功能变化 三组移植有效鼠在术后1周测定丙氨酸转氨酶(ALT)、碱性磷酸酶(AKP)和乳酸脱氢酶(LDH)。它们与正常大鼠相比较,直接肝实质内胰岛移植有明显的肝功能损害,其中LDH达正常鼠二倍以上,经门静脉肝内移植也有程度不等的肝功能损害,而脾髓内移植基本无肝功能损害,LDH的轻度升高考虑可能由手术创伤引起(见表4)。
表4 正常大鼠与移植有效鼠肝功能比较(
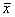 ±s;u/L) 组别
±s;u/L) 组别, 百拇医药 n
ALT(金氏法)
AKP(卡门氏法)
LDH(金氏法)
Ⅰ
11
9.73±8.17
25.91±5.87
138.19±85.54
Ⅱ
9
15.67±9.19
28.56±9.42
, http://www.100md.com
257.78±106.14*
Ⅲ
6
27.83±9.06**
47.83±13.93**
303.33±116.73*
Ⅳ
8
20.25±12.89
35.50±9.62
293.75±109.80**
, http://www.100md.com
F
—
4.75
7.85
5.17
P
—
<0.01
<0.01
<0.01
MS组内
—
97.221
, 百拇医药
89.083
10 527.275
q检验:与正常大鼠比较*P<0.05,**P<0.012.4 移植后排斥反应时间的比较 胰岛移植后,三组间相比较以直接肝实质内胰岛移植发生排斥反应最早(P<0.05),而其它二组间差异无显著性(P>0.05)(见表5)。此结果提示,胰岛在肝实质内存活时间最短,说明肝实质不是胰岛移植的理想部位。
表5 三组移植后排斥反应时间比较(d) 组别
n
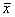 ±s
±sF
P
MS组内
, 百拇医药
Ⅱ
9
10.22±2.95
Ⅲ
6
5.83±2.48
4.38
<0.05
8.296
Ⅳ
8
9.25±3.06
, 百拇医药 q检验:与Ⅲ组比较*P<0.052.5 组织学观察 胰岛移植于脾脏后组织学检查可见脾髓内有成团胰岛细胞与周围组织紧密结合,并有少量淋巴细胞浸润,在移植后期,移植区域则有大量淋巴细胞浸润和出现成团胰岛细胞离散的现象。胰岛移植于肝实质内除成团存活的胰岛细胞外,更可见移植区域大片坏死灶,间质内有炎性细胞浸润。经门静脉肝内胰岛移植,胰岛主要居留于门静脉小分支内,肝实质内可见有梗死灶,部分血管有血栓形成;且肝细胞形态、肝小叶结构均正常。
3 讨论
目前,胰岛移植的疗效还较差,除尚无理想的胰岛制备方法[5]和难以解决的排斥反应外[6],缺乏理想的移植部位也是影响胰岛移植的重要因素[7]。移植部位的选择应该:(1)有利于发挥其生理功能;(2)耐受胰腺外分泌能力强;(3)移植后无并发症发生;(4)对移植部位损伤小。本文采用的三个移植部位,均具有血供丰富、胰岛素首先回肝内代谢再入体循环、手术操作简单、可反复多次输注等优点。但它们又各有特点,因此,移植效果大相径庭。
, http://www.100md.com
通过实验笔者发现,胰岛移植于肝实质内效果最差。移植物早期无功能与肝实质内空间狭小,限制胰岛再生,注射后包膜撕裂,移植物渗漏,造成胰岛数量减少有关,可能亦与植入时损伤肝内小胆管,造成胆汁渗漏而对胰岛产生不良影响有关。组织学检查不仅可见移植区域有大片坏死区,而且间质内有炎性细胞浸润。这种移植区域的非特异性炎性反应,可能是早期移植物无功能的另一原因。因此,肝实质并不是胰岛移植的适宜部位。
在近几年的胰岛移植中,多数经门静脉植入肝内[8]。因为肝脏是胰岛素的作用部位,门脉内移植易于诱导免疫耐受或免疫无反应性,肝窦及小静脉结构有利于胰岛的居留和生长。亦有文献报道,在胰岛经门静脉植入过程中,会有如门脉高压等严重并发症[9]。本实验过程中,笔者提高胰岛纯度,胰岛悬液肝素化以及缓慢的输注速度,使严重并发症的发生得到有效控制。笔者还发现,胰岛移植于门静脉内对外周血糖变化敏感,有利于胰岛发挥其生理功能。从病理结果看,受体肝间质有小片坏死,部分血管有血栓形成。这表明倘若多次反复输注大量胰岛,仍会对受体肝造成明显损害。
, http://www.100md.com
脾脏是人体最大的外周淋巴器官,参与机体的细胞免疫、体液免疫和非特异性免疫反应,似乎不适合作为移植部位。但又因脾脏血供丰富,可以稀释和消除胰酶活力;植入时不致引起任何门脉高压;耐受胰腺外分泌能力强,符合胰岛移植的生理环境,因此笔者试把同种胰岛移植于脾髓内。结果表明,胰岛移植效果良好,未对受体脾造成任何不良影响,无并发症发生,移植物存活时间与门脉内移植组相比差异无显著性。组织学检查提示,在移植早、中期,可见有成团的胰岛细胞与周围组织结合紧密,未有大量淋巴细胞浸润的早期排斥反应现象。正是由于这些特点,同种胰岛脾内移植,不必担心脾脏是一免疫器官,有加速排斥之虞,它仍是一个可实用的部位。
对于同种胰岛移植,排斥反应仍是影响移植物长期存活的主要因素。在实验中,笔者采用硫唑嘌呤抑制排斥反应,结果三个移植组均未能明显延长移植物存活时间,这说明硫唑嘌呤对同种胰岛移植的免疫抑制作用不理想。因此,寻找更为理想的抗排斥反应的方法,仍需进一步研究。
作者简介:鲁 正(1971-),男,安徽亳州人,硕士,主治医师.
, http://www.100md.com
[参考文献]
[1]张洪德,张 洪,胡远峰,等.不同预处理新生猪胰岛异种移植实验研究[J].中华器官移植杂志,1996,17(3)∶111.
[2]张伟杰,姜汉英,陈金枝,等.猪胰岛移植物的大量制备[J].中华器官移植杂志,1993,14(4)∶151.
[3]董锡钧,刘亚辉,张学春,等.采用新式机械法分离成年猪胰岛[J].中华实验外科杂志,1995,13(Suppl)∶80.
[4]Hinshaw DB,Jolley WB.Islet autotransplantation after pancreatectomy for chronic pancreatitis with a new method of islet preparation[J].Am J Surg,1981,142(7)∶118.
, 百拇医药
[5]Farney AC,Najarian JS,Nakhleh RE,et al.Autotransplantation of dispersed pancreatic islet tissue combined with total or near-total pancreatectomy for treatment of chronic pancreatitis[J].Surgery,1991,110(2)∶427.
[6]张学春,刘亚辉,谭毓铨,等.关于胰岛移植的几点探讨[J].普外临床,1997,12(1)∶24.
[7]Alejandro R,Cutfield RG,Shienvold FL,et al.Natural history of intrahepatic canine islet cell autografts[J].J Clin Invest,1986,78(12)∶1 339.
, http://www.100md.com
[8]Goss JA,Flye MW,Lacy PE,et al.Induction of allogenic islet survival by intrahepatic islet preimmunization and transient immunosuppresion[J].Diabetes,1996,459(8)∶144.
[9]Walsh TJ,Eggleston JC,Cameron JL,et al.Portal hypertension,hepatic infarction,and liver failure complicating pancreatic islet autotransplantation[J].Surgery,1982,91(4)∶485.
收稿日期:1999-09-07, http://www.100md.com