提高多药耐药基因导入人CD34+细胞转导效率的探讨
作者:童英 潘凌亚 周生 吴英 毛宁 杨秀玉
单位:童英 潘凌亚 杨秀玉(100730 中国医学科学院、中国协和医科大学北京协和医院妇产科);周生 吴英 毛宁(军事医学科学院基础医学研究所)
关键词:抗药性,多药;造血干细胞;基因转移;造血细胞生长因子;骨髓基质细胞
中华血液学杂志000502 【摘要】 目的 探讨逆转录病毒介导的多药耐药基因(mdr1)导入人CD34+细胞的影响因素,以提高基因转导效率。方法 用流式细胞术(FCM)检测不同组合细胞因子及人骨髓基质细胞+细胞因子支持的基因转导效率;用造血祖细胞集落培养观察耐药性;用FCM检测不同浓度紫杉醇素对基因转导细胞的作用。结果 细胞因子SCF+Flt配体(FL)+IL-3组合支持的基因转导效率高于其它组合(SCF+IL-6+IL-3,SCF+IL-6+IL-3+Tpo,SCF+IL-3)。骨髓基质细胞+细胞因子(SCF+FL+IL-3)支持的基因转导效率(20.5%)又高于单纯用该组细胞因子的转导效率(15.2%),并且前者形成的抗性集落形成细胞数多于后者。在10?ng/ml紫杉醇作用下基因转导CD34+细胞的阳性率可达38.5%。结论 骨髓基质细胞+细胞因子(SCF+FL+IL-3)对基因转导有较强的促进作用;一定浓度的紫杉醇具有富集基因转导细胞的作用。
, http://www.100md.com
Exploration of factors increasing transfer efficiency of retroviral mediated multidrug resistance gene (mdr1) into human CD34+ cells
TONG Ying*, PAN Lingya, ZHOU Sheng, et al.
(Peking Union Hospital, CAMS & PUMC, Beijing 100730,China)
【Abstract】 Objective To explore factors influencing transfer of retroviral mediated multidrug resistance gene (mdr1) into human CD34+ cells. Methods Transduction efficiency in the presence of different combinations of cytokines and human bone marrow stromal cells plus cytokines were determined by flow cytometry (FCM).Drug resistance was evaluated by plating yields of cultured hematopoietic progenitor cells. The effect of Taxol at different concentrations on mdr1 gene transfer cells was determined by FCM. Result Transduction efficiency in the presence of SCF+FL+IL-3 was higher than that in other combinations of cytokines(SCF+IL-6+IL-3,SCF+IL-6+IL-3+Tpo,SCF+IL-3). Transduction efficiency (20.5%) in the presence of bone marrow stromal cells plus cytokines(SCF+FL+IL-3) was higher than that (15.2%) without stromal cells, and the number of drug-resistant colony-forming cells was more in the former than in the latter. The percentage of CD34+ cell with the gene transduction at 10?ng/ml Taxol reached 38.5%. Conclusion Human bone marrow stromal cells plus cytokines (SCF+FL+IL-3) is more effective in enhancing mdr1 gene transduction. Taxol at a certain concentration can enrich mdr1 gene transferred cells.
, 百拇医药
【Key words】 Resistance, multidrug; Hematopoietic stem cell; Gene transfer; Bone marrow stromal cells; Hematopoietic cell growth factors
多药耐药基因(mdr1)编码相对分子质量为170×103的跨膜糖蛋白(P170),该蛋白作为依赖ATP能量的溢出泵,可将进入细胞内的多种药物如紫杉醇(商品名Taxol)、阿霉素等排出细胞外[1]。正常骨髓造血细胞P170表达量极低,将外源性mdr1基因导入其中,肿瘤化疗时可起到保护造血细胞的目的。提高基因转导效率是转基因治疗成功的关键。我们对影响逆转录病毒载体介导的mdr1基因导入人CD34+细胞的一些因素进行探讨,试图找出较适宜的转导条件,以提高转导效率,为造血细胞基因治疗打下基础。
材料和方法
, http://www.100md.com
1 包装细胞的建立及病毒上清的制备 用脂质体介导转染法,将含人全长mdr1 cDNA的重组逆转录病毒载体SF-mdr1(由德国Baum博士赠送)导入双嗜性包装细胞GP-envAM12,用60?ng/ml秋水仙素筛选获得抗性克隆。收集其培养上清,感染同样方法获得的单嗜性包装细胞GP-E86,收集GP-E86抗性克隆培养上清,再次感染GP-envAM12抗性克隆。用NIH3T3细胞测其病毒上清滴度为1.6×105 cfu/ml。将包装细胞培养到满瓶的80%,更换培养液,置32?℃培养24?h,收集病毒上清,用0.45?μm滤膜过滤后立即使用。
2 CD34+细胞的分离纯化 取正常足月妊娠脐血,用淋巴细胞分离液密度梯度离心分出单个核细胞,再按单克隆抗体(单抗)-免疫磁性分离系统说明书分离出CD34+细胞。磁性细胞分离仪和CD34+细胞分离试剂盒由Miltenyi Biotec公司提供。流式细胞仪测CD34+细胞纯度为80%~87%,抗体为标记了藻红蛋白(PE)的抗CD34单抗(Immunotech公司)。
, 百拇医药
3 骨髓基质细胞的制备 骨髓细胞取自胸外科手术切除的肋骨。用注射器冲出肋骨中的骨髓,稀释后用淋巴细胞分离液密度梯度离心分出单个核细胞。按9×106/ml细胞接种于培养瓶中,用长期培养液Myelocult H5100(Stem cell 公司) 和1×10-6mol/L的氢化考的松,在33?℃孵箱中培养4周,每周半量换液。经16?Gy 60 Co 射线照射,然后用2.5?g/L胰酶消化后收集细胞,以2.5×105细胞接种于24孔培养板中,待其贴壁后即可使用。
4 重组造血细胞因子 除SCF为Amgen公司产品,其余均由Peprotech公司提供。SCF 50?ng/ml、FL 50?ng/ml、IL-3 10?ng/ml、Tpo 10?ng/ml、IL-6 10?ng/ml。细胞因子分组为:①SCF+IL-3+IL-6;②SCF+IL-3+FL;③SCF+IL-3+IL-6+Tpo;④SCF+IL-3。
, 百拇医药
5 CD34+细胞体外转染
5.1 细胞因子支持的转染:将CD34+细胞按5×104/ml接种于24孔板,每孔1?ml培养体系。IMDM培养液(Gibco公司)中含有体积分数为15%的马血清、1×10-4mol/L 2-巯基乙醇、2?mmol/L L-谷氨酰胺、100?g/L牛血清白蛋白及不同分组的重组细胞因子,37?℃培养48?h。吸去0.5?ml培养液,加入1?ml新鲜收集的病毒上清、上述剂量的相应细胞因子及8?μg/ml 鱼精蛋白(Sigma公司)。每24?h重复转染1次,连续3次后,离心去除培养上清,再加入原培养体系,培养48?h,收集细胞进行不同目的的培养及检测。
5.2 细胞因子+骨髓基质细胞支持的转染:将CD34+细胞按5×104/ml接种于铺有骨髓基质细胞的24孔板中,加入SCF,FL,IL-3等细胞因子,其余转染过程同上。
, http://www.100md.com
6 造血祖细胞耐药性检测 收集未转基因组、细胞因子(SCF+FL+IL-3)支持的转基因组及细胞因子+基质细胞支持的转基因组CD34+细胞,用甲基纤维素半固体集落培养法培养集落形成细胞(CFC),加入不同浓度的Taxol,每个样品种植3个孔,培养14天后计数CFC数。
7 Taxol作用下的转基因CD34+细胞的培养 收集细胞因子(SCF+FL+IL-3)支持的转基因组CD34+细胞接种于24孔板,在原液体培养体系中加入一定范围浓度的Taxol,37?℃孵箱培养1周,收集细胞进行检测。
8 转基因CD34+细胞mdr1基因表达产物P170及其功能的测定 用PE标记的抗P170单抗UIC-2(Immunotech 公司)标记细胞,然后用流式细胞术(FCM)检测P170阳性率。用罗丹明(Rh-123)排出试验[2]测定P170的功能。
, http://www.100md.com
结果
1 不同造血细胞因子组合作用下的转导效率 以各组相应的未转基因组细胞为对照,将细胞因子组合:①SCF+IL-3+IL-6;②SCF+IL-3+FL;③SCF+IL-3+IL-6+Tpo;④SCF+IL-3。在四组因子作用下转染的CD34+细胞,用FCM检测其mdr1基因表达产物P170,得出转导效率分别为12.1%、19.3%、12.3%、9.8%。其中以SCF+FL+IL-3组基因转导效率最高(与其它各组比较,P<0.01)。Rh-123排出试验也显示该组排出Rh-123的功能较强,其中有P170功能的细胞占15.2%。
2 骨髓基质细胞+细胞因子与单纯细胞因子作用下的转导效率及其转基因造血祖细胞对化疗耐受性的比较 对细胞因子(SCF+FL+IL-3)及同组细胞因子+骨髓基质细胞作用下的转基因CD34+细胞行Rh-123排出试验。根据有P170功能的细胞数得出其转导效率分别为15.2%、20.5%,差异有显著性(P<0.05)。在一定浓度范围的Taxol作用下,以未转基因组细胞为对照,细胞因子支持的转基因组及细胞因子+骨髓基质细胞支持的转基因组CD34+细胞形成的CFC结果见表1。当Taxol浓度为10?ng/ml时,细胞因子+基质细胞支持的转基因组形成的CFC数高于单纯细胞因子支持的转基因组,差异有显著性(P<0.05)。
, http://www.100md.com
3 Taxol对转基因CD34+细胞的作用 以未转基因CD34+细胞为对照,转基因CD34+细胞在含细胞因子SCF+FL+IL-3的液体培养体系中培养1周。用Rh-123排出试验检测P170功能,结果显示:当Taxol浓度为0,5,10?ng/ml时,其具有P170功能的细胞分别为15%、22.7%、38.5%,三者间差异有显著性(P<0.05)。但当Taxol浓度继续升至15?ng/ml以上时,转基因及未转基因组CD34+细胞多数死亡。
表1 转基因脐血CD34+细胞CFC产率
(集落/5000 CD34+细胞,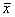 ±s) 组 别
±s) 组 别
, http://www.100md.com
Taxol(ng/ml)
0
5
10
未转基因组
65±3
19±1
2±1
转基因组
细胞因子
63±5
21±2
15±1
, http://www.100md.com
细胞因子+基质细胞
64±6
37±3
26±1
讨 论
1 造血细胞因子在基因转导过程中的作用 逆转录病毒载体介导的基因转移是进行基因治疗研究和临床应用的主要方法。逆转录病毒转染要求靶细胞处于增殖期,而造血干/祖细胞多处于静止期。只有通过增殖性刺激使其进入细胞周期,才有利于逆转录病毒的整合,而将目的基因导入其中。我们采用新型的逆转录病毒载体SF-mdr1,由脂质体介导将其导入包装细胞,收集包装细胞病毒上清,转染人CD34+细胞。转染前先用造血细胞因子预刺激,可促使造血干/祖细胞进入细胞周期,并使造血细胞表面逆转录病毒受体表达增加[3]。常用的细胞因子组合是SCF+IL-3+IL-6[4,5]。近年来的研究表明,细胞因子FL、Tpo能刺激原始的造血前体细胞的增殖[6,7]。我们比较了几种不同组合细胞因子对基因转导效率的影响。发现SCF+FL+IL-3预刺激组转导效率高于SCF+IL-3+IL-6组、SCF+IL-3+IL-6+Tpo组及SCF+IL-3组。
, 百拇医药
2 骨髓基质细胞在基因转导过程中的作用 有文献,表明单纯骨髓基质细胞支持的基因转导效率较低[8],故我们观察骨髓基质细胞+细胞因子支持下的基因转导效率,骨髓基质细胞以成纤维细胞为主。结果显示其支持的基因转导效率高于单纯细胞因子支持组,且在Taxol 10?ng/ml时,前者形成抗性CFC数多于后者。说明骨髓基质细胞层在基因转导过程中发挥十分重要的作用,其作用机制可能是:①基质细胞层中的细胞外基质成分对病毒颗粒有辅助定位的作用;②造血细胞通过与基质成分的附着而被激活;③基质细胞可产生细胞因子而发挥作用。
3 Taxol对基因转导细胞的影响 基因转导后2?d,CD34+细胞中具有P170功能的细胞为15.2%。在Taxol浓度为0,5,10?ng/ml时,体外培养7?d,具有P170功能的细胞分别为15%、22.7%、38.5%,但当Taxol浓度继续升高达15?ng/ml以上时,则转基因组与未转基因组细胞均不能耐受而死亡,这与Sorrentino等[9]在小鼠体内观察的结果相一致。表明:①基因转导后mdr1基因表达稳定;②在一定浓度范围内,Taxol对基因转导细胞有富集作用。在当前基因转导效率较低的情况下,通过药物筛选富集基因转导造血细胞,有可能为满足临床基因治疗的需要提供一个新的途径。
, 百拇医药
志谢:感谢空军总医院妇产科及解放军第三○四医院手术室提供标本
基金项目:卫生部科研基金资助项目(96-1-050)
参考文献
1,Pastan I, Gottesman MM.Multidrug resistance. Ann Rer Med,1991,42:277.
2,Hegewisch-Becker S,Hanania EG, Fu S, et al. Transduction of mdr1 into human and mouse hematopietic progenitor cell : use of rhodamine (Rh-123) to determine transduction frequency and in vivo selection. Br J Haematol ,1995,90:876-883.
, http://www.100md.com
3,Crooks GM, Kohn DB. Growth factors increase amphotropic retrovirus binding to human CD34+ bone marrow progenitor cells .Blood, 1993,83:3290-3297.
4,Veena P, Traycoff CM, Williams DA, et al. Delayed targeting of cytokine-nonre sponsive human bone marrow CD34+ cells with retrovirus-mediated gene transfer enhances transduction efficiency and long-term expression of transduced gene. Blood, 1998, 91:3693-3701.
, 百拇医药
5,Takiyama N,Mohney W,Swaney W, et al. Comparison of methods for retroviral mediated-transfer of glucocerebrosidase gene to CD34+ hematopoietic progenitor cells. Eur J Haematol, 1998, 61:1-6.
6,Shah AJ ,Smogorzewska EM, Hannum C ,et al .Flts ligand (FL) is a potent inducer of proliferation of highly quiescent human bone marrow CD34+ CD38- cells. Blood, 1995,86 Supple: 423a.
, 百拇医药
7,Yoshida M, Tsuji K, Ebihara Y, et al. Thrombopoietin alone stimulates the early proliferation and survival of human erythroid,myeloid and multipotential progenitors in serum-free culture. Br J Haematol,1997,98:254-264.
8,Xu LC,Stahl SK,Blanco M,et al.Growth factors and stromal support generate very efficient retroviral transduction of peripheral blood CD34+ cells from Gaucher patients. Blood, 1995,86:141-146.
9,Sorrentino BP ,Brandt SJ ,Bodine D, et al. Selection of drug-resistant bone marrow cells in vivo after retroviral transfer of human MDR1. Science, 1992,257:99-103.
(收稿日期:1999-06-21), 百拇医药
单位:童英 潘凌亚 杨秀玉(100730 中国医学科学院、中国协和医科大学北京协和医院妇产科);周生 吴英 毛宁(军事医学科学院基础医学研究所)
关键词:抗药性,多药;造血干细胞;基因转移;造血细胞生长因子;骨髓基质细胞
中华血液学杂志000502 【摘要】 目的 探讨逆转录病毒介导的多药耐药基因(mdr1)导入人CD34+细胞的影响因素,以提高基因转导效率。方法 用流式细胞术(FCM)检测不同组合细胞因子及人骨髓基质细胞+细胞因子支持的基因转导效率;用造血祖细胞集落培养观察耐药性;用FCM检测不同浓度紫杉醇素对基因转导细胞的作用。结果 细胞因子SCF+Flt配体(FL)+IL-3组合支持的基因转导效率高于其它组合(SCF+IL-6+IL-3,SCF+IL-6+IL-3+Tpo,SCF+IL-3)。骨髓基质细胞+细胞因子(SCF+FL+IL-3)支持的基因转导效率(20.5%)又高于单纯用该组细胞因子的转导效率(15.2%),并且前者形成的抗性集落形成细胞数多于后者。在10?ng/ml紫杉醇作用下基因转导CD34+细胞的阳性率可达38.5%。结论 骨髓基质细胞+细胞因子(SCF+FL+IL-3)对基因转导有较强的促进作用;一定浓度的紫杉醇具有富集基因转导细胞的作用。
, http://www.100md.com
Exploration of factors increasing transfer efficiency of retroviral mediated multidrug resistance gene (mdr1) into human CD34+ cells
TONG Ying*, PAN Lingya, ZHOU Sheng, et al.
(Peking Union Hospital, CAMS & PUMC, Beijing 100730,China)
【Abstract】 Objective To explore factors influencing transfer of retroviral mediated multidrug resistance gene (mdr1) into human CD34+ cells. Methods Transduction efficiency in the presence of different combinations of cytokines and human bone marrow stromal cells plus cytokines were determined by flow cytometry (FCM).Drug resistance was evaluated by plating yields of cultured hematopoietic progenitor cells. The effect of Taxol at different concentrations on mdr1 gene transfer cells was determined by FCM. Result Transduction efficiency in the presence of SCF+FL+IL-3 was higher than that in other combinations of cytokines(SCF+IL-6+IL-3,SCF+IL-6+IL-3+Tpo,SCF+IL-3). Transduction efficiency (20.5%) in the presence of bone marrow stromal cells plus cytokines(SCF+FL+IL-3) was higher than that (15.2%) without stromal cells, and the number of drug-resistant colony-forming cells was more in the former than in the latter. The percentage of CD34+ cell with the gene transduction at 10?ng/ml Taxol reached 38.5%. Conclusion Human bone marrow stromal cells plus cytokines (SCF+FL+IL-3) is more effective in enhancing mdr1 gene transduction. Taxol at a certain concentration can enrich mdr1 gene transferred cells.
, 百拇医药
【Key words】 Resistance, multidrug; Hematopoietic stem cell; Gene transfer; Bone marrow stromal cells; Hematopoietic cell growth factors
多药耐药基因(mdr1)编码相对分子质量为170×103的跨膜糖蛋白(P170),该蛋白作为依赖ATP能量的溢出泵,可将进入细胞内的多种药物如紫杉醇(商品名Taxol)、阿霉素等排出细胞外[1]。正常骨髓造血细胞P170表达量极低,将外源性mdr1基因导入其中,肿瘤化疗时可起到保护造血细胞的目的。提高基因转导效率是转基因治疗成功的关键。我们对影响逆转录病毒载体介导的mdr1基因导入人CD34+细胞的一些因素进行探讨,试图找出较适宜的转导条件,以提高转导效率,为造血细胞基因治疗打下基础。
材料和方法
, http://www.100md.com
1 包装细胞的建立及病毒上清的制备 用脂质体介导转染法,将含人全长mdr1 cDNA的重组逆转录病毒载体SF-mdr1(由德国Baum博士赠送)导入双嗜性包装细胞GP-envAM12,用60?ng/ml秋水仙素筛选获得抗性克隆。收集其培养上清,感染同样方法获得的单嗜性包装细胞GP-E86,收集GP-E86抗性克隆培养上清,再次感染GP-envAM12抗性克隆。用NIH3T3细胞测其病毒上清滴度为1.6×105 cfu/ml。将包装细胞培养到满瓶的80%,更换培养液,置32?℃培养24?h,收集病毒上清,用0.45?μm滤膜过滤后立即使用。
2 CD34+细胞的分离纯化 取正常足月妊娠脐血,用淋巴细胞分离液密度梯度离心分出单个核细胞,再按单克隆抗体(单抗)-免疫磁性分离系统说明书分离出CD34+细胞。磁性细胞分离仪和CD34+细胞分离试剂盒由Miltenyi Biotec公司提供。流式细胞仪测CD34+细胞纯度为80%~87%,抗体为标记了藻红蛋白(PE)的抗CD34单抗(Immunotech公司)。
, 百拇医药
3 骨髓基质细胞的制备 骨髓细胞取自胸外科手术切除的肋骨。用注射器冲出肋骨中的骨髓,稀释后用淋巴细胞分离液密度梯度离心分出单个核细胞。按9×106/ml细胞接种于培养瓶中,用长期培养液Myelocult H5100(Stem cell 公司) 和1×10-6mol/L的氢化考的松,在33?℃孵箱中培养4周,每周半量换液。经16?Gy 60 Co 射线照射,然后用2.5?g/L胰酶消化后收集细胞,以2.5×105细胞接种于24孔培养板中,待其贴壁后即可使用。
4 重组造血细胞因子 除SCF为Amgen公司产品,其余均由Peprotech公司提供。SCF 50?ng/ml、FL 50?ng/ml、IL-3 10?ng/ml、Tpo 10?ng/ml、IL-6 10?ng/ml。细胞因子分组为:①SCF+IL-3+IL-6;②SCF+IL-3+FL;③SCF+IL-3+IL-6+Tpo;④SCF+IL-3。
, 百拇医药
5 CD34+细胞体外转染
5.1 细胞因子支持的转染:将CD34+细胞按5×104/ml接种于24孔板,每孔1?ml培养体系。IMDM培养液(Gibco公司)中含有体积分数为15%的马血清、1×10-4mol/L 2-巯基乙醇、2?mmol/L L-谷氨酰胺、100?g/L牛血清白蛋白及不同分组的重组细胞因子,37?℃培养48?h。吸去0.5?ml培养液,加入1?ml新鲜收集的病毒上清、上述剂量的相应细胞因子及8?μg/ml 鱼精蛋白(Sigma公司)。每24?h重复转染1次,连续3次后,离心去除培养上清,再加入原培养体系,培养48?h,收集细胞进行不同目的的培养及检测。
5.2 细胞因子+骨髓基质细胞支持的转染:将CD34+细胞按5×104/ml接种于铺有骨髓基质细胞的24孔板中,加入SCF,FL,IL-3等细胞因子,其余转染过程同上。
, http://www.100md.com
6 造血祖细胞耐药性检测 收集未转基因组、细胞因子(SCF+FL+IL-3)支持的转基因组及细胞因子+基质细胞支持的转基因组CD34+细胞,用甲基纤维素半固体集落培养法培养集落形成细胞(CFC),加入不同浓度的Taxol,每个样品种植3个孔,培养14天后计数CFC数。
7 Taxol作用下的转基因CD34+细胞的培养 收集细胞因子(SCF+FL+IL-3)支持的转基因组CD34+细胞接种于24孔板,在原液体培养体系中加入一定范围浓度的Taxol,37?℃孵箱培养1周,收集细胞进行检测。
8 转基因CD34+细胞mdr1基因表达产物P170及其功能的测定 用PE标记的抗P170单抗UIC-2(Immunotech 公司)标记细胞,然后用流式细胞术(FCM)检测P170阳性率。用罗丹明(Rh-123)排出试验[2]测定P170的功能。
, http://www.100md.com
结果
1 不同造血细胞因子组合作用下的转导效率 以各组相应的未转基因组细胞为对照,将细胞因子组合:①SCF+IL-3+IL-6;②SCF+IL-3+FL;③SCF+IL-3+IL-6+Tpo;④SCF+IL-3。在四组因子作用下转染的CD34+细胞,用FCM检测其mdr1基因表达产物P170,得出转导效率分别为12.1%、19.3%、12.3%、9.8%。其中以SCF+FL+IL-3组基因转导效率最高(与其它各组比较,P<0.01)。Rh-123排出试验也显示该组排出Rh-123的功能较强,其中有P170功能的细胞占15.2%。
2 骨髓基质细胞+细胞因子与单纯细胞因子作用下的转导效率及其转基因造血祖细胞对化疗耐受性的比较 对细胞因子(SCF+FL+IL-3)及同组细胞因子+骨髓基质细胞作用下的转基因CD34+细胞行Rh-123排出试验。根据有P170功能的细胞数得出其转导效率分别为15.2%、20.5%,差异有显著性(P<0.05)。在一定浓度范围的Taxol作用下,以未转基因组细胞为对照,细胞因子支持的转基因组及细胞因子+骨髓基质细胞支持的转基因组CD34+细胞形成的CFC结果见表1。当Taxol浓度为10?ng/ml时,细胞因子+基质细胞支持的转基因组形成的CFC数高于单纯细胞因子支持的转基因组,差异有显著性(P<0.05)。
, http://www.100md.com
3 Taxol对转基因CD34+细胞的作用 以未转基因CD34+细胞为对照,转基因CD34+细胞在含细胞因子SCF+FL+IL-3的液体培养体系中培养1周。用Rh-123排出试验检测P170功能,结果显示:当Taxol浓度为0,5,10?ng/ml时,其具有P170功能的细胞分别为15%、22.7%、38.5%,三者间差异有显著性(P<0.05)。但当Taxol浓度继续升至15?ng/ml以上时,转基因及未转基因组CD34+细胞多数死亡。
表1 转基因脐血CD34+细胞CFC产率
(集落/5000 CD34+细胞,
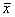 ±s) 组 别
±s) 组 别, http://www.100md.com
Taxol(ng/ml)
0
5
10
未转基因组
65±3
19±1
2±1
转基因组
细胞因子
63±5
21±2
15±1
, http://www.100md.com
细胞因子+基质细胞
64±6
37±3
26±1
讨 论
1 造血细胞因子在基因转导过程中的作用 逆转录病毒载体介导的基因转移是进行基因治疗研究和临床应用的主要方法。逆转录病毒转染要求靶细胞处于增殖期,而造血干/祖细胞多处于静止期。只有通过增殖性刺激使其进入细胞周期,才有利于逆转录病毒的整合,而将目的基因导入其中。我们采用新型的逆转录病毒载体SF-mdr1,由脂质体介导将其导入包装细胞,收集包装细胞病毒上清,转染人CD34+细胞。转染前先用造血细胞因子预刺激,可促使造血干/祖细胞进入细胞周期,并使造血细胞表面逆转录病毒受体表达增加[3]。常用的细胞因子组合是SCF+IL-3+IL-6[4,5]。近年来的研究表明,细胞因子FL、Tpo能刺激原始的造血前体细胞的增殖[6,7]。我们比较了几种不同组合细胞因子对基因转导效率的影响。发现SCF+FL+IL-3预刺激组转导效率高于SCF+IL-3+IL-6组、SCF+IL-3+IL-6+Tpo组及SCF+IL-3组。
, 百拇医药
2 骨髓基质细胞在基因转导过程中的作用 有文献,表明单纯骨髓基质细胞支持的基因转导效率较低[8],故我们观察骨髓基质细胞+细胞因子支持下的基因转导效率,骨髓基质细胞以成纤维细胞为主。结果显示其支持的基因转导效率高于单纯细胞因子支持组,且在Taxol 10?ng/ml时,前者形成抗性CFC数多于后者。说明骨髓基质细胞层在基因转导过程中发挥十分重要的作用,其作用机制可能是:①基质细胞层中的细胞外基质成分对病毒颗粒有辅助定位的作用;②造血细胞通过与基质成分的附着而被激活;③基质细胞可产生细胞因子而发挥作用。
3 Taxol对基因转导细胞的影响 基因转导后2?d,CD34+细胞中具有P170功能的细胞为15.2%。在Taxol浓度为0,5,10?ng/ml时,体外培养7?d,具有P170功能的细胞分别为15%、22.7%、38.5%,但当Taxol浓度继续升高达15?ng/ml以上时,则转基因组与未转基因组细胞均不能耐受而死亡,这与Sorrentino等[9]在小鼠体内观察的结果相一致。表明:①基因转导后mdr1基因表达稳定;②在一定浓度范围内,Taxol对基因转导细胞有富集作用。在当前基因转导效率较低的情况下,通过药物筛选富集基因转导造血细胞,有可能为满足临床基因治疗的需要提供一个新的途径。
, 百拇医药
志谢:感谢空军总医院妇产科及解放军第三○四医院手术室提供标本
基金项目:卫生部科研基金资助项目(96-1-050)
参考文献
1,Pastan I, Gottesman MM.Multidrug resistance. Ann Rer Med,1991,42:277.
2,Hegewisch-Becker S,Hanania EG, Fu S, et al. Transduction of mdr1 into human and mouse hematopietic progenitor cell : use of rhodamine (Rh-123) to determine transduction frequency and in vivo selection. Br J Haematol ,1995,90:876-883.
, http://www.100md.com
3,Crooks GM, Kohn DB. Growth factors increase amphotropic retrovirus binding to human CD34+ bone marrow progenitor cells .Blood, 1993,83:3290-3297.
4,Veena P, Traycoff CM, Williams DA, et al. Delayed targeting of cytokine-nonre sponsive human bone marrow CD34+ cells with retrovirus-mediated gene transfer enhances transduction efficiency and long-term expression of transduced gene. Blood, 1998, 91:3693-3701.
, 百拇医药
5,Takiyama N,Mohney W,Swaney W, et al. Comparison of methods for retroviral mediated-transfer of glucocerebrosidase gene to CD34+ hematopoietic progenitor cells. Eur J Haematol, 1998, 61:1-6.
6,Shah AJ ,Smogorzewska EM, Hannum C ,et al .Flts ligand (FL) is a potent inducer of proliferation of highly quiescent human bone marrow CD34+ CD38- cells. Blood, 1995,86 Supple: 423a.
, 百拇医药
7,Yoshida M, Tsuji K, Ebihara Y, et al. Thrombopoietin alone stimulates the early proliferation and survival of human erythroid,myeloid and multipotential progenitors in serum-free culture. Br J Haematol,1997,98:254-264.
8,Xu LC,Stahl SK,Blanco M,et al.Growth factors and stromal support generate very efficient retroviral transduction of peripheral blood CD34+ cells from Gaucher patients. Blood, 1995,86:141-146.
9,Sorrentino BP ,Brandt SJ ,Bodine D, et al. Selection of drug-resistant bone marrow cells in vivo after retroviral transfer of human MDR1. Science, 1992,257:99-103.
(收稿日期:1999-06-21), 百拇医药