甲胎蛋白启动子调控表达p53基因的肝癌细胞靶向性基因治疗载体的研究
作者:程纪华 冷希圣 彭吉润 何湘君 蔡胜利 张佑彬 王申五 杜如昱
单位:程纪华(北京医科大学人民医院普外科 100044);冷希圣(北京医科大学人民医院普外科 100044);彭吉润(北京医科大学人民医院普外科 100044);蔡胜利(北京医科大学人民医院普外科 100044);张佑彬(北京医科大学人民医院普外科 100044);杜如昱(北京医科大学人民医院普外科 100044);何湘君(中心实验室);王申五(中心实验室)
关键词:腺相关病毒;甲胎蛋白;启动子;基因治疗
中华医学杂志000625 【摘要】 目的 利用含有人甲胎蛋白启动子的腺相关病毒载体,构建能在人肝癌细胞株中特异表达目的基因的质粒。方法 通过设计含有特定酶切位点的引物,选择性地从人基因组中扩增出人甲胎蛋白启动子(AFP promoter)序列并克隆到含有绿色荧光蛋白(GFP)报告基因的质粒pTR-UF5上, 构建成含报告基因的重组腺相关病毒质粒rAAV-AFP-GFP;再通过平端连接的方法,构建成含 p53 基因的质粒 rAAV-AFP-53。通过用rAAV-AFP-GFP转染表达AFP的Hep G2细胞株和不表达AFP的293细胞株,以检测AFP启动子的功能。rAAV-AFP-53转染HLE肝癌细胞株后,用流式细胞分析检测对细胞周期的影响。结果 rAAV-AFP-GFP和经测序、酶切鉴定证实为含有人AFP启动子的质粒。细胞转染表明rAAV-AFP-GFP能特异地在AFP阳性细胞中高效表达目的基因(质粒转染效率为36.5%);rAAV-AFP-53使HLE的凋亡率达到73.88%。结论 成功构建了以腺相关病毒为载体、受人AFP启动子调控表达人野生型p53基因和报告基因的质粒。前者具有特异性促肝癌细胞凋亡的作用。
, 百拇医药
Construction of a hepatoma-targeting vector of adeno-associated virus containing human alpha-fetoprotein promoter and wild p53 gene in gene therapy of liver cancer
CHENG Jihua LENG Xisheng PENG Jirun et al
(Department of Surgery, People's Hospital, Beijng Medical University, Beijing 100044, China)
【Abstract】 Objective To construct plasmids that express target genes in hepatoma cell line using adeno-associated virus (AAV)vectors containing human AFP promoter. Methods Primers containing specific enzyme-cutting sites were designed to amplify the alpha-fetoprotein promoter(AFP promoter) from human genome. The promoter was cloned into pTR-UF5, a plasmid containing GFP reporter gene,resulting in the recombinant AAV plasmid containing the reporter gene (rAAV-AFP-GFP). Blunted ligation was used to construct the recombinant AAV vector plasmid containing human wild p53 gene (rAAV-AFP-53). The plasmid rAAV-AFP-GFP was used to transfect the AFP-expressing Hep G2 and non-AFP-expressing 293 cell lines, respectively, to measure the function of the cloned AFP promoter. Flow cytometry was used to measure the effect of rAAV-AFP-53 on hepatoma cell line HLE. Results rAAV-AFP-53 and rAAV-AFP-GFP were verified by DNA sequencing and enzyme digestion to carry human AFP promoter. Cell transfection of rAAV-AFP-GFP showed selective expression in AFP-positive hepatoma cell lines with a transfection rate of 36.5%; rAAV-AFP-53 induced apoptosis rate was 73.88%. Conclusion Two adeno-associated virus plasmids are successfully constructed that carry p53 gene and reporter gene, respectively, guided by AFP promoter. The former one showes a hepatoma-specific apoptosis-inducing effect.
, 百拇医药
【Key words】 Adeno-Associated viruses; Alpha-fetoprotein; Promoter region (Genetics); Gene therapy
近年来已经有很多病毒载体应用于肝癌的基因治疗,但针对肝癌细胞的特异性不高[1]。我们在国内首次克隆了人甲胎蛋白启动子(AFP promoter )并构建了受 AFP启动子调控的表达目的基因的重组腺相关病毒载体,探讨解决治疗特异性的问题。
材料与方法
一、材料
1.质粒和细胞: 质粒pCMV-Neo-Bam含有人野生型p53基因[2];质粒pTR-UF含有受巨细胞病毒启动子控制的拟人化的绿色荧光蛋白基因(GFP),其骨架为腺相关病毒的倒转重复序列(ITR)结构[3]。
, http://www.100md.com
2.主要试剂: DNA平端连接试剂盒购自美国MBI公司;真核细胞转染试剂FuGENE 6购自美国Boehringer Mannheim公司;内切酶等购自美国Promega公司。
二、方法
1.扩增及克隆AFP启动子的引物设计:根据人AFP基因图谱和启动子图谱[4]设计引物并在上、下游引物5′端分别加入限制性内切酶Kpn Ⅰ和Xba Ⅰ位点。引物序列为:上游5′-GGGGTA-CCCCTGAGGAGAATATTTGTTA-3′;下游:5′-GCTCTAGAGCTGTTATTGGCAGTGGTGG-3′。
2.AFP启动子的扩增:采用50 μl体系。 基因组DNA取自AFP(+)患者手术切除标本,以1 μg为模板;Taq酶1.2 U;上下游引物各50 pmol/L;dNTPs 10 nmol/L。采用热启动法,97℃,7 min后加入Taq酶。94℃, 45 s; 50℃, 60 s; 72℃, 60 s。35个循环后, 72℃延伸7 min。PCR扩增产物为289 bp,纯化后进行双向测序。
, 百拇医药
3.报告基因重组质粒rAAV-AFP-GFP启动子的构建:PCR产物在Wizard DNA Clean-Up System纯化后作Kpn Ⅰ和Xba Ⅰ双酶切(图1)。0.8%琼脂糖凝胶分离出含绿色荧光蛋白基因的5.7 kb载体片断,Wizard柱纯化,定量。AFP启动子与pTR-UF5片断的摩尔数之比为6∶1 ,在10 μl体系中进行连接反应。产物1 μl转化DH-5α菌株,对氨苄抗性菌落进行酶切筛选得到重组质粒rAAV-AFP-GFP。其结构如图1。
4.p53基因重组质粒rAAV-AFP-53的构建:质粒pCMV-Neo-Bam用BamH Ⅰ切下1.8 kb的p53 cDNA片段;质粒rAAV-AFP-GFP用内切酶Sac Ⅱ切除GFP片段,仅保留其载体部分。两者按1∶1的摩尔比,遵照MBI平端连接试剂盒说明书在10 μl体系中进行连接,反应条件:T4 DNA连接酶1.5 U,dNTPs 1 μl (2 mmol/L),p53 cDNA 1 μl(2.4 μg),载体片段1 μl(2.7 μg)。16℃连接过夜。连接产物5 μl转化大肠杆菌DH-5α,用Kpn Ⅰ+ Sma Ⅰ酶后通过0.8%琼脂糖凝胶分离鉴定出p53基因方向与AFP启动子方向相同的克隆。即为p53基因重组AAV载体。
, 百拇医药
5.AFP启动子功能检测:应用3 μl FuGENE 6,将含报告基因GFP的质粒rAAV-AFP-GFP 1.2 μg分别转染人肝癌细胞株Hep G2(2×106)和作为对照的293细胞,转染48 h后在Olympus PM30型倒置相差荧光显微镜下观察(激发波长为450 nm±20 nm),记数30个400倍视野内表达GFP的细胞数所占总数的百分比用以评价其转染效率。
6.重组p53质粒功能检测:应用3 μl FuGENE6,将rAAV-AFP-53质粒转染p53基因突变型人肝癌细胞株HLE,转染后48、72、96 h进行碘化吡啶染色后在美国Becton Dickinson公司的FACSort流式细胞仪上检测细胞周期[5]。
首先用AFP启动子取代质粒pTR-UF5中的CMV启动子,得到rAAV-AFP-GFP;再从pCMV-NEO-BAM切下p53基因,用平端连接的方法取代rAAV-AFP-GFP中的GFP基因,构建成rAAV-AFP-53
, http://www.100md.com
图1 质粒rAAV-AFP-GFP和rAAV-AFP-53的构建过程
结果
1.质粒构建过程见图1,rAAV-AFP-53和rAAV-AFP-GFP分别为p53 基因和GFP报告基因的AAV重组质粒。
2.所有重组质粒均经酶切鉴定结果见图2。
3.在Olympus倒置荧光显微镜下观察,转染rAAV-AFP-GFP质粒的Hep G2细胞可见荧光,其转染效率约为36.5%;而293细胞则未见任何荧光表达(图3)。这表明AFP启动子可以特异性地启动它后面的目的基因在AFP阳性的细胞中高效表达。
4.重组p53质粒转染HLE细胞株72h后出现亚二倍体的凋亡峰,凋亡百分比为73.88%(图4)。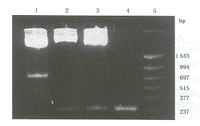
, http://www.100md.com
Line 1.质粒pTR-UF5被Kpn I+Xba I双酶酶切为600 bp的CMV启动子片段;Line 2.质粒rAAV-AFP-53被Kpn I+Xba I双酶酶切为300 bp的AFP启动子片段;Line 3.质粒rAAV-AFP-GFP被Kpn I+Xba I双酶酶切为300 bp的AFP启动子片段;Line 4.PCR产物5 μl;Line 5.PCR marker
图2 AFP启动子克隆的酶切鉴定(2%琼脂糖电泳)
Hep G2细胞中可以检测到荧光而293细胞中检测不到(激发波长450 nm±20 nm,×100倍)
图3 重组质粒rAAV-AFP-GFP转染Hep G2细胞(上图)和
293细胞(下图)
, http://www.100md.com
讨论
为了达到对肝癌细胞的特异杀伤作用,以往研究曾尝试了AFP的许多调控元件。有研究证明大鼠AFP启动子/增强子序列可以在人肝癌细胞株中启动目的基因的表达;但其序列长达7.6 kb,不适合AAV载体系统。Aldo等[4]后来证实,300 bp的人AFP启动子序列已足以在人、大鼠细胞中启动目的基因的表达,应用含这种启动子的逆转录病毒载体在AFP阳性的肝癌细胞株中取得了高效特异表达自杀基因的效果。
本研究结果显示,外源性AFP启动子和内源性AFP启动子一样,可起到使目的基因在AFP阳性的细胞中特异表达的作用,但由于不含增强子序列,它的活性较温和,不至于对也分泌AFP的肝脏干细胞产生太大毒性,有利于体内转基因治疗的进行[4]。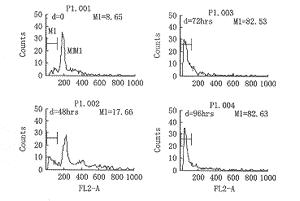
图4 rAAV-AFP-53转染肝癌细胞株HLE后对细胞周期的
, 百拇医药
影响,可见转染后72 h出现细胞凋亡峰,凋亡百分比为73.88
我们所构建的AAV载体系统采用了一种新型的基因治疗报告基因-拟人化的绿色荧光蛋白基因(humanized GFP)。这种基因是由水母的GFP基因改造而来[3]。这种新型报告基因的采用,对于将来病毒滴度及其转染效率的检测都提供了很大的方便。
通过转染Hep G2细胞和293细胞,证实所克隆的AFP启动子能够特异性地启动目的基因在AFP阳性细胞中高效表达,这为将来应用重组腺相关病毒进行肝癌的特异性体内促凋亡研究奠定了基础。
所构建的含有人野生型p53基因的重组腺相关病毒质粒转染肝癌细胞株HLE后,能够明显促进此细胞株的凋亡,凋亡百分比为73.88%。和Kock H的报告相比,这一效率也是很高的[6]。表明该质粒是受AFP启动子调控特异性表达促凋亡基因的质粒。有关载体滴度的测定和外源p53基因转染后表达的检测,仍有待于进一步的研究。
, 百拇医药
参考文献
1,Carroll NM, Tanabe KK. Gene therapy for liver tumors. Surg Oncol Clin N Am ,1998, 7: 617-626.
2,uzanne JB, Sanford M, Eric RF, et al. Suppression of human colorectal carcinoma cells growth by wide-type p53. Science, 1990,249:912-915.
3,Sergei Z, Mark P, William WH, et al. A 'humanized' green fluorescent protein cDNA adapted for high level expression in mammalian cells. J Virol, 1996,70: 4646-4654.
, 百拇医药
4,Aldo I, Keisuke N, Yuji K, et al. Gene therapy for hepatoma cells using a retrovirus vector carrying Hepes Simplex virus thymitidine kinase gene under the control of human α-fetoprotein promoter. Cancer Res, 1995,55:3105-3149.
5,Huschtscha LI, Jeitner TM, Andersson CE, et al. Identification of apoptotic and necrotic human leukemic cells by flow cytometry. Exp Cell Res, 1994, 212:161-165.
6,Kock H, Harris MP, Anderson SC, et al. Adenovirus-mediated p53 gene transfer suppresses growth of human glioblastoma cells in vitro and in vivo. Int J Cancer, 1996,67:808-815.
(收稿日期:1999-07-07)
, 百拇医药
单位:程纪华(北京医科大学人民医院普外科 100044);冷希圣(北京医科大学人民医院普外科 100044);彭吉润(北京医科大学人民医院普外科 100044);蔡胜利(北京医科大学人民医院普外科 100044);张佑彬(北京医科大学人民医院普外科 100044);杜如昱(北京医科大学人民医院普外科 100044);何湘君(中心实验室);王申五(中心实验室)
关键词:腺相关病毒;甲胎蛋白;启动子;基因治疗
中华医学杂志000625 【摘要】 目的 利用含有人甲胎蛋白启动子的腺相关病毒载体,构建能在人肝癌细胞株中特异表达目的基因的质粒。方法 通过设计含有特定酶切位点的引物,选择性地从人基因组中扩增出人甲胎蛋白启动子(AFP promoter)序列并克隆到含有绿色荧光蛋白(GFP)报告基因的质粒pTR-UF5上, 构建成含报告基因的重组腺相关病毒质粒rAAV-AFP-GFP;再通过平端连接的方法,构建成含 p53 基因的质粒 rAAV-AFP-53。通过用rAAV-AFP-GFP转染表达AFP的Hep G2细胞株和不表达AFP的293细胞株,以检测AFP启动子的功能。rAAV-AFP-53转染HLE肝癌细胞株后,用流式细胞分析检测对细胞周期的影响。结果 rAAV-AFP-GFP和经测序、酶切鉴定证实为含有人AFP启动子的质粒。细胞转染表明rAAV-AFP-GFP能特异地在AFP阳性细胞中高效表达目的基因(质粒转染效率为36.5%);rAAV-AFP-53使HLE的凋亡率达到73.88%。结论 成功构建了以腺相关病毒为载体、受人AFP启动子调控表达人野生型p53基因和报告基因的质粒。前者具有特异性促肝癌细胞凋亡的作用。
, 百拇医药
Construction of a hepatoma-targeting vector of adeno-associated virus containing human alpha-fetoprotein promoter and wild p53 gene in gene therapy of liver cancer
CHENG Jihua LENG Xisheng PENG Jirun et al
(Department of Surgery, People's Hospital, Beijng Medical University, Beijing 100044, China)
【Abstract】 Objective To construct plasmids that express target genes in hepatoma cell line using adeno-associated virus (AAV)vectors containing human AFP promoter. Methods Primers containing specific enzyme-cutting sites were designed to amplify the alpha-fetoprotein promoter(AFP promoter) from human genome. The promoter was cloned into pTR-UF5, a plasmid containing GFP reporter gene,resulting in the recombinant AAV plasmid containing the reporter gene (rAAV-AFP-GFP). Blunted ligation was used to construct the recombinant AAV vector plasmid containing human wild p53 gene (rAAV-AFP-53). The plasmid rAAV-AFP-GFP was used to transfect the AFP-expressing Hep G2 and non-AFP-expressing 293 cell lines, respectively, to measure the function of the cloned AFP promoter. Flow cytometry was used to measure the effect of rAAV-AFP-53 on hepatoma cell line HLE. Results rAAV-AFP-53 and rAAV-AFP-GFP were verified by DNA sequencing and enzyme digestion to carry human AFP promoter. Cell transfection of rAAV-AFP-GFP showed selective expression in AFP-positive hepatoma cell lines with a transfection rate of 36.5%; rAAV-AFP-53 induced apoptosis rate was 73.88%. Conclusion Two adeno-associated virus plasmids are successfully constructed that carry p53 gene and reporter gene, respectively, guided by AFP promoter. The former one showes a hepatoma-specific apoptosis-inducing effect.
, 百拇医药
【Key words】 Adeno-Associated viruses; Alpha-fetoprotein; Promoter region (Genetics); Gene therapy
近年来已经有很多病毒载体应用于肝癌的基因治疗,但针对肝癌细胞的特异性不高[1]。我们在国内首次克隆了人甲胎蛋白启动子(AFP promoter )并构建了受 AFP启动子调控的表达目的基因的重组腺相关病毒载体,探讨解决治疗特异性的问题。
材料与方法
一、材料
1.质粒和细胞: 质粒pCMV-Neo-Bam含有人野生型p53基因[2];质粒pTR-UF含有受巨细胞病毒启动子控制的拟人化的绿色荧光蛋白基因(GFP),其骨架为腺相关病毒的倒转重复序列(ITR)结构[3]。
, http://www.100md.com
2.主要试剂: DNA平端连接试剂盒购自美国MBI公司;真核细胞转染试剂FuGENE 6购自美国Boehringer Mannheim公司;内切酶等购自美国Promega公司。
二、方法
1.扩增及克隆AFP启动子的引物设计:根据人AFP基因图谱和启动子图谱[4]设计引物并在上、下游引物5′端分别加入限制性内切酶Kpn Ⅰ和Xba Ⅰ位点。引物序列为:上游5′-GGGGTA-CCCCTGAGGAGAATATTTGTTA-3′;下游:5′-GCTCTAGAGCTGTTATTGGCAGTGGTGG-3′。
2.AFP启动子的扩增:采用50 μl体系。 基因组DNA取自AFP(+)患者手术切除标本,以1 μg为模板;Taq酶1.2 U;上下游引物各50 pmol/L;dNTPs 10 nmol/L。采用热启动法,97℃,7 min后加入Taq酶。94℃, 45 s; 50℃, 60 s; 72℃, 60 s。35个循环后, 72℃延伸7 min。PCR扩增产物为289 bp,纯化后进行双向测序。
, 百拇医药
3.报告基因重组质粒rAAV-AFP-GFP启动子的构建:PCR产物在Wizard DNA Clean-Up System纯化后作Kpn Ⅰ和Xba Ⅰ双酶切(图1)。0.8%琼脂糖凝胶分离出含绿色荧光蛋白基因的5.7 kb载体片断,Wizard柱纯化,定量。AFP启动子与pTR-UF5片断的摩尔数之比为6∶1 ,在10 μl体系中进行连接反应。产物1 μl转化DH-5α菌株,对氨苄抗性菌落进行酶切筛选得到重组质粒rAAV-AFP-GFP。其结构如图1。
4.p53基因重组质粒rAAV-AFP-53的构建:质粒pCMV-Neo-Bam用BamH Ⅰ切下1.8 kb的p53 cDNA片段;质粒rAAV-AFP-GFP用内切酶Sac Ⅱ切除GFP片段,仅保留其载体部分。两者按1∶1的摩尔比,遵照MBI平端连接试剂盒说明书在10 μl体系中进行连接,反应条件:T4 DNA连接酶1.5 U,dNTPs 1 μl (2 mmol/L),p53 cDNA 1 μl(2.4 μg),载体片段1 μl(2.7 μg)。16℃连接过夜。连接产物5 μl转化大肠杆菌DH-5α,用Kpn Ⅰ+ Sma Ⅰ酶后通过0.8%琼脂糖凝胶分离鉴定出p53基因方向与AFP启动子方向相同的克隆。即为p53基因重组AAV载体。
, 百拇医药
5.AFP启动子功能检测:应用3 μl FuGENE 6,将含报告基因GFP的质粒rAAV-AFP-GFP 1.2 μg分别转染人肝癌细胞株Hep G2(2×106)和作为对照的293细胞,转染48 h后在Olympus PM30型倒置相差荧光显微镜下观察(激发波长为450 nm±20 nm),记数30个400倍视野内表达GFP的细胞数所占总数的百分比用以评价其转染效率。
6.重组p53质粒功能检测:应用3 μl FuGENE6,将rAAV-AFP-53质粒转染p53基因突变型人肝癌细胞株HLE,转染后48、72、96 h进行碘化吡啶染色后在美国Becton Dickinson公司的FACSort流式细胞仪上检测细胞周期[5]。

首先用AFP启动子取代质粒pTR-UF5中的CMV启动子,得到rAAV-AFP-GFP;再从pCMV-NEO-BAM切下p53基因,用平端连接的方法取代rAAV-AFP-GFP中的GFP基因,构建成rAAV-AFP-53
, http://www.100md.com
图1 质粒rAAV-AFP-GFP和rAAV-AFP-53的构建过程
结果
1.质粒构建过程见图1,rAAV-AFP-53和rAAV-AFP-GFP分别为p53 基因和GFP报告基因的AAV重组质粒。
2.所有重组质粒均经酶切鉴定结果见图2。
3.在Olympus倒置荧光显微镜下观察,转染rAAV-AFP-GFP质粒的Hep G2细胞可见荧光,其转染效率约为36.5%;而293细胞则未见任何荧光表达(图3)。这表明AFP启动子可以特异性地启动它后面的目的基因在AFP阳性的细胞中高效表达。
4.重组p53质粒转染HLE细胞株72h后出现亚二倍体的凋亡峰,凋亡百分比为73.88%(图4)。

, http://www.100md.com
Line 1.质粒pTR-UF5被Kpn I+Xba I双酶酶切为600 bp的CMV启动子片段;Line 2.质粒rAAV-AFP-53被Kpn I+Xba I双酶酶切为300 bp的AFP启动子片段;Line 3.质粒rAAV-AFP-GFP被Kpn I+Xba I双酶酶切为300 bp的AFP启动子片段;Line 4.PCR产物5 μl;Line 5.PCR marker
图2 AFP启动子克隆的酶切鉴定(2%琼脂糖电泳)

Hep G2细胞中可以检测到荧光而293细胞中检测不到(激发波长450 nm±20 nm,×100倍)
图3 重组质粒rAAV-AFP-GFP转染Hep G2细胞(上图)和
293细胞(下图)
, http://www.100md.com
讨论
为了达到对肝癌细胞的特异杀伤作用,以往研究曾尝试了AFP的许多调控元件。有研究证明大鼠AFP启动子/增强子序列可以在人肝癌细胞株中启动目的基因的表达;但其序列长达7.6 kb,不适合AAV载体系统。Aldo等[4]后来证实,300 bp的人AFP启动子序列已足以在人、大鼠细胞中启动目的基因的表达,应用含这种启动子的逆转录病毒载体在AFP阳性的肝癌细胞株中取得了高效特异表达自杀基因的效果。
本研究结果显示,外源性AFP启动子和内源性AFP启动子一样,可起到使目的基因在AFP阳性的细胞中特异表达的作用,但由于不含增强子序列,它的活性较温和,不至于对也分泌AFP的肝脏干细胞产生太大毒性,有利于体内转基因治疗的进行[4]。

图4 rAAV-AFP-53转染肝癌细胞株HLE后对细胞周期的
, 百拇医药
影响,可见转染后72 h出现细胞凋亡峰,凋亡百分比为73.88
我们所构建的AAV载体系统采用了一种新型的基因治疗报告基因-拟人化的绿色荧光蛋白基因(humanized GFP)。这种基因是由水母的GFP基因改造而来[3]。这种新型报告基因的采用,对于将来病毒滴度及其转染效率的检测都提供了很大的方便。
通过转染Hep G2细胞和293细胞,证实所克隆的AFP启动子能够特异性地启动目的基因在AFP阳性细胞中高效表达,这为将来应用重组腺相关病毒进行肝癌的特异性体内促凋亡研究奠定了基础。
所构建的含有人野生型p53基因的重组腺相关病毒质粒转染肝癌细胞株HLE后,能够明显促进此细胞株的凋亡,凋亡百分比为73.88%。和Kock H的报告相比,这一效率也是很高的[6]。表明该质粒是受AFP启动子调控特异性表达促凋亡基因的质粒。有关载体滴度的测定和外源p53基因转染后表达的检测,仍有待于进一步的研究。
, 百拇医药
参考文献
1,Carroll NM, Tanabe KK. Gene therapy for liver tumors. Surg Oncol Clin N Am ,1998, 7: 617-626.
2,uzanne JB, Sanford M, Eric RF, et al. Suppression of human colorectal carcinoma cells growth by wide-type p53. Science, 1990,249:912-915.
3,Sergei Z, Mark P, William WH, et al. A 'humanized' green fluorescent protein cDNA adapted for high level expression in mammalian cells. J Virol, 1996,70: 4646-4654.
, 百拇医药
4,Aldo I, Keisuke N, Yuji K, et al. Gene therapy for hepatoma cells using a retrovirus vector carrying Hepes Simplex virus thymitidine kinase gene under the control of human α-fetoprotein promoter. Cancer Res, 1995,55:3105-3149.
5,Huschtscha LI, Jeitner TM, Andersson CE, et al. Identification of apoptotic and necrotic human leukemic cells by flow cytometry. Exp Cell Res, 1994, 212:161-165.
6,Kock H, Harris MP, Anderson SC, et al. Adenovirus-mediated p53 gene transfer suppresses growth of human glioblastoma cells in vitro and in vivo. Int J Cancer, 1996,67:808-815.
(收稿日期:1999-07-07)
, 百拇医药