GM1在流体冲击致大鼠脑损伤后的保护作用观察
作者:卓豫 姚一
单位:卓豫(第三军医大学附属大坪医院野战外科研究所第五研究室,重庆 400042);姚一(解放军第174医院外三科,厦门 361003)
关键词:GM1;流体冲击;脑损伤;大鼠
第三军医大学学报000622 提 要: 目的 评价单唾液酸西己糖神经糖甙脂钠盐(Monosialotetrahexosylganglioside,GM1)在流体冲击致大鼠脑损伤(Fluid-percussion brain injury,FPBI)后急性期对大脑的保护作用,以期为脑损伤的临床治疗提供实验依据。方法 流体冲击致大鼠闭合型脑损伤后,用干湿法测定脑组织水含量、氢清除法观测局部脑血流量(rCBF)的改变,以及病理改变。结果 大鼠脑损伤后GM1能显著降低伤后水含量的升高;伤后rCBF未见明显降低,同时病理学检查GM1明显减轻病理学改变。结论 早期应用GM1能有效地阻止rCBF的缺血/再灌流变化,改善脑组织血供从而有效阻止脑水肿、神经元变性、坏死的发生。
, http://www.100md.com
中图法分类号: R651.15;R977.6 文献标识码: A
文章编号:1000-5404(2000)06-0585-03
Protective effect of monosialotetrahexosylganglioside on fluid-percussion brain injury in rats
ZHUO Yu, YAO Yi
(Research Institute of Field Surgery, Daping Hospital, Third Military Medical University, Chongqing 400042, China)
Abstract: Objective To evaluate the protective effect of monosialotetrahexosylganglioside (GM1) on the acute stage of fluid-percussion brain injury (FPBI) in rats to provide experimental basis for the clinical treatment. Methods After the establishment of rat model of FPBI, the water content of brain tissues was detected with dry-wet method and regional cerebral blood flow (rCBF) was measured with H2 elimination method. Pathological changes of the brain were observed with light microscope. Results GM1 significantly inhibited the elevation of the water content in the brain and showed no effect on the rCBF after FPBI. Meanwhile, GM1 significantly ameliorated the pathological manifestation of the brains. Conclusion Early administration of GM1 can prevent ischemia/reperfusion damages of rCBF, improve cerebral blood supply and reduce cerebral edema, denaturation and necrosis of the neurons after fluid-percussion brain injury in rats.
, http://www.100md.com
Key words: monosialotetrahexosylganglioside; fluid-percussion; brain injury; rat
颅脑损伤是如今临床最常见的致病与死亡原因之一,其继发性损伤产生一系列病理改变。单唾液酸西己糖神经糖甙脂钠盐(Monosialotetrahexosylganglioside,GM1)是哺乳动物大脑中主要的神经节苷脂之一,近年来人们发现外源性给予GM1,在体内早期可透过血脑屏障(Blood brain barrier,BBB), 嵌入细胞膜, 起着保护神经细胞膜的作用,纠正离子失衡,降低脑水肿[1]。本实验就GM1对脑损伤早期保护作用的可能机制进行了探讨,为其临床应用提供实验依据。
1 材料与方法
1.1 模型建立和动物分组 成年Wistar大鼠,20%乌拉坦20 mg/kg腹腔注射麻醉,常规消毒后,纵向切开头皮、暴露颅骨,在AP-3 mm、矢状缝左侧旁开2 mm处,用牙科钻钻一直径5 mm的小孔,保持硬脑膜完整,再行气管插管术,将大鼠固定于流体冲击装置的立体定位仪上,把冲击头垂直安装在小孔内,其周边以牙托粉密封。流体冲击装置中注入37°C生理盐水并排出气泡。调整重锤的大小及高度使重锤从恒定角度下落,打击储水池一端的橡皮垫,液体经过冲击头被快速注入颅腔,引起脑损伤。压力传感-计算机检测系统同时检测压力波形,并计算波幅、波宽[2]。
, http://www.100md.com
大鼠随机分为伤前组、损伤组、生理盐水组和GM1治疗组。GM1治疗组于伤后立即腹腔注射30 mg/kg GM1(由巴西TRB PHARMA药厂生产),生理盐水组伤后立即给予等量生理盐水腹腔注射。其中伤前组10只,分别测定脑组织水含量及海马血流量;后3组均观察伤后0.5、1、2、3、6、24、48 h 7个时相点,每个时相点10只,观察内容同伤前组;伤前组及损伤组、GM1组伤后5、6、24、48 h观察病理改变,每个时相点2只动物。
1.2 脑组织水含量的测定
分别取各时相点6个部位脑组织进行测定,即:双侧海马,双侧额叶,损伤区顶叶和对侧相应部位的顶叶。用干湿法测定脑组织含水量。
1.3 海马血流量的测定
测定该指标的所有动物除左侧做钻颅术外,还需在右侧对应颅骨另做直径1mm的颅骨孔(打击时用牙托粉封闭),应用末梢循环仪(日本)检测海马血流量。
, http://www.100md.com
1.4 病理观察 常规灌注固定切片,HE、尼氏染色,光镜下观察。
1.5 统计学处理 数据结果以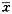 ±s表示,采用方差分析、t检验。
±s表示,采用方差分析、t检验。
2 结果
2.1 脑组织含水量变化 大鼠FPBI后检测的6个部位水含量变化趋势基本一致,即0.5h显著升高,伤后24h达到高峰,致48h仍显著高于伤前。GM1治疗组各时相点的各部位间水含量差异不显著,与假手术组(伤前)相比差异不显著,与损伤组和生理盐水组相比差异显著(P<0.05),见表1。
表1 各组大鼠左侧三部位水含量比较[ω(H2O)/%,n=10]
Tab 1 Water content compare in the three sites of the left in each groups of the rat[ω(H2O)/%,n=10]
, 百拇医药
Left frontal lobe
Left parietal lobe
Left hippocampus
Pre-injury
Injury
NS
GM1
Pre-injury
Injury
NS
GM1
Pre-injury
, 百拇医药
Injury
NS
GM1
0 h
77.1±0.59
77.0±1.19
76.6±1.25
0.5 h
80.0±0.40&
80.2±0.53&
77.9±9.55# *
, 百拇医药
79.8±0.63&
80.1±0.15&
77.9±0.65# *
80.4±0.14&
80.7±0.47&
76.6±0.58# *
1 h
80.2±0.15&
80.5±0.87&
, http://www.100md.com
77.4±0.61# *
80.9±0.377
80.2±0.20&
77.6±0.37# *
80.3±0.31&
80.4±0.81&
77.8±0.37# *
2 h
80.8±0.32&
, 百拇医药
81.3±0.56&
78.2±1.17# *
80.3±0.24&
80.7±0.17&
76.8±0.39# *
80.6±0.07&
80.6±0.72&
77.1±1.06# *
3 h
, 百拇医药
80.9±0.40&
81.5±0.85&
77.7±0.43# *
81.0±0.85&
81.1±0.48&
76.8±0.54# *
80.8±0.17&
80.9±0.37&
76.2±1.08# *
, http://www.100md.com
6 h
81.3±0.11&
81.9±0.71&
76.6±0.46# *
81.4±0.8&
81.6±0.19&
76.4±0.62# *
81.4±0.11&
81.4±0.44&
, 百拇医药
77.5±0.41# *
24 h
82.4±1.23&
82.8±0.37&
77.7±0.27# *
82.2±0.81&
82.1±0.25&
77.6±0.48# *
81.9±0.60&
, http://www.100md.com
82.7±0.63&
77.2±0.28# *
48 h
81.4±0.17&
81.5±0.63&
77.5±0.48# *
781.4±1.14&
81.8±0.46&
76.5±1.89# *
, http://www.100md.com
81.5±0.84&
81.6±0.80&
77.1±0.86# *
#:P<0.05 vs injury;*:P<0.05 vs NS;&:P<0.05 vs pre-injury
2.2 脑损伤后血流量变化趋势
大鼠脑损伤后,双侧海马血流量变化基本同步,均明显下降,均明显下降,其中伤后0.5 h降幅最大,3h为低谷,此后局部脑血流量(Regional cerebral blood flow,rCBF)开始缓慢升高,至48 h基本达到伤前水平,整个变化趋势为缺血/再灌注变化。生理盐水组与损伤组比较双侧各时相点均差异不显著(P>0.05)。GM1治疗后,双侧各时相点与伤前(假损伤组)比较差异仍有显著性(P<0.05),但至6 h已有明显的恢复且到24 h和48 h即恢复正常;各时相点与损伤组和生理盐水组比较除48 h外rCBF均有明显回升(P<0.05),未见缺血/再灌注的变化,见图1。
, 百拇医药
2.3 病理改变
脑损伤后0.5 h即见细胞肿胀、胞浆内有大量空泡形成,血管周围间隙增大,伤后6h更为明显,24 h达到高峰;尼氏染色伤后48 h尼氏体明显变淡、减少。GM1治疗后其病理变化不明显,见图2、3。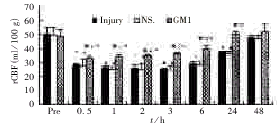
图1 各组大鼠左侧海马血流量比较
Fig 1 Compareof of left hippocampal rCBF in every group
The unit of rCBF: ml/100 g;★:P<0.05 vs injury;
☆:P<0.05 vs NS; #:P<0.05 vs pre-injury
, 百拇医药
图2 损伤组伤后6 h皮层神经元 (HE×400)
Fig 2 Cortic neurons of injury group 6 h (HE×400)
图3 治疗组伤后6 h皮层神经元(HE×400)
Fig 3 Cortic neurons of treatment group 6 h (HE×400)
3 讨论
GM1治疗组的两侧6个部位均未见损伤组伤后水含量的变化趋势,基本上围绕伤前组水含量值波动,呈一水平线。GM1对FPBI后的水含量增加具有显著的阻止作用。我们还发现伤后早期rCBF急剧下降的缺血期,也是含水量升高最急剧时段,而在其后的再灌注期,水含量继续升高,达最高峰,可见rCBF的变化与脑水肿的发生、发展关系密切。因而及时改善rCBF,改善脑组织供血供氧状况对纠正脑水肿有治疗意义。
, http://www.100md.com
海马是最易也是最早发生继发性损伤的部位,因此观察其治疗前后的变化对整个颅脑的治疗具有代表意义。GM1治疗后,可增加伤后早期rCBF,有效地阻断了FPBI伤后缺血/再灌注这一病理生理过程,继而阻止或缓解继发性神经细胞损伤的发生。其增加rCBF不是简单的靠对血管的直接舒缩作用,而是通过其复杂的生物学性质对脑血管及其周围环境的调节得以实现的,如GM1抑制Ca2+/CaM/MLCK系统启动的血管平滑肌的异常收缩[3]:即升高的Ca2+与钙调素(CaM)形成Ca/Cam复合体,在肌球蛋白轻链激酶(MLCK)的作用下,促进肌球蛋白的磷酸化并分解ATP产生能量,启动血管平滑肌异常收缩,而GM1可抑制这一过程。抑制蛋白激酶C(PKC)活化,阻断DG/PKC/IF-Caldesmon系统导致的血管平滑肌痉挛[4];通过其膜稳定作用,保护血管平滑肌免遭损伤[5];加强糖的有氧利用,抑制糖酵解,增加ATP供给,减少乳酸和CO2的生成等机制。
, 百拇医药
GM1虽对改善rCBF有显著作用,但这种作用又是不完全的,表现在治疗组伤后rCBF仍有下降且与伤前组有显著差异。这可能是因为伤后rCBF的变化牵涉多个机制、多种途径,仅就相对单一因素的处理,单用GM1治疗不足以完全纠正损伤,同时也可能与剂量有关。
作者简介:卓豫(1974-),女,重庆市人,助理实验师。电话:(023)68757435
参考文献:
[1] Toffano G, Benvegnu D, Bonetti A C, et al. Interactions of GM1 ganglioside with crude rat brain neuronal membranes[J]. J Neurochem,1980,35(4):861-886.
[2] 吴宝明,刘 彦,廖维宏,等.流体冲击动物脑损伤装置的研制[J].中国医疗器械杂志,1997,21(2):95-98.
, 百拇医药
[3] Minami N, Tani E, Maeda Y, et al. Effects of inhibitors of protein kinase C and calpain in experimental delayed cerebral vasospasm[J]. J Neurosurg,1992,76(1):111-118.
[4] Favaron M, Manev M, Siman R, et al. Down-regulation of protein kinase C protects cerebral granule neurons in primary culture from glutamate-induce neuronal death[J]. Proc Natl Acad Sci USA,1990,86:1 983-1 987.
[5] Krajnc D, Wemlinger T A, Neff N H, et al. Neonatal hypoxia early neurotransmitter responses and the consequences of treatment with GMl ganglioside[J]. J Pharmacol Exp Ther,1994,271(3):1 299-1 305.
收稿日期:1999-07-18;修回日期:2000-03-28, http://www.100md.com
单位:卓豫(第三军医大学附属大坪医院野战外科研究所第五研究室,重庆 400042);姚一(解放军第174医院外三科,厦门 361003)
关键词:GM1;流体冲击;脑损伤;大鼠
第三军医大学学报000622 提 要: 目的 评价单唾液酸西己糖神经糖甙脂钠盐(Monosialotetrahexosylganglioside,GM1)在流体冲击致大鼠脑损伤(Fluid-percussion brain injury,FPBI)后急性期对大脑的保护作用,以期为脑损伤的临床治疗提供实验依据。方法 流体冲击致大鼠闭合型脑损伤后,用干湿法测定脑组织水含量、氢清除法观测局部脑血流量(rCBF)的改变,以及病理改变。结果 大鼠脑损伤后GM1能显著降低伤后水含量的升高;伤后rCBF未见明显降低,同时病理学检查GM1明显减轻病理学改变。结论 早期应用GM1能有效地阻止rCBF的缺血/再灌流变化,改善脑组织血供从而有效阻止脑水肿、神经元变性、坏死的发生。
, http://www.100md.com
中图法分类号: R651.15;R977.6 文献标识码: A
文章编号:1000-5404(2000)06-0585-03
Protective effect of monosialotetrahexosylganglioside on fluid-percussion brain injury in rats
ZHUO Yu, YAO Yi
(Research Institute of Field Surgery, Daping Hospital, Third Military Medical University, Chongqing 400042, China)
Abstract: Objective To evaluate the protective effect of monosialotetrahexosylganglioside (GM1) on the acute stage of fluid-percussion brain injury (FPBI) in rats to provide experimental basis for the clinical treatment. Methods After the establishment of rat model of FPBI, the water content of brain tissues was detected with dry-wet method and regional cerebral blood flow (rCBF) was measured with H2 elimination method. Pathological changes of the brain were observed with light microscope. Results GM1 significantly inhibited the elevation of the water content in the brain and showed no effect on the rCBF after FPBI. Meanwhile, GM1 significantly ameliorated the pathological manifestation of the brains. Conclusion Early administration of GM1 can prevent ischemia/reperfusion damages of rCBF, improve cerebral blood supply and reduce cerebral edema, denaturation and necrosis of the neurons after fluid-percussion brain injury in rats.
, http://www.100md.com
Key words: monosialotetrahexosylganglioside; fluid-percussion; brain injury; rat
颅脑损伤是如今临床最常见的致病与死亡原因之一,其继发性损伤产生一系列病理改变。单唾液酸西己糖神经糖甙脂钠盐(Monosialotetrahexosylganglioside,GM1)是哺乳动物大脑中主要的神经节苷脂之一,近年来人们发现外源性给予GM1,在体内早期可透过血脑屏障(Blood brain barrier,BBB), 嵌入细胞膜, 起着保护神经细胞膜的作用,纠正离子失衡,降低脑水肿[1]。本实验就GM1对脑损伤早期保护作用的可能机制进行了探讨,为其临床应用提供实验依据。
1 材料与方法
1.1 模型建立和动物分组 成年Wistar大鼠,20%乌拉坦20 mg/kg腹腔注射麻醉,常规消毒后,纵向切开头皮、暴露颅骨,在AP-3 mm、矢状缝左侧旁开2 mm处,用牙科钻钻一直径5 mm的小孔,保持硬脑膜完整,再行气管插管术,将大鼠固定于流体冲击装置的立体定位仪上,把冲击头垂直安装在小孔内,其周边以牙托粉密封。流体冲击装置中注入37°C生理盐水并排出气泡。调整重锤的大小及高度使重锤从恒定角度下落,打击储水池一端的橡皮垫,液体经过冲击头被快速注入颅腔,引起脑损伤。压力传感-计算机检测系统同时检测压力波形,并计算波幅、波宽[2]。
, http://www.100md.com
大鼠随机分为伤前组、损伤组、生理盐水组和GM1治疗组。GM1治疗组于伤后立即腹腔注射30 mg/kg GM1(由巴西TRB PHARMA药厂生产),生理盐水组伤后立即给予等量生理盐水腹腔注射。其中伤前组10只,分别测定脑组织水含量及海马血流量;后3组均观察伤后0.5、1、2、3、6、24、48 h 7个时相点,每个时相点10只,观察内容同伤前组;伤前组及损伤组、GM1组伤后5、6、24、48 h观察病理改变,每个时相点2只动物。
1.2 脑组织水含量的测定
分别取各时相点6个部位脑组织进行测定,即:双侧海马,双侧额叶,损伤区顶叶和对侧相应部位的顶叶。用干湿法测定脑组织含水量。
1.3 海马血流量的测定
测定该指标的所有动物除左侧做钻颅术外,还需在右侧对应颅骨另做直径1mm的颅骨孔(打击时用牙托粉封闭),应用末梢循环仪(日本)检测海马血流量。
, http://www.100md.com
1.4 病理观察 常规灌注固定切片,HE、尼氏染色,光镜下观察。
1.5 统计学处理 数据结果以
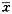 ±s表示,采用方差分析、t检验。
±s表示,采用方差分析、t检验。2 结果
2.1 脑组织含水量变化 大鼠FPBI后检测的6个部位水含量变化趋势基本一致,即0.5h显著升高,伤后24h达到高峰,致48h仍显著高于伤前。GM1治疗组各时相点的各部位间水含量差异不显著,与假手术组(伤前)相比差异不显著,与损伤组和生理盐水组相比差异显著(P<0.05),见表1。
表1 各组大鼠左侧三部位水含量比较[ω(H2O)/%,n=10]
Tab 1 Water content compare in the three sites of the left in each groups of the rat[ω(H2O)/%,n=10]
, 百拇医药
Left frontal lobe
Left parietal lobe
Left hippocampus
Pre-injury
Injury
NS
GM1
Pre-injury
Injury
NS
GM1
Pre-injury
, 百拇医药
Injury
NS
GM1
0 h
77.1±0.59
77.0±1.19
76.6±1.25
0.5 h
80.0±0.40&
80.2±0.53&
77.9±9.55# *
, 百拇医药
79.8±0.63&
80.1±0.15&
77.9±0.65# *
80.4±0.14&
80.7±0.47&
76.6±0.58# *
1 h
80.2±0.15&
80.5±0.87&
, http://www.100md.com
77.4±0.61# *
80.9±0.377
80.2±0.20&
77.6±0.37# *
80.3±0.31&
80.4±0.81&
77.8±0.37# *
2 h
80.8±0.32&
, 百拇医药
81.3±0.56&
78.2±1.17# *
80.3±0.24&
80.7±0.17&
76.8±0.39# *
80.6±0.07&
80.6±0.72&
77.1±1.06# *
3 h
, 百拇医药
80.9±0.40&
81.5±0.85&
77.7±0.43# *
81.0±0.85&
81.1±0.48&
76.8±0.54# *
80.8±0.17&
80.9±0.37&
76.2±1.08# *
, http://www.100md.com
6 h
81.3±0.11&
81.9±0.71&
76.6±0.46# *
81.4±0.8&
81.6±0.19&
76.4±0.62# *
81.4±0.11&
81.4±0.44&
, 百拇医药
77.5±0.41# *
24 h
82.4±1.23&
82.8±0.37&
77.7±0.27# *
82.2±0.81&
82.1±0.25&
77.6±0.48# *
81.9±0.60&
, http://www.100md.com
82.7±0.63&
77.2±0.28# *
48 h
81.4±0.17&
81.5±0.63&
77.5±0.48# *
781.4±1.14&
81.8±0.46&
76.5±1.89# *
, http://www.100md.com
81.5±0.84&
81.6±0.80&
77.1±0.86# *
#:P<0.05 vs injury;*:P<0.05 vs NS;&:P<0.05 vs pre-injury
2.2 脑损伤后血流量变化趋势
大鼠脑损伤后,双侧海马血流量变化基本同步,均明显下降,均明显下降,其中伤后0.5 h降幅最大,3h为低谷,此后局部脑血流量(Regional cerebral blood flow,rCBF)开始缓慢升高,至48 h基本达到伤前水平,整个变化趋势为缺血/再灌注变化。生理盐水组与损伤组比较双侧各时相点均差异不显著(P>0.05)。GM1治疗后,双侧各时相点与伤前(假损伤组)比较差异仍有显著性(P<0.05),但至6 h已有明显的恢复且到24 h和48 h即恢复正常;各时相点与损伤组和生理盐水组比较除48 h外rCBF均有明显回升(P<0.05),未见缺血/再灌注的变化,见图1。
, 百拇医药
2.3 病理改变
脑损伤后0.5 h即见细胞肿胀、胞浆内有大量空泡形成,血管周围间隙增大,伤后6h更为明显,24 h达到高峰;尼氏染色伤后48 h尼氏体明显变淡、减少。GM1治疗后其病理变化不明显,见图2、3。

图1 各组大鼠左侧海马血流量比较
Fig 1 Compareof of left hippocampal rCBF in every group
The unit of rCBF: ml/100 g;★:P<0.05 vs injury;
☆:P<0.05 vs NS; #:P<0.05 vs pre-injury

, 百拇医药
图2 损伤组伤后6 h皮层神经元 (HE×400)
Fig 2 Cortic neurons of injury group 6 h (HE×400)

图3 治疗组伤后6 h皮层神经元(HE×400)
Fig 3 Cortic neurons of treatment group 6 h (HE×400)
3 讨论
GM1治疗组的两侧6个部位均未见损伤组伤后水含量的变化趋势,基本上围绕伤前组水含量值波动,呈一水平线。GM1对FPBI后的水含量增加具有显著的阻止作用。我们还发现伤后早期rCBF急剧下降的缺血期,也是含水量升高最急剧时段,而在其后的再灌注期,水含量继续升高,达最高峰,可见rCBF的变化与脑水肿的发生、发展关系密切。因而及时改善rCBF,改善脑组织供血供氧状况对纠正脑水肿有治疗意义。
, http://www.100md.com
海马是最易也是最早发生继发性损伤的部位,因此观察其治疗前后的变化对整个颅脑的治疗具有代表意义。GM1治疗后,可增加伤后早期rCBF,有效地阻断了FPBI伤后缺血/再灌注这一病理生理过程,继而阻止或缓解继发性神经细胞损伤的发生。其增加rCBF不是简单的靠对血管的直接舒缩作用,而是通过其复杂的生物学性质对脑血管及其周围环境的调节得以实现的,如GM1抑制Ca2+/CaM/MLCK系统启动的血管平滑肌的异常收缩[3]:即升高的Ca2+与钙调素(CaM)形成Ca/Cam复合体,在肌球蛋白轻链激酶(MLCK)的作用下,促进肌球蛋白的磷酸化并分解ATP产生能量,启动血管平滑肌异常收缩,而GM1可抑制这一过程。抑制蛋白激酶C(PKC)活化,阻断DG/PKC/IF-Caldesmon系统导致的血管平滑肌痉挛[4];通过其膜稳定作用,保护血管平滑肌免遭损伤[5];加强糖的有氧利用,抑制糖酵解,增加ATP供给,减少乳酸和CO2的生成等机制。
, 百拇医药
GM1虽对改善rCBF有显著作用,但这种作用又是不完全的,表现在治疗组伤后rCBF仍有下降且与伤前组有显著差异。这可能是因为伤后rCBF的变化牵涉多个机制、多种途径,仅就相对单一因素的处理,单用GM1治疗不足以完全纠正损伤,同时也可能与剂量有关。
作者简介:卓豫(1974-),女,重庆市人,助理实验师。电话:(023)68757435
参考文献:
[1] Toffano G, Benvegnu D, Bonetti A C, et al. Interactions of GM1 ganglioside with crude rat brain neuronal membranes[J]. J Neurochem,1980,35(4):861-886.
[2] 吴宝明,刘 彦,廖维宏,等.流体冲击动物脑损伤装置的研制[J].中国医疗器械杂志,1997,21(2):95-98.
, 百拇医药
[3] Minami N, Tani E, Maeda Y, et al. Effects of inhibitors of protein kinase C and calpain in experimental delayed cerebral vasospasm[J]. J Neurosurg,1992,76(1):111-118.
[4] Favaron M, Manev M, Siman R, et al. Down-regulation of protein kinase C protects cerebral granule neurons in primary culture from glutamate-induce neuronal death[J]. Proc Natl Acad Sci USA,1990,86:1 983-1 987.
[5] Krajnc D, Wemlinger T A, Neff N H, et al. Neonatal hypoxia early neurotransmitter responses and the consequences of treatment with GMl ganglioside[J]. J Pharmacol Exp Ther,1994,271(3):1 299-1 305.
收稿日期:1999-07-18;修回日期:2000-03-28, http://www.100md.com