丙型肝炎病毒丝氨酸蛋白酶基因的克隆和表达
作者:范涛 程计林 梁庆华 陶其敏
单位:北京医科大学人民医院肝病研究所,100044
关键词:丙型肝炎病毒;丝氨酸蛋白酶;基因表达
中华微生物学和免疫学杂志000609 【 摘要 】 目的 从感染HCV的中国患者血清中扩增编码HCV丝氨酸蛋白酶的cDNA,在大肠杆菌中进行表达。 方法 从血清中提取HCV RNA,应用RT-PCR方法扩增HCV丝氨酸蛋白酶cDNA, Sanger双脱氧链终止法测定其序列,与pBV220载体构建重组质粒,在大肠杆菌中表达,SDS-PAGE和Western blot分析重组蛋白。 结果 用RT-PCR方法扩增得到了HCV丝氨酸蛋白酶基因,序列分析表明其读码框架正确,丝氨酸蛋白酶活性中心高度保守,同源性比较表明该区段来源于HCVⅡ/1b中国株,构建重组载体后,在大肠杆菌中获得了丝氨酸蛋白酶的表达。 结论 HCVⅡ/1b型中国株丝氨酸蛋白酶基因的克隆及其在大肠杆菌中的成功表达,为进一步研究该蛋白酶活性及影响因素打下了基础。
, 百拇医药
Cloning and expression of hepatitis C virus serine protease gene
FAN Tao, CHENG Jilin, LIANG Qinghua, et al.
(Institute of Hepatology, People′s Hospital, Beijing Medical University, Beijing 100044, P.R.China)
【 Abstract 】 Objective To amplify and clone the HCV cDNA fragment that encode serine protease from the serum of a Chinese patient infected with HCV and express it in E.coli. Methods The HCV RNA was extracted from serum, the cDNA that encode HCV serine protease was amplified by RT-PCR. Its sequence was determined by dideoxy-chain termination method. It was subcloned into vector pBV220 and expressed in E.coli. The expressed recombinant protein was analysed by SDS-PAGE electrophoresis and Western blot. Results The HCV serine cDNA was cloned. Sequence analysis showed that its reading frame is correct and no insert or deletion mutation happened. Homology comparison suggested it is from a HCV typeⅡ/1b isolate. This cDNA fragment was efficiently expressed in E.coli. Conclusion The serine protease cDNA was amplified successfully from the serum of a Chinese patient with HCV(Ⅱ/1b) infection. The expression of the serine protease in E.coli rollouted a basis for the study of its activity.
, http://www.100md.com
【 Subject words 】 Hepatitis C virus; Serine protease; Gene expression
HCV为单股正链RNA病毒,其基因组长约9.5kb,编码区含一个大开放读码框架,编码3 010~3 033个氨基酸残基的多蛋白前体,经宿主蛋白酶和病毒蛋白酶加工成具有生物学功能的成熟蛋白。研究表明,HCV非结构蛋白NS3/NS4A,NS4A/NS4B,NS4B/NS5A,NS5A/NS5B位点的裂解由病毒编码的丝氨酸蛋白酶介导,该酶位于NS3区N端〔1,2〕。本研究中我们应用RT-PCR方法,从感染HCV的患者血清中扩增了编码丝氨酸蛋白酶的cDNA,测定其核苷酸序列,构建表达载体,并在大肠杆菌中进行表达。
材料和方法
血清标本来源:HCV患者血清来自本院门诊。
, http://www.100md.com
工具酶和试剂:AMV-RT酶、Taq DNA聚合酶、dNTP、Klenow大片段和限制性内切酶EcoRⅠ和XbaⅠ等均为Promega公司产品。RNasin为华美公司产品。
菌种和质粒:大肠杆菌DH5α为本所保存,pBV220质粒由预防医学科学院病毒研究所张智清教授构建并惠赠。pcDNA3为Invitrogen公司产品。
PCR引物设计:参考HCV-J序列〔3〕,经Oligo5.0软件辅助设计,合成内、外两组引物,在内引物对的5′端和3′端分别引入EcoRⅠ和XbaⅠ酶切位点及起始密码子和终止密码子。引物由CyberSyn 公司合成。引物序列为:外引物1R(4 118~4 135):GACATATACGCTCCAAAG;1F(3 315~3 334):ATCATCTCGGGTCTACCAGT;内引物2R(4 091~4 106):GACTCTAGATTAGTTTAGGACGAGCACC;2F(3 372~3 387):CAGGAATTCATGGCCGATAGTTTTGGAG。
, 百拇医药
RT-PCR扩增目的基因:HCV RNA的提取参考文献〔4〕制备好的RNA于70℃变性5 min,再加入逆转录反应液,10μl反应体系中,含1×AMV-RT逆转录酶缓冲液,外引物1R 50pmol,dNTP终浓度各为200μmol/L,AMV-RT酶0.5μl,RNasin 10U,于42℃1 h后,95℃ 20 min。在逆转录产物中加入一次PCR反应液,50μl反应体系中镁离子终浓度为1.5mmol/L,dNTP终浓度各为200μmol/L,Taq-P为1.5U,引物1F 50pmol。第二次PCR仍为50μl反应体系,取第一次PCR产物5μl,内引物2R和2F各为50pmol,余同第一次PCR。PCR循环条件为94℃变性60 s,55℃退火90 s,72℃延伸120 s,35个循环。用6%的聚丙烯酰胺凝胶电泳检测扩增产物。
重组表达质粒的构建:先将扩增的目的基因克隆至pcDNA3质粒的EcoRⅠ/XbaⅠ之间,测定其序列,然后亚克隆至M13mp18载体,用EcoRⅠ/SalⅠ酶切后,亚克隆至pBV220相应的位点。转化DH5α感受态细胞。用含Amp的固体培养基(LA)筛选阳性克隆,小量提取质粒,酶切鉴定,构建重组表达载体pBV220-NS3S。具体重组技术参考文献〔5〕有关章节。
, 百拇医药
核苷酸序列测定:采用Sanger双脱氧链终止法,以SP6和T7通用引物进行双向测序。
目的蛋白的诱导表达和鉴定:挑取含重组载体pBV220-NS3S的单个菌落置于LA液体培养基中,30℃培养过夜,次日加入等量预温的培养基,42℃培养4 h。离心收集菌体,重悬菌体,加入等量2×SDS-PAGE缓冲液,100℃煮沸5 min。经SDS-PAGE后,Coomassie亮蓝染色,观察结果。
Western blot鉴定:蛋白经电泳分离后,电转移至硝酸纤维素膜上,以5%脱脂奶粉封闭,HCV抗体阳性血清为一抗,将碱性磷酸酶标记的羊抗人IgG酶标抗体为二抗,在NBT/BCIP显色系统显色。
结果
1.目的基因的扩增:经过RT-PCR扩增后,获得的扩增产物与预期大小一致,无非特异扩增条带。我们将该片段称为NS3S(见图1)。
, http://www.100md.com
2.序列分析:以SP6和T7通用引物对pcDNA3-NS3S中的目的基因片段进行双向测序,结果表明,该片段为HCV基因,序列阅读框架正确。该片段长723个碱基(不含起始密码子和终止密码子),翻译成241个氨基酸。同源性分析表明属于HCVⅡ/1b 型,与HCVⅡ型其它序列:中国河北株,HC-C2,HCV-J的同源性分别为:核苷酸95.16%,91.56%,91.15%;氨基酸95.85%,94.19%,93.78%。其核苷酸序列见图2,氨基酸序列见图3。
图1 RT-PCR法扩增HCV NS3S cDNA
Fig 1. HCV NS3S cDNA amplification by RT-PCR
M: PCR marker;Lane 1: Amplified product of HCV NS3S cDNA;Lane 2: Negative control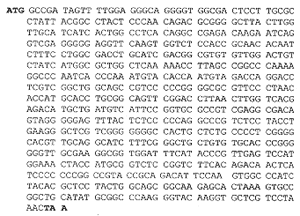
, 百拇医药
图2 NS3S核苷酸序列
Fig 2. NS3S nucleotide sequence
图3 NS3S氨基酸序列
Fig 3.Amino acid sequence of NS3S
3.表达质粒的构建和鉴定:将NS3S片段定向克隆至pBV220载体,转化DH5α细胞后,在LA固体培养基上筛选抗性克隆,挑取阳性菌落经培养,提取质粒,用EcoRⅠ/XbaⅠ酶切鉴定,电泳后可见载体片段和目的基因片段均与预期大小一致,成功构建重组载体pBV220-NS3S(见图4)。
4.NS3S基因在E.coli中的表达:pBV220是一个含PLPR启动子的原核高效表达载体,它同时含有cI调控基因,多酶切位点和两个强的转录终止序列,带有起始密码子ATG的外源基因可以插入启动子下游的多酶切位点,表达非融合蛋白〔6〕含重组载体的E.coli经温控诱导后,SDS-PAGE染色显示,表达了相对分子质量(Mr)约2.8×103的NS3S蛋白。Western blot结果显示,该蛋白条带为HCV特异蛋白。
, 百拇医药
图4 重组载体pBV220-NS3S的鉴定
Fig 4. Identification of recombinant vector pBV220-NS3S
M1: λDNA/HindⅢ marker;Lane 1: pBV220 digested by EcoRⅠ;Lane 2: pBV220-NS3S digested by EcoRⅠ/XbaⅠ;M2: φX174 DNA/HaeⅢ marker
讨论
HCV基因组具有很大的变异性,这可能是由于HCV复制酶缺乏校正功能,以及宿主的免疫选择压力共同作用所致。对HCV的序列和型别进行分析,有助于HCV的流行病学调查,研制诊断试剂,发展预防性疫苗,并且对临床治疗有重要的指导作用〔7〕。对HCV基因序列进行分析也有助于HCV的生物学功能研究。Yamaka K等〔8〕在对HCV蛋白酶活性进行研究时发现,来自同一患者血清的多个NS3 cDNA克隆中,有蛋白酶活性的克隆和无蛋白酶活性的克隆同时存在。对所有的克隆进行序列分析和比较表明,无蛋白酶活性的克隆其序列存在如下特点:(1) 氨基酸1079位无义突变,导致蛋白翻译过程的提前终止,病毒株表现为复制缺损。(2) HDS催化中心His-1083点突变,直接导致蛋白酶活性缺失。(3) 某些位点的点突变可能与蛋白酶活性缺失有关,如Pro1168-Thr,Arg1135-Gly, 这些氨基酸似与维持NS3蛋白酶活性中心的构型有密切关系。
, 百拇医药
本研究中我们应用RT-PCR方法,从HCV感染者血清中成功地扩增了HCV丝氨酸蛋白酶基因,克隆和序列分析结果显示,该片段来源于HCVⅡ/1b株。其阅读框架正确,无缺失或插入突变,未发生无义突变。丝氨酸蛋白酶催化中心三联体基序His-1083,Asp-1107,Ser-1165,及上述与蛋白酶活性密切相关的位点,在我们克隆的片段中均高度保守。
我们将扩增的HCV丝氨酸蛋白酶基因克隆至原核表达载体pBV220,经温控诱导后,在大肠杆菌中获得了高效表达。由于HCV基因组在翻译后前体蛋白的酶切加工是其基因表达的重要策略,通过酶切加工,前体蛋白裂解成有生物学活性的成熟蛋白〔9〕。因此,HCV蛋白酶与病毒基因组的复制表达,以至病毒的整个生命周期均有密切的关系。而且,HCV丝氨酸蛋白酶是抗HCV药物作用的重要的靶点之一,对丝氨酸蛋白酶的克隆和表达,有助于研制抗HCV药物〔10〕。我们对HCV蛋白酶基因的克隆和表达为这些领域的研究打下了基础。
, 百拇医药
参考文献
1,Major ME, Feinstone SM. The molecular virology of hepatitis. Hepatology, 1997, 25:1527-1538.
2,Lin C, Pragai BM, Grakoui A, et al. Hepatitis C virus NS3 serine proteinase: trans-cleavage requirements and processing kinetics. J Virol, 1994, 68:8147-8157.
3,Kato N, Hijikata M, Ootsuyama Y, et al. Molecular cloning of the human hepatitis C virus genome from Japanese patients with non-A, non-B hepatitis. Proc Natl Acad Sci USA, 1990, 87:9524-9528.
, 百拇医药
4,杜绍财,陶其敏,孙焱,等. 双PCR检测丙型肝炎病毒RNA. 北京医科大学学报, 1991,23:429-431.
5,Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning, 2nd ed, Cold Spring Harbor Laboratary Press, 1989.
6,张智清, 姚立红, 侯云德. 含PRPL启动子的原核高效表达载体的组建及其应用. 病毒学报, 1990, 6:111-116.
7,Simmonds P. Variability of hepatitis C virus. Hepatology,1995,21:570-583.
8,Yamada K, Mori A, Seki M, et al. Critical point mutations for hepatitis C virus NS3 proteinase. Virology, 1998, 246:104-112.
9,Spall VE, Shanks M, Lomonossoff. Polyprotein processing as a strategy for gene expression in RNA viruses. Semin Virol, 1997, 8:15-23.
10,Kakiuchi N, Komoda Y,Komoda K, et al. Non-peptide inhibitors of HCV serine proteinase. FEBS, 1998, 421:217-220.
(收稿日期:1999-06-07), 百拇医药
单位:北京医科大学人民医院肝病研究所,100044
关键词:丙型肝炎病毒;丝氨酸蛋白酶;基因表达
中华微生物学和免疫学杂志000609 【 摘要 】 目的 从感染HCV的中国患者血清中扩增编码HCV丝氨酸蛋白酶的cDNA,在大肠杆菌中进行表达。 方法 从血清中提取HCV RNA,应用RT-PCR方法扩增HCV丝氨酸蛋白酶cDNA, Sanger双脱氧链终止法测定其序列,与pBV220载体构建重组质粒,在大肠杆菌中表达,SDS-PAGE和Western blot分析重组蛋白。 结果 用RT-PCR方法扩增得到了HCV丝氨酸蛋白酶基因,序列分析表明其读码框架正确,丝氨酸蛋白酶活性中心高度保守,同源性比较表明该区段来源于HCVⅡ/1b中国株,构建重组载体后,在大肠杆菌中获得了丝氨酸蛋白酶的表达。 结论 HCVⅡ/1b型中国株丝氨酸蛋白酶基因的克隆及其在大肠杆菌中的成功表达,为进一步研究该蛋白酶活性及影响因素打下了基础。
, 百拇医药
Cloning and expression of hepatitis C virus serine protease gene
FAN Tao, CHENG Jilin, LIANG Qinghua, et al.
(Institute of Hepatology, People′s Hospital, Beijing Medical University, Beijing 100044, P.R.China)
【 Abstract 】 Objective To amplify and clone the HCV cDNA fragment that encode serine protease from the serum of a Chinese patient infected with HCV and express it in E.coli. Methods The HCV RNA was extracted from serum, the cDNA that encode HCV serine protease was amplified by RT-PCR. Its sequence was determined by dideoxy-chain termination method. It was subcloned into vector pBV220 and expressed in E.coli. The expressed recombinant protein was analysed by SDS-PAGE electrophoresis and Western blot. Results The HCV serine cDNA was cloned. Sequence analysis showed that its reading frame is correct and no insert or deletion mutation happened. Homology comparison suggested it is from a HCV typeⅡ/1b isolate. This cDNA fragment was efficiently expressed in E.coli. Conclusion The serine protease cDNA was amplified successfully from the serum of a Chinese patient with HCV(Ⅱ/1b) infection. The expression of the serine protease in E.coli rollouted a basis for the study of its activity.
, http://www.100md.com
【 Subject words 】 Hepatitis C virus; Serine protease; Gene expression
HCV为单股正链RNA病毒,其基因组长约9.5kb,编码区含一个大开放读码框架,编码3 010~3 033个氨基酸残基的多蛋白前体,经宿主蛋白酶和病毒蛋白酶加工成具有生物学功能的成熟蛋白。研究表明,HCV非结构蛋白NS3/NS4A,NS4A/NS4B,NS4B/NS5A,NS5A/NS5B位点的裂解由病毒编码的丝氨酸蛋白酶介导,该酶位于NS3区N端〔1,2〕。本研究中我们应用RT-PCR方法,从感染HCV的患者血清中扩增了编码丝氨酸蛋白酶的cDNA,测定其核苷酸序列,构建表达载体,并在大肠杆菌中进行表达。
材料和方法
血清标本来源:HCV患者血清来自本院门诊。
, http://www.100md.com
工具酶和试剂:AMV-RT酶、Taq DNA聚合酶、dNTP、Klenow大片段和限制性内切酶EcoRⅠ和XbaⅠ等均为Promega公司产品。RNasin为华美公司产品。
菌种和质粒:大肠杆菌DH5α为本所保存,pBV220质粒由预防医学科学院病毒研究所张智清教授构建并惠赠。pcDNA3为Invitrogen公司产品。
PCR引物设计:参考HCV-J序列〔3〕,经Oligo5.0软件辅助设计,合成内、外两组引物,在内引物对的5′端和3′端分别引入EcoRⅠ和XbaⅠ酶切位点及起始密码子和终止密码子。引物由CyberSyn 公司合成。引物序列为:外引物1R(4 118~4 135):GACATATACGCTCCAAAG;1F(3 315~3 334):ATCATCTCGGGTCTACCAGT;内引物2R(4 091~4 106):GACTCTAGATTAGTTTAGGACGAGCACC;2F(3 372~3 387):CAGGAATTCATGGCCGATAGTTTTGGAG。
, 百拇医药
RT-PCR扩增目的基因:HCV RNA的提取参考文献〔4〕制备好的RNA于70℃变性5 min,再加入逆转录反应液,10μl反应体系中,含1×AMV-RT逆转录酶缓冲液,外引物1R 50pmol,dNTP终浓度各为200μmol/L,AMV-RT酶0.5μl,RNasin 10U,于42℃1 h后,95℃ 20 min。在逆转录产物中加入一次PCR反应液,50μl反应体系中镁离子终浓度为1.5mmol/L,dNTP终浓度各为200μmol/L,Taq-P为1.5U,引物1F 50pmol。第二次PCR仍为50μl反应体系,取第一次PCR产物5μl,内引物2R和2F各为50pmol,余同第一次PCR。PCR循环条件为94℃变性60 s,55℃退火90 s,72℃延伸120 s,35个循环。用6%的聚丙烯酰胺凝胶电泳检测扩增产物。
重组表达质粒的构建:先将扩增的目的基因克隆至pcDNA3质粒的EcoRⅠ/XbaⅠ之间,测定其序列,然后亚克隆至M13mp18载体,用EcoRⅠ/SalⅠ酶切后,亚克隆至pBV220相应的位点。转化DH5α感受态细胞。用含Amp的固体培养基(LA)筛选阳性克隆,小量提取质粒,酶切鉴定,构建重组表达载体pBV220-NS3S。具体重组技术参考文献〔5〕有关章节。
, 百拇医药
核苷酸序列测定:采用Sanger双脱氧链终止法,以SP6和T7通用引物进行双向测序。
目的蛋白的诱导表达和鉴定:挑取含重组载体pBV220-NS3S的单个菌落置于LA液体培养基中,30℃培养过夜,次日加入等量预温的培养基,42℃培养4 h。离心收集菌体,重悬菌体,加入等量2×SDS-PAGE缓冲液,100℃煮沸5 min。经SDS-PAGE后,Coomassie亮蓝染色,观察结果。
Western blot鉴定:蛋白经电泳分离后,电转移至硝酸纤维素膜上,以5%脱脂奶粉封闭,HCV抗体阳性血清为一抗,将碱性磷酸酶标记的羊抗人IgG酶标抗体为二抗,在NBT/BCIP显色系统显色。
结果
1.目的基因的扩增:经过RT-PCR扩增后,获得的扩增产物与预期大小一致,无非特异扩增条带。我们将该片段称为NS3S(见图1)。
, http://www.100md.com
2.序列分析:以SP6和T7通用引物对pcDNA3-NS3S中的目的基因片段进行双向测序,结果表明,该片段为HCV基因,序列阅读框架正确。该片段长723个碱基(不含起始密码子和终止密码子),翻译成241个氨基酸。同源性分析表明属于HCVⅡ/1b 型,与HCVⅡ型其它序列:中国河北株,HC-C2,HCV-J的同源性分别为:核苷酸95.16%,91.56%,91.15%;氨基酸95.85%,94.19%,93.78%。其核苷酸序列见图2,氨基酸序列见图3。

图1 RT-PCR法扩增HCV NS3S cDNA
Fig 1. HCV NS3S cDNA amplification by RT-PCR
M: PCR marker;Lane 1: Amplified product of HCV NS3S cDNA;Lane 2: Negative control

, 百拇医药
图2 NS3S核苷酸序列
Fig 2. NS3S nucleotide sequence

图3 NS3S氨基酸序列
Fig 3.Amino acid sequence of NS3S
3.表达质粒的构建和鉴定:将NS3S片段定向克隆至pBV220载体,转化DH5α细胞后,在LA固体培养基上筛选抗性克隆,挑取阳性菌落经培养,提取质粒,用EcoRⅠ/XbaⅠ酶切鉴定,电泳后可见载体片段和目的基因片段均与预期大小一致,成功构建重组载体pBV220-NS3S(见图4)。
4.NS3S基因在E.coli中的表达:pBV220是一个含PLPR启动子的原核高效表达载体,它同时含有cI调控基因,多酶切位点和两个强的转录终止序列,带有起始密码子ATG的外源基因可以插入启动子下游的多酶切位点,表达非融合蛋白〔6〕含重组载体的E.coli经温控诱导后,SDS-PAGE染色显示,表达了相对分子质量(Mr)约2.8×103的NS3S蛋白。Western blot结果显示,该蛋白条带为HCV特异蛋白。

, 百拇医药
图4 重组载体pBV220-NS3S的鉴定
Fig 4. Identification of recombinant vector pBV220-NS3S
M1: λDNA/HindⅢ marker;Lane 1: pBV220 digested by EcoRⅠ;Lane 2: pBV220-NS3S digested by EcoRⅠ/XbaⅠ;M2: φX174 DNA/HaeⅢ marker
讨论
HCV基因组具有很大的变异性,这可能是由于HCV复制酶缺乏校正功能,以及宿主的免疫选择压力共同作用所致。对HCV的序列和型别进行分析,有助于HCV的流行病学调查,研制诊断试剂,发展预防性疫苗,并且对临床治疗有重要的指导作用〔7〕。对HCV基因序列进行分析也有助于HCV的生物学功能研究。Yamaka K等〔8〕在对HCV蛋白酶活性进行研究时发现,来自同一患者血清的多个NS3 cDNA克隆中,有蛋白酶活性的克隆和无蛋白酶活性的克隆同时存在。对所有的克隆进行序列分析和比较表明,无蛋白酶活性的克隆其序列存在如下特点:(1) 氨基酸1079位无义突变,导致蛋白翻译过程的提前终止,病毒株表现为复制缺损。(2) HDS催化中心His-1083点突变,直接导致蛋白酶活性缺失。(3) 某些位点的点突变可能与蛋白酶活性缺失有关,如Pro1168-Thr,Arg1135-Gly, 这些氨基酸似与维持NS3蛋白酶活性中心的构型有密切关系。
, 百拇医药
本研究中我们应用RT-PCR方法,从HCV感染者血清中成功地扩增了HCV丝氨酸蛋白酶基因,克隆和序列分析结果显示,该片段来源于HCVⅡ/1b株。其阅读框架正确,无缺失或插入突变,未发生无义突变。丝氨酸蛋白酶催化中心三联体基序His-1083,Asp-1107,Ser-1165,及上述与蛋白酶活性密切相关的位点,在我们克隆的片段中均高度保守。
我们将扩增的HCV丝氨酸蛋白酶基因克隆至原核表达载体pBV220,经温控诱导后,在大肠杆菌中获得了高效表达。由于HCV基因组在翻译后前体蛋白的酶切加工是其基因表达的重要策略,通过酶切加工,前体蛋白裂解成有生物学活性的成熟蛋白〔9〕。因此,HCV蛋白酶与病毒基因组的复制表达,以至病毒的整个生命周期均有密切的关系。而且,HCV丝氨酸蛋白酶是抗HCV药物作用的重要的靶点之一,对丝氨酸蛋白酶的克隆和表达,有助于研制抗HCV药物〔10〕。我们对HCV蛋白酶基因的克隆和表达为这些领域的研究打下了基础。
, 百拇医药
参考文献
1,Major ME, Feinstone SM. The molecular virology of hepatitis. Hepatology, 1997, 25:1527-1538.
2,Lin C, Pragai BM, Grakoui A, et al. Hepatitis C virus NS3 serine proteinase: trans-cleavage requirements and processing kinetics. J Virol, 1994, 68:8147-8157.
3,Kato N, Hijikata M, Ootsuyama Y, et al. Molecular cloning of the human hepatitis C virus genome from Japanese patients with non-A, non-B hepatitis. Proc Natl Acad Sci USA, 1990, 87:9524-9528.
, 百拇医药
4,杜绍财,陶其敏,孙焱,等. 双PCR检测丙型肝炎病毒RNA. 北京医科大学学报, 1991,23:429-431.
5,Sambrook J, Fritsch EF, Maniatis T. Molecular Cloning, 2nd ed, Cold Spring Harbor Laboratary Press, 1989.
6,张智清, 姚立红, 侯云德. 含PRPL启动子的原核高效表达载体的组建及其应用. 病毒学报, 1990, 6:111-116.
7,Simmonds P. Variability of hepatitis C virus. Hepatology,1995,21:570-583.
8,Yamada K, Mori A, Seki M, et al. Critical point mutations for hepatitis C virus NS3 proteinase. Virology, 1998, 246:104-112.
9,Spall VE, Shanks M, Lomonossoff. Polyprotein processing as a strategy for gene expression in RNA viruses. Semin Virol, 1997, 8:15-23.
10,Kakiuchi N, Komoda Y,Komoda K, et al. Non-peptide inhibitors of HCV serine proteinase. FEBS, 1998, 421:217-220.
(收稿日期:1999-06-07), 百拇医药