兔出血性休克时肝组织PtiO2、PtiCO2和pHti值的变化
作者:马驰原 高进喜 包映晖 江基尧 朱诚
单位:上海第二军医大学长征医院神经外科,200003
关键词:出血性休克;肝脏;氧分压;二氧化碳值;pH值
中国急救医学000601 [摘 要] 目的 探讨出血性休克及复苏过程中肝脏局部组织PtiO2、PtiCO2和pHti变化规律、原因及其意义。方法 家兔麻醉并放血至MAP=40 mmHg,60分钟后复苏至MAP=80 mmHg,维持30分钟。持续监测肝脏组织氧分压(PtiO2)、二氧化碳分压(PtiCO2)及酸碱度(pHti)。结果 休克过程中,PtiO2逐渐下降至0;PtiCO2升高至41.2±15.6 mmHg(P<0.001);pHti降至7.41±0.09(P<0.001)。复苏后PtiO2迅速上升并稳定在11.0±2.0 mmHg,PtiCO2逐渐下降至39.1±14.7 mmHg(P<0.001),pHti逐渐升高至7.46±0.08(P<0.001)。结论 严重长时间出血性休克可导致肝脏缺氧,CO2蓄积和组织酸中毒。复苏后,组织缺氧,CO2蓄积及酸中毒可部分减轻,但难以在短时间内恢复至正常。肝组织PtiO2、PtiCO2和pHti可能是评价缺血性休克严重程度及复苏有效性的有用指标。
, 百拇医药
[中图分类号] R 605.971;R 361.2 [文献标识码] A
[文章编号] 1002-1949(2000)06-0319-03
Alteration of liver tissue PtiO2,PtiCO2 and pHti following hemorrhagic shock in rabbits
MA Chi-yuan,GAO Jin-xi,BAO Ying-hui
(Department of Neurosurgery,Changzheng Hospital,Second Military Medical University,Shanghai 200003,China)
[Abstract] Objective To study the alteration of liver tissue PtiO2,PtiCO2 and pHti,and their roles following hemorrhagic shock.Methods The rabbits were anesthetized and bled to an MAP of 40 mmHg,and then resusciated to an MAP of 80 mmHg after 60 min.We measured liver tissue PtiO2,PtiCO2 and pHti during hemorrhagic shock and followed resusciation.Results During shock,PtiO2 decreased to zero gradully,PtiCO2 increased slowly at first,then fastly,and slowly again at last to 41.2±15.6 mmHg(P<0.001),pHti decreased to 7.41±0.09(P<0.001).During resusciation,significant increases of PtiO2 to 11.0±2.0 mmHg,and pHti to 7.46±0.08 (P<0.001) as well as a reduction of PtiO2 to 39.1±14.7 mmHg(P<0.001) were observed.Conclusions Severe and long time hemorrhagic shock may lead to hyponea,hyper CO2 and acidosis in the liver.During resusciation,these indexes may recover partly,but not return to normal in short time.Liver tissue PtiO2,PtiCO2,and pHti may be useful indexes in hemorrhagic shock and resusciation.
, 百拇医药
[Key words] Hemorrhagic shock; Liver; PtiO2; PtiCO2; pHti▲
肝脏血液供应丰富,休克及复苏是其最常见的缺血—再灌注损伤原因。休克时,由于微循环动脉血流量急剧减少,引起组织严重缺氧,导致细胞功能障碍和死亡[1]。因此,测定组织氧分压(PtiO2)可以及时发现和防治休克引起的组织缺氧和多脏器衰竭,降低危重患者的病死率[2]。休克多伴有代谢性酸中毒,微循环障碍导致二氧化碳蓄积。这些都间接反映组织缺氧,并影响细胞和组织器官功能。因此,监测组织酸碱度(pHti)和二氧化碳分压(PtiCO2)亦有助于早期发现和防治休克[3]。由于再灌注损伤休克病人多器官功能衰竭常发生于复苏早期[4]。因此,PtiO2、pHti和PtiCO2监测在复苏期仍有重要意义。所以,出血性休克时肝脏组织PtiO2、pHti和PtiCO2值变化的研究对于休克的早期发现和指导复苏都具有重要意义。
, 百拇医药
1 材料与方法
1.1 动物准备
选择健康新西兰雌性大白兔16只,平均体重1.7~2.2 kg。随机分为实验组和对照组。两组均禁食16小时(随意饮水),异丙酚5 mg/kg体重经耳缘静脉麻醉,以后每30分钟静注异丙酚2.5 mg/kg体重和芬太尼12.5 μg/kg体重。麻醉后将兔仰卧位固定于实验台上,行气管插管,自主呼吸空气。左侧股动脉、股静脉及右侧股静脉插管。左侧股动脉插管接血压计(X11D型,上海医疗器械公司,中国上海),直接法监测平均动脉压(MAP)。沿正中线切开腹腔,将组织气体分析仪(Diametrics Medical Inc.Minnesota,USA)的Neurotrend探头自肝右叶下缘插入肝实质内约4厘米,并固定。缝合腹腔及股部切口。手术结束后,肝素化(50 U/kg体重),1小时后给半量。
1.2 实验步骤
, 百拇医药
术后稳定30分钟。读取MAP、肝组织PtiO2、pHti、PtiCO2。实验组从右侧股静脉于5分钟内均匀放血至MAP=40 mmHg,若血压升高则少量放血,若血压下降则少量回输血液。维持60分钟后,经左侧股静脉回输抗凝自体血,并静脉滴注平衡液至MAP=80 mmHg,维持30分钟。持续监测PtiO2、pHti、PtiCO2值。对照组除放血外均与实验组相同。
1.3 肝组织病理学检查
实验组分别于放血前、复苏前及复苏30分钟后,对照组亦分别于相同时间,取肝组织(右叶)进行下列处理:①10%福尔马林固定,石蜡包埋,HE染色,光镜观察。②3%戊二醛及四氧化锇双重固定,环氧树脂618包埋,LKB超薄切片机切片,HITACHI 800电镜观察。
1.4 统计学分析
, 百拇医药
数据以 ±s表示。采用配对t检验进行差异检验,P值小于0.05认为有显著差异。
±s表示。采用配对t检验进行差异检验,P值小于0.05认为有显著差异。
2 结果
2.1 放血与补液 实验兔放血前MAP=82.50±6.55 mmHg,放血35.63±9.35 ml后MAP降至40 mmHg。休克期MAP有所波动,通过放血或输血保持血压稳定。复苏阶段,先回输自体抗凝血,再静滴平衡液68.13±18.31 ml,使MAP上升至80 mmHg,并维持30分钟。实验过程中对照组MAP无明显变化。
2.2 肝组织氧分压(PtiO2)的变化 实验组放血前PtiO2=22.4±8.3 mmHg,放血至MAP=40 mmHg后,PtiO2逐渐下降,在29.0±13.0分钟内降至4 mmHg以下,在35.3±10.7分钟内降至0,直至复苏。复苏后,PtiO2在8.1±6.9分钟内上升至4 mmHg以上,并最终稳定在11.0±2.0 mmHg,而尤以复苏最初15分钟上升较快,后15分钟则上升缓慢。而对照组PtiO2始终无明显变化(图1)。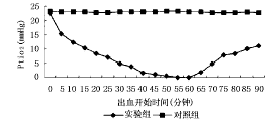
, 百拇医药
图1 出血性休克时肝脏PtiO2的变化
2.3 肝组织酸碱度(pHti)的变化 实验组放血前pHti=7.49±0.10,放血至MAP=40 mmHg后,最初缓慢下降,5分钟后下降较快,30分钟左右下降减慢并稳定在7.41±0.09(P<0.001)。复苏后,pHti逐渐升高至7.46±0.08(P<0.010),而对照组PtiO2始终无明显变化(图2)。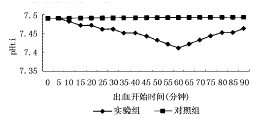
图2 出血性休克时肝脏pHti的变化
2.4 肝组织二氧化碳分压(PtiCO2)的变化 实验组放血前PtiCO2=36.7±15.3 mmHg,放血至MAP=40 mmHg后,最初缓慢升高,5分钟后升高较快,约30分钟左右升高减慢并稳定在41.2±15.6 mmHg(P<0.001)。复苏后,PtiCO2逐渐下降至39.1±14.7 mmHg(P<0.001)(图3)。而对照组PtiCO2始终无明显变化。
, 百拇医药
图3 出血性休克时肝脏PtiCO2的变化
2.5 肝脏病理学检查 光镜发现,休克60分钟后,小叶中央区及中间区较大范围的肝细胞脂肪变(小脂滴),另可见小灶性的肝细胞坏死,局部中性白细胞浸润。复苏30分钟后,中央静脉周围肝细胞变性,并可见到肝细胞坏死,严重者累及2区及3区。电镜发现,休克60分钟后,肝细胞窦面的微绒毛消失,细胞膜伸展,局部断裂。近窦面的细胞质中出现大小不等的空泡。线粒体基质致密颗粒消失。粗面内质网开始有局部断裂,泡状囊腔增多,长形囊腔有串珠状膨大。复苏30分钟后,肝细胞毛细胆管面的微绒毛肿大,部分消失。胞质内的空泡亦分布于核附近和毛细胆管周围。线粒体肿胀变圆,基质变淡,嵴短而间隙增宽。粗面内质网囊腔扩大、断裂,开始脱颗粒。
3 讨论
3.1 肝脏血供丰富,肝细胞对缺血缺氧敏感。出血性休克时肝脏损害已经引起人们注意。其根本原因是组织缺氧。一方面,血红蛋白含量减少,致血液携带氧减少,血氧含量降低,引起血液性缺氧;另一方面,由于微循环障碍,动脉灌流急剧减少,而引起循环性缺氧。Soini等[5]发现MAP下降30%,肝组织PO2下降33%(从30±3到20±3 mmHg)。Makisalo等[2]发现MAP在1小时内降至40~50 mmHg,肝组织PO2从32.4±1.1降至16.1±0.4 mmHg。而此实验维持MAP=40 mmHg 60分钟,PtiO2从22.4±8.3 mmHg逐渐降至0(图1),降低幅度相近。
, 百拇医药
3.2 出血性休克时肝脏代谢的改变
生理条件下,耗氧量(VO2)是自变量,取决于代谢率,供氧量(DO2)是应变量,随VO2变化。DO2降低时,机体通过提高氧提取率(O2ER),血液重新分配和(或)增加心输出量(Q)来保证VO2恒定(VO2不依赖DO2期)。DO2降至临界值(临界供氧量DO2-Crit)以下时,O2ER虽然继续增大,但不能满足组织对氧的需要,VO2随DO2线性降低,即表现为“VO2依赖DO2期”。本实验所测PtiO2为供氧量与耗氧量之差。
实验发现休克30分钟内,PtiCO2逐渐升高,pHti逐渐下降(图2、3)。考虑此时处于VO2不依赖DO2期,CO2主要由有氧代谢产生,并且因为创伤刺激,代谢加快而增加,pHti下降系CO2蓄积引起的组织酸中毒。
, 百拇医药
30分钟以后,PtiCO2继续趋于稳定,pHti却更快地下降(图2、3)。此期VO2依赖DO2期,VO2随DO2下降而下降,因此有氧代谢产生的CO2量逐渐减少,而此期由于ATP生成减少,ATP/ADP比值降低[6],使磷酸果糖激酶、丙酮酸激酶活性增强,糖酵解增多,从糖酵解过程可以产生少量ATP,但乳酸生成不断增加,并因微循环障碍而堆积在局部组织内,导致pHti进一步下降[7]。此实验发现,休克30分钟时PtiO2约为4.0 mmHg(图1)。因此,考虑4.0 mmHg可能是有氧氧化所需的最低氧分压,亦即临界氧分压。有人认为线粒体内生物氧化所需的最低氧分压(临界氧分压)约0.067 kPa(0.5 mmHg)[8]。维持细胞呼吸的最低毛细血管氧分压(PcapO2)约为0.530 kPa(4.0 mmHg)。与本实验结果相似。Makisalo等[9]亦发现随着MAP在1小时内降至40~50 mmHg,肝组织PCO2由45±1 mmHg升高至53±1 mmHg。Takahashi等[6]采用磁共振频谱的方法测得,当MAP=40 mmHg维持50分钟后,肝组织pH明显下降。
, http://www.100md.com
3.3 复苏时肝脏代谢的变化
复苏后,有效循环血量和血红蛋白量恢复,PtiO2逐渐上升(图1)。随着微循环障碍的减轻,蓄积的CO2和乳酸逐渐运出,PtiCO2逐渐下降,pHti逐渐上升(图2、3)。但三者却并未在短时间内恢复至正常。这是因为出血性休克时,细胞所在的内外环境发生了变化,如酸碱失衡,电解质紊乱,代谢产物堆积等,导致细胞膜结构(包括线粒体)及其功能发生变化,在供氧充分的情况下,仍不能正常发挥作用[10]。还有,复苏过程中因活性氧等所致的再灌注损伤,导致复苏早期血流动力学恢复后,血管内皮细胞肿胀,管腔狭窄甚至闭塞,血流量逐渐减少;组织细胞利用氧的能力降低。Makisalo等[2]亦发现肝组织PO2休克时由32.4±1.1降至16.1±0.4 mmHg,经40分钟复苏后升至36.9±2.4 mmHg。
综上所述,严重长时间出血性休克可导致肝脏缺氧,CO2蓄积和组织酸中毒。复苏后,组织缺氧,CO2蓄积及酸中毒可部分减轻,但因为再灌注损伤等原因难以在短时间内恢复至正常。肝组织PtiO2、PtiCO2和pHti可能是评价出血性休克严重程度及复苏有效性的有用指标。尤其PtiO2=4 mmHg可能是有氧氧化所需的临界氧分压。
, 百拇医药
[参考文献]
[1]Canada AT,Stein K,Martel D.Biochemical appraisal of models for hepatic ischemia-reperfusion injury[J].Circ Shock,1992,36:163.
[2]Makisalo HJ,Soini HO,Lalla MLT,et al.Subcutaneous and liver tissue oxygen tension in hemorrhagic shock:an experimental study with whole blood and two collids[J].Crit Care Med,1988,16:857.
[3]Zhang H,Vincent JL.Arteriovenous differences in PO2 and pH are good indicators of critical hypoperfusion[J].Am Rev Respir Dis,1993,148:867.
, 百拇医药
[4]Reilly PM,Bulkley GB.Tissue injuries by free radicals and other toxic oxygen metabolites[J].Br J Surg,1990,1324.
[5]Soini HO,Takala J,Nordin AJ,et al.Peripheral and liver tissue oxygen tensions in hemorrhagic shock[J].Crit Care Med,1992,20:1330.
[6]Takahashi K,Shigemori S,Nosaka S,et al.The effects of halothane and isoflurane on the phosphoenergetic state of the liver during hemorrhagic shock in rats:an in vivo 31P nuclear magnetic resonance spectroscopic study[J].Anesth Analg,1997,85:347.
, 百拇医药
[7]Takahashi K,Nosaka S,Morikawa S,et al.Hepatic energy metabolism during katamine and Isoflurane anaesthesia in haemorrhagic shock[J].Br J Analesth,1997,85:347.
[8]Robin ED,et al.Oxygen transport and cellular respiration[A].In Frohlich ED (ed).Pathophysiology[C]:2nd ed.1976,167,Lippincott.
[9]Makisalo HJ,Soini HO,Nordin AJ,et al.Effects of bicarbonate therapy on tissue oxygenation during resuscitation of hemorrhagic shock[J].Crit Care Med,1989,17:1170[1].Van der Linden P,Gilbat E,Engelman E,et al.Effects of anesthetic agents on systemic critical O2 delivery[J].J Appl Physiol,1991,83.
[10]Nakatani T,Spolter L,Kobayashi K.Arterial ketone body ratio as a parameter of hepatic mitochondrial redox state during and after hemorrhagic shock[J].World J Surg,1995,19:592.
[收稿:2000-05-18], http://www.100md.com
单位:上海第二军医大学长征医院神经外科,200003
关键词:出血性休克;肝脏;氧分压;二氧化碳值;pH值
中国急救医学000601 [摘 要] 目的 探讨出血性休克及复苏过程中肝脏局部组织PtiO2、PtiCO2和pHti变化规律、原因及其意义。方法 家兔麻醉并放血至MAP=40 mmHg,60分钟后复苏至MAP=80 mmHg,维持30分钟。持续监测肝脏组织氧分压(PtiO2)、二氧化碳分压(PtiCO2)及酸碱度(pHti)。结果 休克过程中,PtiO2逐渐下降至0;PtiCO2升高至41.2±15.6 mmHg(P<0.001);pHti降至7.41±0.09(P<0.001)。复苏后PtiO2迅速上升并稳定在11.0±2.0 mmHg,PtiCO2逐渐下降至39.1±14.7 mmHg(P<0.001),pHti逐渐升高至7.46±0.08(P<0.001)。结论 严重长时间出血性休克可导致肝脏缺氧,CO2蓄积和组织酸中毒。复苏后,组织缺氧,CO2蓄积及酸中毒可部分减轻,但难以在短时间内恢复至正常。肝组织PtiO2、PtiCO2和pHti可能是评价缺血性休克严重程度及复苏有效性的有用指标。
, 百拇医药
[中图分类号] R 605.971;R 361.2 [文献标识码] A
[文章编号] 1002-1949(2000)06-0319-03
Alteration of liver tissue PtiO2,PtiCO2 and pHti following hemorrhagic shock in rabbits
MA Chi-yuan,GAO Jin-xi,BAO Ying-hui
(Department of Neurosurgery,Changzheng Hospital,Second Military Medical University,Shanghai 200003,China)
[Abstract] Objective To study the alteration of liver tissue PtiO2,PtiCO2 and pHti,and their roles following hemorrhagic shock.Methods The rabbits were anesthetized and bled to an MAP of 40 mmHg,and then resusciated to an MAP of 80 mmHg after 60 min.We measured liver tissue PtiO2,PtiCO2 and pHti during hemorrhagic shock and followed resusciation.Results During shock,PtiO2 decreased to zero gradully,PtiCO2 increased slowly at first,then fastly,and slowly again at last to 41.2±15.6 mmHg(P<0.001),pHti decreased to 7.41±0.09(P<0.001).During resusciation,significant increases of PtiO2 to 11.0±2.0 mmHg,and pHti to 7.46±0.08 (P<0.001) as well as a reduction of PtiO2 to 39.1±14.7 mmHg(P<0.001) were observed.Conclusions Severe and long time hemorrhagic shock may lead to hyponea,hyper CO2 and acidosis in the liver.During resusciation,these indexes may recover partly,but not return to normal in short time.Liver tissue PtiO2,PtiCO2,and pHti may be useful indexes in hemorrhagic shock and resusciation.
, 百拇医药
[Key words] Hemorrhagic shock; Liver; PtiO2; PtiCO2; pHti▲
肝脏血液供应丰富,休克及复苏是其最常见的缺血—再灌注损伤原因。休克时,由于微循环动脉血流量急剧减少,引起组织严重缺氧,导致细胞功能障碍和死亡[1]。因此,测定组织氧分压(PtiO2)可以及时发现和防治休克引起的组织缺氧和多脏器衰竭,降低危重患者的病死率[2]。休克多伴有代谢性酸中毒,微循环障碍导致二氧化碳蓄积。这些都间接反映组织缺氧,并影响细胞和组织器官功能。因此,监测组织酸碱度(pHti)和二氧化碳分压(PtiCO2)亦有助于早期发现和防治休克[3]。由于再灌注损伤休克病人多器官功能衰竭常发生于复苏早期[4]。因此,PtiO2、pHti和PtiCO2监测在复苏期仍有重要意义。所以,出血性休克时肝脏组织PtiO2、pHti和PtiCO2值变化的研究对于休克的早期发现和指导复苏都具有重要意义。
, 百拇医药
1 材料与方法
1.1 动物准备
选择健康新西兰雌性大白兔16只,平均体重1.7~2.2 kg。随机分为实验组和对照组。两组均禁食16小时(随意饮水),异丙酚5 mg/kg体重经耳缘静脉麻醉,以后每30分钟静注异丙酚2.5 mg/kg体重和芬太尼12.5 μg/kg体重。麻醉后将兔仰卧位固定于实验台上,行气管插管,自主呼吸空气。左侧股动脉、股静脉及右侧股静脉插管。左侧股动脉插管接血压计(X11D型,上海医疗器械公司,中国上海),直接法监测平均动脉压(MAP)。沿正中线切开腹腔,将组织气体分析仪(Diametrics Medical Inc.Minnesota,USA)的Neurotrend探头自肝右叶下缘插入肝实质内约4厘米,并固定。缝合腹腔及股部切口。手术结束后,肝素化(50 U/kg体重),1小时后给半量。
1.2 实验步骤
, 百拇医药
术后稳定30分钟。读取MAP、肝组织PtiO2、pHti、PtiCO2。实验组从右侧股静脉于5分钟内均匀放血至MAP=40 mmHg,若血压升高则少量放血,若血压下降则少量回输血液。维持60分钟后,经左侧股静脉回输抗凝自体血,并静脉滴注平衡液至MAP=80 mmHg,维持30分钟。持续监测PtiO2、pHti、PtiCO2值。对照组除放血外均与实验组相同。
1.3 肝组织病理学检查
实验组分别于放血前、复苏前及复苏30分钟后,对照组亦分别于相同时间,取肝组织(右叶)进行下列处理:①10%福尔马林固定,石蜡包埋,HE染色,光镜观察。②3%戊二醛及四氧化锇双重固定,环氧树脂618包埋,LKB超薄切片机切片,HITACHI 800电镜观察。
1.4 统计学分析
, 百拇医药
数据以
 ±s表示。采用配对t检验进行差异检验,P值小于0.05认为有显著差异。
±s表示。采用配对t检验进行差异检验,P值小于0.05认为有显著差异。2 结果
2.1 放血与补液 实验兔放血前MAP=82.50±6.55 mmHg,放血35.63±9.35 ml后MAP降至40 mmHg。休克期MAP有所波动,通过放血或输血保持血压稳定。复苏阶段,先回输自体抗凝血,再静滴平衡液68.13±18.31 ml,使MAP上升至80 mmHg,并维持30分钟。实验过程中对照组MAP无明显变化。
2.2 肝组织氧分压(PtiO2)的变化 实验组放血前PtiO2=22.4±8.3 mmHg,放血至MAP=40 mmHg后,PtiO2逐渐下降,在29.0±13.0分钟内降至4 mmHg以下,在35.3±10.7分钟内降至0,直至复苏。复苏后,PtiO2在8.1±6.9分钟内上升至4 mmHg以上,并最终稳定在11.0±2.0 mmHg,而尤以复苏最初15分钟上升较快,后15分钟则上升缓慢。而对照组PtiO2始终无明显变化(图1)。

, 百拇医药
图1 出血性休克时肝脏PtiO2的变化
2.3 肝组织酸碱度(pHti)的变化 实验组放血前pHti=7.49±0.10,放血至MAP=40 mmHg后,最初缓慢下降,5分钟后下降较快,30分钟左右下降减慢并稳定在7.41±0.09(P<0.001)。复苏后,pHti逐渐升高至7.46±0.08(P<0.010),而对照组PtiO2始终无明显变化(图2)。

图2 出血性休克时肝脏pHti的变化
2.4 肝组织二氧化碳分压(PtiCO2)的变化 实验组放血前PtiCO2=36.7±15.3 mmHg,放血至MAP=40 mmHg后,最初缓慢升高,5分钟后升高较快,约30分钟左右升高减慢并稳定在41.2±15.6 mmHg(P<0.001)。复苏后,PtiCO2逐渐下降至39.1±14.7 mmHg(P<0.001)(图3)。而对照组PtiCO2始终无明显变化。

, 百拇医药
图3 出血性休克时肝脏PtiCO2的变化
2.5 肝脏病理学检查 光镜发现,休克60分钟后,小叶中央区及中间区较大范围的肝细胞脂肪变(小脂滴),另可见小灶性的肝细胞坏死,局部中性白细胞浸润。复苏30分钟后,中央静脉周围肝细胞变性,并可见到肝细胞坏死,严重者累及2区及3区。电镜发现,休克60分钟后,肝细胞窦面的微绒毛消失,细胞膜伸展,局部断裂。近窦面的细胞质中出现大小不等的空泡。线粒体基质致密颗粒消失。粗面内质网开始有局部断裂,泡状囊腔增多,长形囊腔有串珠状膨大。复苏30分钟后,肝细胞毛细胆管面的微绒毛肿大,部分消失。胞质内的空泡亦分布于核附近和毛细胆管周围。线粒体肿胀变圆,基质变淡,嵴短而间隙增宽。粗面内质网囊腔扩大、断裂,开始脱颗粒。
3 讨论
3.1 肝脏血供丰富,肝细胞对缺血缺氧敏感。出血性休克时肝脏损害已经引起人们注意。其根本原因是组织缺氧。一方面,血红蛋白含量减少,致血液携带氧减少,血氧含量降低,引起血液性缺氧;另一方面,由于微循环障碍,动脉灌流急剧减少,而引起循环性缺氧。Soini等[5]发现MAP下降30%,肝组织PO2下降33%(从30±3到20±3 mmHg)。Makisalo等[2]发现MAP在1小时内降至40~50 mmHg,肝组织PO2从32.4±1.1降至16.1±0.4 mmHg。而此实验维持MAP=40 mmHg 60分钟,PtiO2从22.4±8.3 mmHg逐渐降至0(图1),降低幅度相近。
, 百拇医药
3.2 出血性休克时肝脏代谢的改变
生理条件下,耗氧量(VO2)是自变量,取决于代谢率,供氧量(DO2)是应变量,随VO2变化。DO2降低时,机体通过提高氧提取率(O2ER),血液重新分配和(或)增加心输出量(Q)来保证VO2恒定(VO2不依赖DO2期)。DO2降至临界值(临界供氧量DO2-Crit)以下时,O2ER虽然继续增大,但不能满足组织对氧的需要,VO2随DO2线性降低,即表现为“VO2依赖DO2期”。本实验所测PtiO2为供氧量与耗氧量之差。
实验发现休克30分钟内,PtiCO2逐渐升高,pHti逐渐下降(图2、3)。考虑此时处于VO2不依赖DO2期,CO2主要由有氧代谢产生,并且因为创伤刺激,代谢加快而增加,pHti下降系CO2蓄积引起的组织酸中毒。
, 百拇医药
30分钟以后,PtiCO2继续趋于稳定,pHti却更快地下降(图2、3)。此期VO2依赖DO2期,VO2随DO2下降而下降,因此有氧代谢产生的CO2量逐渐减少,而此期由于ATP生成减少,ATP/ADP比值降低[6],使磷酸果糖激酶、丙酮酸激酶活性增强,糖酵解增多,从糖酵解过程可以产生少量ATP,但乳酸生成不断增加,并因微循环障碍而堆积在局部组织内,导致pHti进一步下降[7]。此实验发现,休克30分钟时PtiO2约为4.0 mmHg(图1)。因此,考虑4.0 mmHg可能是有氧氧化所需的最低氧分压,亦即临界氧分压。有人认为线粒体内生物氧化所需的最低氧分压(临界氧分压)约0.067 kPa(0.5 mmHg)[8]。维持细胞呼吸的最低毛细血管氧分压(PcapO2)约为0.530 kPa(4.0 mmHg)。与本实验结果相似。Makisalo等[9]亦发现随着MAP在1小时内降至40~50 mmHg,肝组织PCO2由45±1 mmHg升高至53±1 mmHg。Takahashi等[6]采用磁共振频谱的方法测得,当MAP=40 mmHg维持50分钟后,肝组织pH明显下降。
, http://www.100md.com
3.3 复苏时肝脏代谢的变化
复苏后,有效循环血量和血红蛋白量恢复,PtiO2逐渐上升(图1)。随着微循环障碍的减轻,蓄积的CO2和乳酸逐渐运出,PtiCO2逐渐下降,pHti逐渐上升(图2、3)。但三者却并未在短时间内恢复至正常。这是因为出血性休克时,细胞所在的内外环境发生了变化,如酸碱失衡,电解质紊乱,代谢产物堆积等,导致细胞膜结构(包括线粒体)及其功能发生变化,在供氧充分的情况下,仍不能正常发挥作用[10]。还有,复苏过程中因活性氧等所致的再灌注损伤,导致复苏早期血流动力学恢复后,血管内皮细胞肿胀,管腔狭窄甚至闭塞,血流量逐渐减少;组织细胞利用氧的能力降低。Makisalo等[2]亦发现肝组织PO2休克时由32.4±1.1降至16.1±0.4 mmHg,经40分钟复苏后升至36.9±2.4 mmHg。
综上所述,严重长时间出血性休克可导致肝脏缺氧,CO2蓄积和组织酸中毒。复苏后,组织缺氧,CO2蓄积及酸中毒可部分减轻,但因为再灌注损伤等原因难以在短时间内恢复至正常。肝组织PtiO2、PtiCO2和pHti可能是评价出血性休克严重程度及复苏有效性的有用指标。尤其PtiO2=4 mmHg可能是有氧氧化所需的临界氧分压。
, 百拇医药
[参考文献]
[1]Canada AT,Stein K,Martel D.Biochemical appraisal of models for hepatic ischemia-reperfusion injury[J].Circ Shock,1992,36:163.
[2]Makisalo HJ,Soini HO,Lalla MLT,et al.Subcutaneous and liver tissue oxygen tension in hemorrhagic shock:an experimental study with whole blood and two collids[J].Crit Care Med,1988,16:857.
[3]Zhang H,Vincent JL.Arteriovenous differences in PO2 and pH are good indicators of critical hypoperfusion[J].Am Rev Respir Dis,1993,148:867.
, 百拇医药
[4]Reilly PM,Bulkley GB.Tissue injuries by free radicals and other toxic oxygen metabolites[J].Br J Surg,1990,1324.
[5]Soini HO,Takala J,Nordin AJ,et al.Peripheral and liver tissue oxygen tensions in hemorrhagic shock[J].Crit Care Med,1992,20:1330.
[6]Takahashi K,Shigemori S,Nosaka S,et al.The effects of halothane and isoflurane on the phosphoenergetic state of the liver during hemorrhagic shock in rats:an in vivo 31P nuclear magnetic resonance spectroscopic study[J].Anesth Analg,1997,85:347.
, 百拇医药
[7]Takahashi K,Nosaka S,Morikawa S,et al.Hepatic energy metabolism during katamine and Isoflurane anaesthesia in haemorrhagic shock[J].Br J Analesth,1997,85:347.
[8]Robin ED,et al.Oxygen transport and cellular respiration[A].In Frohlich ED (ed).Pathophysiology[C]:2nd ed.1976,167,Lippincott.
[9]Makisalo HJ,Soini HO,Nordin AJ,et al.Effects of bicarbonate therapy on tissue oxygenation during resuscitation of hemorrhagic shock[J].Crit Care Med,1989,17:1170[1].Van der Linden P,Gilbat E,Engelman E,et al.Effects of anesthetic agents on systemic critical O2 delivery[J].J Appl Physiol,1991,83.
[10]Nakatani T,Spolter L,Kobayashi K.Arterial ketone body ratio as a parameter of hepatic mitochondrial redox state during and after hemorrhagic shock[J].World J Surg,1995,19:592.
[收稿:2000-05-18], http://www.100md.com