携氧液对大鼠高血压脑出血脑保护的实验研究
作者:刘宏毅 李明 邹元杰 张岩松 常义 肖红
单位:刘宏毅 邹元杰 张岩松 常义(南京医科大学附属脑科医院神经外科 210029);李明(南京大学医学院研究生);肖红(南京医科大学附属脑科医院神经生化室)
关键词:携氧液;脑出血
临床神经病学杂志000605 【摘要】 目的 研究携氧液对大鼠高血压脑出血脑组织的保护作用。方法 通过立体定向手术对大鼠脑尾状核用胶原酶加肝素联合注射诱导大鼠出血模型,观察各组大鼠脑含水量、组织形态学、脑血流及生化指标的变化。结果 B组 (非携氧液组)患侧组织形态学及细胞器损伤明显较A组(携氧液组)严重;B组脑含水量(80.55±0.80%)高于A组(77.94±1.16%)、B组髓鞘碱性蛋白(MBP)和神经元特异性烯醇化酶(NSE)分别为0.87±0.44 ng/ml、1.74±0.68 ng/ml,A组为0.54±0.19 ng/ml、1.19±0.49 ng/ml,两组具有显著性差异(均P<0.01)。结论 携氧液对高血压脑出血的血肿周围脑组织有良好的保护作用。
, 百拇医药
Protective effect of oxygen-carrying liquid to brain tissue after hypertensive intracerebral hemorrhage in rats
Liu Hongyi, Li Ming, Zhou Yuanjie, et al.
(Department of Neurosurgery,Brain Hospital Affiliated to Nanjing Medical University,Nanjing 210029)
【Abstract】 Objective To study the protective effect of oxygen-carrying liquid to brain tissue after hypertensive intracerebral hemorrhage in rats.Methods Collagenase and heparin were injected into the caudate nucleus of rats by stereotactic operation to induce a hemorrhage model,we observed the water content of brain,the morphology of the brain,the change of cerebral blood flow (CBF) and biochemical markers in each group.Results Group B without oxygen-carrying liquid had more serious injury than group A with oxygen-carrying liquid.Water content of brain tissue in group B (80.55±0.80%) was higher than group A (77.94±1.16%),group B had higher MBP levels(0.87±0.44 ng/ml) than group A (0.54±0.19 ng/ml), group B had higher NSE levels (1.74±0.68 ng/ml) than group A (1.19±0.49 ng/ml),There was remarkable difference in the two groups.Conclusion The oxygen-carrying liquid had fine protective effect to the brain tissue around the hematoma after hypertensive intracerebral hemorrhage.
, 百拇医药
【Key words】 Oxygen-carrying liquid Cerebral hemorrhage
目前对高血压脑出血的治疗尽管采用了超早期开瓣血肿清除、立体定向血肿排空等各种方法以挽救病人生命,但是对血肿周围缺血缺氧的脑组织—即半暗带的早期干预仍缺少有效的措施,使受损的神经功能难以恢复。为此,我们应用携氧液对脑出血动物模型进行研究,以探讨其对脑缺血、缺氧及脑水肿的疗效。
1 材料与方法
1.1 实验动物及分组 采用有卒中倾向的自发性高血压大鼠50只,体重200~230克,雌雄不拘,随机分为3组。A组:携氧液组20只;B组:非携氧液组20只;C组:空白对照组10只。
1.2 实验模型制作 大鼠用戊巴比妥钠腹腔注射麻醉(30 mg/kg),俯卧位固定于立体定向仪。头皮正中切口约8.0 mm,于颅骨背侧前囟后0.2 mm、中线旁开2.0 mm处钻孔,用固定于立体定向仪上的微量注射器沿钻孔进针,深度6 mm(尾状核位置),注射混合液(Ⅱ型胶原酶0.5 mg/ml加肝素12500 U/ml)1 μl,退针后缝合头皮。术后2小时可形成直径2~3 mm血肿[1]。全部大鼠均于术后6小时处死,取血离心,取上层血清,置于-73℃超低温冰箱内保存备用。3组均于术后2小时给予大鼠股静脉插管输液,滴速每分钟12~14滴。A组输携氧液,将地塞米松20 mg、速尿20 mg、维生素C 2.0 g加入复方乳酸钠500 ml溶液中,然后置于4℃冰箱冷藏备用,应用时采用袁氏法进行充氧,调节氧流量0.5 L/min,充氧10分钟,使液体氧分压达到66.6~79.7 kPa(500~600 mmHg)。B组输非携氧液:液体配置同携氧液,但不充氧。 C组输复方乳酸钠500 ml加速尿20 mg。
, 百拇医药
1.3 观察指标
1.3.1 神经元特异性烯醇化酶(NSE) 采用酶联免疫法(ELISA)检测各份血清样品,用酶联仪在492 nm波长依序测量各孔的光密度(OD值)和浓度。
1.3.2 血清髓鞘碱性蛋白(MBP) 采用ELISA方法检测各份血清样品,用酶联仪在450 nm波长依序测量各孔的光密度(OD值)和浓度。
1.3.3 局部脑血流量(rCBF) 采用激光多普勒血流测定仪(LDF),测量皮质表面的微循环血流量。
1.3.4 病理学检查 取脑切片置于2%氯化2,3,5-三苯甲基四氯唑(TTC)液体内,37℃避光温育40分钟,移至10%甲醛溶液内固定,照相观察苍白区范围;取脑固定于10%甲醛溶液内24小时以上,脱水、石蜡包埋、切片、HE染色,观察组织学变化;取血肿周围5 mm组织固定于2.5%戊二醛溶液中,制透射电镜切片,观察神经细胞线粒体、突起等亚细胞结构。
, http://www.100md.com
1.3.5 脑含水量测定 取冠状脑切片,取血肿周围脑组织2~3块(约1 mm3),称取湿重后,在110℃红外线干燥箱中烘干24小时至恒重,称取干重,脑含水量(%)=(湿重-干重)×100/湿重。
1.4 统计学处理 计量资料以均数加减标准差(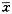 ±s)表示,采用t检验。
±s)表示,采用t检验。
2 结 果
2.1 形态学改变
2.1.1 大体标本观察结果 携氧组TTC染色健侧与患侧均呈淡红色;非携氧组及对照组的TTC染色患侧呈苍白色,健侧呈淡红色。
2.1.2 光镜观察结果 携氧组血肿旁的缺血区神经细胞有脱髓鞘及轻度水肿改变,偶见神经细胞核固缩(图1)。非携氧组血肿旁的缺血区普遍可见神经细胞核固缩及脱髓鞘(图2),对照组更显著并有凋亡小体形成。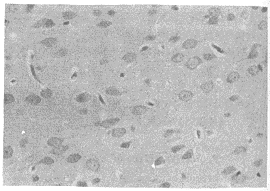
, 百拇医药
图1 携氧组血肿旁的缺血区神经细胞有脱髓鞘及轻度水肿改变,偶见神经细胞核固缩(×400)
图2 非携氧组血肿旁的缺血区普遍可见神经细胞核变性(×400)
2.1.3 透射电镜观察结果 携氧组血肿旁的缺血区神经细胞内线粒体轻度肿胀(图3),突起内微管肿胀不明显。非携氧组血肿旁的缺血区神经细胞内线粒体显著肿胀,嵴少(图4);突起内微管及线粒体肿胀明显;毛细血管内皮细胞线粒体肿胀、变性,血管周围星形胶质细胞肿胀明显,对照组变化程度更显著。
2.2 局部脑血流量测定结果 携氧组皮质表面微循环血流量均数为223.75±29.47,非携氧组为188.75±14.48,但样本数量少(各4例),有待进一步观察。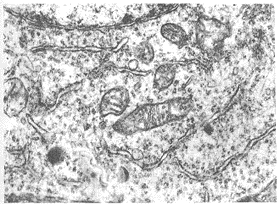
, 百拇医药
图3 携氧组血肿旁的缺血区神经细胞内线粒体轻度肿胀(×20k)
图4 非携氧组血肿旁的缺血区神经细胞内线粒体显著肿胀,嵴少(×20k)
2.3 脑组织样本含水量、髓鞘碱性蛋白、神经元特异性烯醇化酶变化比较,两组动物有明显差异(均P<0.01),提示携氧液对缺氧损伤脑组织有保护作用(表1)。
表1 3组含水量、血清MBP和NSE浓度比较(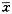 ±s) 组别
±s) 组别
含水量(%)
MBP(ng/ml)
, 百拇医药 NSE(ng/ml)
携氧组
(n=20)
77.94±1.16*
0.54±0.19**
1.19±0.48**
非携氧组
(n=20)
80.55±0.79
0.87±0.44
1.74±0.68
, 百拇医药
对照组
(n=10)
82.42±1.10
与非携氧组及对照组比*P<0.01,与非携氧组比**P<0.013 讨 论
脑组织对缺氧耐受力低,脑出血后周围脑组织因缺血缺氧将迅速产生一系列病理生理改变,这是影响患者预后的重要因素。本实验证实脑缺血后6小时脑组织有缺血性损伤:TTC染色不能着色而呈现苍白,光镜发现该区域神经细胞变性坏死,并有凋亡小体形成;电镜下可见细胞内线粒体及微管结构明显肿胀,嵴减少。这是由于机体在缺血缺氧时线粒体膜损伤,线粒体呼吸功能发生障碍使其高度肿胀,线粒体的功能障碍将引起脑神经细胞的损伤。由此可见脑出血的外科治疗不仅是血肿的清除,同时应注重缺血区脑保护的研究。长期以来,人们设法恢复血肿周围缺血区神经细胞功能,在实验室缺血模型中观察了许多种增加氧供的方法,如控制灌注压、血液流变学和提高血液携氧能力等。最近,Watson等[2]使用一种新的氧输送剂RSR-13来提高缺血区血流的氧输送,RSR-13通过改变血红蛋白(Hb)分子构型,使Hb氧离曲线向右移动,提高氧从Hb释放。但是当动脉血氧浓度较低时,RSR-13的疗效受到限制。显微镜观察鼠脑皮质发现10%~20%的脑毛细血管在任何时候都不含有红细胞[3],而携氧液内物理溶解状态的氧将向低氧区弥散,从而弥补该区域的缺氧。本实验证实携氧液治疗组的病理变化明显轻于非携氧液组。
, http://www.100md.com
脑出血后周围脑组织多有不同程度的水肿,产生水肿的因素很多。本组发现在脑出血后6小时,缺血区血管内皮细胞变性,血管周围星形胶质细胞轴突肿胀,反映血脑屏障(BBB)遭受损害,血管通透性增加,液体得以渗出而产生细胞外水肿;携氧液治疗组电镜下未见明显血脑屏障损害,周围水肿明显减轻,说明脑毛细血管内皮细胞对缺氧非常敏感,携氧液有助于细胞外水肿的预防。现有研究发现脑缺血再灌流后自由基明显升高,可直接造成细胞的损伤而发生脑水肿, 自由基清除剂可明显减轻脑缺血后脑水肿[4、5]。地塞米松及维生素C等具有自由基清除作用[6],本组实验结果显示在应用地塞米松及维生素C后,非携氧组脑含水量(80.55±0.79%)与对照组脑含水量(82.42±1.10%)相比,前者显著低于后者(P<0.01),说明脑出血后应用自由基清除剂有利于减轻脑水肿;而携氧组的脑含水量(77.94±1.16%)与非携氧组相比,前者显著低于后者(P<0.01),且携氧组神经细胞的病理改变明显轻于非携氧组,说明携氧液对缺氧脑组织有保护作用。
, http://www.100md.com
脑出血后血肿周围脑组织将出现不同程度的缺血。Suzuki等[7]用XeCT对7例壳核出血、血肿量为中等大小病人的局部脑血流(rCBF)进行了测定,发现血肿区的脑血流量非常低。Kanaya等[8]也报告血肿区和周围水肿区脑血流、糖代谢成比例地降低。本实验也观察到患侧脑血流量减少,但携氧组脑血流量高于非携氧组,这是由于后者脑水肿显著,颅内压高于前者,脑血液回流阻力增加,而脑血流量与脑血管阻力之间成反比关系[9],故患侧半球血流量减少。
髓鞘碱性蛋白(MBP)是神经髓鞘特有的蛋白质,当中枢神经损伤时髓鞘亦受到不同程度的破坏,MBP向脑脊液中释放,若伴有血脑屏障破坏时则进入血液中,因此脑脊液和血清中MBP含量测定是脑实质性破坏或脱髓鞘的生化指标。Strand等[10]报道在急性脑血管病时,MBP变化与临床表现和CT表现相一致,与预后也有良好的相关性。神经元特异性烯醇化酶是定位于神经元和神经内分泌细胞内的特异性的糖酵解酶,在神经元损伤和坏死时, NSE从细胞内溢出进入脑脊液和血液中,使两种液体内NSE都升高,且脑脊液和血清NSE明显升高者预后不良[11、12]。因此MBP与NSE是敏感的高特异性体内神经元损伤的标志。本组以这两种酶评价携氧与非携氧组的神经生化改变,结果非携氧组的血清含量显著高于携氧组。
, 百拇医药
从本实验可以看到,自发性高血压大鼠脑出血后,血肿周围组织因缺血缺氧而发生神经细胞线粒体及突起内微管结构损伤,细胞普遍变性坏死,并较快形成凋亡小体,说明脑出血后仅清除血肿是不够的,在出血早期应对缺血缺氧脑组织进行干预,改善脑的供氧,挽救可逆性损害的神经元。实验结果表明与非携氧组相比,携氧组神经细胞结构的损伤明显减轻,髓鞘碱性蛋白及神经元特异性烯醇化酶的血清含量亦佐证如此。说明在脑出血早期应用携氧液可以有效地改善脑缺氧、缩小半暗带区域、减轻脑水肿,保护大脑皮质神经细胞功能,因此对于高血压脑出血的脑保护具有重要意义。
参 考 文 献
1,任泽光,吴建中.大鼠脑出血模型.中华神经外科杂志,1993,9:205
2,Watson JC, Doppenberg EMR, Bullock MR, et al. Effects of the allosteric modification of hemoglobin on brain oxygen and infarct size in a feline model of stroke.Stroke,1997,28:1624
, http://www.100md.com
3,Tajima A, Nakata H, Lin SZ, et al. Differences and similarities in albumin and red blood cell flows through cerebral microvessels.Am J Physiol,1992,262:1515
4,Yamamoto M,Shima T, Uozumi T, et al. A possible of lipid peroxidation in cellular damages caused by cerebral ischemia and the protective effect of tocopherol administration. Stroke, 1983,14:977
5,Martz D, Beer M, Betz AL. Dimethylthiourea reduces ischemic brain edema without affecting cerebral blood flow. J Cerebral Blood Flow and Metablism, 1990,10:352
, http://www.100md.com
6,江基尧,朱诚.现代颅脑损伤学.第二军医大学出版社,1999.133~148
7,Suzuki R , Ohno K, Matsushima Y, et al. Serial changes in focal hyperemia associated with hypertensive putaminal hemorrhage . Stroke, 1988,19:322
8,Kanaya H. Hypertensive intracerebral hemarrhag.New York:Raven Press,1983.147
9,王忠诚.神经外科学.第1版.武汉:湖北科学技术出版社,1998.60
10,Strand T. Brain and plasma in spinal fluid as markers for brain damage and severity of stroke.Stroke,1984,15:138
, http://www.100md.com
11,Yamazaki Y, Yada K, Morii S, et al. Diagnostic significance of serum neuron-specific enolase and myelin basic protein assay in patients with acute head injury. Surg Neurol, 1995,43:267
12,Ross SA, Cunningham RT, Johnston CF, et al. Neuron specific enolase as an aid to outcome prediction in head injury. British Journal of Neurosurgery,1996,10:471
(收稿2000-06-05,修回2000-08-04), http://www.100md.com
单位:刘宏毅 邹元杰 张岩松 常义(南京医科大学附属脑科医院神经外科 210029);李明(南京大学医学院研究生);肖红(南京医科大学附属脑科医院神经生化室)
关键词:携氧液;脑出血
临床神经病学杂志000605 【摘要】 目的 研究携氧液对大鼠高血压脑出血脑组织的保护作用。方法 通过立体定向手术对大鼠脑尾状核用胶原酶加肝素联合注射诱导大鼠出血模型,观察各组大鼠脑含水量、组织形态学、脑血流及生化指标的变化。结果 B组 (非携氧液组)患侧组织形态学及细胞器损伤明显较A组(携氧液组)严重;B组脑含水量(80.55±0.80%)高于A组(77.94±1.16%)、B组髓鞘碱性蛋白(MBP)和神经元特异性烯醇化酶(NSE)分别为0.87±0.44 ng/ml、1.74±0.68 ng/ml,A组为0.54±0.19 ng/ml、1.19±0.49 ng/ml,两组具有显著性差异(均P<0.01)。结论 携氧液对高血压脑出血的血肿周围脑组织有良好的保护作用。
, 百拇医药
Protective effect of oxygen-carrying liquid to brain tissue after hypertensive intracerebral hemorrhage in rats
Liu Hongyi, Li Ming, Zhou Yuanjie, et al.
(Department of Neurosurgery,Brain Hospital Affiliated to Nanjing Medical University,Nanjing 210029)
【Abstract】 Objective To study the protective effect of oxygen-carrying liquid to brain tissue after hypertensive intracerebral hemorrhage in rats.Methods Collagenase and heparin were injected into the caudate nucleus of rats by stereotactic operation to induce a hemorrhage model,we observed the water content of brain,the morphology of the brain,the change of cerebral blood flow (CBF) and biochemical markers in each group.Results Group B without oxygen-carrying liquid had more serious injury than group A with oxygen-carrying liquid.Water content of brain tissue in group B (80.55±0.80%) was higher than group A (77.94±1.16%),group B had higher MBP levels(0.87±0.44 ng/ml) than group A (0.54±0.19 ng/ml), group B had higher NSE levels (1.74±0.68 ng/ml) than group A (1.19±0.49 ng/ml),There was remarkable difference in the two groups.Conclusion The oxygen-carrying liquid had fine protective effect to the brain tissue around the hematoma after hypertensive intracerebral hemorrhage.
, 百拇医药
【Key words】 Oxygen-carrying liquid Cerebral hemorrhage
目前对高血压脑出血的治疗尽管采用了超早期开瓣血肿清除、立体定向血肿排空等各种方法以挽救病人生命,但是对血肿周围缺血缺氧的脑组织—即半暗带的早期干预仍缺少有效的措施,使受损的神经功能难以恢复。为此,我们应用携氧液对脑出血动物模型进行研究,以探讨其对脑缺血、缺氧及脑水肿的疗效。
1 材料与方法
1.1 实验动物及分组 采用有卒中倾向的自发性高血压大鼠50只,体重200~230克,雌雄不拘,随机分为3组。A组:携氧液组20只;B组:非携氧液组20只;C组:空白对照组10只。
1.2 实验模型制作 大鼠用戊巴比妥钠腹腔注射麻醉(30 mg/kg),俯卧位固定于立体定向仪。头皮正中切口约8.0 mm,于颅骨背侧前囟后0.2 mm、中线旁开2.0 mm处钻孔,用固定于立体定向仪上的微量注射器沿钻孔进针,深度6 mm(尾状核位置),注射混合液(Ⅱ型胶原酶0.5 mg/ml加肝素12500 U/ml)1 μl,退针后缝合头皮。术后2小时可形成直径2~3 mm血肿[1]。全部大鼠均于术后6小时处死,取血离心,取上层血清,置于-73℃超低温冰箱内保存备用。3组均于术后2小时给予大鼠股静脉插管输液,滴速每分钟12~14滴。A组输携氧液,将地塞米松20 mg、速尿20 mg、维生素C 2.0 g加入复方乳酸钠500 ml溶液中,然后置于4℃冰箱冷藏备用,应用时采用袁氏法进行充氧,调节氧流量0.5 L/min,充氧10分钟,使液体氧分压达到66.6~79.7 kPa(500~600 mmHg)。B组输非携氧液:液体配置同携氧液,但不充氧。 C组输复方乳酸钠500 ml加速尿20 mg。
, 百拇医药
1.3 观察指标
1.3.1 神经元特异性烯醇化酶(NSE) 采用酶联免疫法(ELISA)检测各份血清样品,用酶联仪在492 nm波长依序测量各孔的光密度(OD值)和浓度。
1.3.2 血清髓鞘碱性蛋白(MBP) 采用ELISA方法检测各份血清样品,用酶联仪在450 nm波长依序测量各孔的光密度(OD值)和浓度。
1.3.3 局部脑血流量(rCBF) 采用激光多普勒血流测定仪(LDF),测量皮质表面的微循环血流量。
1.3.4 病理学检查 取脑切片置于2%氯化2,3,5-三苯甲基四氯唑(TTC)液体内,37℃避光温育40分钟,移至10%甲醛溶液内固定,照相观察苍白区范围;取脑固定于10%甲醛溶液内24小时以上,脱水、石蜡包埋、切片、HE染色,观察组织学变化;取血肿周围5 mm组织固定于2.5%戊二醛溶液中,制透射电镜切片,观察神经细胞线粒体、突起等亚细胞结构。
, http://www.100md.com
1.3.5 脑含水量测定 取冠状脑切片,取血肿周围脑组织2~3块(约1 mm3),称取湿重后,在110℃红外线干燥箱中烘干24小时至恒重,称取干重,脑含水量(%)=(湿重-干重)×100/湿重。
1.4 统计学处理 计量资料以均数加减标准差(
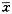 ±s)表示,采用t检验。
±s)表示,采用t检验。2 结 果
2.1 形态学改变
2.1.1 大体标本观察结果 携氧组TTC染色健侧与患侧均呈淡红色;非携氧组及对照组的TTC染色患侧呈苍白色,健侧呈淡红色。
2.1.2 光镜观察结果 携氧组血肿旁的缺血区神经细胞有脱髓鞘及轻度水肿改变,偶见神经细胞核固缩(图1)。非携氧组血肿旁的缺血区普遍可见神经细胞核固缩及脱髓鞘(图2),对照组更显著并有凋亡小体形成。

, 百拇医药
图1 携氧组血肿旁的缺血区神经细胞有脱髓鞘及轻度水肿改变,偶见神经细胞核固缩(×400)

图2 非携氧组血肿旁的缺血区普遍可见神经细胞核变性(×400)
2.1.3 透射电镜观察结果 携氧组血肿旁的缺血区神经细胞内线粒体轻度肿胀(图3),突起内微管肿胀不明显。非携氧组血肿旁的缺血区神经细胞内线粒体显著肿胀,嵴少(图4);突起内微管及线粒体肿胀明显;毛细血管内皮细胞线粒体肿胀、变性,血管周围星形胶质细胞肿胀明显,对照组变化程度更显著。
2.2 局部脑血流量测定结果 携氧组皮质表面微循环血流量均数为223.75±29.47,非携氧组为188.75±14.48,但样本数量少(各4例),有待进一步观察。

, 百拇医药
图3 携氧组血肿旁的缺血区神经细胞内线粒体轻度肿胀(×20k)

图4 非携氧组血肿旁的缺血区神经细胞内线粒体显著肿胀,嵴少(×20k)
2.3 脑组织样本含水量、髓鞘碱性蛋白、神经元特异性烯醇化酶变化比较,两组动物有明显差异(均P<0.01),提示携氧液对缺氧损伤脑组织有保护作用(表1)。
表1 3组含水量、血清MBP和NSE浓度比较(
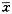 ±s) 组别
±s) 组别含水量(%)
MBP(ng/ml)
, 百拇医药 NSE(ng/ml)
携氧组
(n=20)
77.94±1.16*
0.54±0.19**
1.19±0.48**
非携氧组
(n=20)
80.55±0.79
0.87±0.44
1.74±0.68
, 百拇医药
对照组
(n=10)
82.42±1.10
与非携氧组及对照组比*P<0.01,与非携氧组比**P<0.013 讨 论
脑组织对缺氧耐受力低,脑出血后周围脑组织因缺血缺氧将迅速产生一系列病理生理改变,这是影响患者预后的重要因素。本实验证实脑缺血后6小时脑组织有缺血性损伤:TTC染色不能着色而呈现苍白,光镜发现该区域神经细胞变性坏死,并有凋亡小体形成;电镜下可见细胞内线粒体及微管结构明显肿胀,嵴减少。这是由于机体在缺血缺氧时线粒体膜损伤,线粒体呼吸功能发生障碍使其高度肿胀,线粒体的功能障碍将引起脑神经细胞的损伤。由此可见脑出血的外科治疗不仅是血肿的清除,同时应注重缺血区脑保护的研究。长期以来,人们设法恢复血肿周围缺血区神经细胞功能,在实验室缺血模型中观察了许多种增加氧供的方法,如控制灌注压、血液流变学和提高血液携氧能力等。最近,Watson等[2]使用一种新的氧输送剂RSR-13来提高缺血区血流的氧输送,RSR-13通过改变血红蛋白(Hb)分子构型,使Hb氧离曲线向右移动,提高氧从Hb释放。但是当动脉血氧浓度较低时,RSR-13的疗效受到限制。显微镜观察鼠脑皮质发现10%~20%的脑毛细血管在任何时候都不含有红细胞[3],而携氧液内物理溶解状态的氧将向低氧区弥散,从而弥补该区域的缺氧。本实验证实携氧液治疗组的病理变化明显轻于非携氧液组。
, http://www.100md.com
脑出血后周围脑组织多有不同程度的水肿,产生水肿的因素很多。本组发现在脑出血后6小时,缺血区血管内皮细胞变性,血管周围星形胶质细胞轴突肿胀,反映血脑屏障(BBB)遭受损害,血管通透性增加,液体得以渗出而产生细胞外水肿;携氧液治疗组电镜下未见明显血脑屏障损害,周围水肿明显减轻,说明脑毛细血管内皮细胞对缺氧非常敏感,携氧液有助于细胞外水肿的预防。现有研究发现脑缺血再灌流后自由基明显升高,可直接造成细胞的损伤而发生脑水肿, 自由基清除剂可明显减轻脑缺血后脑水肿[4、5]。地塞米松及维生素C等具有自由基清除作用[6],本组实验结果显示在应用地塞米松及维生素C后,非携氧组脑含水量(80.55±0.79%)与对照组脑含水量(82.42±1.10%)相比,前者显著低于后者(P<0.01),说明脑出血后应用自由基清除剂有利于减轻脑水肿;而携氧组的脑含水量(77.94±1.16%)与非携氧组相比,前者显著低于后者(P<0.01),且携氧组神经细胞的病理改变明显轻于非携氧组,说明携氧液对缺氧脑组织有保护作用。
, http://www.100md.com
脑出血后血肿周围脑组织将出现不同程度的缺血。Suzuki等[7]用XeCT对7例壳核出血、血肿量为中等大小病人的局部脑血流(rCBF)进行了测定,发现血肿区的脑血流量非常低。Kanaya等[8]也报告血肿区和周围水肿区脑血流、糖代谢成比例地降低。本实验也观察到患侧脑血流量减少,但携氧组脑血流量高于非携氧组,这是由于后者脑水肿显著,颅内压高于前者,脑血液回流阻力增加,而脑血流量与脑血管阻力之间成反比关系[9],故患侧半球血流量减少。
髓鞘碱性蛋白(MBP)是神经髓鞘特有的蛋白质,当中枢神经损伤时髓鞘亦受到不同程度的破坏,MBP向脑脊液中释放,若伴有血脑屏障破坏时则进入血液中,因此脑脊液和血清中MBP含量测定是脑实质性破坏或脱髓鞘的生化指标。Strand等[10]报道在急性脑血管病时,MBP变化与临床表现和CT表现相一致,与预后也有良好的相关性。神经元特异性烯醇化酶是定位于神经元和神经内分泌细胞内的特异性的糖酵解酶,在神经元损伤和坏死时, NSE从细胞内溢出进入脑脊液和血液中,使两种液体内NSE都升高,且脑脊液和血清NSE明显升高者预后不良[11、12]。因此MBP与NSE是敏感的高特异性体内神经元损伤的标志。本组以这两种酶评价携氧与非携氧组的神经生化改变,结果非携氧组的血清含量显著高于携氧组。
, 百拇医药
从本实验可以看到,自发性高血压大鼠脑出血后,血肿周围组织因缺血缺氧而发生神经细胞线粒体及突起内微管结构损伤,细胞普遍变性坏死,并较快形成凋亡小体,说明脑出血后仅清除血肿是不够的,在出血早期应对缺血缺氧脑组织进行干预,改善脑的供氧,挽救可逆性损害的神经元。实验结果表明与非携氧组相比,携氧组神经细胞结构的损伤明显减轻,髓鞘碱性蛋白及神经元特异性烯醇化酶的血清含量亦佐证如此。说明在脑出血早期应用携氧液可以有效地改善脑缺氧、缩小半暗带区域、减轻脑水肿,保护大脑皮质神经细胞功能,因此对于高血压脑出血的脑保护具有重要意义。
参 考 文 献
1,任泽光,吴建中.大鼠脑出血模型.中华神经外科杂志,1993,9:205
2,Watson JC, Doppenberg EMR, Bullock MR, et al. Effects of the allosteric modification of hemoglobin on brain oxygen and infarct size in a feline model of stroke.Stroke,1997,28:1624
, http://www.100md.com
3,Tajima A, Nakata H, Lin SZ, et al. Differences and similarities in albumin and red blood cell flows through cerebral microvessels.Am J Physiol,1992,262:1515
4,Yamamoto M,Shima T, Uozumi T, et al. A possible of lipid peroxidation in cellular damages caused by cerebral ischemia and the protective effect of tocopherol administration. Stroke, 1983,14:977
5,Martz D, Beer M, Betz AL. Dimethylthiourea reduces ischemic brain edema without affecting cerebral blood flow. J Cerebral Blood Flow and Metablism, 1990,10:352
, http://www.100md.com
6,江基尧,朱诚.现代颅脑损伤学.第二军医大学出版社,1999.133~148
7,Suzuki R , Ohno K, Matsushima Y, et al. Serial changes in focal hyperemia associated with hypertensive putaminal hemorrhage . Stroke, 1988,19:322
8,Kanaya H. Hypertensive intracerebral hemarrhag.New York:Raven Press,1983.147
9,王忠诚.神经外科学.第1版.武汉:湖北科学技术出版社,1998.60
10,Strand T. Brain and plasma in spinal fluid as markers for brain damage and severity of stroke.Stroke,1984,15:138
, http://www.100md.com
11,Yamazaki Y, Yada K, Morii S, et al. Diagnostic significance of serum neuron-specific enolase and myelin basic protein assay in patients with acute head injury. Surg Neurol, 1995,43:267
12,Ross SA, Cunningham RT, Johnston CF, et al. Neuron specific enolase as an aid to outcome prediction in head injury. British Journal of Neurosurgery,1996,10:471
(收稿2000-06-05,修回2000-08-04), http://www.100md.com