大黄煎剂延迟并下调肠道相关淋巴细胞凋亡
作者:宋路线 徐迎新 宋旭华 孟宪钧
单位:100853 北京市,解放军总医院普通外科研究所
关键词:大黄;再灌注损伤;抗氧化药;内毒素类;脱噬作用
实用医学杂志000706 摘 要 目的:探讨药用大黄煎剂的肠粘膜屏障保护作用机制。方法:制备小鼠肠系膜上动脉缺血-再灌注损伤的实验模型,术后6,12和24 h处死动物并留取标本,检测血浆总抗氧化能力、内毒素、小肠组织相对含水量和肠粘膜上皮细胞(EC)、固有层淋巴细胞(LPL)及Peyer’s结节淋巴细胞(PPL)凋亡情况。结果:药用大黄煎剂可以显著提高小鼠的血浆总抗氧化能力(P<0.01),降低血浆内毒素水平和小肠组织含水量(P<0.05),延迟并下调LPL和PPL凋亡。结论:致伤后早期应用药用大黄煎剂对肠道粘膜屏障具有保护作用,其机制可能与其延迟并下调肠粘膜EC,LPL及PPL凋亡有关。
, http://www.100md.com
本实验采用小鼠肠系膜上动脉(supermesenteric artery,SMA)缺血-再灌注模型,通过检测血浆总抗氧化能力(total antioxidant capacity,TAC)、内毒素、小肠组织含水量的变化和肠粘膜上皮细胞(epithelial cells,EC)、固有层淋巴细胞(lamina propria lymphocytes,LPL)及Peyer's结节淋巴细胞(Peyer's patch lymphocytes,PPL)凋亡情况,探讨其肠粘膜保护作用机制。
1 材料与方法
1.1 材料 雄性NIH小鼠60只,7~10周龄,体重20~25 g(解放军总医院实验动物中心提供),随机分为药用大黄(北京同仁堂药店提供)煎剂组和对照组各30只。
1.2 方法 60只小鼠术前24 h禁食,自由饮水。采用乙醚吸入麻醉,经腹白线开腹,暴露并钝性分离肠系膜上动脉,根部用小动脉夹夹闭,腹内容物还纳腹腔,用生理盐水纱布覆盖切口,45 min后松开动脉夹恢复肠血液供应,分两层用1-0丝线关闭腹腔,每只均在下腹部皮内注射0.6 ml生理盐水以复苏。术后大黄煎剂组立即予生药9.1 g/kg灌胃,每天2次[1];对照组以等量生理盐水灌胃代替。两组均按术后6,12和24 h不同处死时间分为3个亚组,留取血液、肠道标本待测。
, 百拇医药
EC,LPL和PPL的分离及单细胞悬液制备分别采取EDTA-胶原酶法和机械法,DNA提取采用酚-氯仿抽提法并在1%的琼脂糖凝胶上进行电泳,凝胶扫描仪扫描并打印。
TAC采用铁还原法测定,结果以U/ml计,试剂药盒由南京建成生物工程研究所生产;内毒素检测采用改良过氯酸预处理,血浆基质显色法鲎实验定量测定,结果以EU/ml计,试剂药盒由上海医用化学研究所提供。
小肠组织相对含水量检测,取一段长约10 cm的小肠,用PBS冲洗去除肠内容物,滤纸吸去水分,精确称重后,置于80℃烤箱烘干至恒重时再次称重,以肠道的相对含水量[(肠道湿重-肠道干重)/肠道干重]来表示肠道的水肿情况。
1.3 统计学方法 结果以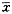 ±s表示,用t检验进行统计分析。
±s表示,用t检验进行统计分析。
, http://www.100md.com
2 结果
2.1 对血浆成份及组织的影响 (1)血浆TAC水平测定:对照组致伤后6 h血浆TAC值为(9.69±3.39)U/ml,并随着观察时间的延长而逐步下降,在缺血-再灌注后24 h达到最低点,仅为(2.92±1.88)U/ml,与对照组相比大黄煎剂可以显著提高各时间点缺血-再灌注小鼠的血浆TAC值,见表1。(2)小肠组织含水量:治疗组再灌注后24 h的小肠组织水肿情况与对照组比较明显降低,见表2。(3)血浆内毒素检测:与对照组相比,处理组致伤后各相应时间点的血浆内毒素水平均显著下降(P<0.05),见表3。
2.2 DNA琼脂糖凝胶电泳 对照组的EC,LPL和PPL在所观察的3个时间点均可见明显的DNA梯状条带(DNA ladder),而大黄煎剂组除EC在所观察的时间点见到较弱的梯状条带外,LPL和PPL仅在致伤后12 h见到明显的梯状条带。
表1 两组致伤后不同时间点SMA缺血-再灌注小鼠血浆TAC活性比较(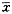 ±s,U/ml) 组别
±s,U/ml) 组别
, 百拇医药
n
致伤后6 h
致伤后12 h
致伤后24 h
对照组
10
9.69±3.39
7.25±1.62
2.92±1.88
大黄煎剂组
10
16.41±3.30
, 百拇医药 17.32±1.68
18.54±3.10
t值
4.01
10.54
11.41
P值
0.001
0.0001
0.0001
表2 两组致伤后不同时间点SMA缺血-再灌注小鼠小肠组织含水量比较(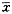 ±s) 组别
±s) 组别
, http://www.100md.com
n
致伤后6 h
致伤后12 h
致伤后24 h
对照组
10
3.41±0.42
4.51±0.77
3.20±0.23
大黄煎剂组
10
3.63±0.55
, http://www.100md.com 4.23±0.70
2.64±0.15
t值
0.87
0.71
5.27
P值
0.40
0.49
0.0003
表3 两组致伤后不同时间点SMA缺血-再灌注小鼠血浆内毒素比较(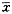 ±s,EU/ml) 组别
±s,EU/ml) 组别
, http://www.100md.com
n
致伤后6 h
致伤后12 h
致伤后24 h
对照组
10
0.52±0.06
0.56±0.05
0.51±0.04
大黄煎剂组
10
0.40±0.04
, http://www.100md.com 0.44±0.07
0.43±0.06
t值
4.23
3.22
2.63
P值
0.001
0.009
0.025
3 讨论
TAC是反映机体抗氧化体系的容量和能力的指标,在危重患者[2]和多器官功能不全综合征(MODS)的实验动物模型[3]均可发生血浆TAC水平下降。抗氧化治疗可以改善脓毒症大鼠的末端器官氧利用[4],减轻嗜中性粒细胞介导的肺损伤,并全面提高其生存状况[5]。在实验中我们观察到,大黄煎剂治疗组小鼠血浆的TAC水平在所观察的各时间点相对稳定,而对照组小鼠的TAC水平呈进行性下降趋势,表明大黄煎剂中含有的蒽醌类和芪类等具有清除氧自由基作用的活性成分[1],有助于重新恢复氧化-抗氧化作用之间的平衡,避免或减轻组织发生氧化损伤的程度。小肠组织的相对含水量可以反应受累肠道的局部损伤情况,治疗组再灌注后24 h的小肠组织相对含水量与对照组相比显著降低,进一步证实了大黄煎剂治疗确实能够对氧化应激所造成的肠道组织损伤起到有效的保护作用。
, http://www.100md.com
细胞凋亡是不同于坏死的另一种细胞死亡方式,它是一种受内在基因调控的程序化的“主动”死亡,一方面它是个体发育和机体维持内环境稳定,清除“多余”或“变质”细胞所必需的一种生理反应,另一方面它又可以是一种疾病发生时的病理机制。近年来的研究证明,肠道粘膜屏障相关细胞在缺血-再灌注损伤过程中发生凋亡是其主要的死亡方式,肠上皮细胞异常凋亡的增加,损害肠道粘膜的机械性屏障[6,7],而肠道相关淋巴细胞凋亡的异常增加则损害肠道粘膜的免疫学屏障[8],其直接结果是肠道的通透性上升,细菌和内毒素发生移位。本实验的研究结果表明,大黄煎剂可以延迟并下调肠道LPL和PPL发生异常凋亡,改善缺血-再灌注损伤时肠道的免疫屏障功能,增强肠道屏障对细菌和内毒素移位发生的抵抗作用。虽然两组的肠上皮细胞均可以见到明显的DNA梯状条带,但是治疗组梯状条带的强度明显低于对照组,这可能与病理情况下肠道粘膜上皮细胞的更新速度加快有关。
大黄煎剂治疗组小鼠血浆内毒素水平在所观察的各时间点均有明显下降,可能与大黄煎剂维持肠道粘膜屏障的生理完整性,降低肠道粘膜的通透性[9],并通过加强肠蠕动而促进内毒素随粪便排出及大黄的抑菌作用[1]等多种因素有关。
, http://www.100md.com
综上所述,我们有理由认为致伤后早期应用大黄煎剂有助于恢复机体氧化-抗氧化作用的相对平衡,维持内环境的相对稳定,减轻组织发生氧化损伤的程度,其直接结果是肠道粘膜屏障相关细胞凋亡发生被延迟和下调,改善了肠道粘膜屏障的功能,有助于减少细菌和内毒素移位的发生,对过度的炎症反应和MODS发生的预防和治疗有重要的意义。
参考文献
1,高晓山,主编. 常用中药现代研究丛书.大黄. 北京:中国医药科技出版社,1988.366~436.
2,Cowley HC,Bacon PJ,Cerretti DP,et al. Plasma antioxidant potential in severe sepsis:a comparison of survivors and nonsurvivors. Crit Care Med,1996,24(8):1179~1183.
, 百拇医药
3,Rojas C,Cadenas S,Berson DR,et al. Endotoxin depletes ascobate in the guinea pig heart:protective effects of vitamin C and E against oxidative stress. Life Sci,1996,59(6):649~657.
4,Krysztopik RJ,Bentley FR,Bernhard L,et al. Free radical scavenging by lazaroids improves renal blood flood during sepsis. Surgery,1996,120(5):657~662.
5,Blackwell TS,Blackwell TR,Potten CS,et al. In vivo antioxidant treatment suppresses nuclear factor-kappa-B activation and neutrophlic lung inflammation. J Immunol,1996,157(7):1630~1637.
, http://www.100md.com
6 Ikeda H,Suzuki Y,Koike M,et al. Apoptosis is a major mode of cell death caused by ischaemia and ischaemia /reperfusion injury to the rat intestinal epithelium.Gut,1998,42(4):530~537.
7,Sun Z,Wang R,Wallen X,et al. The influence of apoptosis on intestinal barrier integruty in rats. Scand J Gastroenterol,1998,33(4):415~422.
8,Mongni C,Ruybal P,Garcia RH,et al. Apoptosis in gut-associated lymphoid tissue:a responsive to injury or a physiological mechanisms?Transplant Proc,1998,30(6):2673~2676.
9,陈德昌,景炳文. 大黄对出血性休克大鼠肠粘膜通透性的影响. 中国中医急症. 1994,3(3):131~132.
(收稿日期:2000-02-11), 百拇医药
单位:100853 北京市,解放军总医院普通外科研究所
关键词:大黄;再灌注损伤;抗氧化药;内毒素类;脱噬作用
实用医学杂志000706 摘 要 目的:探讨药用大黄煎剂的肠粘膜屏障保护作用机制。方法:制备小鼠肠系膜上动脉缺血-再灌注损伤的实验模型,术后6,12和24 h处死动物并留取标本,检测血浆总抗氧化能力、内毒素、小肠组织相对含水量和肠粘膜上皮细胞(EC)、固有层淋巴细胞(LPL)及Peyer’s结节淋巴细胞(PPL)凋亡情况。结果:药用大黄煎剂可以显著提高小鼠的血浆总抗氧化能力(P<0.01),降低血浆内毒素水平和小肠组织含水量(P<0.05),延迟并下调LPL和PPL凋亡。结论:致伤后早期应用药用大黄煎剂对肠道粘膜屏障具有保护作用,其机制可能与其延迟并下调肠粘膜EC,LPL及PPL凋亡有关。
, http://www.100md.com
本实验采用小鼠肠系膜上动脉(supermesenteric artery,SMA)缺血-再灌注模型,通过检测血浆总抗氧化能力(total antioxidant capacity,TAC)、内毒素、小肠组织含水量的变化和肠粘膜上皮细胞(epithelial cells,EC)、固有层淋巴细胞(lamina propria lymphocytes,LPL)及Peyer's结节淋巴细胞(Peyer's patch lymphocytes,PPL)凋亡情况,探讨其肠粘膜保护作用机制。
1 材料与方法
1.1 材料 雄性NIH小鼠60只,7~10周龄,体重20~25 g(解放军总医院实验动物中心提供),随机分为药用大黄(北京同仁堂药店提供)煎剂组和对照组各30只。
1.2 方法 60只小鼠术前24 h禁食,自由饮水。采用乙醚吸入麻醉,经腹白线开腹,暴露并钝性分离肠系膜上动脉,根部用小动脉夹夹闭,腹内容物还纳腹腔,用生理盐水纱布覆盖切口,45 min后松开动脉夹恢复肠血液供应,分两层用1-0丝线关闭腹腔,每只均在下腹部皮内注射0.6 ml生理盐水以复苏。术后大黄煎剂组立即予生药9.1 g/kg灌胃,每天2次[1];对照组以等量生理盐水灌胃代替。两组均按术后6,12和24 h不同处死时间分为3个亚组,留取血液、肠道标本待测。
, 百拇医药
EC,LPL和PPL的分离及单细胞悬液制备分别采取EDTA-胶原酶法和机械法,DNA提取采用酚-氯仿抽提法并在1%的琼脂糖凝胶上进行电泳,凝胶扫描仪扫描并打印。
TAC采用铁还原法测定,结果以U/ml计,试剂药盒由南京建成生物工程研究所生产;内毒素检测采用改良过氯酸预处理,血浆基质显色法鲎实验定量测定,结果以EU/ml计,试剂药盒由上海医用化学研究所提供。
小肠组织相对含水量检测,取一段长约10 cm的小肠,用PBS冲洗去除肠内容物,滤纸吸去水分,精确称重后,置于80℃烤箱烘干至恒重时再次称重,以肠道的相对含水量[(肠道湿重-肠道干重)/肠道干重]来表示肠道的水肿情况。
1.3 统计学方法 结果以
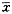 ±s表示,用t检验进行统计分析。
±s表示,用t检验进行统计分析。, http://www.100md.com
2 结果
2.1 对血浆成份及组织的影响 (1)血浆TAC水平测定:对照组致伤后6 h血浆TAC值为(9.69±3.39)U/ml,并随着观察时间的延长而逐步下降,在缺血-再灌注后24 h达到最低点,仅为(2.92±1.88)U/ml,与对照组相比大黄煎剂可以显著提高各时间点缺血-再灌注小鼠的血浆TAC值,见表1。(2)小肠组织含水量:治疗组再灌注后24 h的小肠组织水肿情况与对照组比较明显降低,见表2。(3)血浆内毒素检测:与对照组相比,处理组致伤后各相应时间点的血浆内毒素水平均显著下降(P<0.05),见表3。
2.2 DNA琼脂糖凝胶电泳 对照组的EC,LPL和PPL在所观察的3个时间点均可见明显的DNA梯状条带(DNA ladder),而大黄煎剂组除EC在所观察的时间点见到较弱的梯状条带外,LPL和PPL仅在致伤后12 h见到明显的梯状条带。
表1 两组致伤后不同时间点SMA缺血-再灌注小鼠血浆TAC活性比较(
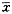 ±s,U/ml) 组别
±s,U/ml) 组别, 百拇医药
n
致伤后6 h
致伤后12 h
致伤后24 h
对照组
10
9.69±3.39
7.25±1.62
2.92±1.88
大黄煎剂组
10
16.41±3.30
, 百拇医药 17.32±1.68
18.54±3.10
t值
4.01
10.54
11.41
P值
0.001
0.0001
0.0001
表2 两组致伤后不同时间点SMA缺血-再灌注小鼠小肠组织含水量比较(
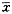 ±s) 组别
±s) 组别, http://www.100md.com
n
致伤后6 h
致伤后12 h
致伤后24 h
对照组
10
3.41±0.42
4.51±0.77
3.20±0.23
大黄煎剂组
10
3.63±0.55
, http://www.100md.com 4.23±0.70
2.64±0.15
t值
0.87
0.71
5.27
P值
0.40
0.49
0.0003
表3 两组致伤后不同时间点SMA缺血-再灌注小鼠血浆内毒素比较(
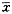 ±s,EU/ml) 组别
±s,EU/ml) 组别, http://www.100md.com
n
致伤后6 h
致伤后12 h
致伤后24 h
对照组
10
0.52±0.06
0.56±0.05
0.51±0.04
大黄煎剂组
10
0.40±0.04
, http://www.100md.com 0.44±0.07
0.43±0.06
t值
4.23
3.22
2.63
P值
0.001
0.009
0.025
3 讨论
TAC是反映机体抗氧化体系的容量和能力的指标,在危重患者[2]和多器官功能不全综合征(MODS)的实验动物模型[3]均可发生血浆TAC水平下降。抗氧化治疗可以改善脓毒症大鼠的末端器官氧利用[4],减轻嗜中性粒细胞介导的肺损伤,并全面提高其生存状况[5]。在实验中我们观察到,大黄煎剂治疗组小鼠血浆的TAC水平在所观察的各时间点相对稳定,而对照组小鼠的TAC水平呈进行性下降趋势,表明大黄煎剂中含有的蒽醌类和芪类等具有清除氧自由基作用的活性成分[1],有助于重新恢复氧化-抗氧化作用之间的平衡,避免或减轻组织发生氧化损伤的程度。小肠组织的相对含水量可以反应受累肠道的局部损伤情况,治疗组再灌注后24 h的小肠组织相对含水量与对照组相比显著降低,进一步证实了大黄煎剂治疗确实能够对氧化应激所造成的肠道组织损伤起到有效的保护作用。
, http://www.100md.com
细胞凋亡是不同于坏死的另一种细胞死亡方式,它是一种受内在基因调控的程序化的“主动”死亡,一方面它是个体发育和机体维持内环境稳定,清除“多余”或“变质”细胞所必需的一种生理反应,另一方面它又可以是一种疾病发生时的病理机制。近年来的研究证明,肠道粘膜屏障相关细胞在缺血-再灌注损伤过程中发生凋亡是其主要的死亡方式,肠上皮细胞异常凋亡的增加,损害肠道粘膜的机械性屏障[6,7],而肠道相关淋巴细胞凋亡的异常增加则损害肠道粘膜的免疫学屏障[8],其直接结果是肠道的通透性上升,细菌和内毒素发生移位。本实验的研究结果表明,大黄煎剂可以延迟并下调肠道LPL和PPL发生异常凋亡,改善缺血-再灌注损伤时肠道的免疫屏障功能,增强肠道屏障对细菌和内毒素移位发生的抵抗作用。虽然两组的肠上皮细胞均可以见到明显的DNA梯状条带,但是治疗组梯状条带的强度明显低于对照组,这可能与病理情况下肠道粘膜上皮细胞的更新速度加快有关。
大黄煎剂治疗组小鼠血浆内毒素水平在所观察的各时间点均有明显下降,可能与大黄煎剂维持肠道粘膜屏障的生理完整性,降低肠道粘膜的通透性[9],并通过加强肠蠕动而促进内毒素随粪便排出及大黄的抑菌作用[1]等多种因素有关。
, http://www.100md.com
综上所述,我们有理由认为致伤后早期应用大黄煎剂有助于恢复机体氧化-抗氧化作用的相对平衡,维持内环境的相对稳定,减轻组织发生氧化损伤的程度,其直接结果是肠道粘膜屏障相关细胞凋亡发生被延迟和下调,改善了肠道粘膜屏障的功能,有助于减少细菌和内毒素移位的发生,对过度的炎症反应和MODS发生的预防和治疗有重要的意义。
参考文献
1,高晓山,主编. 常用中药现代研究丛书.大黄. 北京:中国医药科技出版社,1988.366~436.
2,Cowley HC,Bacon PJ,Cerretti DP,et al. Plasma antioxidant potential in severe sepsis:a comparison of survivors and nonsurvivors. Crit Care Med,1996,24(8):1179~1183.
, 百拇医药
3,Rojas C,Cadenas S,Berson DR,et al. Endotoxin depletes ascobate in the guinea pig heart:protective effects of vitamin C and E against oxidative stress. Life Sci,1996,59(6):649~657.
4,Krysztopik RJ,Bentley FR,Bernhard L,et al. Free radical scavenging by lazaroids improves renal blood flood during sepsis. Surgery,1996,120(5):657~662.
5,Blackwell TS,Blackwell TR,Potten CS,et al. In vivo antioxidant treatment suppresses nuclear factor-kappa-B activation and neutrophlic lung inflammation. J Immunol,1996,157(7):1630~1637.
, http://www.100md.com
6 Ikeda H,Suzuki Y,Koike M,et al. Apoptosis is a major mode of cell death caused by ischaemia and ischaemia /reperfusion injury to the rat intestinal epithelium.Gut,1998,42(4):530~537.
7,Sun Z,Wang R,Wallen X,et al. The influence of apoptosis on intestinal barrier integruty in rats. Scand J Gastroenterol,1998,33(4):415~422.
8,Mongni C,Ruybal P,Garcia RH,et al. Apoptosis in gut-associated lymphoid tissue:a responsive to injury or a physiological mechanisms?Transplant Proc,1998,30(6):2673~2676.
9,陈德昌,景炳文. 大黄对出血性休克大鼠肠粘膜通透性的影响. 中国中医急症. 1994,3(3):131~132.
(收稿日期:2000-02-11), 百拇医药