普通型心房扑动的新现象
欧阳非凡 Karl-Heinz Kuck
摘 要:普通型心房扑动(AFL)的完整折返环路以及界嵴(CT)和AFL的关系仍不太清楚,笔者应用电解剖(CARTO)标测系统执行两项研究。Ⅰ:对12例持续AFL的病人实施右房CARTO标测及多部位拖带。于三尖瓣环(TA)周围测量传导速度。双电位(DP)位于右房后下壁,相当于解剖上的界嵴,从下腔静脉(IVC)与心房肌的连接处向上、稍前延伸,其长度为40.9±7.9 mm。所有病人的DP间期从上至下逐渐增加。在9例逆向AFL病人中,右心耳后基底部的后方一狭长心肌位于折返环内,结果来自右心耳基底前、后方的两个心房激动波融合于右房下游离壁。在另3例病人中(1例顺钟向、2例逆钟向)右心耳基底部后方未发现位于折返环内,迫使折返环仅绕三尖瓣与右心耳基底部前方之间的心肌兴奋右房下游离壁。在AFL的折返环中,没有固定的缓慢传导区,大部分病人的缓慢传导区位于间隔部和侧壁。Ⅱ:对7例普通型AFL及6例非AFL病人,在冠状窦起搏下,标测右房后壁。通过在右房重建中出现DP确认CT。以600,300 ms周长以及静脉注射氟卡胺(1 mg/kg)后以600 ms周长起搏冠状窦,分别测量CT上、中、下部位的刺激信号至双电位中第一及第二个心房激动波的传导时间(SD1及SD2)和此部位的电位间期(DPI)。在AFL病例中,与以600 ms周长起搏冠状窦时相比,以300 ms以及静脉注射氟卡胺后以600 ms周长起搏冠状窦时,CT的SD2和DPI从上至下逐渐增加。结论:①右心耳基底前、后方的心房激动波传导存在差异,结果导致了AFL的2种不同的折返环。②在人类的AFL折返环中,没有固定的缓慢传导区,缓慢传导区位于沿TA的间隔部和侧壁。③在AFL折返环路中,CT是一功能性解剖障碍;在没有AFL的病人中,CT被证实为是一缓慢传导区。④频率依赖性和氟卡胺诱导的跨CT的功能性传导阻滞是一种常见现象,此可能是临床AFL的诱发和维持的触发因素。
, 百拇医药
关键词:心房扑动,普通型 CARTO系统 电解剖标测 拖带标测 缓慢传导区 双电位 界嵴 电生理学 导管消融,射频电流
普通型心房扑动(简称房扑)是一种大折返房性心动过速,其折返环位于右房,包括逆钟向和顺钟向型房扑。三尖瓣和下腔静脉形成的峡部是折返环的关键部位,射频消融此峡部可治愈房扑,其成功率达95%[1~9]。若射频消融以峡部双向阻滞为终点,其复发率约5%左右[10]。最近研究显示三尖瓣环和界嵴(crista terminalis)是房扑两个固定和/或功能性解剖屏障[1~3],但界嵴的电生理特性与房扑的关系尚不清楚,且对峡部是否为缓慢传导区仍有争论。我们电生理室通过使用新的标测系统——电解剖标测系统(Electroanatomical mapping systm,即CARTOTM mapping system)研究房扑的折返环、折返环内传导速度及房扑患者与未有房扑患者界嵴的电生理现象的差异,以期解释为什么仅有一部分人发生房扑这一电生理现象。本系列研究由两大部分组成:普通型房扑的折返环、界嵴的电生理特性。
, 百拇医药
Ⅰ 普通型房扑的折返环
1 资料与方法
12例持续性房扑患者,其中男8例、女4例,年龄60±8岁。所有患者无心脏外科手术及射频消融史。无明确结构性心脏病证据者9例、冠心病2例、扩张型心肌病1例。停用抗心律失常药物至少5个半衰期以上。
电生理检查及CARTO标测:穿刺左、右股静脉及左锁骨下静脉,置7F Jackman电极于冠状窦内、6F 10极Webster His束旁电极于His束部位,另外置7F 20极Webster A—20电极于右房游离壁,且近可能靠近三尖瓣环。CARTO标测中,空间定位电极置于病人背部,时间定位心房电信号来源于冠状窦内稳定的心房电信号。为了确保右房电解剖标测的精确性,常规穿刺右颈内静脉,以期使Biosense Navi—Star标测电极可经右股静脉或右颈内静脉到达右房内任何部位。标测采用双极和单极同时记录,滤波范围分别为10~400 Hz和0~400 Hz。
, 百拇医药
双电位定义为有两个恒定的电位,且两者间的等电位线长于20 ms。所有病人完成右房电解剖重构后,必须进行右房多部位拖带标测以检测此处是否在房扑的折返环内。这些部位包括三尖瓣环(峡部、侧壁、间隔及前壁)、房间隔、冠状窦口的前方及后方、右心耳内及基底部的前方和后方。我们定义某标测点位于房扑折返环内的标准是:起搏后停顿间期(post-pacing interval,PPI)-房扑周长<30 ms,且(刺激信号-P波间期)-(局部传导时间-P波间期)<30 ms。传导速度的测量必须确保两标测点位于折返环内,且两点间距离少于3 cm。另外测量峡部间隔部和侧壁的宽度以及计算机自动分析的右房容积。
统计学处理:所有参数均采用X±s表示。
2 结果
12例持续性房扑,其中11例为逆钟向房扑、1例为顺钟向房扑。标测点为258±35(196~304)个,房扑周长为271±37(233~350) ms,被标测的房扑周长为96.1%±2.1%(93%~100%)。电解剖重构的右房容积为118±24(92~160)ml。峡部宽度:间隔部为20.9±5.2(12~29) mm、侧壁为27.5±5.8(19~34) mm。所有病人三尖瓣环都构成其房扑的解剖屏障。PPI长于房扑周长30 ms部位分布在冠状窦口后方、高位右房后壁及右心耳内。3例病人(其中1例顺钟向和2例逆钟向房扑)右心耳基底部后方未发现位于折返环内,迫使折返环仅绕三尖瓣与右心耳基底部前方之间的心肌兴奋右房下游离壁(附图A);另9例病人,右心耳后基底部的后方一狭长心肌位于折返环内,结果来自右心耳基底前方和后方的两个心房激动波融合于右房下游离壁(附图B)。
, 百拇医药
附图 房扑的折返环 SVC=上腔静脉,IVC=下腔静脉,RAA=右心耳,TA=三尖瓣环
双电位区域位于右房后壁,相当于解剖上的界嵴,从下腔静脉与心房肌的连接处向上、稍前延伸。右房后壁双电位区域的长度为40.9±7.9(29.6~52.6) mm。双电位间期上部为45.9±12.8(30~71) ms、中部为68.2±16.0(73~93) ms和下部为95.3±19.7(53~122) ms。从上至下双电位间期增加主要是由于第二个心房电位的进行性延迟所致。
折返环内靠近三尖瓣处局部传导速度见表1。峡部平均传导速度为0.79±0.29 m/s,间隔部及侧壁分别为0.68±0.40,0.62±0.52 m/s,仅前壁平均传导速度最快为0.98±0.59 m/s。若以每一个折返环内最慢传导速度为缓慢传导区域,其中7例缓慢传导区位于间隔部、4例位于侧壁及1例位于前壁,未有1例缓慢传导区发生于峡部。
, 百拇医药
射频消融位于三尖瓣和下腔静脉之间的峡部,平均放电6.1(1~14)次达到峡部双向传导阻滞;平均X线射照时间6.25(2.9~10.3) min。平均随访8个月,无一例房扑复发。
表1 房扑折返环内近瓣环处局部传导速度(m/s)
病例
房扑
类型
峡部
侧壁
间隔
前壁
前
中
, 百拇医药
后
1
CW
0.44
0.52
0.88
0.66
0.36
1.48
2
CCW
1.14
0.73
, 百拇医药
0.41
0.28
0.73
0.62
3
CCW
1.07
0.65
0.43
0.35
1.75
0.67
4
, 百拇医药
CCW
0.51
0.38
0.21
0.48
0.45
1.52
5
CCW
0.69
1.05
1.16
0.52
, 百拇医药
1.00
0.43
6
CCW
0.52
0.63
0.75
0.43
0.42
0.47
7
CCW
0.69
, 百拇医药
0.71
1.04
0.68
0.67
0.84
8
CCW
0.51
0.79
2.21
0.32
0.92
1.82
, http://www.100md.com
9
CCW
0.33
0.57
0.82
2.17
0.60
2.1
10
CCW
0.48
0.19
0.19
, http://www.100md.com
0.34
0.48
0.9
11
CCW
0.99
1.01
1.07
0.39
0.29
0.45
12
CCW
, 百拇医药
1.45
0.61
1.15
0.79
0.48
0.51
X±s
0.79±0.29
0.62
±0.52
0.68
±0.40
0.98
, http://www.100md.com
±0.59
注:CW=顺钟向型房扑,CCW=逆钟向型个月,无一例房扑复发。
3 讨论
在12例普通型房扑中,使用电解剖标测及拖带标测,有三个主要发现:①房扑折返环:房扑时,间隔的心房激动波兴奋心房前壁,于右心耳间隔基底部分裂为两个心房激动波,分别进入右心耳基底前和后方。75%病例(9/12)两者同时进入右房下游离壁并融于此;另25%病例由于两个激动波速度不匹配两者融合于右心耳基底部的后方,结果仅有一个激动波兴奋右房游离壁,进入三尖瓣和下腔静脉之间的峡部。②右房后壁双电位区域:在右房后壁有一个连续双电位区域,相当于解剖上的界嵴[11~15]。双电位区域从下腔静脉与心房的连结处向上稍前延伸,长达4 cm,形成房扑的另一解剖屏障。③局部传导速度:我们资料显示,不同病例折返环内传导速度有很大差异,且没有恒定的缓慢传导区域。但折返环内缓慢传导区主要分布于三尖瓣环间隔部和游离壁。下面对这三个主要发现分别作详细阐述。
, 百拇医药
3.1 房扑折返环 使用拖带标测揭示心动过速的折返环在心肌梗死后室性心运过速[16~18]上已得到证实。停顿后间期与心动过速周期的关系是一个非常有益的标测折返环的指标。以前的研究显示,三尖瓣和界嵴之间形成的通路“tunnel”延继至由三尖瓣和界嵴之间形成的峡部是折返环的一部分[1,3]。最近Shah[20]在没有使用拖带标测的研究中显示,心房激动波沿房间隔上行,分裂成两个激动波,激动于高位右房前后壁,并融合于右房游离壁。这与我们激动标测的结果相符,其融合处相当于解剖上的上部分界嵴,只是由于激动时间上的同一性,未能记录到双电位。但我们拖带标测结果显示,右房后部未在普通型房扑折返环内。此一结果证实CARTO激动和传导标测并不足以证实大折返性心动过速的折返环,这与Kalman等[3]其他研究结果相同。由于右心耳作为另一个解剖屏障,心房激动波于此分裂为两个激动波:一个激动波位于三尖瓣环和右心耳前基底部之间,另一个激动波位于右心耳后基底部和界嵴之间。我们资料显示,75%病例两个激动波同时激动右房下游离壁且融合于此,随后进入位于三尖瓣环和下腔静脉之间的峡部。更重要的是,有25%病例整个房扑折返环仅靠近三尖瓣环处。从CARTO标测仍可见两个心房激动波同时兴奋位于三尖瓣环和右心耳前基底部之间的心房肌及位于右心耳后基底部和界嵴之间的心房肌。但与大多数不同的是:两个激动波融合处不在右房下游离壁,而在右心耳后基底部与界嵴之间,最终导致位于右心耳后基底部与界嵴之间的激动波消失,仅遗留位于三尖瓣环和右心耳前基底部之间的激动波,沿三尖瓣环兴奋所有心房肌。我们推测是两个激动波的传导速度不匹配导致了这一独特的电生理现象。
, 百拇医药
3.2 右房后壁双电位区域 右房后壁功能性或解剖上的屏障是普通型房扑的共同特征[11~15],这一发现也在标测人类房扑时得到证实[1,2],并建议这是持续性房扑诱发和持续的前提[21]。X线指导右房后壁双电位标测缺乏精确的定位性。在心内超声指导下,置多极导管于界嵴,记录连续双电位,证实界嵴为一个传导阻滞区域,但对双电位间期缺乏详细记录[1]。最近Shan[20]采用CARTO标测系统研究人体普通型房扑结果显示:右房后壁双电位呈不规律、非线性分布。而我们的资料显示:右房后壁双电位区域从下腔静脉与心房的连结处向上、稍前连续延伸4 cm左右,且伴有第二个心房电活动从上至下进行性延迟,建议此区域为一连续线性传导阻滞。对这一矛盾结论的可能解释是:与我们采用了高密度的标测有关。
3.3 局部传导速度 以前对三尖瓣和下腔静脉间峡部的传导速度进行不同方法研究[4~9],仍有研究显示此峡部是房扑时缓慢传导区域。X线指导下将多极电极导管经此峡部置于冠状窦口,测量起搏冠状窦或房扑时峡部传导速度,证明此峡部为一缓慢传导组织,但这一结论仍有较大的局限性[3]。其一:多极导管仅位于峡部一个部位,且不一定平行于三尖瓣环;其二:众所周知冠状窦口周围为缓慢传导区域或功能性传导阻滞部位,尤其在房扑患者中。若将多极导管置于冠状窦口内,常规X线下有时极难区别导管的某一部位是否位于冠状窦口内,这会造成测量上误差。而我们研究采用更精确电解剖标测方法。首先CARTO系统可十分清楚地显示冠状窦口,且我们测量尽可能避免冠状窦及附近区域;其二:我们资料显示峡部内平行于三尖瓣环前、中、后三部位传导速度分布未有规律性,我们测量每一患者这三个部位的不同传导速度,且取其中最快传导速度作为峡部传导速度,这可能是我们测量的峡部传导速度较快的主要原因。最近Shan[20]采用同样技术,发现大多数患者峡部传导速度较慢,这可能是他们标测点较少、患者右房容积较小和单部位测量传导速度有关。值得指出的是,我们的资料显示房扑时个体间折返环内局部传导速度变异较大,但折返环内慢传导区主要位于三尖瓣环的间隔部和侧壁,这一结果与房扑的诱发和持续之间的关系仍有待进一步研究。
, http://www.100md.com
Ⅱ 界嵴的电生理特性
1 资料与方法
本研究包括两组病例:①房扑组:常规ECG有典型的普通型房扑ECG的表现和心内电生理检查证实有房扑,由7例患者组成,其中男5例、女2例,年龄63±8(55~78)岁。②对照组:常规ECG均未有房扑的证据,由6例患者组成,其中男2例、女4例,年龄54±8(42~67)岁。5例房室结折返性心动过速、1例预激综合征、2例无结构性心脏病的证据,且无心脏外科手术及射频消融史。停用抗心律失常药物至少5个半衰期以上。
电生理检查及CARTO标测:穿刺左、右股静脉,左锁骨下及颈内静脉。常规置7F Jackman电极于冠状窦内,采用Biosense Navi-Star标测导管经右股静脉及右颈内静脉入右房行右房标测。CARTO标测中,空间定位电极置于病人背部,时间定位取稳定起搏冠状窦夺获心房时的刺激信号。标测右房时,标测电极同时采用单极和双极记录,滤波范围同前,分别为10~40 Hz和0~400 Hz。
, 百拇医药
CARTO标测右房时分成三个部分。首先在冠状窦起搏(周长600 ms)时,标测整个右房后壁,从三尖瓣间隔部至三尖瓣侧壁,确定双电位的分布区域,再精标此区域——即解剖学上的界嵴中、下部,并测量其长度。我们人为把右房后壁双电位区域均等地分成上、中、下三个部位,分别测量刺激信号至双电位中第一及第二个心房激动波的传导时间及此部位的双电位间期。其二:在同一冠状窦起搏(周长300 ms)时,标测右房后壁双电位区域,测量所有参数,方法同上。其三:在恒定冠状窦起搏(周长600 ms)情况下,静脉给予1 mg/kg Flecainide(氟卡胺——Ic类抗心律失常药物)10 min,标测右房后壁双电位区域。观察起搏周长及氟卡胺对双电位的影响及在房扑组和对照组双电位是否有差异。另外在房扑组中,4例患者先行射频消融位于三尖瓣及下腔静脉之间的峡部,且成功地使峡部双向传导阻滞,然后标测右房后壁双电位区域;另3例患者先标测右房后壁双电位区域,随后行射频消融三尖瓣和下腔静脉间的峡部。所有对照组病例,均先标测右房后壁双电位区域,然后对不同心律失常进行处理。
, http://www.100md.com
统计学处理:所有资料用X±s表示,采用配对t检验,以P<0.05为差异有显著性。
2 结果
所有两组病例右房后壁均有相似的双电位分布区域,即从下腔静腔与右房交界处向上、稍前延伸。所有参数包括刺激信号至第一个及第二个心房激动波的时间、双电位间期及双电位区域的长度见表2。其中在房扑组中4例峡部阻断和3例峡部未阻断者的所有这些参数无任何差异。
表2显示,冠状窦起搏周长600 ms时,右房后壁双电位区域的长度在房扑组和对照组中分别为31.4±7.3和32.7±4.4 mm,二者间没有差异。另外,在两组病例中,刺激信号至第一个心房激动波时间(SD1)从下至上增加,而刺激信号至第二个心房激动波时间(SD2)没有差异。尽管双电位间期在两组病例中显示由上至下增加,其增加是由于SD1由下至上延长所致。两组间双电位间期无差异。在冠状窦起搏周长300 ms时,两组病例双电位区域的长度没有差异,分别为30.3±6.9和32.8±3.1 mm。在房扑和对照组中,SD1仍然由下至上增加,但仅在房扑组中,SD2由上至下进行性增加,而对照组中SD2由上至下没有明显变化。位于双电位区域下端的双电位间期在房扑组时为79±27 ms,明显长于对照组的50±21 ms,且有显著性差异。与对照组相比较,房扑组中双电位间期由上至下增加是由于SD2的进行延迟所致。
, 百拇医药
表2 不同刺激周长及氟卡胺对右房后壁上、中、下部位双电位的作用( X±s,ms)
组别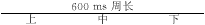
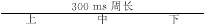
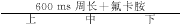
SD1
114±19
104±15
100±19
, http://www.100md.com 116±17
101±16
94±18
122±7.0
114±15
104±3.0
房扑组
SD2
143±26
140±28
142±28
142±29
, 百拇医药
151±24
165±29
173±35
167±21
182±31
(n=7)
DPI
29±8
36±13
42±13
35±14
54±22
79±27*
, 百拇医药
45±16
68±26
94±28*
长度
31.4±7.3
30.3±6.9
28.0±7.7
SD1
94±8
82±12
71±13
97±19
, 百拇医药
88±20
79±20
99±12
88±11
78±11
对照组
SD2
114±7
112±12
111±12
128±21
126±11
, http://www.100md.com 128±14
129±17
127±14
128±14
(n=6)
DPI
21±6
29±16
40±18
31±6
38±16
50±21
30±10
, http://www.100md.com
39±12
50±23
长度
32.7±4.4
32.8±3.1
30.2±3.5
注:SD1=刺激信号至双电位中第一个心房激动波时间,SD2=刺激信号至双电位中第二个心房激动波时间,DPI=双电位间期,长度=以电位区域从下至上长度。上、中、下即为双电位区域的上、中、下端。与对照组相应的DPI比较,* P<0.05
静脉给予1 mg/kg氟卡胺10 min后,起搏冠状窦(周长600 ms),两组病例双电位区域长度仍然相似,分别为28.0±7.7和30.2±3.5 mm。仅在房扑组中,SD2由上至下增加,这与冠状窦起搏时相似,而对照组中,SD2由上至下未有变化。两组双电位区域下端双电位间期分别为94±28和50±23 mm,两者间有显著性差异。其双电位间期增加原因是由于在房扑组中SD2进行性延迟所产生。
, 百拇医药
表2显示,静脉氟卡胺及冠状窦起搏300 ms与基础冠状窦起搏600 ms相比较,双电位区域的长度未有明显变化。值得一提的是:对照组6例中,5例在冠状窦起搏周长600,300 ms及静脉注射1 mg/kg氟卡胺后,SD2由上至下未有任何差异。但在1例67岁老年患者中,冠状窦起搏周长为300 ms和静脉注射1 mg/kg氟卡胺后,SD2由上至下进行性延迟,类似房扑组病例的结果。在这一病例研究中,不管刺激方式和强度怎样变化,均未诱发房扑。
3 讨论
普通型房扑是一种较常见的房性心律失常,但不是所有人都有房扑。动物实验研究表明在6条狗界嵴损伤的情况下,均诱发房扑[22],这与以前动物实验,包括损伤上、下腔静脉心房肌,Y型手术切口等相似[11~15]。这些动物实验证实若造成右房后壁解剖屏障,可诱发房扑。我们的资料表明在冠状窦起搏周长为600 ms时,SD2由上至下未有变化,推测此种情况下的界嵴横向传导是一个缓慢传导区域,而并非真正的传导阻滞。这一结果也指示双电位并不足以表示局部传导阻滞,还要取决于激动时间上的顺序关系。房扑组中4例峡部阻滞后和3例峡部未阻滞的病例均显示非常一致结果。即在冠状窦起搏情况下,界嵴的传导并不取决于峡部传导,而取决于横跨界嵴的传导速度及冠状窦起搏时沿三尖瓣环逆钟向兴奋右房游离壁的传导速度。在冠状窦起搏周长为300 ms和静脉给予1 mg/kg氟卡胺后,在房扑组病例中SD2均由上至下进行性延迟,指示第二个心房波激动主要是由间隔激动沿三尖瓣环逆钟向兴奋右房游离壁所致,显示出跨界嵴传导功能性阻滞。相反,在大多数对照组病例中,不管冠状窦起搏周长为600 ms,还是300 ms和静脉给予1 mg/kg氟卡胺,右房后壁双电位区域的第二个心房激动时间未显示任何由上至下进行性延迟,表明为其慢传导区域。但在对照组一老年病例中,起搏冠状窦周长为300 ms和静脉给予1 mg/kg氟卡胺后,右房后壁双电位区域中第二个心房激动时间显示由上至下进行性延迟,表明跨界嵴传导阻滞。通过以上两组病例研究,我们强烈建议跨界嵴的传导阻滞是房扑诱发和维持的必须前提,且不是唯一的前提。
, http://www.100md.com
作者简介:欧阳非凡(1965— ),男(汉族),湖南衡阳人,硕士,1993年评为广东省中级职称(心内科主治医师),1995年9月至今工作于德国汉堡St.Geory医院电生理室,现为Senior electrophysiology。主要致力于心律失常的诊治,特别是快速心律失常的非药物治疗。
作者单位:欧阳非凡(AK St.Georg,20009 Hamburg,Germany)
Karl-Heinz Kuck(AK St.Georg,20009 Hamburg,Germany)
参考文献:
[1] Olgin JE,Kalman JM,Fitzpatrick AP,et al.Role of right atrial endocardial structure as barriers to conduction during human type Ⅰ atrial flutter [J].Circulation,1995,92:1 839
, 百拇医药
[2] Nakagawa H,Lazzara R,Khastgir T,et al.Role of the tricuspid annulus and the eustachian valve/ridge on atrial flutter [J].Circulation,1996,94:407
[3] Kalman JM,Olgin JE,Saxon LA,et al.Activation and entrainment mapping defines the tricuspid annulus as the anterior barrier in typical atrial flutter [J].Circulation,1996,94:398
[4] Tai C-T,Chen S-A,Chiang C-E et al.Characterization of low right atrial isthmus as the slow conduction zone and phamacological target in typical atrial flutter [J].Circulation,1997,96:2 601
, http://www.100md.com
[5] Tai C-T,Chen S-A,Chiang C-E et al.Electrophysiologic characteristics and radiofrequency catheter ablation in patients with clockwise atrial flutter [J].J Cardiovasc Electrophysiol,1997,8:24
[6] Schwartzman D,Callans DJ,Gottlieb CD,et al.Conduction block in the inferior vena caval-tricuspid valve isthmus:association with outcome of radiofrequncy ablation of type Ⅰ atrial flutter [J].J Am Coll Cardiol,1996,28:1 519
[7] Shah DC,Haissaguerre M,Jais P,et al.Atrial flutter:Contemporary electrophysiology and catheter ablaion [J].PACE,1999,22:344
, 百拇医药
[8] Feld GK,Fleck P,Chen P-S,et al.Radiofrequency catheter ablation for the treatment of human type Ⅰ atrial flutter [J].Circulation,1992,86:1 233
[9] Caushemez B,Haissaguerre M,Fischer B,et al.Electrophysiological effects of catheter ablation of inferior vena cava-tricuspid annulus isthmus in common atrial flutter [J].Circulation,1996,93:284
[10] Ouyang F,Volkmer M,Emst S,et al.Identification of a conduction gap for successful focal reablation in patients with recurrent atrial flutter after inifial bidirectional block [J].Eur Heart J,1999,20(suppl):343
, 百拇医药
[11] Feld GK,Shahandeh-Rad F.Mechanism of double potentials recorded during sustained atrial flutter in the canine right atrial crush-injury model [J].Circulation,1992,86:628
[12] Boyden PA.Activation sequence during atrial flutter in dogs with surgically induced right atrial enlargement:Ⅰ.obervations during sustained rhythms [J].Circ Res,1988,62:596
[13] Frame LH,Page RL,Hoffman BF.Atrial reentry around an anatomic barrier with a partially refractory excitable gap.A canine model of atrial flutter [J].Circ Res,1986,58:495
, 百拇医药
[14] Okumura K,Plumb VJ,Page PL,et al.Atrial activation sequence during atrial flutter in the canine pericarditis model and its effects on the polarity of the flutter wave in the electrogram [J].J Am Coll Cardiol,1991;17:509
[15] Shimizu A,Nozaki A,Rudy Y,et al.Onset of induced atrial flutter in the canine pericarditis model [J].J Am Coll Cardiol,1991,17:1 223
[16] Stevenson WG,Khan H,Sager P,et al.Identification of reentry circuit sites during catheter mapping and radiofrequency ablation of ventricular tachycardia late after myocardial infarction [J].Circulation,1993,88:1 647
, 百拇医药
[17] Stevenson WG,Friedman L,Sager PT,et al.Exploring postinfarction reentrant ventricular tachycardia with entrainment paing [J].J Am Coll Cardiol,1997,29:1 180
[18] Klan HH,Stevenson WG.Activation times in and adjacent to reentry circuits during entrainment:Implications for mapping ventricular tachycardia [J].Am Heart J,1994,127:833
[19] Cosio FG,Gil ML,Arribas F,et al.Mechanisms of entrainment of human common flutter studied with multiple endocardial recordings [J].Circulation,1994,89:2 117
, 百拇医药
[20] Shah DC,Jais P,Haissaguerre M,et al.Three-demensional mapping of the common atrial flutter circuit in the right atrium [J].Circulation,1997,96:3 904
[21] Cosio FG,Arribas F,Barbero JM,et al.Validation of double-spike electrograms as markers of conduction delay or block in atril flutter [J].Am J Cardiol,1988,61:775
[22] Nakagawa H,Jackmanm WM.Use of a three-dimensional,nonfluoroscopic mapping system for catheter ablation of typical atrial flutter [J].PACE,1998,21:1 279, 百拇医药
摘 要:普通型心房扑动(AFL)的完整折返环路以及界嵴(CT)和AFL的关系仍不太清楚,笔者应用电解剖(CARTO)标测系统执行两项研究。Ⅰ:对12例持续AFL的病人实施右房CARTO标测及多部位拖带。于三尖瓣环(TA)周围测量传导速度。双电位(DP)位于右房后下壁,相当于解剖上的界嵴,从下腔静脉(IVC)与心房肌的连接处向上、稍前延伸,其长度为40.9±7.9 mm。所有病人的DP间期从上至下逐渐增加。在9例逆向AFL病人中,右心耳后基底部的后方一狭长心肌位于折返环内,结果来自右心耳基底前、后方的两个心房激动波融合于右房下游离壁。在另3例病人中(1例顺钟向、2例逆钟向)右心耳基底部后方未发现位于折返环内,迫使折返环仅绕三尖瓣与右心耳基底部前方之间的心肌兴奋右房下游离壁。在AFL的折返环中,没有固定的缓慢传导区,大部分病人的缓慢传导区位于间隔部和侧壁。Ⅱ:对7例普通型AFL及6例非AFL病人,在冠状窦起搏下,标测右房后壁。通过在右房重建中出现DP确认CT。以600,300 ms周长以及静脉注射氟卡胺(1 mg/kg)后以600 ms周长起搏冠状窦,分别测量CT上、中、下部位的刺激信号至双电位中第一及第二个心房激动波的传导时间(SD1及SD2)和此部位的电位间期(DPI)。在AFL病例中,与以600 ms周长起搏冠状窦时相比,以300 ms以及静脉注射氟卡胺后以600 ms周长起搏冠状窦时,CT的SD2和DPI从上至下逐渐增加。结论:①右心耳基底前、后方的心房激动波传导存在差异,结果导致了AFL的2种不同的折返环。②在人类的AFL折返环中,没有固定的缓慢传导区,缓慢传导区位于沿TA的间隔部和侧壁。③在AFL折返环路中,CT是一功能性解剖障碍;在没有AFL的病人中,CT被证实为是一缓慢传导区。④频率依赖性和氟卡胺诱导的跨CT的功能性传导阻滞是一种常见现象,此可能是临床AFL的诱发和维持的触发因素。
, 百拇医药
关键词:心房扑动,普通型 CARTO系统 电解剖标测 拖带标测 缓慢传导区 双电位 界嵴 电生理学 导管消融,射频电流
普通型心房扑动(简称房扑)是一种大折返房性心动过速,其折返环位于右房,包括逆钟向和顺钟向型房扑。三尖瓣和下腔静脉形成的峡部是折返环的关键部位,射频消融此峡部可治愈房扑,其成功率达95%[1~9]。若射频消融以峡部双向阻滞为终点,其复发率约5%左右[10]。最近研究显示三尖瓣环和界嵴(crista terminalis)是房扑两个固定和/或功能性解剖屏障[1~3],但界嵴的电生理特性与房扑的关系尚不清楚,且对峡部是否为缓慢传导区仍有争论。我们电生理室通过使用新的标测系统——电解剖标测系统(Electroanatomical mapping systm,即CARTOTM mapping system)研究房扑的折返环、折返环内传导速度及房扑患者与未有房扑患者界嵴的电生理现象的差异,以期解释为什么仅有一部分人发生房扑这一电生理现象。本系列研究由两大部分组成:普通型房扑的折返环、界嵴的电生理特性。
, 百拇医药
Ⅰ 普通型房扑的折返环
1 资料与方法
12例持续性房扑患者,其中男8例、女4例,年龄60±8岁。所有患者无心脏外科手术及射频消融史。无明确结构性心脏病证据者9例、冠心病2例、扩张型心肌病1例。停用抗心律失常药物至少5个半衰期以上。
电生理检查及CARTO标测:穿刺左、右股静脉及左锁骨下静脉,置7F Jackman电极于冠状窦内、6F 10极Webster His束旁电极于His束部位,另外置7F 20极Webster A—20电极于右房游离壁,且近可能靠近三尖瓣环。CARTO标测中,空间定位电极置于病人背部,时间定位心房电信号来源于冠状窦内稳定的心房电信号。为了确保右房电解剖标测的精确性,常规穿刺右颈内静脉,以期使Biosense Navi—Star标测电极可经右股静脉或右颈内静脉到达右房内任何部位。标测采用双极和单极同时记录,滤波范围分别为10~400 Hz和0~400 Hz。
, 百拇医药
双电位定义为有两个恒定的电位,且两者间的等电位线长于20 ms。所有病人完成右房电解剖重构后,必须进行右房多部位拖带标测以检测此处是否在房扑的折返环内。这些部位包括三尖瓣环(峡部、侧壁、间隔及前壁)、房间隔、冠状窦口的前方及后方、右心耳内及基底部的前方和后方。我们定义某标测点位于房扑折返环内的标准是:起搏后停顿间期(post-pacing interval,PPI)-房扑周长<30 ms,且(刺激信号-P波间期)-(局部传导时间-P波间期)<30 ms。传导速度的测量必须确保两标测点位于折返环内,且两点间距离少于3 cm。另外测量峡部间隔部和侧壁的宽度以及计算机自动分析的右房容积。
统计学处理:所有参数均采用X±s表示。
2 结果
12例持续性房扑,其中11例为逆钟向房扑、1例为顺钟向房扑。标测点为258±35(196~304)个,房扑周长为271±37(233~350) ms,被标测的房扑周长为96.1%±2.1%(93%~100%)。电解剖重构的右房容积为118±24(92~160)ml。峡部宽度:间隔部为20.9±5.2(12~29) mm、侧壁为27.5±5.8(19~34) mm。所有病人三尖瓣环都构成其房扑的解剖屏障。PPI长于房扑周长30 ms部位分布在冠状窦口后方、高位右房后壁及右心耳内。3例病人(其中1例顺钟向和2例逆钟向房扑)右心耳基底部后方未发现位于折返环内,迫使折返环仅绕三尖瓣与右心耳基底部前方之间的心肌兴奋右房下游离壁(附图A);另9例病人,右心耳后基底部的后方一狭长心肌位于折返环内,结果来自右心耳基底前方和后方的两个心房激动波融合于右房下游离壁(附图B)。

, 百拇医药
附图 房扑的折返环 SVC=上腔静脉,IVC=下腔静脉,RAA=右心耳,TA=三尖瓣环
双电位区域位于右房后壁,相当于解剖上的界嵴,从下腔静脉与心房肌的连接处向上、稍前延伸。右房后壁双电位区域的长度为40.9±7.9(29.6~52.6) mm。双电位间期上部为45.9±12.8(30~71) ms、中部为68.2±16.0(73~93) ms和下部为95.3±19.7(53~122) ms。从上至下双电位间期增加主要是由于第二个心房电位的进行性延迟所致。
折返环内靠近三尖瓣处局部传导速度见表1。峡部平均传导速度为0.79±0.29 m/s,间隔部及侧壁分别为0.68±0.40,0.62±0.52 m/s,仅前壁平均传导速度最快为0.98±0.59 m/s。若以每一个折返环内最慢传导速度为缓慢传导区域,其中7例缓慢传导区位于间隔部、4例位于侧壁及1例位于前壁,未有1例缓慢传导区发生于峡部。
, 百拇医药
射频消融位于三尖瓣和下腔静脉之间的峡部,平均放电6.1(1~14)次达到峡部双向传导阻滞;平均X线射照时间6.25(2.9~10.3) min。平均随访8个月,无一例房扑复发。
表1 房扑折返环内近瓣环处局部传导速度(m/s)
病例
房扑
类型
峡部
侧壁
间隔
前壁
前
中
, 百拇医药
后
1
CW
0.44
0.52
0.88
0.66
0.36
1.48
2
CCW
1.14
0.73
, 百拇医药
0.41
0.28
0.73
0.62
3
CCW
1.07
0.65
0.43
0.35
1.75
0.67
4
, 百拇医药
CCW
0.51
0.38
0.21
0.48
0.45
1.52
5
CCW
0.69
1.05
1.16
0.52
, 百拇医药
1.00
0.43
6
CCW
0.52
0.63
0.75
0.43
0.42
0.47
7
CCW
0.69
, 百拇医药
0.71
1.04
0.68
0.67
0.84
8
CCW
0.51
0.79
2.21
0.32
0.92
1.82
, http://www.100md.com
9
CCW
0.33
0.57
0.82
2.17
0.60
2.1
10
CCW
0.48
0.19
0.19
, http://www.100md.com
0.34
0.48
0.9
11
CCW
0.99
1.01
1.07
0.39
0.29
0.45
12
CCW
, 百拇医药
1.45
0.61
1.15
0.79
0.48
0.51
X±s
0.79±0.29
0.62
±0.52
0.68
±0.40
0.98
, http://www.100md.com
±0.59
注:CW=顺钟向型房扑,CCW=逆钟向型个月,无一例房扑复发。
3 讨论
在12例普通型房扑中,使用电解剖标测及拖带标测,有三个主要发现:①房扑折返环:房扑时,间隔的心房激动波兴奋心房前壁,于右心耳间隔基底部分裂为两个心房激动波,分别进入右心耳基底前和后方。75%病例(9/12)两者同时进入右房下游离壁并融于此;另25%病例由于两个激动波速度不匹配两者融合于右心耳基底部的后方,结果仅有一个激动波兴奋右房游离壁,进入三尖瓣和下腔静脉之间的峡部。②右房后壁双电位区域:在右房后壁有一个连续双电位区域,相当于解剖上的界嵴[11~15]。双电位区域从下腔静脉与心房的连结处向上稍前延伸,长达4 cm,形成房扑的另一解剖屏障。③局部传导速度:我们资料显示,不同病例折返环内传导速度有很大差异,且没有恒定的缓慢传导区域。但折返环内缓慢传导区主要分布于三尖瓣环间隔部和游离壁。下面对这三个主要发现分别作详细阐述。
, 百拇医药
3.1 房扑折返环 使用拖带标测揭示心动过速的折返环在心肌梗死后室性心运过速[16~18]上已得到证实。停顿后间期与心动过速周期的关系是一个非常有益的标测折返环的指标。以前的研究显示,三尖瓣和界嵴之间形成的通路“tunnel”延继至由三尖瓣和界嵴之间形成的峡部是折返环的一部分[1,3]。最近Shah[20]在没有使用拖带标测的研究中显示,心房激动波沿房间隔上行,分裂成两个激动波,激动于高位右房前后壁,并融合于右房游离壁。这与我们激动标测的结果相符,其融合处相当于解剖上的上部分界嵴,只是由于激动时间上的同一性,未能记录到双电位。但我们拖带标测结果显示,右房后部未在普通型房扑折返环内。此一结果证实CARTO激动和传导标测并不足以证实大折返性心动过速的折返环,这与Kalman等[3]其他研究结果相同。由于右心耳作为另一个解剖屏障,心房激动波于此分裂为两个激动波:一个激动波位于三尖瓣环和右心耳前基底部之间,另一个激动波位于右心耳后基底部和界嵴之间。我们资料显示,75%病例两个激动波同时激动右房下游离壁且融合于此,随后进入位于三尖瓣环和下腔静脉之间的峡部。更重要的是,有25%病例整个房扑折返环仅靠近三尖瓣环处。从CARTO标测仍可见两个心房激动波同时兴奋位于三尖瓣环和右心耳前基底部之间的心房肌及位于右心耳后基底部和界嵴之间的心房肌。但与大多数不同的是:两个激动波融合处不在右房下游离壁,而在右心耳后基底部与界嵴之间,最终导致位于右心耳后基底部与界嵴之间的激动波消失,仅遗留位于三尖瓣环和右心耳前基底部之间的激动波,沿三尖瓣环兴奋所有心房肌。我们推测是两个激动波的传导速度不匹配导致了这一独特的电生理现象。
, 百拇医药
3.2 右房后壁双电位区域 右房后壁功能性或解剖上的屏障是普通型房扑的共同特征[11~15],这一发现也在标测人类房扑时得到证实[1,2],并建议这是持续性房扑诱发和持续的前提[21]。X线指导右房后壁双电位标测缺乏精确的定位性。在心内超声指导下,置多极导管于界嵴,记录连续双电位,证实界嵴为一个传导阻滞区域,但对双电位间期缺乏详细记录[1]。最近Shan[20]采用CARTO标测系统研究人体普通型房扑结果显示:右房后壁双电位呈不规律、非线性分布。而我们的资料显示:右房后壁双电位区域从下腔静脉与心房的连结处向上、稍前连续延伸4 cm左右,且伴有第二个心房电活动从上至下进行性延迟,建议此区域为一连续线性传导阻滞。对这一矛盾结论的可能解释是:与我们采用了高密度的标测有关。
3.3 局部传导速度 以前对三尖瓣和下腔静脉间峡部的传导速度进行不同方法研究[4~9],仍有研究显示此峡部是房扑时缓慢传导区域。X线指导下将多极电极导管经此峡部置于冠状窦口,测量起搏冠状窦或房扑时峡部传导速度,证明此峡部为一缓慢传导组织,但这一结论仍有较大的局限性[3]。其一:多极导管仅位于峡部一个部位,且不一定平行于三尖瓣环;其二:众所周知冠状窦口周围为缓慢传导区域或功能性传导阻滞部位,尤其在房扑患者中。若将多极导管置于冠状窦口内,常规X线下有时极难区别导管的某一部位是否位于冠状窦口内,这会造成测量上误差。而我们研究采用更精确电解剖标测方法。首先CARTO系统可十分清楚地显示冠状窦口,且我们测量尽可能避免冠状窦及附近区域;其二:我们资料显示峡部内平行于三尖瓣环前、中、后三部位传导速度分布未有规律性,我们测量每一患者这三个部位的不同传导速度,且取其中最快传导速度作为峡部传导速度,这可能是我们测量的峡部传导速度较快的主要原因。最近Shan[20]采用同样技术,发现大多数患者峡部传导速度较慢,这可能是他们标测点较少、患者右房容积较小和单部位测量传导速度有关。值得指出的是,我们的资料显示房扑时个体间折返环内局部传导速度变异较大,但折返环内慢传导区主要位于三尖瓣环的间隔部和侧壁,这一结果与房扑的诱发和持续之间的关系仍有待进一步研究。
, http://www.100md.com
Ⅱ 界嵴的电生理特性
1 资料与方法
本研究包括两组病例:①房扑组:常规ECG有典型的普通型房扑ECG的表现和心内电生理检查证实有房扑,由7例患者组成,其中男5例、女2例,年龄63±8(55~78)岁。②对照组:常规ECG均未有房扑的证据,由6例患者组成,其中男2例、女4例,年龄54±8(42~67)岁。5例房室结折返性心动过速、1例预激综合征、2例无结构性心脏病的证据,且无心脏外科手术及射频消融史。停用抗心律失常药物至少5个半衰期以上。
电生理检查及CARTO标测:穿刺左、右股静脉,左锁骨下及颈内静脉。常规置7F Jackman电极于冠状窦内,采用Biosense Navi-Star标测导管经右股静脉及右颈内静脉入右房行右房标测。CARTO标测中,空间定位电极置于病人背部,时间定位取稳定起搏冠状窦夺获心房时的刺激信号。标测右房时,标测电极同时采用单极和双极记录,滤波范围同前,分别为10~40 Hz和0~400 Hz。
, 百拇医药
CARTO标测右房时分成三个部分。首先在冠状窦起搏(周长600 ms)时,标测整个右房后壁,从三尖瓣间隔部至三尖瓣侧壁,确定双电位的分布区域,再精标此区域——即解剖学上的界嵴中、下部,并测量其长度。我们人为把右房后壁双电位区域均等地分成上、中、下三个部位,分别测量刺激信号至双电位中第一及第二个心房激动波的传导时间及此部位的双电位间期。其二:在同一冠状窦起搏(周长300 ms)时,标测右房后壁双电位区域,测量所有参数,方法同上。其三:在恒定冠状窦起搏(周长600 ms)情况下,静脉给予1 mg/kg Flecainide(氟卡胺——Ic类抗心律失常药物)10 min,标测右房后壁双电位区域。观察起搏周长及氟卡胺对双电位的影响及在房扑组和对照组双电位是否有差异。另外在房扑组中,4例患者先行射频消融位于三尖瓣及下腔静脉之间的峡部,且成功地使峡部双向传导阻滞,然后标测右房后壁双电位区域;另3例患者先标测右房后壁双电位区域,随后行射频消融三尖瓣和下腔静脉间的峡部。所有对照组病例,均先标测右房后壁双电位区域,然后对不同心律失常进行处理。
, http://www.100md.com
统计学处理:所有资料用X±s表示,采用配对t检验,以P<0.05为差异有显著性。
2 结果
所有两组病例右房后壁均有相似的双电位分布区域,即从下腔静腔与右房交界处向上、稍前延伸。所有参数包括刺激信号至第一个及第二个心房激动波的时间、双电位间期及双电位区域的长度见表2。其中在房扑组中4例峡部阻断和3例峡部未阻断者的所有这些参数无任何差异。
表2显示,冠状窦起搏周长600 ms时,右房后壁双电位区域的长度在房扑组和对照组中分别为31.4±7.3和32.7±4.4 mm,二者间没有差异。另外,在两组病例中,刺激信号至第一个心房激动波时间(SD1)从下至上增加,而刺激信号至第二个心房激动波时间(SD2)没有差异。尽管双电位间期在两组病例中显示由上至下增加,其增加是由于SD1由下至上延长所致。两组间双电位间期无差异。在冠状窦起搏周长300 ms时,两组病例双电位区域的长度没有差异,分别为30.3±6.9和32.8±3.1 mm。在房扑和对照组中,SD1仍然由下至上增加,但仅在房扑组中,SD2由上至下进行性增加,而对照组中SD2由上至下没有明显变化。位于双电位区域下端的双电位间期在房扑组时为79±27 ms,明显长于对照组的50±21 ms,且有显著性差异。与对照组相比较,房扑组中双电位间期由上至下增加是由于SD2的进行延迟所致。
, 百拇医药
表2 不同刺激周长及氟卡胺对右房后壁上、中、下部位双电位的作用( X±s,ms)
组别
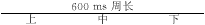
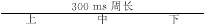
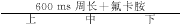
SD1
114±19
104±15
100±19
, http://www.100md.com 116±17
101±16
94±18
122±7.0
114±15
104±3.0
房扑组
SD2
143±26
140±28
142±28
142±29
, 百拇医药
151±24
165±29
173±35
167±21
182±31
(n=7)
DPI
29±8
36±13
42±13
35±14
54±22
79±27*
, 百拇医药
45±16
68±26
94±28*
长度
31.4±7.3
30.3±6.9
28.0±7.7
SD1
94±8
82±12
71±13
97±19
, 百拇医药
88±20
79±20
99±12
88±11
78±11
对照组
SD2
114±7
112±12
111±12
128±21
126±11
, http://www.100md.com 128±14
129±17
127±14
128±14
(n=6)
DPI
21±6
29±16
40±18
31±6
38±16
50±21
30±10
, http://www.100md.com
39±12
50±23
长度
32.7±4.4
32.8±3.1
30.2±3.5
注:SD1=刺激信号至双电位中第一个心房激动波时间,SD2=刺激信号至双电位中第二个心房激动波时间,DPI=双电位间期,长度=以电位区域从下至上长度。上、中、下即为双电位区域的上、中、下端。与对照组相应的DPI比较,* P<0.05
静脉给予1 mg/kg氟卡胺10 min后,起搏冠状窦(周长600 ms),两组病例双电位区域长度仍然相似,分别为28.0±7.7和30.2±3.5 mm。仅在房扑组中,SD2由上至下增加,这与冠状窦起搏时相似,而对照组中,SD2由上至下未有变化。两组双电位区域下端双电位间期分别为94±28和50±23 mm,两者间有显著性差异。其双电位间期增加原因是由于在房扑组中SD2进行性延迟所产生。
, 百拇医药
表2显示,静脉氟卡胺及冠状窦起搏300 ms与基础冠状窦起搏600 ms相比较,双电位区域的长度未有明显变化。值得一提的是:对照组6例中,5例在冠状窦起搏周长600,300 ms及静脉注射1 mg/kg氟卡胺后,SD2由上至下未有任何差异。但在1例67岁老年患者中,冠状窦起搏周长为300 ms和静脉注射1 mg/kg氟卡胺后,SD2由上至下进行性延迟,类似房扑组病例的结果。在这一病例研究中,不管刺激方式和强度怎样变化,均未诱发房扑。
3 讨论
普通型房扑是一种较常见的房性心律失常,但不是所有人都有房扑。动物实验研究表明在6条狗界嵴损伤的情况下,均诱发房扑[22],这与以前动物实验,包括损伤上、下腔静脉心房肌,Y型手术切口等相似[11~15]。这些动物实验证实若造成右房后壁解剖屏障,可诱发房扑。我们的资料表明在冠状窦起搏周长为600 ms时,SD2由上至下未有变化,推测此种情况下的界嵴横向传导是一个缓慢传导区域,而并非真正的传导阻滞。这一结果也指示双电位并不足以表示局部传导阻滞,还要取决于激动时间上的顺序关系。房扑组中4例峡部阻滞后和3例峡部未阻滞的病例均显示非常一致结果。即在冠状窦起搏情况下,界嵴的传导并不取决于峡部传导,而取决于横跨界嵴的传导速度及冠状窦起搏时沿三尖瓣环逆钟向兴奋右房游离壁的传导速度。在冠状窦起搏周长为300 ms和静脉给予1 mg/kg氟卡胺后,在房扑组病例中SD2均由上至下进行性延迟,指示第二个心房波激动主要是由间隔激动沿三尖瓣环逆钟向兴奋右房游离壁所致,显示出跨界嵴传导功能性阻滞。相反,在大多数对照组病例中,不管冠状窦起搏周长为600 ms,还是300 ms和静脉给予1 mg/kg氟卡胺,右房后壁双电位区域的第二个心房激动时间未显示任何由上至下进行性延迟,表明为其慢传导区域。但在对照组一老年病例中,起搏冠状窦周长为300 ms和静脉给予1 mg/kg氟卡胺后,右房后壁双电位区域中第二个心房激动时间显示由上至下进行性延迟,表明跨界嵴传导阻滞。通过以上两组病例研究,我们强烈建议跨界嵴的传导阻滞是房扑诱发和维持的必须前提,且不是唯一的前提。
, http://www.100md.com
作者简介:欧阳非凡(1965— ),男(汉族),湖南衡阳人,硕士,1993年评为广东省中级职称(心内科主治医师),1995年9月至今工作于德国汉堡St.Geory医院电生理室,现为Senior electrophysiology。主要致力于心律失常的诊治,特别是快速心律失常的非药物治疗。
作者单位:欧阳非凡(AK St.Georg,20009 Hamburg,Germany)
Karl-Heinz Kuck(AK St.Georg,20009 Hamburg,Germany)
参考文献:
[1] Olgin JE,Kalman JM,Fitzpatrick AP,et al.Role of right atrial endocardial structure as barriers to conduction during human type Ⅰ atrial flutter [J].Circulation,1995,92:1 839
, 百拇医药
[2] Nakagawa H,Lazzara R,Khastgir T,et al.Role of the tricuspid annulus and the eustachian valve/ridge on atrial flutter [J].Circulation,1996,94:407
[3] Kalman JM,Olgin JE,Saxon LA,et al.Activation and entrainment mapping defines the tricuspid annulus as the anterior barrier in typical atrial flutter [J].Circulation,1996,94:398
[4] Tai C-T,Chen S-A,Chiang C-E et al.Characterization of low right atrial isthmus as the slow conduction zone and phamacological target in typical atrial flutter [J].Circulation,1997,96:2 601
, http://www.100md.com
[5] Tai C-T,Chen S-A,Chiang C-E et al.Electrophysiologic characteristics and radiofrequency catheter ablation in patients with clockwise atrial flutter [J].J Cardiovasc Electrophysiol,1997,8:24
[6] Schwartzman D,Callans DJ,Gottlieb CD,et al.Conduction block in the inferior vena caval-tricuspid valve isthmus:association with outcome of radiofrequncy ablation of type Ⅰ atrial flutter [J].J Am Coll Cardiol,1996,28:1 519
[7] Shah DC,Haissaguerre M,Jais P,et al.Atrial flutter:Contemporary electrophysiology and catheter ablaion [J].PACE,1999,22:344
, 百拇医药
[8] Feld GK,Fleck P,Chen P-S,et al.Radiofrequency catheter ablation for the treatment of human type Ⅰ atrial flutter [J].Circulation,1992,86:1 233
[9] Caushemez B,Haissaguerre M,Fischer B,et al.Electrophysiological effects of catheter ablation of inferior vena cava-tricuspid annulus isthmus in common atrial flutter [J].Circulation,1996,93:284
[10] Ouyang F,Volkmer M,Emst S,et al.Identification of a conduction gap for successful focal reablation in patients with recurrent atrial flutter after inifial bidirectional block [J].Eur Heart J,1999,20(suppl):343
, 百拇医药
[11] Feld GK,Shahandeh-Rad F.Mechanism of double potentials recorded during sustained atrial flutter in the canine right atrial crush-injury model [J].Circulation,1992,86:628
[12] Boyden PA.Activation sequence during atrial flutter in dogs with surgically induced right atrial enlargement:Ⅰ.obervations during sustained rhythms [J].Circ Res,1988,62:596
[13] Frame LH,Page RL,Hoffman BF.Atrial reentry around an anatomic barrier with a partially refractory excitable gap.A canine model of atrial flutter [J].Circ Res,1986,58:495
, 百拇医药
[14] Okumura K,Plumb VJ,Page PL,et al.Atrial activation sequence during atrial flutter in the canine pericarditis model and its effects on the polarity of the flutter wave in the electrogram [J].J Am Coll Cardiol,1991;17:509
[15] Shimizu A,Nozaki A,Rudy Y,et al.Onset of induced atrial flutter in the canine pericarditis model [J].J Am Coll Cardiol,1991,17:1 223
[16] Stevenson WG,Khan H,Sager P,et al.Identification of reentry circuit sites during catheter mapping and radiofrequency ablation of ventricular tachycardia late after myocardial infarction [J].Circulation,1993,88:1 647
, 百拇医药
[17] Stevenson WG,Friedman L,Sager PT,et al.Exploring postinfarction reentrant ventricular tachycardia with entrainment paing [J].J Am Coll Cardiol,1997,29:1 180
[18] Klan HH,Stevenson WG.Activation times in and adjacent to reentry circuits during entrainment:Implications for mapping ventricular tachycardia [J].Am Heart J,1994,127:833
[19] Cosio FG,Gil ML,Arribas F,et al.Mechanisms of entrainment of human common flutter studied with multiple endocardial recordings [J].Circulation,1994,89:2 117
, 百拇医药
[20] Shah DC,Jais P,Haissaguerre M,et al.Three-demensional mapping of the common atrial flutter circuit in the right atrium [J].Circulation,1997,96:3 904
[21] Cosio FG,Arribas F,Barbero JM,et al.Validation of double-spike electrograms as markers of conduction delay or block in atril flutter [J].Am J Cardiol,1988,61:775
[22] Nakagawa H,Jackmanm WM.Use of a three-dimensional,nonfluoroscopic mapping system for catheter ablation of typical atrial flutter [J].PACE,1998,21:1 279, 百拇医药