氧化应激在糖代谢紊乱中的作用
叶于薇 仲伟鉴 董妙珠 张荣泉
摘 要:为探讨氧化应激和糖尿病发生/发展的相互关系,由四氧嘧啶诱导建立糖尿病大鼠模型,进行抗氧化干预。动物经此化学诱导剂处理后,血糖/血脂和硫代巴比妥酸反应产物(TBARs)升高,SOD降低,再经抗氧化干预,即可发生逆转恢复。试验结果表明糖/脂代谢调节和氧化应激密切相关。
关键词:糖尿病,实验性 自由基 氧化性应激
一般认为糖尿病是由于绝对或相对胰岛素分泌不足引起的糖、蛋白质、脂肪等代谢紊乱,特征为血糖过高、糖尿、葡萄糖耐量减低及胰岛素释放异常。旷日持久的高血糖又将成为一些慢性并发症的病理、生理基础。事实上,糖尿病及其并发症的发病机理十分复杂,至今尚未完全阐明。近年来,将氧化应激(Oxidative stress)和糖尿病及其并发症的复杂病理机制联系在一起,[1,2]颇受注意。本文试图通过用含有复合抗氧化组份的保健食品对四氧嘧啶诱导的糖尿病大鼠进行干预试验,探讨其氧化应激和糖尿病发生/发展的相互关系。
, http://www.100md.com
1 材料和方法
动物 Wistar大白鼠,雄性,体重120~150 g。
试剂 四氧嘧啶(Alloxan)、黄嘌呤氧化酶,均为Sigma公司产品;TBA,Merck公司产品;其余均为国产试剂。
TSP 全复合抗氧化组分的某保健食品。
造模及抗氧化干预 大鼠空腹8 h后,按Alloxan 200 mg/kg BW(ip)造模,模型造成后,选择FBG(空腹血糖)>10 mmol/L者分组进行试验,干预组分设低、中、高3个TSP剂量,分别为30、300、900 mg/kg BW。连续喂饲2周后,内眦取血,分离血清,测定以下指标。
血糖测定 采用Johnson微型血糖仪(Ⅱ型)测定。
, 百拇医药 血脂测定 甘油三酯(TG),总胆固醇(TC)和高密度脂蛋白(HDL)均采用Meric Alize型自动生化仪及其kit测定。
SOD测定 按Yanagni法测定。[3]
TBARs测定 按Yagi K法测定,[4]反应产物以MDA(丙二醛)定量。
统计分析 数据用X±SD表示,统计分析用SAS软件包处理。
2 结果
2.1 TSP对于实验性糖尿病大鼠FBG的影响(表1) 大鼠经四氧嘧啶诱导后,空腹血糖(FBG)值显著高于正常对照组(高血糖模型对照组FBG几乎为正常对照组的5倍)。但经TSP喂饲2周后,各实验组FBG值均有不同程度的下降,并显示一定程度的剂量—效应关系;中、高二剂量组与模型对照组相比,具有显著性差异(P<0.05)。
, http://www.100md.com
表1 TSP对糖尿病大鼠FBG的影响
组别
动物数 只
FBG mmol/L
模型对照
10
27.6±2.6
正常对照
10
5.6±0.9
低剂量
10
25.2±4.2
, 百拇医药
中剂量
10
23.9±4.1(1)
高剂量
10
21.4±2.4(1)
注:(1) 与模型对照组比较 P<0.05。2.2 TSP对于实验性糖尿病大鼠血脂的影响(表2) 高血糖模型对照组甘油三酯(TG)、总胆固醇(TC)和动脉粥样硬化指数(AI)3项指标均显著高于正常对照组;经喂饲TSP 2周后,各实验组上述3项指标均随剂量增加而降低,并接近恢复至正常水平,与高血糖模型对照组比较,具有显著性差异。
表2 TSP对于实验性糖尿病大鼠血脂的影响
, 百拇医药
组别
动物数 只
TG mmol/L
TC mmol/L
HDL mmol/L
HDL/TC
AI(2)
正常对照
10
1.12±0.22
2.85±0.61
1.31±0.19
, 百拇医药
0.48±0.11
1.19±0.46
高血糖模型
10
2.02±0.83
3.98±1.13
1.24±0.08
0.33±0.09
2.22±0.95
低剂量
10
1.20±0.18(1)
, 百拇医药
3.02±0.23(1)
1.14±0.08
0.38±0.05
1.66±0.32(1)
中剂量
10
1.18±0.25(1)
3.18±0.50(1)
1.32±0.25
0.43±0.12
1.48±0.55(1)
, http://www.100md.com
高剂量
10
1.00±0.22(1)
2.80±0.57(1)
1.22±0.11
0.45±0.08
1.29±0.39(1)
注(1)与高血糖模型组相比 P<0.05 (2)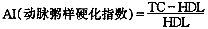 2.3 TSP对于实验性糖尿病大鼠自由基代谢的影响(表3) 由表3可见,与正常对照组比较,高血糖模型对照组血清SOD显著降低,巴比妥酸反应产物(MDA)显著增高。但经TSP喂饲2周后,各实验组SOD随剂量增加而升高;而MDA值随剂量增加而降低。
2.3 TSP对于实验性糖尿病大鼠自由基代谢的影响(表3) 由表3可见,与正常对照组比较,高血糖模型对照组血清SOD显著降低,巴比妥酸反应产物(MDA)显著增高。但经TSP喂饲2周后,各实验组SOD随剂量增加而升高;而MDA值随剂量增加而降低。
, http://www.100md.com
表3 TSP对于实验性糖尿病大鼠自由基代谢的影响
组别
动物数 只
SOD μ/mL
MDA nmol/mL
正常对照
10
30.74±1.66
3.49±1.15
高血糖模型
10
19.43±1.83
, http://www.100md.com
12.24±3.08
低剂量
10
24.06±1.70(1)
5.29±1.37(1)
中剂量
10
25.99±2.71(1)
4.23±0.71(1)
高剂量
10
, 百拇医药
26.62±3.25(1)
4.16±1.27(1)
注:(1)与高血糖模型组相比 P<0.053 讨论
四氧嘧啶现已广泛用于糖尿病动物模型的建立。这种模型具有以下优点:1、近似人类糖尿病,2、胰岛外分泌部不受损伤影响,3、β细胞功能仅是不同程度的降低,不是丧失,有利于胰岛组织再生和功能修复。
本实验结果说明,大鼠经四氧嘧啶诱导后,胰岛β细胞损伤,分泌功能降低,因而糖元合成和脂类生成作用受阻,血糖 、血脂和动脉粥样硬化指数升高,同时,主要抗氧化酶类——血清SOD降低,外周组织膜脂蛋白代谢末端产物——TBARs(或脂质过氧化产物)升高,MDA/SOD比值增加。说明糖尿病大鼠抗氧化防御体系受抑制,自由基产生率大于清除率,氧化应激增强,[5]这与糖尿病患者体内变化相一致。[2,6]
, 百拇医药
动物Ⅰ型糖尿病可由化学剂或免疫剂轰击胰β细胞中建立,在这二种情况下,都产生活性氧,并在杀伤β细胞中起到重要作用。四氧嘧啶易于还原成dialuric acid(5-羟巴比妥酸)。用ESR(电子自旋共振)和化学发光方法证明在还原剂、过渡金属存在下,无细胞或β细胞的离体实验中,[6,7]通过5-羟巴比妥酸的自氧化,产生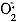 、H2O2,继而由Haber-Weiss反应转化成·OH,攻击损伤β细胞。β细胞之所以易受·OH攻击损伤,是由于这种细胞总抗氧化能力特别低下。氧化应激在糖尿病发病中的作用是肯定的。由自由基介导的四氧嘧啶致糖尿病发生发展过程中,体内自由基总产生率高于其清除率,加重了氧化应激。
、H2O2,继而由Haber-Weiss反应转化成·OH,攻击损伤β细胞。β细胞之所以易受·OH攻击损伤,是由于这种细胞总抗氧化能力特别低下。氧化应激在糖尿病发病中的作用是肯定的。由自由基介导的四氧嘧啶致糖尿病发生发展过程中,体内自由基总产生率高于其清除率,加重了氧化应激。
表4 参数相关性分析
, http://www.100md.com
AI
MDA
SOD
TC
TG
GLU
r
0.3449
-0.36605
0.50510
, 百拇医药 -0.66793
0.29178
0.36605
P
0.0142
0.0089
0.0002
0.0001
0.0398
0.0381
TG
r
0.67306
, 百拇医药
-0.50314
0.60094
-0.52391
0.62257
P
0.0001
0.0002
0.0001
0.0001
0.0001
TC
r
0.91305
, 百拇医药
-0.78109
0.51334
-0.45337
-
P
0.0001
0.0001
0.0001
0.0009
AI
r
-
-0.92229
, 百拇医药
0.46306
-0.48476
0.91305
P
0.0001
0.0007
0.0004
0.0001
本文结果显示用复合抗氧化剂TSP干预后,上述观察指标产生逆转缓解。这些变化经相关性分析后发现,血糖与血脂、AI和TBARs正相关;血糖和SOD是负相关(表4)。由此可见糖/脂代谢调节和氧化应激密切相关。
作者单位:叶于薇(上海市卫生防疫站,上海 200336)
, 百拇医药
仲伟鉴(上海市卫生防疫站,上海 200336)
董妙珠(上海市卫生防疫站,上海 200336)
张荣泉(上海市卫生防疫站,上海 200336)
参考文献:
[1]Kowluru, RA, et al. Abnormatilities of retinal metabolism in diabetes[J]. Free Radical Biol&Med, 1997,22(4):587~592
[2]Baynes, JW. Perspectiues in diabetes[J]. Diabetes, 1991,40:405~411
[3]Yanagui Y. Preevaluation of assay methods for superoxides dismutase activity[J]. Anal Biochem, 1986,146:290~296
, 百拇医药
[4]Kunio Yagi. Assay for blood plasma or serum[J]. Methods in Enzymology Ⅴ,1984,105:328~331
[5]Pigeolet E, et al. GSHPx, SOD and CAT inactivation by peroxides and oxygen derived free radicals[J]. Mech Ageing Dev, 1990,50:283~297
[6]Oberley, LW. Free radicals and diabetes[J]. Free Radical Biol and Med. 1988,5:13~24
[7]Dulin, WI, et al. Experimental and spontaneous diabetes in animals[J]. In:Ellenbeirg M eds, Diabetes Mellitus, Theory and Practice, New Hyde Park; Medical Examinations Publ, 1983,361
[8]Jenmings, PE. The relationship of oxidative stress to thrombotic tendency in type Ⅰ diebetic patients with diabetic retinopathy[J]. Diabetic Med. 1992,87:860~865, 百拇医药
摘 要:为探讨氧化应激和糖尿病发生/发展的相互关系,由四氧嘧啶诱导建立糖尿病大鼠模型,进行抗氧化干预。动物经此化学诱导剂处理后,血糖/血脂和硫代巴比妥酸反应产物(TBARs)升高,SOD降低,再经抗氧化干预,即可发生逆转恢复。试验结果表明糖/脂代谢调节和氧化应激密切相关。
关键词:糖尿病,实验性 自由基 氧化性应激
一般认为糖尿病是由于绝对或相对胰岛素分泌不足引起的糖、蛋白质、脂肪等代谢紊乱,特征为血糖过高、糖尿、葡萄糖耐量减低及胰岛素释放异常。旷日持久的高血糖又将成为一些慢性并发症的病理、生理基础。事实上,糖尿病及其并发症的发病机理十分复杂,至今尚未完全阐明。近年来,将氧化应激(Oxidative stress)和糖尿病及其并发症的复杂病理机制联系在一起,[1,2]颇受注意。本文试图通过用含有复合抗氧化组份的保健食品对四氧嘧啶诱导的糖尿病大鼠进行干预试验,探讨其氧化应激和糖尿病发生/发展的相互关系。
, http://www.100md.com
1 材料和方法
动物 Wistar大白鼠,雄性,体重120~150 g。
试剂 四氧嘧啶(Alloxan)、黄嘌呤氧化酶,均为Sigma公司产品;TBA,Merck公司产品;其余均为国产试剂。
TSP 全复合抗氧化组分的某保健食品。
造模及抗氧化干预 大鼠空腹8 h后,按Alloxan 200 mg/kg BW(ip)造模,模型造成后,选择FBG(空腹血糖)>10 mmol/L者分组进行试验,干预组分设低、中、高3个TSP剂量,分别为30、300、900 mg/kg BW。连续喂饲2周后,内眦取血,分离血清,测定以下指标。
血糖测定 采用Johnson微型血糖仪(Ⅱ型)测定。
, 百拇医药 血脂测定 甘油三酯(TG),总胆固醇(TC)和高密度脂蛋白(HDL)均采用Meric Alize型自动生化仪及其kit测定。
SOD测定 按Yanagni法测定。[3]
TBARs测定 按Yagi K法测定,[4]反应产物以MDA(丙二醛)定量。
统计分析 数据用X±SD表示,统计分析用SAS软件包处理。
2 结果
2.1 TSP对于实验性糖尿病大鼠FBG的影响(表1) 大鼠经四氧嘧啶诱导后,空腹血糖(FBG)值显著高于正常对照组(高血糖模型对照组FBG几乎为正常对照组的5倍)。但经TSP喂饲2周后,各实验组FBG值均有不同程度的下降,并显示一定程度的剂量—效应关系;中、高二剂量组与模型对照组相比,具有显著性差异(P<0.05)。
, http://www.100md.com
表1 TSP对糖尿病大鼠FBG的影响
组别
动物数 只
FBG mmol/L
模型对照
10
27.6±2.6
正常对照
10
5.6±0.9
低剂量
10
25.2±4.2
, 百拇医药
中剂量
10
23.9±4.1(1)
高剂量
10
21.4±2.4(1)
注:(1) 与模型对照组比较 P<0.05。2.2 TSP对于实验性糖尿病大鼠血脂的影响(表2) 高血糖模型对照组甘油三酯(TG)、总胆固醇(TC)和动脉粥样硬化指数(AI)3项指标均显著高于正常对照组;经喂饲TSP 2周后,各实验组上述3项指标均随剂量增加而降低,并接近恢复至正常水平,与高血糖模型对照组比较,具有显著性差异。
表2 TSP对于实验性糖尿病大鼠血脂的影响
, 百拇医药
组别
动物数 只
TG mmol/L
TC mmol/L
HDL mmol/L
HDL/TC
AI(2)
正常对照
10
1.12±0.22
2.85±0.61
1.31±0.19
, 百拇医药
0.48±0.11
1.19±0.46
高血糖模型
10
2.02±0.83
3.98±1.13
1.24±0.08
0.33±0.09
2.22±0.95
低剂量
10
1.20±0.18(1)
, 百拇医药
3.02±0.23(1)
1.14±0.08
0.38±0.05
1.66±0.32(1)
中剂量
10
1.18±0.25(1)
3.18±0.50(1)
1.32±0.25
0.43±0.12
1.48±0.55(1)
, http://www.100md.com
高剂量
10
1.00±0.22(1)
2.80±0.57(1)
1.22±0.11
0.45±0.08
1.29±0.39(1)
注(1)与高血糖模型组相比 P<0.05 (2)
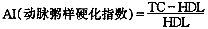 2.3 TSP对于实验性糖尿病大鼠自由基代谢的影响(表3) 由表3可见,与正常对照组比较,高血糖模型对照组血清SOD显著降低,巴比妥酸反应产物(MDA)显著增高。但经TSP喂饲2周后,各实验组SOD随剂量增加而升高;而MDA值随剂量增加而降低。
2.3 TSP对于实验性糖尿病大鼠自由基代谢的影响(表3) 由表3可见,与正常对照组比较,高血糖模型对照组血清SOD显著降低,巴比妥酸反应产物(MDA)显著增高。但经TSP喂饲2周后,各实验组SOD随剂量增加而升高;而MDA值随剂量增加而降低。, http://www.100md.com
表3 TSP对于实验性糖尿病大鼠自由基代谢的影响
组别
动物数 只
SOD μ/mL
MDA nmol/mL
正常对照
10
30.74±1.66
3.49±1.15
高血糖模型
10
19.43±1.83
, http://www.100md.com
12.24±3.08
低剂量
10
24.06±1.70(1)
5.29±1.37(1)
中剂量
10
25.99±2.71(1)
4.23±0.71(1)
高剂量
10
, 百拇医药
26.62±3.25(1)
4.16±1.27(1)
注:(1)与高血糖模型组相比 P<0.053 讨论
四氧嘧啶现已广泛用于糖尿病动物模型的建立。这种模型具有以下优点:1、近似人类糖尿病,2、胰岛外分泌部不受损伤影响,3、β细胞功能仅是不同程度的降低,不是丧失,有利于胰岛组织再生和功能修复。
本实验结果说明,大鼠经四氧嘧啶诱导后,胰岛β细胞损伤,分泌功能降低,因而糖元合成和脂类生成作用受阻,血糖 、血脂和动脉粥样硬化指数升高,同时,主要抗氧化酶类——血清SOD降低,外周组织膜脂蛋白代谢末端产物——TBARs(或脂质过氧化产物)升高,MDA/SOD比值增加。说明糖尿病大鼠抗氧化防御体系受抑制,自由基产生率大于清除率,氧化应激增强,[5]这与糖尿病患者体内变化相一致。[2,6]
, 百拇医药
动物Ⅰ型糖尿病可由化学剂或免疫剂轰击胰β细胞中建立,在这二种情况下,都产生活性氧,并在杀伤β细胞中起到重要作用。四氧嘧啶易于还原成dialuric acid(5-羟巴比妥酸)。用ESR(电子自旋共振)和化学发光方法证明在还原剂、过渡金属存在下,无细胞或β细胞的离体实验中,[6,7]通过5-羟巴比妥酸的自氧化,产生
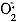 、H2O2,继而由Haber-Weiss反应转化成·OH,攻击损伤β细胞。β细胞之所以易受·OH攻击损伤,是由于这种细胞总抗氧化能力特别低下。氧化应激在糖尿病发病中的作用是肯定的。由自由基介导的四氧嘧啶致糖尿病发生发展过程中,体内自由基总产生率高于其清除率,加重了氧化应激。
、H2O2,继而由Haber-Weiss反应转化成·OH,攻击损伤β细胞。β细胞之所以易受·OH攻击损伤,是由于这种细胞总抗氧化能力特别低下。氧化应激在糖尿病发病中的作用是肯定的。由自由基介导的四氧嘧啶致糖尿病发生发展过程中,体内自由基总产生率高于其清除率,加重了氧化应激。表4 参数相关性分析
, http://www.100md.com
AI
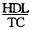
MDA
SOD
TC
TG
GLU
r
0.3449
-0.36605
0.50510
, 百拇医药 -0.66793
0.29178
0.36605
P
0.0142
0.0089
0.0002
0.0001
0.0398
0.0381
TG
r
0.67306
, 百拇医药
-0.50314
0.60094
-0.52391
0.62257
P
0.0001
0.0002
0.0001
0.0001
0.0001
TC
r
0.91305
, 百拇医药
-0.78109
0.51334
-0.45337
-
P
0.0001
0.0001
0.0001
0.0009
AI
r
-
-0.92229
, 百拇医药
0.46306
-0.48476
0.91305
P
0.0001
0.0007
0.0004
0.0001
本文结果显示用复合抗氧化剂TSP干预后,上述观察指标产生逆转缓解。这些变化经相关性分析后发现,血糖与血脂、AI和TBARs正相关;血糖和SOD是负相关(表4)。由此可见糖/脂代谢调节和氧化应激密切相关。
作者单位:叶于薇(上海市卫生防疫站,上海 200336)
, 百拇医药
仲伟鉴(上海市卫生防疫站,上海 200336)
董妙珠(上海市卫生防疫站,上海 200336)
张荣泉(上海市卫生防疫站,上海 200336)
参考文献:
[1]Kowluru, RA, et al. Abnormatilities of retinal metabolism in diabetes[J]. Free Radical Biol&Med, 1997,22(4):587~592
[2]Baynes, JW. Perspectiues in diabetes[J]. Diabetes, 1991,40:405~411
[3]Yanagui Y. Preevaluation of assay methods for superoxides dismutase activity[J]. Anal Biochem, 1986,146:290~296
, 百拇医药
[4]Kunio Yagi. Assay for blood plasma or serum[J]. Methods in Enzymology Ⅴ,1984,105:328~331
[5]Pigeolet E, et al. GSHPx, SOD and CAT inactivation by peroxides and oxygen derived free radicals[J]. Mech Ageing Dev, 1990,50:283~297
[6]Oberley, LW. Free radicals and diabetes[J]. Free Radical Biol and Med. 1988,5:13~24
[7]Dulin, WI, et al. Experimental and spontaneous diabetes in animals[J]. In:Ellenbeirg M eds, Diabetes Mellitus, Theory and Practice, New Hyde Park; Medical Examinations Publ, 1983,361
[8]Jenmings, PE. The relationship of oxidative stress to thrombotic tendency in type Ⅰ diebetic patients with diabetic retinopathy[J]. Diabetic Med. 1992,87:860~865, 百拇医药