选择性肝自主神经切断术对大鼠肝癌生长及侵袭转移的影响
作者:孟照华 何振平 王曙光 董家鸿 韩本立 别平
单位:孟照华(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038);何振平(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038);王曙光(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038);董家鸿(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038);韩本立(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038)
关键词:肝癌模型;选择性肝自主神经切断术
第三军医大学学报000815
提 要: 目的 探讨肝交感或迷走神经分别或两者联合膈神经切断术对Wistar大鼠肝癌生长及侵袭转移的影响。方法 应用Wistar大鼠肝癌模型,在外科显微镜下选择性切断支配靶肝叶的肝交感或肝迷走神经及膈神经分支,在肝自主神经联合切断术(HANCA)同时切除肿瘤并分别采用肝动脉化疗栓塞(HAE)、门静脉化疗栓塞(PVE)及肝管化疗栓塞(HBDE)法。观察肝肿瘤大体形态、肿瘤生长率、肿瘤坏死面积、动物生存期及肿瘤复发转移、肝癌细胞凋亡及S-100阳性蛋白表达。结果 支配靶肝叶的肝自主神经联合切断术及同时切除肝肿瘤并分别与HAE、PVE及HBDE的作用效果显著高于单一的肝交感或迷走神经切断术的效果。结论 肝自主神经联合切断术+肿瘤切除或分别与HAE、PVE及HBDE是有效控制肝癌生长及侵袭转移的较理想手段。
, 百拇医药
中图法分类号: R651;R735.7 文献标识码: A
文章编号:1000-5404(2000)08-0760-06
Selective hepatic autonomic neurotomy on growth, invasion and metastasis of hepatocellular carcinoma in Wistar rats
MENG Zhao-hua, HE Zhen-ping, WANG Shu-guang, DONG Jia-hong, HAN Ben-li, BIE Ping
(Department of Hepatobiliary Surgery, Southwest Hospital, Third Military Medical University, Chongqing 400038, China)
, 百拇医药
Abstract: Objective To explore the effects of the amputation of hepatic sympathetic and vagus nerve respectively and the combination of the two and phrenic nerve,i.e. hepatic autonomic nerve combination amputation. (HANCA) on the growth, invasion and metastasis of hepatocellular carcinoma (HCC) in Wistar rats. Methods Selective amputations of hepatic sympathetic, vagus nerve and phrenic nerve which controlling target liver lobe was performed under surgical microscope in Wistar rat model of HCC and tumor resection, HAE, PVE or HBDE was carried out respectively at the same time. Gross morphology, growth rate, necrosis area of the tumor and survival time of the animals were observed. The relapse, metastasis of HCC and apoptosis and S-100 positive expression of HCC cells were also studied. Results The combination amputation of the three nerves plus tumor resection, HAE, PVE or HBDE was more significant than the amputations of hepatic sympathetic and vagus nerve respectively. Conclusion The combination amputation of the three nerves plus tumor resection and HAE, PVE or HBDE exerts very significant effect on and might be an ideal approach for controlling the growth, invasion and metastasis of HCC.
, http://www.100md.com
Key words: hepatocellular carcinoma model; selective hepatic autonomic neurotomy; efficiency
自主神经又称腹腔内脏神经或植物神经,它包括腹腔交感与副交感神经(迷走神经)[1],肝脏与其他脏器同样接受以上两种神经的双重支配,文献[2,3]报道,腹腔交感神经节(丛)切除可显著控制上腹部癌性疼痛,而迷走神经切断后则能有效的抑制或延迟二乙基亚硝胺类致癌物导致肝癌的发生和发展[4]。有鉴于此,肝自主神经与肝肿瘤的生长及侵袭转移的关系有待探讨。
1 实验动物的肝癌模型建立
1.1 实验动物
选用健康雄性Wistar大鼠157只,由第三军医大学实验动物中心提供,体重385~410g,接种肝癌细胞前每只动物须间隔5d经60Co照射4.5Gy2次,并在接种肝癌细胞前1周肌肉注射地塞米松0.6mg/次,1次/d,连续7d。
, 百拇医药
1.2 CBRH-7919Wistar大鼠肝癌细胞株来源与培养
CBRH-7919Wistar大鼠肝癌细胞株由上海中科院细胞生物研究所提供,此种细胞株为甲胎蛋白(AFP)阳性的传代细胞。快速复苏后用以15%小牛血清RPMI-1640培养液传代培养。
1.3 CBRH-7919Wistar大鼠肝癌细胞株接种方法
选用传代培养的第13代肝癌细胞株,用微量注射器将肝癌细胞悬液0.5ml(107癌细胞),注入左肝叶被膜下,于接种14d随机取13只动物检测成瘤情况,结果13只动物成瘤11只,成瘤率为84.6%,肝癌灶均位于左肝叶(以下统称为靶肝叶),肿瘤纵轴直径0.47~0.58cm,轻度隆起,色泽灰白,瘤表面可见微血管,取成瘤标本经病理证实为肝细胞癌。
2 实验动物分组与实验方法
, 百拇医药
2.1 动物分组
应用建立成功的Wistar大鼠肝癌模型144只,于动物无明显腹水或转移时,随机分为8组,D:对照组(Control,n=18);G1:左肝交感神经切断术组(LS,n=18);G2:左肝迷走神经切断术组(LV,n=18);G3:左肝交感神经+左肝迷走神经及膈神经左支联合切断术组(LHNCA,n=18);H1:左肝自主神经联合切断术+肝动脉化疗栓塞组(LHNCA+HAE,n=18);H2:左肝自主神经联合切断术+门静脉化疗栓塞组(LHNCA+PVE,n=18);H3:左肝自主神经联合切断术+肝管化疗栓塞组(LHNCA+HBDE,n=18);J:左肝自主神经联合切断术+靶肝叶肿瘤切除组(LHNCA+HBDE,n=18)。
2.2 实验方法
2.2.1 手术与麻醉
术前动物禁食8h,每100g体重用1%戊巴比妥0.3ml,经腹腔注射麻醉,上腹正中切口入腹,显露肝脏及肝门,在外科显微镜下解剖出支配肝脏的迷走神经及交感神经见图1,然后进一步游离显露出支配靶肝叶的迷走及交感神经分支以及膈神经,予以切断。继之在同样条件下游离出支配靶肝叶的肝动脉、门静脉及肝胆管支,用3-0丝线结扎肝动脉、门静脉及肝胆管,用4号头皮针在结扎供肝血管及肝胆管近肝侧端,注入栓塞剂或其它药物后关腹,对照组不作任何处理。
, http://www.100md.com
图1 肝交感神经、迷走神经手术解剖
Fig 1 Operative anatorny of hepatic sympathetic and vagus nerve
2.2.2 栓塞剂制备与用量 40%碘油(上海淮海制药厂产品)10 ml+氟脲嘧啶20 ml(上海旭东海普药业有限公司生产)混合成乳化液。肝动脉、门静脉或肝胆管内分别注射1.2 ml。2.2.3 抗癌药物的选择方法与用量 根据CBRH-7919大鼠肝癌细胞及肝癌活体组织、制成肿瘤细胞悬液分别进行快速化疗药物敏感试验(MTT),从中择优使用较为敏感的抗癌药物。阿霉素(ADM)每次每只0.5 mg(意大利FARMITACTP CRRLOERBALtd生产)与榄香烯乳每次每只1 mg(中国大连金港制药有限公司生产)联合用药。
2.3 观察指标
2.3.1各组动物手术前后肝肿瘤大体形态 术前检测肿瘤最大径(a)和最小径(b)、按公式计算肿瘤体积:V=ab2/2,术后2周各组均取6只动物,复测肿瘤大小并计算肿瘤生长率,取出肿瘤行病理检测并观察下列指标:
, http://www.100md.com
肿瘤生长率:肿瘤生长率(%)=(治疗后体积-治疗前体积)/治疗后体积×100%。
肿瘤坏死面积:取最大直径下肿瘤切片,在光镜及电镜下观察肿瘤坏死范围,根据肿瘤坏死范围分为轻度(<40%),中度(40%~70%),重度(>70%)。
生存期及肿瘤复发转移,各组均取6只动物在相同条件下观察生存时间及肝癌在肝内外的复发转移情况。
每组余下6只动物活杀取活体肿瘤组织作以下检测。
2.3.2 手术前后动物肝癌细胞凋亡的检测 应用POD(原位细胞凋亡检测试剂盒,辣根过氧化酶 USA Boehringer Mambeim),取术前及术后2周各组6只动物肝癌标本按试剂盒说明进行检测。凋亡的细胞核呈黄色,光镜下随机观察每个标本切片5~8个具有代表性的高倍视野(×400),计数500个肿瘤细胞中的凋亡细胞数。
, http://www.100md.com
2.3.3 动物肝癌手术前后医学计算机图像分析 采用CAMH-CMASO7真彩色医学图像分析系统(北京空军总院生物工程医学研究所),手术前随机取6只动物肝癌在术中外科显微镜固定下拍摄的左肝叶彩色片及肝肿瘤组织经HE染色后的切片,手术后第14 d各组均取6只动物在上述术同样条件下拍摄的靶肝叶彩色片及术后肝肿瘤组织经HE染色后的切片,上述样品在图像摄像头固定高度25 cm下摄像并借此图像分析,目的了解手术前后各组动物肝癌大小变化,靶肝叶目标总面积内肝癌细胞总数量的增减变化。
2.3.4 各组肝癌组织S-100阳性蛋白表达检测 取建立成功的Wistar大鼠肝癌模型处死的11只动物肝癌组织标本及各组术后各6只动物肝癌标本,应用Elivision二步法免疫组化检测各组肝癌组织内S-100阳性表达,S-100 Protein(兔抗)多克隆抗体。S-100工作滴度液为1∶130 μl,此种抗体为即用型,由USA-MAXIM公司提供。具体操作步骤按试剂盒说明书进行,结果判断:S-100胞浆出现棕黄色颗粒为阳性细胞,否则为阴性。计算各组(随机选择5~8个高倍视野×400)500个细胞中S-100阳性细胞数,以确定S-100阳性表达标记指数(Labeling index, LI),LI= S-100阳性细胞数/计数细胞总数×100%。
, http://www.100md.com
2.4 统计学处理
实验结果以 ±s表示,应用四医大SPLM软件包单因素方差分析处理各组动物手术前后肝肿瘤大小变化及肝肿瘤细胞数目的变化,用t检验处理各组动物手术前后平均肿瘤生长率结果,用χ2检验或方差分析处理肝肿瘤细胞凋亡及S-100阳性细胞表达率。
±s表示,应用四医大SPLM软件包单因素方差分析处理各组动物手术前后肝肿瘤大小变化及肝肿瘤细胞数目的变化,用t检验处理各组动物手术前后平均肿瘤生长率结果,用χ2检验或方差分析处理肝肿瘤细胞凋亡及S-100阳性细胞表达率。
3 结果
3.1 各组动物手术后靶肝叶及肿瘤大体形态变化情况
术后2周:D组6只动物靶肝叶癌灶明显增大,向四周浸润性生长(并与大网膜、胃肠及胸腹壁粘连,侧枝循环丰富),腹水明显。
G1及G2组各6只动物靶肝叶无明显增大或萎缩样改变,肝质地稍硬,色泽无明显变化,癌灶无显著增大,并未见肝内外转移灶及腹水发生。
, 百拇医药
G3组6只动物靶肝叶轻度萎缩,肝色泽呈轻中度瘀血样变,质地变脆,癌灶大部分组织呈坏死样变,但未见肝内外转移灶及腹水发生。
H1、H2、H3 3组动物靶肝叶均呈中重度萎缩,色泽变浅,质地脆,癌灶呈坏死样变,但无腹水发生,靶肝叶与大网膜或胃肠及胸腹壁粘连严重。亦未见肝内外转移灶及腹水发生。
J组6只动物靶肝叶已切除,残肝断面与周围脏器粘连,分离后见肝质地脆,肝色泽暗淡,但未见肝内外转移灶及腹水发生。
3.2 各组动物手术前后肝肿瘤变化
3.2.1肝肿瘤大小变化 各组动物术前肝肿瘤大小无显著性差异。D组动物术后2周肝肿瘤显著增大,与术前比较差异显著(P<0.01);G1、G2、G3、H1、H2、H3 6组动物术后2周肝肿瘤大小变化与术前及D组术后比较差异均显著(P<0.01);术后2周G1与G2组间比较差异无显著性;术后2周G1和G2两组动物肝肿瘤显著大于G3、H1、H2、H3 4组(P<0.01),见图2。
, http://www.100md.com
图2 术前术后肝肿瘤大小变化
Fig 2 Changes of tumor size before and after operation
3.2.2 肝肿瘤平均生长率 各组动物术后平均生长率明显不同,见图3。
图3 肿瘤平均生长率
Fig 3 Average growth rate of tumors
G1、G2、G3、H1、H2、H3 6组与D组比较差异非常显著(P<0.01);G1、G2两组间比较差异无显著性;G3、H1、H2、H3 4组与G1、G2两组比较差异非常显著(P<0.01);H1、H2、H3 3组肿瘤呈负生长,G3组与H1、H2、H3 3组比较差异非常显著(P<0.01)。
, 百拇医药
3.2.3 肝肿瘤坏死范围 术后各组肝肿瘤坏死范围显著不同:D组术后均未见肿瘤坏死,光镜下见肝肿瘤组织增生活跃,肝小叶结构破坏。G1、G2两组术后肝肿瘤坏死范围<40%,光镜下见肿瘤灶呈散在局限性坏死,部分视野癌细胞生长活跃;G3组5/6只动物术后肝肿瘤坏死范围达70%,其中1只达80%,光镜下见癌细胞呈大片状坏死,其周围仅见少数癌细胞残存及炎性细胞浸润,外周细胞索排列整齐,肝小叶结构存在,残存肿瘤细胞多在肿瘤周边或一侧,见图4,电镜下易见残留肝癌细胞。
图4 HANCA 2周残存肿瘤细胞多在肿瘤一侧 (HE×200)
Fig 4 Residual tumor cells mostly located at one side of the
tumor 2 weeks after HANCA (HE×200)
, 百拇医药
H1、H2、H3 3组术后肝肿瘤坏死范围均可达96%~100%,光镜下均未见残留癌细胞、电镜下肝癌细胞出血坏死,炎性细胞浸润,血管内红细胞旁可见脂肪空泡样变,电镜下可见癌细胞核固缩,胞壁退形性变,空泡状,并见髓样小体,肿瘤坏死灶周围纤维包裹。
3.3 各组动物手术后生存期情况
各组动物手术处理方法不同,生存期差异显著,动物于术后90d全部处死时,G3、H1、H2、H3、J组动物多数仍存活,见图5。实验结果表明:D组动物生存期较短,G1、G2两组术后动物生存期与D组比较差异显著(P<0.05);G3、H1、H2、H3、J5组术后动物生存期与D组比较差异非常显著(P<0.01);G3、H1、H2、H3、J5组术后动物生存期亦显著高于G1、G2两组(P<0.01)。
图5 各组动物术后第14天生存时间
, 百拇医药
Fig5 Survival time 14dafter operation
3.4 各组动物手术后肝癌复发转移情况
D组6只动物解剖发现均出现侵袭邻近器官,其中4只发生其它肝叶转移转灶,肿瘤灶直径0.33~0.42cm,3/4只发生右肺上叶及右肺下叶癌灶,肿瘤直径0.35~0.40cm,病理检查证实为肺转移癌。G1、G2两组术后的动物肝癌灶较术前无显著增大,癌灶未见侵袭其它肝叶,亦未见远处器官转移灶。G3、H1、H2、H3、J5组术后的动物均未见肝内外器官转移灶。
3.5 各组动物手术前后肝癌细胞发生凋亡情况
D组肿瘤细胞凋亡<10%;G1、G2两组术后肝癌细胞凋亡>20%~40%,见图6;G3肝癌细胞凋亡40%~70%;H1、H2、H3、J4组肝癌细胞凋亡达95%~100%。结果说明G3、H1、H2、H3、J5组术后通过显著控制肝癌细胞增殖,而抑制肝肿瘤生长。
, http://www.100md.com
图6 左为大鼠交感神经切断2周肝癌细胞发生的凋亡;右为大鼠迷走神经切断2周肝癌细胞发生的凋亡 (×200)
Fig 6 Left:Apoptosis of hepatic cancerous cell 2 weeks after hepatic sympathetic neurotomy. Right:Apoptosis of hepatic cancerous cell 2 weeks after hepatic vagus neurotomy (×200)
3.6 各组动物手术前后医学计算机图像分析情况
3.6.1靶肝肿瘤大小的变化 手术处理方法不同,肝癌即目标总面积、直径或周长变化差异亦有显著性,见图7、8。
D组术后靶肝癌即目标总面积、直径或周长均显著大于术前(P<0.01);G1、G2两组术后靶肝癌即目标总面积、直径或周长与术前比较无显著性差异,与术后D组比较差异非常显著(P<0.01);G1、G2两组间比较差异不显著;G3、H1、H2、H3 4组术后靶肝癌即目标总面积、直径或周长与术前比较及与D、G1、G2 3组比较均差异显著(P<0.01);G3组与H1、H2、H3 3组间比较差异亦显著(P<0.01)。
, 百拇医药
图7 术前及术后第14天靶肝肿瘤大小变化的图像分析情况
Fig 7 Image analysis of the tumor sizes before and
14 d after operation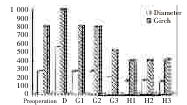
图8 术前及术后第14天靶肝肿瘤周长和直径变化的图像分析情况
Fig 8 Image analysis of the tumor diameters and circumference
before and 14 d after operation
3.6.2 左肝癌细胞数目的变化情况 不同的手术处理方法,靶肝叶癌细胞的总数目差异显著。D组术后肝癌细胞总数显著高于术前(P<0.01);G1、G2、G3、H1、H2、H3 6组术后肝癌细胞总数目显著低于术前(P<0.01);G1、G2、G3、H1、H2、H3 6组术后肝癌细胞总数目显著低于D组(P<0.01);G1、G2、G3 3两组术后肝癌细胞总数目显著高于H1、H2、H3 3组(P<0.01);G1、G2两组术后肝癌细胞总数目显著高于G3组(P<0.01);G1、G2两组间比较及H1、H2、H3 3组间比较差异不显著。见图9。
, 百拇医药
3.7 各组动物靶肝叶组织S-100蛋白基因表达情况
S-100阳性蛋白表达定位于胞浆,见图10,G1、G2、G3、H1、H2、H36组S-100蛋白阳性表达水平显著低于D组及J组(P<0.01);G1、G2两组比较差异无显著性;G1、G2两组与G3、H1、H2、H34组比较阳性蛋白表达显著增高(P<0.01);G3组S-100阳性蛋白表达水平显著下降,但与H1、H2、H33组比较阳性蛋白表达显著增高(P<0.01);H1、H2、H33组S-100阳性表达水平,其中H1、H32组均显著低于H2组(P<0.05),H1与H3组比较S-100阳性蛋白表达水平显著增高(P<0.05),见图11。
图9 各组动物术前及术后第14天靶肝癌细胞数目
变化情况
, 百拇医药
Fig 9 Changes of hepotic cancer cell count before and 14 d
after operation
图10 大鼠肝癌组织S-100阳性表达 (Elivision×200)
Fig 10 Positive expression of S-100 in hepatic carcinoma
tissues (Elivision×200)
图11 不同术式对S-100阳性蛋白表达的影响
, http://www.100md.com
Fig 11 Effects of different operations on the expression of S-100
4 讨论
早在1807年法国学者Reil即把支配内脏神经称之为“植物神经”。1889年英国学者Langley提出“自主神经”一名,用以强调内脏器官的运动具有自主性,在很大程度上不受意识直接控制,随后Langley在生理研究基础上,又把自主神经划分为交感与副交感(迷走神经)神经两部分,由此认为,自主神经由交感和迷走神经两部分组成,而支配与调节肝脏的神经亦是内脏自主神经的重要组成部分。
肝脏与神经的联系是通过两侧胸7~9交感神经发出分支及左右两侧迷走神经发出的分支而实现的,此外还有右侧膈神经的分支。①支配肝的交感神经起自脊髓发出的胸7~9神经节,下行至腹腔神经节(丛)[1,5,6]再由腹腔神经节(丛)向肝等器官发出分支(因此认为肝丛或腹腔神经丛是肝支,腹腔支的中继站)经肝神经丛在第1肝门入肝。本实验所进行左肝迷走神经切断术的解剖部位即是在腹腔神经节发出的纤维即支配左肝叶的交感神经支处切断。②支配肝脏的迷走神经由延髓发出[8],分为:左迷走神经(多为一条、也可呈多条或网状,呈白色线状)直接进入肝脏;右迷走神经则先进入腹腔神经节(丛),由腹腔神经节发出支配肝的主要分支,构成肝前丛和肝后丛,肝前后两丛神经包括交感神经和迷走神经纤维,肝前丛发出的纤维沿动脉分布,经第1肝门入肝,肝后丛发出的分支沿门静脉入肝。有人认为肝动脉和门静脉是由交感神经支配,而胆管系统则同时受交感和副交感神经的调节,并认为右膈神经的感觉纤维也分布肝冠状、镰状韧带及附近的肝包膜内,尚有部分纤维与肝前后丛结合,随肝丛纤维分布肝内外胆道系统[6]。因此,在患有胆囊结石或肝结石等引起的肝区疼痛和胆绞痛,同时可出现右肩背部疼痛,则是因为膈神经引起的放散性疼痛。本研究经大量动物手术在外科显微镜下发现肝交感神经及迷走神经走行与上述研究结果相一致。
, 百拇医药
目前有关肝自主神经在肝内的分布报道较少,过去认为自主神经几乎完全是支配肝脏的血管,但后来随着组织化学及电镜技术的应用,发现肝实质内也存在着自主神经末梢,进一步研究发现肝细胞或小血管内皮层亦有较少的神经纤维。目前认为S-100是神经组织内一种蛋白基因,近年来国内外学者用免疫组化方法对S-100蛋白基因表达进行了较多的研究,发现S-100蛋白基因不仅在神经组织内高表达,而且在癌组织或转移的淋巴结内亦呈高表达[7~10],并发现正常肝组织内阳性表达显著低于癌组织。本实验应用Elivision法进行免疫组化检测发现肝交感神经及迷走神经切断组较对照组S-100蛋白阳性表达显著降低,而肝交感+迷走神经及膈神经联合切断组S-100蛋白阳性表达基本消失,实验结果提示S-100蛋白与肝自主神经有着密切的联系。
最近Katsuaki等在切除大鼠肝部分组织时发现,切断支配肝脏的迷走神经支可使肝脏DNA合成发生障碍,肝的再生作用延缓。肝自主神经与肝肿瘤的关系研究起步较晚,目前国内外尚无文献报道。但已有研究表明交感神经的活动主要其抑制免疫效应的作用[11],有人用化学性切断(6-羟多巴胺,6-OHDA)支配颌下淋巴结的颈交感神经,结果发现该侧颈淋巴细胞抗体分泌能力增强。Khansari(1990)研究发现E、NE能抑制淋巴对PHA、PWM等诱导的增殖反应。但在体外将α、β1、β2肾上腺素受体激动剂加入含绵羊红细胞(SRBC)及小鼠脾细胞悬液中,却能增强脾细胞的免疫应答,并导致溶血素产生增多。Stayanova等[12]研究认为自主神经系统在肝脏病理生理过程中有着重要的调节作用,作者曾对胃恶性肿瘤在未发生肝转移前应用光镜、电镜或免疫组化检测了肝组织内肽神经纤维的分布或含量,结果发现生长抑素、P物质、降钙素基因相关肽能神经广泛分布于肝内门静脉周围,窦间隙充满了淋巴细胞。Duek等[13]报道高选迷切后能影响胃癌发生肝转移。Dubovaia等[4]报道迷走神经切断术能有效的抑制或延迟二乙基亚硝类致癌物导致肝癌的发生,其机制是迷走神经切断后通过降低肝内6-磷酸葡萄糖和三磷酸腺苷及γ-谷丙转肽酶而发挥其抑制作用。Fukuda等[14]在对胆管癌的病例研究发现,16例其中10例存在着神经侵犯,这正是说明肝自主神经切断术的意义所在,对这些病例倘若施行肝自主神经切断,将可能提高治愈率,降低复发或转移的机率。本实验应用Wistar大鼠肝癌模型,选择性分别或联合切断支配靶肝叶的肝交感、迷走神经及膈神经左支,结果表明:肝交感神经或迷走神经分别切断术均会影响肝肿瘤的生长,肝肿瘤的坏死范围可达40%,而肝交感和迷走神经及膈神经左支联合切断术,可使肝肿瘤坏死达70%,肝癌细胞增殖率显著下降,肝肿瘤细胞凋亡增加,动物生存期较对照组显著延长,进一步发现肝内神经系统S-100蛋白阳性表达显著降低。本实验在对支配靶肝叶的肝自主神经联合切断术的同时切除肿瘤并分别与HAE、PVE或HBDE,结果发现肝肿瘤坏死范围可达96%~100%。然而无论是肝交感或迷走神经分别切断或者两种神经与膈神经左支3种神经联合切断术+肿瘤切除以及3种神经联合切断术并与HAE、PVE或HBDE分别栓塞均会有效的控制肝癌生长及复发转移。
, http://www.100md.com
关于肝自主神经与肝癌生长及侵袭转移的影响机制可能是因为[11,15]自主神经系统对免疫功能具有着重要的调节功能或者是自主神经通过末梢释放的分子活性递质在发挥其重要作用,提示肝自主神经切断有效的控制肝癌生长及侵袭转移的机制可能是通过提高或降低某些分子神经递质的生物学作用的结果。肝自主神经或称植物神经切断术治疗肝癌的研究虽已取得一定疗效,但对其治疗的效果及其作用的分子机制尚有待进一步深入探讨。
作者简介:孟照华(1960-),男,山东省济南市人,博士,主治医师,主要从事肝癌复发转移方面的研究,发表论文48篇。电话: (023)65300054
作者单位:别平(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038)
参考文献:
[1] 张镜如 主编.生理学[M].第4版,北京:人民卫生出版社,1998.281-349.
, http://www.100md.com
[2] 郑汉光,汪国香,陶 凡. 腹腔神经节(丛)阻滞治疗癌性腹痛的临床和实验动物组织学的初步观察[J].河北医学,1999,5(1):12-14.
[3] Hina M O. A new approach to neurolytic block of the celiac plexus. Transintervertabral disc technique[J]. Anesthesiology, 1991,75(3):718-720.
[4] Dubovaia T K, Kobliakov V A, Merkulova I B, et al. Early stages of hepatic carcinogenesis after vagotomy[J]. Arkn Anat Gistol Embriol,1989,97(7):65-70.
[5] 三轮晃一,宫崎逸夫.胃癌手术における神经温存のコツ[J].手术,1994,48(8):1 131-1 135.
, http://www.100md.com
[6] 张培林 主编.神经解剖学[M].北京:人民卫生出版社,1998.143-163.
[7] 石素胜, 刘复生, 李泰生,等. 原发性肝肉瘤6例报告[J].中华肿瘤杂志.1994.16(3):228-230.
[8] 张晓智, 安怀伦, 张学斌. 食管癌及其区域淋巴结中S-100+树突状细胞的免疫组化研究[J]. 西安医科大学学报,1998,19(2):215-218.
[9] Atojl Y, Nakaoka T, Yamamoto Y, et al. Antigen stimulation alters the expression of S-100 protein in the giant macrophages and follicular dendritic cells of the guinea pig lymph nodes[J].Acta Anat (Basel) 1994,149(5):203-208.
, 百拇医药
[10] Oka K, Nakano T, Arai T. Adenocarcinoma of the cervix treated with radiation alone: prognsotic significance of S-100 protiein and vimentin immunostaming[J]. Obstet Gynecol, 1992,79(3):347-350.
[11] 许绍芬 主编.神经生物学[M].第2版,上海:上海医科大学出版社.1999.437-445.
[12] Stoyanova II, Gulubova M V. Peptidergic nerve fibres in the human liver[J]. Acta Histochem, 1998,100(3):245-256.
[13] Duek S D, Barzilai A. Treatment of Zollinger-Ellison syndrome. Harefuah[J].1991,120(7):384-385.
[14] Fukuda T, Iwanaga S, Sakamoto I et al. CT of neural plexus invasion in common bile duct carcinoma[J]. J Comput Assist Tomogr, 1998,68(3):351-354.
[15] 陈宜张 主编. 分子神经生物学[M]. 北京:人民军医出版社,1995.10-11.
收稿日期:2000-06-10;修回日期:2000-07-07, http://www.100md.com
单位:孟照华(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038);何振平(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038);王曙光(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038);董家鸿(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038);韩本立(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038)
关键词:肝癌模型;选择性肝自主神经切断术
第三军医大学学报000815
提 要: 目的 探讨肝交感或迷走神经分别或两者联合膈神经切断术对Wistar大鼠肝癌生长及侵袭转移的影响。方法 应用Wistar大鼠肝癌模型,在外科显微镜下选择性切断支配靶肝叶的肝交感或肝迷走神经及膈神经分支,在肝自主神经联合切断术(HANCA)同时切除肿瘤并分别采用肝动脉化疗栓塞(HAE)、门静脉化疗栓塞(PVE)及肝管化疗栓塞(HBDE)法。观察肝肿瘤大体形态、肿瘤生长率、肿瘤坏死面积、动物生存期及肿瘤复发转移、肝癌细胞凋亡及S-100阳性蛋白表达。结果 支配靶肝叶的肝自主神经联合切断术及同时切除肝肿瘤并分别与HAE、PVE及HBDE的作用效果显著高于单一的肝交感或迷走神经切断术的效果。结论 肝自主神经联合切断术+肿瘤切除或分别与HAE、PVE及HBDE是有效控制肝癌生长及侵袭转移的较理想手段。
, 百拇医药
中图法分类号: R651;R735.7 文献标识码: A
文章编号:1000-5404(2000)08-0760-06
Selective hepatic autonomic neurotomy on growth, invasion and metastasis of hepatocellular carcinoma in Wistar rats
MENG Zhao-hua, HE Zhen-ping, WANG Shu-guang, DONG Jia-hong, HAN Ben-li, BIE Ping
(Department of Hepatobiliary Surgery, Southwest Hospital, Third Military Medical University, Chongqing 400038, China)
, 百拇医药
Abstract: Objective To explore the effects of the amputation of hepatic sympathetic and vagus nerve respectively and the combination of the two and phrenic nerve,i.e. hepatic autonomic nerve combination amputation. (HANCA) on the growth, invasion and metastasis of hepatocellular carcinoma (HCC) in Wistar rats. Methods Selective amputations of hepatic sympathetic, vagus nerve and phrenic nerve which controlling target liver lobe was performed under surgical microscope in Wistar rat model of HCC and tumor resection, HAE, PVE or HBDE was carried out respectively at the same time. Gross morphology, growth rate, necrosis area of the tumor and survival time of the animals were observed. The relapse, metastasis of HCC and apoptosis and S-100 positive expression of HCC cells were also studied. Results The combination amputation of the three nerves plus tumor resection, HAE, PVE or HBDE was more significant than the amputations of hepatic sympathetic and vagus nerve respectively. Conclusion The combination amputation of the three nerves plus tumor resection and HAE, PVE or HBDE exerts very significant effect on and might be an ideal approach for controlling the growth, invasion and metastasis of HCC.
, http://www.100md.com
Key words: hepatocellular carcinoma model; selective hepatic autonomic neurotomy; efficiency
自主神经又称腹腔内脏神经或植物神经,它包括腹腔交感与副交感神经(迷走神经)[1],肝脏与其他脏器同样接受以上两种神经的双重支配,文献[2,3]报道,腹腔交感神经节(丛)切除可显著控制上腹部癌性疼痛,而迷走神经切断后则能有效的抑制或延迟二乙基亚硝胺类致癌物导致肝癌的发生和发展[4]。有鉴于此,肝自主神经与肝肿瘤的生长及侵袭转移的关系有待探讨。
1 实验动物的肝癌模型建立
1.1 实验动物
选用健康雄性Wistar大鼠157只,由第三军医大学实验动物中心提供,体重385~410g,接种肝癌细胞前每只动物须间隔5d经60Co照射4.5Gy2次,并在接种肝癌细胞前1周肌肉注射地塞米松0.6mg/次,1次/d,连续7d。
, 百拇医药
1.2 CBRH-7919Wistar大鼠肝癌细胞株来源与培养
CBRH-7919Wistar大鼠肝癌细胞株由上海中科院细胞生物研究所提供,此种细胞株为甲胎蛋白(AFP)阳性的传代细胞。快速复苏后用以15%小牛血清RPMI-1640培养液传代培养。
1.3 CBRH-7919Wistar大鼠肝癌细胞株接种方法
选用传代培养的第13代肝癌细胞株,用微量注射器将肝癌细胞悬液0.5ml(107癌细胞),注入左肝叶被膜下,于接种14d随机取13只动物检测成瘤情况,结果13只动物成瘤11只,成瘤率为84.6%,肝癌灶均位于左肝叶(以下统称为靶肝叶),肿瘤纵轴直径0.47~0.58cm,轻度隆起,色泽灰白,瘤表面可见微血管,取成瘤标本经病理证实为肝细胞癌。
2 实验动物分组与实验方法
, 百拇医药
2.1 动物分组
应用建立成功的Wistar大鼠肝癌模型144只,于动物无明显腹水或转移时,随机分为8组,D:对照组(Control,n=18);G1:左肝交感神经切断术组(LS,n=18);G2:左肝迷走神经切断术组(LV,n=18);G3:左肝交感神经+左肝迷走神经及膈神经左支联合切断术组(LHNCA,n=18);H1:左肝自主神经联合切断术+肝动脉化疗栓塞组(LHNCA+HAE,n=18);H2:左肝自主神经联合切断术+门静脉化疗栓塞组(LHNCA+PVE,n=18);H3:左肝自主神经联合切断术+肝管化疗栓塞组(LHNCA+HBDE,n=18);J:左肝自主神经联合切断术+靶肝叶肿瘤切除组(LHNCA+HBDE,n=18)。
2.2 实验方法
2.2.1 手术与麻醉
术前动物禁食8h,每100g体重用1%戊巴比妥0.3ml,经腹腔注射麻醉,上腹正中切口入腹,显露肝脏及肝门,在外科显微镜下解剖出支配肝脏的迷走神经及交感神经见图1,然后进一步游离显露出支配靶肝叶的迷走及交感神经分支以及膈神经,予以切断。继之在同样条件下游离出支配靶肝叶的肝动脉、门静脉及肝胆管支,用3-0丝线结扎肝动脉、门静脉及肝胆管,用4号头皮针在结扎供肝血管及肝胆管近肝侧端,注入栓塞剂或其它药物后关腹,对照组不作任何处理。

, http://www.100md.com
图1 肝交感神经、迷走神经手术解剖
Fig 1 Operative anatorny of hepatic sympathetic and vagus nerve
2.2.2 栓塞剂制备与用量 40%碘油(上海淮海制药厂产品)10 ml+氟脲嘧啶20 ml(上海旭东海普药业有限公司生产)混合成乳化液。肝动脉、门静脉或肝胆管内分别注射1.2 ml。2.2.3 抗癌药物的选择方法与用量 根据CBRH-7919大鼠肝癌细胞及肝癌活体组织、制成肿瘤细胞悬液分别进行快速化疗药物敏感试验(MTT),从中择优使用较为敏感的抗癌药物。阿霉素(ADM)每次每只0.5 mg(意大利FARMITACTP CRRLOERBALtd生产)与榄香烯乳每次每只1 mg(中国大连金港制药有限公司生产)联合用药。
2.3 观察指标
2.3.1各组动物手术前后肝肿瘤大体形态 术前检测肿瘤最大径(a)和最小径(b)、按公式计算肿瘤体积:V=ab2/2,术后2周各组均取6只动物,复测肿瘤大小并计算肿瘤生长率,取出肿瘤行病理检测并观察下列指标:
, http://www.100md.com
肿瘤生长率:肿瘤生长率(%)=(治疗后体积-治疗前体积)/治疗后体积×100%。
肿瘤坏死面积:取最大直径下肿瘤切片,在光镜及电镜下观察肿瘤坏死范围,根据肿瘤坏死范围分为轻度(<40%),中度(40%~70%),重度(>70%)。
生存期及肿瘤复发转移,各组均取6只动物在相同条件下观察生存时间及肝癌在肝内外的复发转移情况。
每组余下6只动物活杀取活体肿瘤组织作以下检测。
2.3.2 手术前后动物肝癌细胞凋亡的检测 应用POD(原位细胞凋亡检测试剂盒,辣根过氧化酶 USA Boehringer Mambeim),取术前及术后2周各组6只动物肝癌标本按试剂盒说明进行检测。凋亡的细胞核呈黄色,光镜下随机观察每个标本切片5~8个具有代表性的高倍视野(×400),计数500个肿瘤细胞中的凋亡细胞数。
, http://www.100md.com
2.3.3 动物肝癌手术前后医学计算机图像分析 采用CAMH-CMASO7真彩色医学图像分析系统(北京空军总院生物工程医学研究所),手术前随机取6只动物肝癌在术中外科显微镜固定下拍摄的左肝叶彩色片及肝肿瘤组织经HE染色后的切片,手术后第14 d各组均取6只动物在上述术同样条件下拍摄的靶肝叶彩色片及术后肝肿瘤组织经HE染色后的切片,上述样品在图像摄像头固定高度25 cm下摄像并借此图像分析,目的了解手术前后各组动物肝癌大小变化,靶肝叶目标总面积内肝癌细胞总数量的增减变化。
2.3.4 各组肝癌组织S-100阳性蛋白表达检测 取建立成功的Wistar大鼠肝癌模型处死的11只动物肝癌组织标本及各组术后各6只动物肝癌标本,应用Elivision二步法免疫组化检测各组肝癌组织内S-100阳性表达,S-100 Protein(兔抗)多克隆抗体。S-100工作滴度液为1∶130 μl,此种抗体为即用型,由USA-MAXIM公司提供。具体操作步骤按试剂盒说明书进行,结果判断:S-100胞浆出现棕黄色颗粒为阳性细胞,否则为阴性。计算各组(随机选择5~8个高倍视野×400)500个细胞中S-100阳性细胞数,以确定S-100阳性表达标记指数(Labeling index, LI),LI= S-100阳性细胞数/计数细胞总数×100%。
, http://www.100md.com
2.4 统计学处理
实验结果以
 ±s表示,应用四医大SPLM软件包单因素方差分析处理各组动物手术前后肝肿瘤大小变化及肝肿瘤细胞数目的变化,用t检验处理各组动物手术前后平均肿瘤生长率结果,用χ2检验或方差分析处理肝肿瘤细胞凋亡及S-100阳性细胞表达率。
±s表示,应用四医大SPLM软件包单因素方差分析处理各组动物手术前后肝肿瘤大小变化及肝肿瘤细胞数目的变化,用t检验处理各组动物手术前后平均肿瘤生长率结果,用χ2检验或方差分析处理肝肿瘤细胞凋亡及S-100阳性细胞表达率。3 结果
3.1 各组动物手术后靶肝叶及肿瘤大体形态变化情况
术后2周:D组6只动物靶肝叶癌灶明显增大,向四周浸润性生长(并与大网膜、胃肠及胸腹壁粘连,侧枝循环丰富),腹水明显。
G1及G2组各6只动物靶肝叶无明显增大或萎缩样改变,肝质地稍硬,色泽无明显变化,癌灶无显著增大,并未见肝内外转移灶及腹水发生。
, 百拇医药
G3组6只动物靶肝叶轻度萎缩,肝色泽呈轻中度瘀血样变,质地变脆,癌灶大部分组织呈坏死样变,但未见肝内外转移灶及腹水发生。
H1、H2、H3 3组动物靶肝叶均呈中重度萎缩,色泽变浅,质地脆,癌灶呈坏死样变,但无腹水发生,靶肝叶与大网膜或胃肠及胸腹壁粘连严重。亦未见肝内外转移灶及腹水发生。
J组6只动物靶肝叶已切除,残肝断面与周围脏器粘连,分离后见肝质地脆,肝色泽暗淡,但未见肝内外转移灶及腹水发生。
3.2 各组动物手术前后肝肿瘤变化
3.2.1肝肿瘤大小变化 各组动物术前肝肿瘤大小无显著性差异。D组动物术后2周肝肿瘤显著增大,与术前比较差异显著(P<0.01);G1、G2、G3、H1、H2、H3 6组动物术后2周肝肿瘤大小变化与术前及D组术后比较差异均显著(P<0.01);术后2周G1与G2组间比较差异无显著性;术后2周G1和G2两组动物肝肿瘤显著大于G3、H1、H2、H3 4组(P<0.01),见图2。

, http://www.100md.com
图2 术前术后肝肿瘤大小变化
Fig 2 Changes of tumor size before and after operation
3.2.2 肝肿瘤平均生长率 各组动物术后平均生长率明显不同,见图3。

图3 肿瘤平均生长率
Fig 3 Average growth rate of tumors
G1、G2、G3、H1、H2、H3 6组与D组比较差异非常显著(P<0.01);G1、G2两组间比较差异无显著性;G3、H1、H2、H3 4组与G1、G2两组比较差异非常显著(P<0.01);H1、H2、H3 3组肿瘤呈负生长,G3组与H1、H2、H3 3组比较差异非常显著(P<0.01)。
, 百拇医药
3.2.3 肝肿瘤坏死范围 术后各组肝肿瘤坏死范围显著不同:D组术后均未见肿瘤坏死,光镜下见肝肿瘤组织增生活跃,肝小叶结构破坏。G1、G2两组术后肝肿瘤坏死范围<40%,光镜下见肿瘤灶呈散在局限性坏死,部分视野癌细胞生长活跃;G3组5/6只动物术后肝肿瘤坏死范围达70%,其中1只达80%,光镜下见癌细胞呈大片状坏死,其周围仅见少数癌细胞残存及炎性细胞浸润,外周细胞索排列整齐,肝小叶结构存在,残存肿瘤细胞多在肿瘤周边或一侧,见图4,电镜下易见残留肝癌细胞。

图4 HANCA 2周残存肿瘤细胞多在肿瘤一侧 (HE×200)
Fig 4 Residual tumor cells mostly located at one side of the
tumor 2 weeks after HANCA (HE×200)
, 百拇医药
H1、H2、H3 3组术后肝肿瘤坏死范围均可达96%~100%,光镜下均未见残留癌细胞、电镜下肝癌细胞出血坏死,炎性细胞浸润,血管内红细胞旁可见脂肪空泡样变,电镜下可见癌细胞核固缩,胞壁退形性变,空泡状,并见髓样小体,肿瘤坏死灶周围纤维包裹。
3.3 各组动物手术后生存期情况
各组动物手术处理方法不同,生存期差异显著,动物于术后90d全部处死时,G3、H1、H2、H3、J组动物多数仍存活,见图5。实验结果表明:D组动物生存期较短,G1、G2两组术后动物生存期与D组比较差异显著(P<0.05);G3、H1、H2、H3、J5组术后动物生存期与D组比较差异非常显著(P<0.01);G3、H1、H2、H3、J5组术后动物生存期亦显著高于G1、G2两组(P<0.01)。

图5 各组动物术后第14天生存时间
, 百拇医药
Fig5 Survival time 14dafter operation
3.4 各组动物手术后肝癌复发转移情况
D组6只动物解剖发现均出现侵袭邻近器官,其中4只发生其它肝叶转移转灶,肿瘤灶直径0.33~0.42cm,3/4只发生右肺上叶及右肺下叶癌灶,肿瘤直径0.35~0.40cm,病理检查证实为肺转移癌。G1、G2两组术后的动物肝癌灶较术前无显著增大,癌灶未见侵袭其它肝叶,亦未见远处器官转移灶。G3、H1、H2、H3、J5组术后的动物均未见肝内外器官转移灶。
3.5 各组动物手术前后肝癌细胞发生凋亡情况
D组肿瘤细胞凋亡<10%;G1、G2两组术后肝癌细胞凋亡>20%~40%,见图6;G3肝癌细胞凋亡40%~70%;H1、H2、H3、J4组肝癌细胞凋亡达95%~100%。结果说明G3、H1、H2、H3、J5组术后通过显著控制肝癌细胞增殖,而抑制肝肿瘤生长。

, http://www.100md.com
图6 左为大鼠交感神经切断2周肝癌细胞发生的凋亡;右为大鼠迷走神经切断2周肝癌细胞发生的凋亡 (×200)
Fig 6 Left:Apoptosis of hepatic cancerous cell 2 weeks after hepatic sympathetic neurotomy. Right:Apoptosis of hepatic cancerous cell 2 weeks after hepatic vagus neurotomy (×200)
3.6 各组动物手术前后医学计算机图像分析情况
3.6.1靶肝肿瘤大小的变化 手术处理方法不同,肝癌即目标总面积、直径或周长变化差异亦有显著性,见图7、8。
D组术后靶肝癌即目标总面积、直径或周长均显著大于术前(P<0.01);G1、G2两组术后靶肝癌即目标总面积、直径或周长与术前比较无显著性差异,与术后D组比较差异非常显著(P<0.01);G1、G2两组间比较差异不显著;G3、H1、H2、H3 4组术后靶肝癌即目标总面积、直径或周长与术前比较及与D、G1、G2 3组比较均差异显著(P<0.01);G3组与H1、H2、H3 3组间比较差异亦显著(P<0.01)。

, 百拇医药
图7 术前及术后第14天靶肝肿瘤大小变化的图像分析情况
Fig 7 Image analysis of the tumor sizes before and
14 d after operation

图8 术前及术后第14天靶肝肿瘤周长和直径变化的图像分析情况
Fig 8 Image analysis of the tumor diameters and circumference
before and 14 d after operation
3.6.2 左肝癌细胞数目的变化情况 不同的手术处理方法,靶肝叶癌细胞的总数目差异显著。D组术后肝癌细胞总数显著高于术前(P<0.01);G1、G2、G3、H1、H2、H3 6组术后肝癌细胞总数目显著低于术前(P<0.01);G1、G2、G3、H1、H2、H3 6组术后肝癌细胞总数目显著低于D组(P<0.01);G1、G2、G3 3两组术后肝癌细胞总数目显著高于H1、H2、H3 3组(P<0.01);G1、G2两组术后肝癌细胞总数目显著高于G3组(P<0.01);G1、G2两组间比较及H1、H2、H3 3组间比较差异不显著。见图9。
, 百拇医药
3.7 各组动物靶肝叶组织S-100蛋白基因表达情况
S-100阳性蛋白表达定位于胞浆,见图10,G1、G2、G3、H1、H2、H36组S-100蛋白阳性表达水平显著低于D组及J组(P<0.01);G1、G2两组比较差异无显著性;G1、G2两组与G3、H1、H2、H34组比较阳性蛋白表达显著增高(P<0.01);G3组S-100阳性蛋白表达水平显著下降,但与H1、H2、H33组比较阳性蛋白表达显著增高(P<0.01);H1、H2、H33组S-100阳性表达水平,其中H1、H32组均显著低于H2组(P<0.05),H1与H3组比较S-100阳性蛋白表达水平显著增高(P<0.05),见图11。

图9 各组动物术前及术后第14天靶肝癌细胞数目
变化情况
, 百拇医药
Fig 9 Changes of hepotic cancer cell count before and 14 d
after operation

图10 大鼠肝癌组织S-100阳性表达 (Elivision×200)
Fig 10 Positive expression of S-100 in hepatic carcinoma
tissues (Elivision×200)

图11 不同术式对S-100阳性蛋白表达的影响
, http://www.100md.com
Fig 11 Effects of different operations on the expression of S-100
4 讨论
早在1807年法国学者Reil即把支配内脏神经称之为“植物神经”。1889年英国学者Langley提出“自主神经”一名,用以强调内脏器官的运动具有自主性,在很大程度上不受意识直接控制,随后Langley在生理研究基础上,又把自主神经划分为交感与副交感(迷走神经)神经两部分,由此认为,自主神经由交感和迷走神经两部分组成,而支配与调节肝脏的神经亦是内脏自主神经的重要组成部分。
肝脏与神经的联系是通过两侧胸7~9交感神经发出分支及左右两侧迷走神经发出的分支而实现的,此外还有右侧膈神经的分支。①支配肝的交感神经起自脊髓发出的胸7~9神经节,下行至腹腔神经节(丛)[1,5,6]再由腹腔神经节(丛)向肝等器官发出分支(因此认为肝丛或腹腔神经丛是肝支,腹腔支的中继站)经肝神经丛在第1肝门入肝。本实验所进行左肝迷走神经切断术的解剖部位即是在腹腔神经节发出的纤维即支配左肝叶的交感神经支处切断。②支配肝脏的迷走神经由延髓发出[8],分为:左迷走神经(多为一条、也可呈多条或网状,呈白色线状)直接进入肝脏;右迷走神经则先进入腹腔神经节(丛),由腹腔神经节发出支配肝的主要分支,构成肝前丛和肝后丛,肝前后两丛神经包括交感神经和迷走神经纤维,肝前丛发出的纤维沿动脉分布,经第1肝门入肝,肝后丛发出的分支沿门静脉入肝。有人认为肝动脉和门静脉是由交感神经支配,而胆管系统则同时受交感和副交感神经的调节,并认为右膈神经的感觉纤维也分布肝冠状、镰状韧带及附近的肝包膜内,尚有部分纤维与肝前后丛结合,随肝丛纤维分布肝内外胆道系统[6]。因此,在患有胆囊结石或肝结石等引起的肝区疼痛和胆绞痛,同时可出现右肩背部疼痛,则是因为膈神经引起的放散性疼痛。本研究经大量动物手术在外科显微镜下发现肝交感神经及迷走神经走行与上述研究结果相一致。
, 百拇医药
目前有关肝自主神经在肝内的分布报道较少,过去认为自主神经几乎完全是支配肝脏的血管,但后来随着组织化学及电镜技术的应用,发现肝实质内也存在着自主神经末梢,进一步研究发现肝细胞或小血管内皮层亦有较少的神经纤维。目前认为S-100是神经组织内一种蛋白基因,近年来国内外学者用免疫组化方法对S-100蛋白基因表达进行了较多的研究,发现S-100蛋白基因不仅在神经组织内高表达,而且在癌组织或转移的淋巴结内亦呈高表达[7~10],并发现正常肝组织内阳性表达显著低于癌组织。本实验应用Elivision法进行免疫组化检测发现肝交感神经及迷走神经切断组较对照组S-100蛋白阳性表达显著降低,而肝交感+迷走神经及膈神经联合切断组S-100蛋白阳性表达基本消失,实验结果提示S-100蛋白与肝自主神经有着密切的联系。
最近Katsuaki等在切除大鼠肝部分组织时发现,切断支配肝脏的迷走神经支可使肝脏DNA合成发生障碍,肝的再生作用延缓。肝自主神经与肝肿瘤的关系研究起步较晚,目前国内外尚无文献报道。但已有研究表明交感神经的活动主要其抑制免疫效应的作用[11],有人用化学性切断(6-羟多巴胺,6-OHDA)支配颌下淋巴结的颈交感神经,结果发现该侧颈淋巴细胞抗体分泌能力增强。Khansari(1990)研究发现E、NE能抑制淋巴对PHA、PWM等诱导的增殖反应。但在体外将α、β1、β2肾上腺素受体激动剂加入含绵羊红细胞(SRBC)及小鼠脾细胞悬液中,却能增强脾细胞的免疫应答,并导致溶血素产生增多。Stayanova等[12]研究认为自主神经系统在肝脏病理生理过程中有着重要的调节作用,作者曾对胃恶性肿瘤在未发生肝转移前应用光镜、电镜或免疫组化检测了肝组织内肽神经纤维的分布或含量,结果发现生长抑素、P物质、降钙素基因相关肽能神经广泛分布于肝内门静脉周围,窦间隙充满了淋巴细胞。Duek等[13]报道高选迷切后能影响胃癌发生肝转移。Dubovaia等[4]报道迷走神经切断术能有效的抑制或延迟二乙基亚硝类致癌物导致肝癌的发生,其机制是迷走神经切断后通过降低肝内6-磷酸葡萄糖和三磷酸腺苷及γ-谷丙转肽酶而发挥其抑制作用。Fukuda等[14]在对胆管癌的病例研究发现,16例其中10例存在着神经侵犯,这正是说明肝自主神经切断术的意义所在,对这些病例倘若施行肝自主神经切断,将可能提高治愈率,降低复发或转移的机率。本实验应用Wistar大鼠肝癌模型,选择性分别或联合切断支配靶肝叶的肝交感、迷走神经及膈神经左支,结果表明:肝交感神经或迷走神经分别切断术均会影响肝肿瘤的生长,肝肿瘤的坏死范围可达40%,而肝交感和迷走神经及膈神经左支联合切断术,可使肝肿瘤坏死达70%,肝癌细胞增殖率显著下降,肝肿瘤细胞凋亡增加,动物生存期较对照组显著延长,进一步发现肝内神经系统S-100蛋白阳性表达显著降低。本实验在对支配靶肝叶的肝自主神经联合切断术的同时切除肿瘤并分别与HAE、PVE或HBDE,结果发现肝肿瘤坏死范围可达96%~100%。然而无论是肝交感或迷走神经分别切断或者两种神经与膈神经左支3种神经联合切断术+肿瘤切除以及3种神经联合切断术并与HAE、PVE或HBDE分别栓塞均会有效的控制肝癌生长及复发转移。
, http://www.100md.com
关于肝自主神经与肝癌生长及侵袭转移的影响机制可能是因为[11,15]自主神经系统对免疫功能具有着重要的调节功能或者是自主神经通过末梢释放的分子活性递质在发挥其重要作用,提示肝自主神经切断有效的控制肝癌生长及侵袭转移的机制可能是通过提高或降低某些分子神经递质的生物学作用的结果。肝自主神经或称植物神经切断术治疗肝癌的研究虽已取得一定疗效,但对其治疗的效果及其作用的分子机制尚有待进一步深入探讨。
作者简介:孟照华(1960-),男,山东省济南市人,博士,主治医师,主要从事肝癌复发转移方面的研究,发表论文48篇。电话: (023)65300054
作者单位:别平(第三军医大学附属西南医院肝胆外科中心、西南肝胆外科医院,重庆 400038)
参考文献:
[1] 张镜如 主编.生理学[M].第4版,北京:人民卫生出版社,1998.281-349.
, http://www.100md.com
[2] 郑汉光,汪国香,陶 凡. 腹腔神经节(丛)阻滞治疗癌性腹痛的临床和实验动物组织学的初步观察[J].河北医学,1999,5(1):12-14.
[3] Hina M O. A new approach to neurolytic block of the celiac plexus. Transintervertabral disc technique[J]. Anesthesiology, 1991,75(3):718-720.
[4] Dubovaia T K, Kobliakov V A, Merkulova I B, et al. Early stages of hepatic carcinogenesis after vagotomy[J]. Arkn Anat Gistol Embriol,1989,97(7):65-70.
[5] 三轮晃一,宫崎逸夫.胃癌手术における神经温存のコツ[J].手术,1994,48(8):1 131-1 135.
, http://www.100md.com
[6] 张培林 主编.神经解剖学[M].北京:人民卫生出版社,1998.143-163.
[7] 石素胜, 刘复生, 李泰生,等. 原发性肝肉瘤6例报告[J].中华肿瘤杂志.1994.16(3):228-230.
[8] 张晓智, 安怀伦, 张学斌. 食管癌及其区域淋巴结中S-100+树突状细胞的免疫组化研究[J]. 西安医科大学学报,1998,19(2):215-218.
[9] Atojl Y, Nakaoka T, Yamamoto Y, et al. Antigen stimulation alters the expression of S-100 protein in the giant macrophages and follicular dendritic cells of the guinea pig lymph nodes[J].Acta Anat (Basel) 1994,149(5):203-208.
, 百拇医药
[10] Oka K, Nakano T, Arai T. Adenocarcinoma of the cervix treated with radiation alone: prognsotic significance of S-100 protiein and vimentin immunostaming[J]. Obstet Gynecol, 1992,79(3):347-350.
[11] 许绍芬 主编.神经生物学[M].第2版,上海:上海医科大学出版社.1999.437-445.
[12] Stoyanova II, Gulubova M V. Peptidergic nerve fibres in the human liver[J]. Acta Histochem, 1998,100(3):245-256.
[13] Duek S D, Barzilai A. Treatment of Zollinger-Ellison syndrome. Harefuah[J].1991,120(7):384-385.
[14] Fukuda T, Iwanaga S, Sakamoto I et al. CT of neural plexus invasion in common bile duct carcinoma[J]. J Comput Assist Tomogr, 1998,68(3):351-354.
[15] 陈宜张 主编. 分子神经生物学[M]. 北京:人民军医出版社,1995.10-11.
收稿日期:2000-06-10;修回日期:2000-07-07, http://www.100md.com