BMP对异种骨移植局部TNF-α和IL-6基因表达的调节
http://www.100md.com
BMP对异种骨移植局部TNF-α和IL-6基因表达的调节
BMP对异种骨移植局部TNF-α和IL-6基因表达的调节
郭征 胡蕴玉 吕荣 王军
摘 要:目的 观察骨形态发生蛋白(BMP)在异种骨移植局部对TNF-α和IL-6 mRNA表达的调节作用. 方法 将含有一定抗原性的牛松质骨载体与不同剂量的牛BMP复合,植入小鼠股部肌袋,于术后5,10和20 d取材,制备石蜡切片,采用核酸分子原位杂交的方法,定性定位检测植骨局部TNF-α和IL-6 mRNA表达情况,通过图像分析,确定TNF-α和IL-6 mRNA表达强度,分析植骨局部不同计量BMP对TNF-α和IL-6 mRNA表达的影响. 结果 植骨术后5,10和20 d,各组植骨局部均检测到TNF-α和IL-6 mRNA阳性表达,以单纯载体组表达最强, 高剂量BMP组表达最弱, P<0.01;牛松质骨载体中复合的BMP对植骨局部TNF-α和IL-6 mRNA表达有抑制作用,其表达抑制程度与BMP呈剂量依赖关系. 结论 外源性BMP在异种骨移植局部对TNF-α和IL-6 mRNA表达有抑制作用,提示BMP在植骨局部具有诱导成骨和免疫调节双重作用.
, http://www.100md.com
关键词:骨形态发生蛋白;骨移植;细胞因子;基因表达;原位杂交
0 引言
骨形态发生蛋白(BMP)是一种得到广泛研究并已初步应用于临床的高效骨诱导活性因子,近来研究提示,BMP可能还是一种较强的细胞免疫抑制剂[1]. 通过复合植骨中外源性BMP的引入,植骨局部的骨代谢状况和免疫状态将受到影响. TNF-α和IL-6是细胞免疫中两种重要的相关因子[2, 3],植骨局部TNF-α和IL-6的表达可以用来反映机体局部的细胞免疫状态. 我们将含有一定抗原性的牛松质骨载体与不同剂量的牛BMP复合,观察BMP在植骨局部对TNF-α和IL-6基因表达的调节作用,进一步探讨BMP在植骨局部诱导成骨和免疫调节双重功效.
1 材料和方法
1.1 材料
, 百拇医药
1.1.1 部分脱抗原牛松质骨载体的制备 取新鲜小牛长骨两端松质部分,切成3 mm×3 mm×3 mm骨粒,用50℃水反复冲洗2 h,1∶1氯仿甲醇脱脂10 h,300 mL*L-1过氧化氢选择性脱蛋白8 h,0.6 mol.L-1盐酸脱钙1 min,蒸馏水冲洗浸泡30 min,冻干,制备成部分脱抗原牛松质骨载体并分成B0, B1, B2 3组.
1.1.2 复合植骨材料的制备 按照Urist方法[4],从新鲜牛骨中提取BMP,经小鼠肌袋实验证实其诱导成骨活性. 采用已报道的方法[5],将上述3组骨粒分别与不同计量的BMP复合,其中B0组不复合BMP,B1组和B2组每粒骨粒分别复合1 mg和2 mg BMP,冻干备用.
, http://www.100md.com
1.2 方法 取封闭群健康BALB/c小鼠54只,均为雄性,体质量20~22 g,随机分成B0,B1,B2 3个实验组,每组18只. 采用小鼠肌袋模型,在无菌条件下将复合骨粒植入小鼠右侧股部肌间隙内,每只小鼠植入1粒. 各组分别植入上述不同类型的植入物,于术后5, 10和20 d每组各处死小鼠6只,取材,制备组织标本,行细胞因子表达检测.
1.2.1 原位杂交 ①石蜡切片,置于涂有APES防脱片胶的载玻片上,60℃过夜,常规脱蜡,加入0.01 mol.L-1 PBS洗涤5 min(3次),0.2 mol.L-1 HCl浸泡10 min, 5 μg*mL-1蛋白酶K消化20 min,0.01 mol.L-1 PBS洗涤5 min(3次), 乙醇逐级脱水, 室温下干燥组织片. ②地高辛标记小鼠TNF-α和IL-6 cDNA探针在98~100℃水浴中变性10 min,冰浴5 min, 加于组织切片上, 37℃杂交过夜. ③梯度SSC洗涤, buffer Ⅰ洗涤2次, 分别为5 min和15 min, 封闭(buffer Ⅲ+TritonX-100+NSS), 30 min,滴加抗体复合物, 室温下2 h, buffer Ⅰ洗涤5 min (2次), buffer Ⅲ洗涤3 min, 避光显色(buffer Ⅲ+NBT+BCIP) 40 min, 中止反应, 常规乙醇脱水, 二甲苯透明, 树脂胶封片, 镜检观察,细胞核及胞质内呈紫蓝色或蓝色反应物质为阳性. 同时设立阳性及空白对照.
, 百拇医药
1.2.2 图像分析与统计处理 原位杂交组织切片经显微照像后,照片用Microtek E6扫描仪扫描,图像采集入计算机,再用Photoshop V4.0图像处理软件处理分析,提取图中阳性表达信号彩色阀值,统计图像中所有提取出的信号,计算平均密度值,最后用Base统计软件进行统计学处理,团体t检验比较不同时间点各组间是否存在显著差异.
2 结果
原位杂交检测图像分析结果见Tab 1. 结果发现, 植骨术后, 各组植骨局部均可见TNF-α和IL-6 mRNA的阳性表达, 但表达强度不同. 不同时间点各组间TNF-α和IL-6 mRNA表达强度有显著性差异(P<0.01), 其中以B0组表达最强(Fig 1, 2), B2组表达最弱(Fig 3, 4), 此表明载体中BMP对TNF-α和IL-6 mRNA表达有抑制作用, 并呈剂量依赖关系.
, http://www.100md.com 表1 植骨术后不同时间各组TNF-α和IL-6 mRNA表达强度的变化
Tab 1 The expression of TNF-α and IL-6 mRNA after implantation
(n=54, X±s)
m(BMP)
/mg
5 d
10 d
20 d
TNF-α
IL-6
TNF-α
, http://www.100md.com
IL-6
TNF-α
IL-6
0
38.6±2.1
29.3±2.4
68.4±2.2
50.8±4.6
52.5±2.6
74.6±2.8
1
21.8±1.7b
, http://www.100md.com
18.7±1.9b
41.7±1.4b
23.4±3.1b
39.1±2.3b
68.7±2.1b
2
11.3±1.1bd
8.2±1.7bd
15.1±2.6bd
11.6±2.0bd
, 百拇医药
36.5±2.0bd
60.4±2.1bd
bP<0.01 vs BMP 0 mg; dP<0.01 vs BMP 1 mg.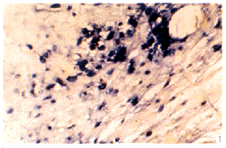
图1 单纯载体组术后10 d TNF-α mRNA阳性表达
Fig 1 Positive expression of TNF-α mRNA in BMP 0 mg group at 10th day ISH ×400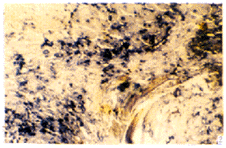
, http://www.100md.com
图2 单纯载体组术后10 d IL-6 mRNA阳性表达
Fig 2 Positive expression of IL-6 mRNA in BMP 0 mg group at 10th day ISH ×400
图3 复合BMP 2 mg组术后10 d TNF-α mRNA阳性表达
Fig 3 Positive expression of TNF-α mRNA in BMP 2 mg group at 10th day ISH ×400
, http://www.100md.com
图4 复合BMP 2 mg组术后10 d IL-6 mRNA阳性表达
Fig 4 Positive expression of IL-6 mRNA in BMP 2 mg group at 10th day ISH ×400
3 讨论
BMP是目前研究较深入的骨生成启动因子,能直接诱导软组织成骨,在骨的形成、生长、发育及骨修复中均发挥重要作用[6]. 将BMP与脱抗原异种骨复合使用,对于骨修复和重建过程将有更好的促进作用[7].
BMP属于TGF-β超家族的重要成员,与TGF-β有高度的同源性. 鉴于TGF-β在免疫调节方面的作用[8],有人推测BMP可能对免疫系统也有调节作用. 黄传书等[1]的研究证实了上述假设,发现BMP在体外同样具有广泛的免疫抑制特性,且呈剂量依赖关系,并指出其免疫调节活性位点不同于骨形成活性位点. 然而,体外实验结果并不表明BMP在体内有同样的作用,因此,研究BMP在体内对免疫的调节作用更具意义.
, 百拇医药
随着分子免疫学的发展,细胞因子在移植免疫中的作用日益受到重视,在细胞因子网络中,TNF-α和IL-6对特异性免疫应答的调节非常关键. TNF-α可使T细胞活化,并诱导MHC-I加强表达,这样就有利于抗原呈递,促进细胞免疫的进行[9]. IL-6对细胞免疫的调节可表现在对T细胞不同分化阶段均发挥刺激作用,如IL-6可刺激已被IL-2和IL-4共同刺激的CD4+和CD8+ T细胞亚群的增殖[10],对成熟的T细胞,IL-6能活化IL-2产物[11]. 因此,通过检测TNF-α和IL-6等免疫细胞因子的变化可以反映体内细胞免疫的状态. 本实验从基因分子水平观察BMP在植骨局部对TNF-α和IL-6表达的调节作用,并就BMP在复合植骨中的作用提出新看法.
本实验选择不同剂量的bBMP与部分脱抗原牛松质骨载体复合,在植骨局部观察TNF-α和IL-6表达情况,结果发现,植骨局部TNF-α和IL-6表达的抑制程度与载体中bBMP复合量呈剂量依赖关系. 实验结果提示,bBMP在植骨局部对细胞免疫有抑制作用.
, 百拇医药
植骨局部的免疫细胞因子多在细胞介导的免疫反应中产生,但在某些无抗原性的骨替代材料植入区,也可检测到TNF-α和IL-6等细胞因子的表达[12]. 这些细胞因子对植骨或(和)受区骨的影响主要表现为刺激骨吸收. 当复合骨材料中的外源性细胞因子介入后,局部细胞因子的网络调节将发生变化,这种变化可能对植骨材料的吸收和骨诱导形成过程产生影响. 本实验表明,BMP作为外源性介质,在骨移植局部发挥着双重作用:一是诱导成骨作用,二是免疫抑制作用. 由于BMP的免疫调节功能区和诱导成骨功能区并不相同,提示BMP同时发挥双重作用. BMP在植骨局部的双重作用对促进骨形成和抑制骨吸收是有益的,两种作用的协同结果使BMP更好地发挥诱导成骨效能.
基金项目:国家自然科学基金资助项目(39570709)
作者简介:郭 征(1965-),男(汉族),辽宁省沈阳市人. 讲师,主治医师,博士. Tel. (029)3373645(O) Email. osteop@fmmu.edu.cn
, 百拇医药
郭征(第四军医大学西京医院骨科研究所,陕西 西安 710033)
胡蕴玉(第四军医大学西京医院骨科研究所,陕西 西安 710033)
吕荣(第四军医大学西京医院骨科研究所,陕西 西安 710033)
王军(第四军医大学西京医院骨科研究所,陕西 西安 710033)
参考文献
[1]黄传书, 金伯泉, 杨连甲et al. 骨形成蛋白对rhIL-2和同种异体抗原诱导人和小鼠杀伤细胞活性的抑制作用[J]. 中华微生物学和免疫学杂志,1992;12(1):37-40.
[2]Hirano T, Akira S, Taga T et al. Biological and clinical aspects of interleukin 6[J]. Immunol Today,1990;11(12):443-449.
, 百拇医药
[3]Vassalli P. The pathophysiology of tumor necrosis factors[J]. Annu Rev Immunol,1992;10:411-452.
[4]Urist MR, Lietze A, Mizutani H et al. A bovine low molecular weight bone morphogenetic protein (BMP) fraction[J]. Clin Orthop, 1982;Jan-Feb(162):219-232.
[5]刘 玮,胡蕴玉,陆裕朴. 异种骨移植抗原的免疫组织化学实验研究[J]. 中华骨科杂志,1989;9(1):53-54.
[6]Urist MR, Chang JJ, Lietze A et al. Preparation and bioassay of bone morphogenetic protein and polypeptide fragments[A]. In: Barnes D, Sirbaska DA. Method in enzymology[M]. New York: Academic Press,1987;146:294-305.
, 百拇医药
[7]刘 玮,胡蕴玉,陆裕朴. 重组合异种骨的研究牛骨松质与BMP的再结合[J].骨与关节损伤杂志,1991;6(1):18-20.
[8]金伯泉, 刘雪松. 转化生长因子-β对免疫系统的调节作用[J].《免疫学杂志》,1989;5(4):265-268.
[9]Beutler B, Cerami A. The biology of cachectin/TNF-a primary mediator of the host response[J]. Annu Rev Immunol,1989;7:625-655.
[10]Hodgkin PD, Bond MW, O'Garra A et al. Identification of IL-6 as a T cell-derived factor that enhances the proliferative response of thymocytes to IL-4 and phorbol myristate acetate[J]. J Immunol,1988;141(1):151-157.
[11]Garman RD, Jacobs KA, Clark SC et al. B-cell-stimulatory factor 2 (beta 2 interferon) functions as a second signal for interleukin 2 production by mature murine T cells[J]. Proc Natl Acad Sci USA,1987;84(21):7629-7633.
[12]戴克戎. 骨溶解与人工关节后期松动[J]. 中华骨科杂志,1997;17(1):3-4., http://www.100md.com
郭征 胡蕴玉 吕荣 王军
摘 要:目的 观察骨形态发生蛋白(BMP)在异种骨移植局部对TNF-α和IL-6 mRNA表达的调节作用. 方法 将含有一定抗原性的牛松质骨载体与不同剂量的牛BMP复合,植入小鼠股部肌袋,于术后5,10和20 d取材,制备石蜡切片,采用核酸分子原位杂交的方法,定性定位检测植骨局部TNF-α和IL-6 mRNA表达情况,通过图像分析,确定TNF-α和IL-6 mRNA表达强度,分析植骨局部不同计量BMP对TNF-α和IL-6 mRNA表达的影响. 结果 植骨术后5,10和20 d,各组植骨局部均检测到TNF-α和IL-6 mRNA阳性表达,以单纯载体组表达最强, 高剂量BMP组表达最弱, P<0.01;牛松质骨载体中复合的BMP对植骨局部TNF-α和IL-6 mRNA表达有抑制作用,其表达抑制程度与BMP呈剂量依赖关系. 结论 外源性BMP在异种骨移植局部对TNF-α和IL-6 mRNA表达有抑制作用,提示BMP在植骨局部具有诱导成骨和免疫调节双重作用.
, http://www.100md.com
关键词:骨形态发生蛋白;骨移植;细胞因子;基因表达;原位杂交
0 引言
骨形态发生蛋白(BMP)是一种得到广泛研究并已初步应用于临床的高效骨诱导活性因子,近来研究提示,BMP可能还是一种较强的细胞免疫抑制剂[1]. 通过复合植骨中外源性BMP的引入,植骨局部的骨代谢状况和免疫状态将受到影响. TNF-α和IL-6是细胞免疫中两种重要的相关因子[2, 3],植骨局部TNF-α和IL-6的表达可以用来反映机体局部的细胞免疫状态. 我们将含有一定抗原性的牛松质骨载体与不同剂量的牛BMP复合,观察BMP在植骨局部对TNF-α和IL-6基因表达的调节作用,进一步探讨BMP在植骨局部诱导成骨和免疫调节双重功效.
1 材料和方法
1.1 材料
, 百拇医药
1.1.1 部分脱抗原牛松质骨载体的制备 取新鲜小牛长骨两端松质部分,切成3 mm×3 mm×3 mm骨粒,用50℃水反复冲洗2 h,1∶1氯仿甲醇脱脂10 h,300 mL*L-1过氧化氢选择性脱蛋白8 h,0.6 mol.L-1盐酸脱钙1 min,蒸馏水冲洗浸泡30 min,冻干,制备成部分脱抗原牛松质骨载体并分成B0, B1, B2 3组.
1.1.2 复合植骨材料的制备 按照Urist方法[4],从新鲜牛骨中提取BMP,经小鼠肌袋实验证实其诱导成骨活性. 采用已报道的方法[5],将上述3组骨粒分别与不同计量的BMP复合,其中B0组不复合BMP,B1组和B2组每粒骨粒分别复合1 mg和2 mg BMP,冻干备用.
, http://www.100md.com
1.2 方法 取封闭群健康BALB/c小鼠54只,均为雄性,体质量20~22 g,随机分成B0,B1,B2 3个实验组,每组18只. 采用小鼠肌袋模型,在无菌条件下将复合骨粒植入小鼠右侧股部肌间隙内,每只小鼠植入1粒. 各组分别植入上述不同类型的植入物,于术后5, 10和20 d每组各处死小鼠6只,取材,制备组织标本,行细胞因子表达检测.
1.2.1 原位杂交 ①石蜡切片,置于涂有APES防脱片胶的载玻片上,60℃过夜,常规脱蜡,加入0.01 mol.L-1 PBS洗涤5 min(3次),0.2 mol.L-1 HCl浸泡10 min, 5 μg*mL-1蛋白酶K消化20 min,0.01 mol.L-1 PBS洗涤5 min(3次), 乙醇逐级脱水, 室温下干燥组织片. ②地高辛标记小鼠TNF-α和IL-6 cDNA探针在98~100℃水浴中变性10 min,冰浴5 min, 加于组织切片上, 37℃杂交过夜. ③梯度SSC洗涤, buffer Ⅰ洗涤2次, 分别为5 min和15 min, 封闭(buffer Ⅲ+TritonX-100+NSS), 30 min,滴加抗体复合物, 室温下2 h, buffer Ⅰ洗涤5 min (2次), buffer Ⅲ洗涤3 min, 避光显色(buffer Ⅲ+NBT+BCIP) 40 min, 中止反应, 常规乙醇脱水, 二甲苯透明, 树脂胶封片, 镜检观察,细胞核及胞质内呈紫蓝色或蓝色反应物质为阳性. 同时设立阳性及空白对照.
, 百拇医药
1.2.2 图像分析与统计处理 原位杂交组织切片经显微照像后,照片用Microtek E6扫描仪扫描,图像采集入计算机,再用Photoshop V4.0图像处理软件处理分析,提取图中阳性表达信号彩色阀值,统计图像中所有提取出的信号,计算平均密度值,最后用Base统计软件进行统计学处理,团体t检验比较不同时间点各组间是否存在显著差异.
2 结果
原位杂交检测图像分析结果见Tab 1. 结果发现, 植骨术后, 各组植骨局部均可见TNF-α和IL-6 mRNA的阳性表达, 但表达强度不同. 不同时间点各组间TNF-α和IL-6 mRNA表达强度有显著性差异(P<0.01), 其中以B0组表达最强(Fig 1, 2), B2组表达最弱(Fig 3, 4), 此表明载体中BMP对TNF-α和IL-6 mRNA表达有抑制作用, 并呈剂量依赖关系.
, http://www.100md.com 表1 植骨术后不同时间各组TNF-α和IL-6 mRNA表达强度的变化
Tab 1 The expression of TNF-α and IL-6 mRNA after implantation
(n=54, X±s)
m(BMP)
/mg
5 d
10 d
20 d
TNF-α
IL-6
TNF-α
, http://www.100md.com
IL-6
TNF-α
IL-6
0
38.6±2.1
29.3±2.4
68.4±2.2
50.8±4.6
52.5±2.6
74.6±2.8
1
21.8±1.7b
, http://www.100md.com
18.7±1.9b
41.7±1.4b
23.4±3.1b
39.1±2.3b
68.7±2.1b
2
11.3±1.1bd
8.2±1.7bd
15.1±2.6bd
11.6±2.0bd
, 百拇医药
36.5±2.0bd
60.4±2.1bd
bP<0.01 vs BMP 0 mg; dP<0.01 vs BMP 1 mg.

图1 单纯载体组术后10 d TNF-α mRNA阳性表达
Fig 1 Positive expression of TNF-α mRNA in BMP 0 mg group at 10th day ISH ×400

, http://www.100md.com
图2 单纯载体组术后10 d IL-6 mRNA阳性表达
Fig 2 Positive expression of IL-6 mRNA in BMP 0 mg group at 10th day ISH ×400

图3 复合BMP 2 mg组术后10 d TNF-α mRNA阳性表达
Fig 3 Positive expression of TNF-α mRNA in BMP 2 mg group at 10th day ISH ×400

, http://www.100md.com
图4 复合BMP 2 mg组术后10 d IL-6 mRNA阳性表达
Fig 4 Positive expression of IL-6 mRNA in BMP 2 mg group at 10th day ISH ×400
3 讨论
BMP是目前研究较深入的骨生成启动因子,能直接诱导软组织成骨,在骨的形成、生长、发育及骨修复中均发挥重要作用[6]. 将BMP与脱抗原异种骨复合使用,对于骨修复和重建过程将有更好的促进作用[7].
BMP属于TGF-β超家族的重要成员,与TGF-β有高度的同源性. 鉴于TGF-β在免疫调节方面的作用[8],有人推测BMP可能对免疫系统也有调节作用. 黄传书等[1]的研究证实了上述假设,发现BMP在体外同样具有广泛的免疫抑制特性,且呈剂量依赖关系,并指出其免疫调节活性位点不同于骨形成活性位点. 然而,体外实验结果并不表明BMP在体内有同样的作用,因此,研究BMP在体内对免疫的调节作用更具意义.
, 百拇医药
随着分子免疫学的发展,细胞因子在移植免疫中的作用日益受到重视,在细胞因子网络中,TNF-α和IL-6对特异性免疫应答的调节非常关键. TNF-α可使T细胞活化,并诱导MHC-I加强表达,这样就有利于抗原呈递,促进细胞免疫的进行[9]. IL-6对细胞免疫的调节可表现在对T细胞不同分化阶段均发挥刺激作用,如IL-6可刺激已被IL-2和IL-4共同刺激的CD4+和CD8+ T细胞亚群的增殖[10],对成熟的T细胞,IL-6能活化IL-2产物[11]. 因此,通过检测TNF-α和IL-6等免疫细胞因子的变化可以反映体内细胞免疫的状态. 本实验从基因分子水平观察BMP在植骨局部对TNF-α和IL-6表达的调节作用,并就BMP在复合植骨中的作用提出新看法.
本实验选择不同剂量的bBMP与部分脱抗原牛松质骨载体复合,在植骨局部观察TNF-α和IL-6表达情况,结果发现,植骨局部TNF-α和IL-6表达的抑制程度与载体中bBMP复合量呈剂量依赖关系. 实验结果提示,bBMP在植骨局部对细胞免疫有抑制作用.
, 百拇医药
植骨局部的免疫细胞因子多在细胞介导的免疫反应中产生,但在某些无抗原性的骨替代材料植入区,也可检测到TNF-α和IL-6等细胞因子的表达[12]. 这些细胞因子对植骨或(和)受区骨的影响主要表现为刺激骨吸收. 当复合骨材料中的外源性细胞因子介入后,局部细胞因子的网络调节将发生变化,这种变化可能对植骨材料的吸收和骨诱导形成过程产生影响. 本实验表明,BMP作为外源性介质,在骨移植局部发挥着双重作用:一是诱导成骨作用,二是免疫抑制作用. 由于BMP的免疫调节功能区和诱导成骨功能区并不相同,提示BMP同时发挥双重作用. BMP在植骨局部的双重作用对促进骨形成和抑制骨吸收是有益的,两种作用的协同结果使BMP更好地发挥诱导成骨效能.
基金项目:国家自然科学基金资助项目(39570709)
作者简介:郭 征(1965-),男(汉族),辽宁省沈阳市人. 讲师,主治医师,博士. Tel. (029)3373645(O) Email. osteop@fmmu.edu.cn
, 百拇医药
郭征(第四军医大学西京医院骨科研究所,陕西 西安 710033)
胡蕴玉(第四军医大学西京医院骨科研究所,陕西 西安 710033)
吕荣(第四军医大学西京医院骨科研究所,陕西 西安 710033)
王军(第四军医大学西京医院骨科研究所,陕西 西安 710033)
参考文献
[1]黄传书, 金伯泉, 杨连甲et al. 骨形成蛋白对rhIL-2和同种异体抗原诱导人和小鼠杀伤细胞活性的抑制作用[J]. 中华微生物学和免疫学杂志,1992;12(1):37-40.
[2]Hirano T, Akira S, Taga T et al. Biological and clinical aspects of interleukin 6[J]. Immunol Today,1990;11(12):443-449.
, 百拇医药
[3]Vassalli P. The pathophysiology of tumor necrosis factors[J]. Annu Rev Immunol,1992;10:411-452.
[4]Urist MR, Lietze A, Mizutani H et al. A bovine low molecular weight bone morphogenetic protein (BMP) fraction[J]. Clin Orthop, 1982;Jan-Feb(162):219-232.
[5]刘 玮,胡蕴玉,陆裕朴. 异种骨移植抗原的免疫组织化学实验研究[J]. 中华骨科杂志,1989;9(1):53-54.
[6]Urist MR, Chang JJ, Lietze A et al. Preparation and bioassay of bone morphogenetic protein and polypeptide fragments[A]. In: Barnes D, Sirbaska DA. Method in enzymology[M]. New York: Academic Press,1987;146:294-305.
, 百拇医药
[7]刘 玮,胡蕴玉,陆裕朴. 重组合异种骨的研究牛骨松质与BMP的再结合[J].骨与关节损伤杂志,1991;6(1):18-20.
[8]金伯泉, 刘雪松. 转化生长因子-β对免疫系统的调节作用[J].《免疫学杂志》,1989;5(4):265-268.
[9]Beutler B, Cerami A. The biology of cachectin/TNF-a primary mediator of the host response[J]. Annu Rev Immunol,1989;7:625-655.
[10]Hodgkin PD, Bond MW, O'Garra A et al. Identification of IL-6 as a T cell-derived factor that enhances the proliferative response of thymocytes to IL-4 and phorbol myristate acetate[J]. J Immunol,1988;141(1):151-157.
[11]Garman RD, Jacobs KA, Clark SC et al. B-cell-stimulatory factor 2 (beta 2 interferon) functions as a second signal for interleukin 2 production by mature murine T cells[J]. Proc Natl Acad Sci USA,1987;84(21):7629-7633.
[12]戴克戎. 骨溶解与人工关节后期松动[J]. 中华骨科杂志,1997;17(1):3-4., http://www.100md.com