雌、孕激素调控人子宫内膜间质细胞HB-EGF的表达
作者:姜群英 陈士岭 邢福祺
单位:第一军医大学南方医院妇产科 广州510515
关键词:
中华医学杂志001118 肝素结合表皮生长因子(HB-EGF)是表皮生长因子(EGF)超家族成员之一,作用与EGF相似,但促细胞分裂活性较强,与肝素有较强的亲和性,而EGF不与肝素结合[1]。HB-EGF在人子宫内膜上皮细胞和间质细胞上有表达,是介导胚泡着床的必须细胞因子之一[2]。关于HB-EGF在人子宫内膜中表达结果的报道并不完全一致[3,4],而对其表达调控方面的研究又仅限于啮齿类动物[5],故我们观察了雌二醇(E2)、孕酮(P)对体外培养人子宫内膜间质细胞HB-EGF表达的调节作用。
一、对象和方法
, http://www.100md.com
1.对象:选取8例育龄期妇女,年龄25~35岁,月经周期28~30 d,术前3个月无激素服用史,于月经周期第6~12 d刮取子宫内膜。将刮取的子宫内膜组织投入盛有10 ml D-Hank's液的青霉素瓶中,放入冰壶内,30 min内送入实验室进行培养,另取部分组织用体积分数为10%的中性甲醛固定后作病理学检查,结果证实为增殖期子宫内膜。
2.试剂与仪器:17β-E2、P(美国,Calchembio公司),用无水乙醇配制[6];一抗:山羊抗人HB-EGF多克隆抗体,二抗:荧光标记兔抗山羊抗体(IgG/FITC)均购自美国Santa Cruz公司。激光扫描共聚焦显微镜(LSCM,美国Meridian公司)。
3.方法:(1)培养液成分:D-Hank's液(自配),DMEM细胞培养液(美国Gibco公司),体积分数为10%灭活胎牛血清(杭州四季青公司),青霉素100 U/ml,链霉素100 μg/ml,用NaHCO3调pH致7.4。(2)培养容器:培养瓶(容积100 ml),培养面积30 cm2;Corning培养皿,直径35 mm(日本Molecular prober公司)。(3)原代培养:参照Chegini等[7]的培养方法并稍加改进。将内膜组织用D-Hank's液洗涤3次,剪成1 mm3的小块,在青霉素瓶内加入体积分数为0.25%胶原酶(Ⅲ型,美国Sigma公司)5 ml和DNA酶15 U(美国Promega公司),在37℃水浴中持续慢速电磁搅拌3~4 h,将消化后的细胞悬液离心700~1 000 r/min,5 min,弃上清,向沉淀物中加入Hank's液漂洗,用450 μm的滤网过滤细胞,收集滤液中的单个间质细胞,离心,弃上清,加培养液使成细胞悬液,台盼蓝染色,以活细胞5×104个/cm2接种于培养瓶,置37℃,体积分数为5%的CO2恒温箱内培养,约30~40 min间质细胞既可贴壁,每3 d更换培养液。(4)传代培养:细胞长满瓶壁既可传代,体积分数为0.25%胰蛋白酶(美国Sigma公司)3 ml,于室温下消化3~4 min,见细胞皱缩变圆后吸去胰酶,加入DMEM液将细胞自瓶壁摧打下来,混匀,一瓶分成两瓶继续培养。(5)细胞免疫荧光法:细胞长满瓶壁后再传代培养约3~4代后接种于Corning培养皿,约24 h后换无血清培养液各1 ml,并分别加入E2、P,浓度分别为0(为对照组,即加入等量的无水乙醇)、10-9、10-8及10-7 mol/L和0、10-11、10-10及10-9 mol/L,E2+P协同作用量浓度为10-7 mol/L+10-9 mol/L经培养24、48 h,弃去培养液,用磷酸盐缓冲液(PBS)洗,加入体积分数为4%多聚甲醛液固定30 min,PBS洗,加一抗于4℃冰箱过夜,PBS洗,加二抗孵育30 min,PBS洗,用LSCM检测细胞表面的荧光强度。(6)LSCM检测方法:将培养皿置于LSCM载物台,打开激光,选择5个视野,逐个视野储存,对所存视野进行逐个扫描后,对其进行定量分析统计。荧光激发波长为488 nm。
, 百拇医药
4.统计学分析:实验数据以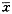 ±s表示,用t检验进行处理。
±s表示,用t检验进行处理。
二、结果
1.间质细胞生长状态观察:倒置显微镜下观察体外培养的间质细胞呈多角形,胞浆突起延伸相互连接,核圆居中,细胞平铺生长,经多次传代后细胞体积变大,细胞伸长成梭形,胞浆丰富,核椭圆,相互平行排列,密度大的区域细胞聚集成堆,细胞经角蛋白染色呈阴性反应,可证实为间质细胞。
2.E2、P对间质细胞HB-EGF表达的影响:不同量浓度的E2、P均可促进间质细胞HB-EGF表达,而E2、P量浓度分别为10-7 mol/L和10-9 mol/L培养48 h作用时最明显,与对照组比较荧光强度值明显增大,P或E2+P的协同作用与对照组比较差异有显著意义(t=7.375,t=11.459,P<0.01)。见表1。
, http://www.100md.com
三、讨论
雌、孕激素可以促进大、小鼠子宫内膜上皮细胞和间质细胞HB-EGF的表达[5]。目前关于子宫内膜间质细胞表达HB-EGF的情况报道不一,Birdsall等1996年首次在人的整个月经周期子宫内膜上皮细胞和间质细胞检测到有HB-EGF蛋白的表达,并发现HB-EGF在种植窗期子宫内膜腔上皮细胞的高表达可能与介导胚泡着床有关。Yoo等[3]于1997年发现在子宫内膜增殖期间质细胞表达HB-EGF水平低,而在分泌期后表达升高。Leach等[4]则认为在增殖晚期和分泌早期间质细胞HB-EGF表达增强。
表1 雌、孕激素对间质细胞肝素结合表皮生长因子
表达的影响(荧光强度值,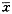 ±s) 组别
±s) 组别
, 百拇医药
例数
不同培养时间肝素结合表皮生长因子的表达
24 h
48 h
对照组
8
399±137
403±141
雌二醇组
8
617±159*
979±197△
, 百拇医药
孕酮组
8
833±263*
1 208±276△
雌二醇+孕酮组
8
1 421±270**
1 674±281△**
注:雌二醇、孕酮量浓度分别为10-7 mol/L和10-9 mol/L;与对照组比较*t=2.964,P<0.05;△t=6.741,P<0.01;**t=11.459,P<0.01
, http://www.100md.com
子宫内膜间质细胞具有潜在的增殖和再分化能力,经卵巢甾体激素充分协调作用后子宫内膜一旦受到蜕膜反应原刺激,即可发生蜕膜样变,对于妊娠的建立和维持至关重要。本研究发现体外培养的间质细胞表达HB-EGF,E2、P均可促进其表达,且P或P+E2的协同作用明显大于E2。生理条件下间质细胞在P作用下增生、水肿、肥大,营养丰富,有利于胚泡着床。我们还用免疫组织化学方法研究证实增殖期子宫内膜间质细胞表达HB-EGF低,在分泌中期表达增强(另文报道),与体外培养P能促进子宫内膜间质细胞HB-EGF表达结果一致。亦有学者发现在人子宫内膜上皮细胞和间质细胞、胚泡细胞上有EGFR,HB-EGF可能通过自分泌或旁分泌的方式与受体结合发挥它的生物学作用。本研究结果提示,孕激素促进着床与维持早期妊娠的机制之一可能是通过增强HB-EGF表达进而促进间质细胞的增殖和蜕膜化来实现的。
参考文献
1,Raab G, Klagsbyun M. Heparin-binding EGF-like growth factor. Acta Biochem Biophys, 1997,1333:F179-199.
, http://www.100md.com
2,Stewart CL, Abbondanzo SL, Cullinan EB, et al. Regulation by maternally derived cytokines of pre-implantation development and uterine receptiveness. Contracept Fertil Sex, 1995,23:555-562.
3,Yoo HJ, Barlow DH, Mardon HJ. Temporal and spatial regulation of expression of heparin-binding eidermal growth factor-like growth factor in the human endometrium: a possible role in blastocyst implantation. Dev Genet, 1997,21:102-108.
4,Leach RE, Khalifa R, Ramirez ND, et al. Multiple roles for heparin-binding epidermal growth factor-like growth factor are sugested by its cell-specific expression during the human endometrial cycle and early placentation. J Clin Endocrinol Metab, 1999,84:3355-3363.
, http://www.100md.com
5,Zhang ZM, Laping J, Glasser S, et al. Mediators of estradial-stimulated mitosis in the rat uterine luminal epithelium. Endocrinology, 1998,139:961-966.
6,郭洪敏,杜靖远.17-雌二醇对新生大鼠成骨细胞增殖和分化的影响.中华妇产科杂志,1999,34:119-120.
7,Chegini N, Rossi MJ, Masterson BJ, et al. Platelet-derived growth factor (PDGF), epidermal growth factor (EGF), and EGF, and PDGF β-receptor in human endometrial tissue: localization and in vitro action. Endocrinology, 1992,130:2373-2378.
(收稿日期:1999-11-02), http://www.100md.com
单位:第一军医大学南方医院妇产科 广州510515
关键词:
中华医学杂志001118 肝素结合表皮生长因子(HB-EGF)是表皮生长因子(EGF)超家族成员之一,作用与EGF相似,但促细胞分裂活性较强,与肝素有较强的亲和性,而EGF不与肝素结合[1]。HB-EGF在人子宫内膜上皮细胞和间质细胞上有表达,是介导胚泡着床的必须细胞因子之一[2]。关于HB-EGF在人子宫内膜中表达结果的报道并不完全一致[3,4],而对其表达调控方面的研究又仅限于啮齿类动物[5],故我们观察了雌二醇(E2)、孕酮(P)对体外培养人子宫内膜间质细胞HB-EGF表达的调节作用。
一、对象和方法
, http://www.100md.com
1.对象:选取8例育龄期妇女,年龄25~35岁,月经周期28~30 d,术前3个月无激素服用史,于月经周期第6~12 d刮取子宫内膜。将刮取的子宫内膜组织投入盛有10 ml D-Hank's液的青霉素瓶中,放入冰壶内,30 min内送入实验室进行培养,另取部分组织用体积分数为10%的中性甲醛固定后作病理学检查,结果证实为增殖期子宫内膜。
2.试剂与仪器:17β-E2、P(美国,Calchembio公司),用无水乙醇配制[6];一抗:山羊抗人HB-EGF多克隆抗体,二抗:荧光标记兔抗山羊抗体(IgG/FITC)均购自美国Santa Cruz公司。激光扫描共聚焦显微镜(LSCM,美国Meridian公司)。
3.方法:(1)培养液成分:D-Hank's液(自配),DMEM细胞培养液(美国Gibco公司),体积分数为10%灭活胎牛血清(杭州四季青公司),青霉素100 U/ml,链霉素100 μg/ml,用NaHCO3调pH致7.4。(2)培养容器:培养瓶(容积100 ml),培养面积30 cm2;Corning培养皿,直径35 mm(日本Molecular prober公司)。(3)原代培养:参照Chegini等[7]的培养方法并稍加改进。将内膜组织用D-Hank's液洗涤3次,剪成1 mm3的小块,在青霉素瓶内加入体积分数为0.25%胶原酶(Ⅲ型,美国Sigma公司)5 ml和DNA酶15 U(美国Promega公司),在37℃水浴中持续慢速电磁搅拌3~4 h,将消化后的细胞悬液离心700~1 000 r/min,5 min,弃上清,向沉淀物中加入Hank's液漂洗,用450 μm的滤网过滤细胞,收集滤液中的单个间质细胞,离心,弃上清,加培养液使成细胞悬液,台盼蓝染色,以活细胞5×104个/cm2接种于培养瓶,置37℃,体积分数为5%的CO2恒温箱内培养,约30~40 min间质细胞既可贴壁,每3 d更换培养液。(4)传代培养:细胞长满瓶壁既可传代,体积分数为0.25%胰蛋白酶(美国Sigma公司)3 ml,于室温下消化3~4 min,见细胞皱缩变圆后吸去胰酶,加入DMEM液将细胞自瓶壁摧打下来,混匀,一瓶分成两瓶继续培养。(5)细胞免疫荧光法:细胞长满瓶壁后再传代培养约3~4代后接种于Corning培养皿,约24 h后换无血清培养液各1 ml,并分别加入E2、P,浓度分别为0(为对照组,即加入等量的无水乙醇)、10-9、10-8及10-7 mol/L和0、10-11、10-10及10-9 mol/L,E2+P协同作用量浓度为10-7 mol/L+10-9 mol/L经培养24、48 h,弃去培养液,用磷酸盐缓冲液(PBS)洗,加入体积分数为4%多聚甲醛液固定30 min,PBS洗,加一抗于4℃冰箱过夜,PBS洗,加二抗孵育30 min,PBS洗,用LSCM检测细胞表面的荧光强度。(6)LSCM检测方法:将培养皿置于LSCM载物台,打开激光,选择5个视野,逐个视野储存,对所存视野进行逐个扫描后,对其进行定量分析统计。荧光激发波长为488 nm。
, 百拇医药
4.统计学分析:实验数据以
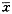 ±s表示,用t检验进行处理。
±s表示,用t检验进行处理。二、结果
1.间质细胞生长状态观察:倒置显微镜下观察体外培养的间质细胞呈多角形,胞浆突起延伸相互连接,核圆居中,细胞平铺生长,经多次传代后细胞体积变大,细胞伸长成梭形,胞浆丰富,核椭圆,相互平行排列,密度大的区域细胞聚集成堆,细胞经角蛋白染色呈阴性反应,可证实为间质细胞。
2.E2、P对间质细胞HB-EGF表达的影响:不同量浓度的E2、P均可促进间质细胞HB-EGF表达,而E2、P量浓度分别为10-7 mol/L和10-9 mol/L培养48 h作用时最明显,与对照组比较荧光强度值明显增大,P或E2+P的协同作用与对照组比较差异有显著意义(t=7.375,t=11.459,P<0.01)。见表1。
, http://www.100md.com
三、讨论
雌、孕激素可以促进大、小鼠子宫内膜上皮细胞和间质细胞HB-EGF的表达[5]。目前关于子宫内膜间质细胞表达HB-EGF的情况报道不一,Birdsall等1996年首次在人的整个月经周期子宫内膜上皮细胞和间质细胞检测到有HB-EGF蛋白的表达,并发现HB-EGF在种植窗期子宫内膜腔上皮细胞的高表达可能与介导胚泡着床有关。Yoo等[3]于1997年发现在子宫内膜增殖期间质细胞表达HB-EGF水平低,而在分泌期后表达升高。Leach等[4]则认为在增殖晚期和分泌早期间质细胞HB-EGF表达增强。
表1 雌、孕激素对间质细胞肝素结合表皮生长因子
表达的影响(荧光强度值,
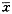 ±s) 组别
±s) 组别, 百拇医药
例数
不同培养时间肝素结合表皮生长因子的表达
24 h
48 h
对照组
8
399±137
403±141
雌二醇组
8
617±159*
979±197△
, 百拇医药
孕酮组
8
833±263*
1 208±276△
雌二醇+孕酮组
8
1 421±270**
1 674±281△**
注:雌二醇、孕酮量浓度分别为10-7 mol/L和10-9 mol/L;与对照组比较*t=2.964,P<0.05;△t=6.741,P<0.01;**t=11.459,P<0.01
, http://www.100md.com
子宫内膜间质细胞具有潜在的增殖和再分化能力,经卵巢甾体激素充分协调作用后子宫内膜一旦受到蜕膜反应原刺激,即可发生蜕膜样变,对于妊娠的建立和维持至关重要。本研究发现体外培养的间质细胞表达HB-EGF,E2、P均可促进其表达,且P或P+E2的协同作用明显大于E2。生理条件下间质细胞在P作用下增生、水肿、肥大,营养丰富,有利于胚泡着床。我们还用免疫组织化学方法研究证实增殖期子宫内膜间质细胞表达HB-EGF低,在分泌中期表达增强(另文报道),与体外培养P能促进子宫内膜间质细胞HB-EGF表达结果一致。亦有学者发现在人子宫内膜上皮细胞和间质细胞、胚泡细胞上有EGFR,HB-EGF可能通过自分泌或旁分泌的方式与受体结合发挥它的生物学作用。本研究结果提示,孕激素促进着床与维持早期妊娠的机制之一可能是通过增强HB-EGF表达进而促进间质细胞的增殖和蜕膜化来实现的。
参考文献
1,Raab G, Klagsbyun M. Heparin-binding EGF-like growth factor. Acta Biochem Biophys, 1997,1333:F179-199.
, http://www.100md.com
2,Stewart CL, Abbondanzo SL, Cullinan EB, et al. Regulation by maternally derived cytokines of pre-implantation development and uterine receptiveness. Contracept Fertil Sex, 1995,23:555-562.
3,Yoo HJ, Barlow DH, Mardon HJ. Temporal and spatial regulation of expression of heparin-binding eidermal growth factor-like growth factor in the human endometrium: a possible role in blastocyst implantation. Dev Genet, 1997,21:102-108.
4,Leach RE, Khalifa R, Ramirez ND, et al. Multiple roles for heparin-binding epidermal growth factor-like growth factor are sugested by its cell-specific expression during the human endometrial cycle and early placentation. J Clin Endocrinol Metab, 1999,84:3355-3363.
, http://www.100md.com
5,Zhang ZM, Laping J, Glasser S, et al. Mediators of estradial-stimulated mitosis in the rat uterine luminal epithelium. Endocrinology, 1998,139:961-966.
6,郭洪敏,杜靖远.17-雌二醇对新生大鼠成骨细胞增殖和分化的影响.中华妇产科杂志,1999,34:119-120.
7,Chegini N, Rossi MJ, Masterson BJ, et al. Platelet-derived growth factor (PDGF), epidermal growth factor (EGF), and EGF, and PDGF β-receptor in human endometrial tissue: localization and in vitro action. Endocrinology, 1992,130:2373-2378.
(收稿日期:1999-11-02), http://www.100md.com