内皮素-1预处理时大鼠心脏Gαq/11和Giα蛋白含量的变化
 |
 |
汪香婷;王瑾瑜;吴立玲(北京医科大学病理生理教研室;北京 100083);杨啸林;芦玲巧;张立克(首都医科大学病理生理教研室;北京 100054);孙银平(新乡医学院病理生理教研室;新乡 453003); 汪香婷;杨啸林;芦玲巧;张立克;孙银平;王瑾瑜;吴立玲
关键词:G蛋白;缺血-再灌注;缺血预处理;内皮素-1
摘要:探讨内皮素-1预处理和缺血预处理两种预处理方式与G蛋白有关的信号转导途径的异同。用0.5 nmol/ml内皮素-1左心室注射或夹闭左冠状动脉5 min/再灌5 min×2进行预处理, 然后两组均缺血60 min, 再灌30 min。观察心电变化, 免疫印迹法测定心脏Gαq/11和Giα2的含量。结果显示, 无论是内皮素-1预处理还是缺血预处理均明显减轻缺血再灌注性室性心律失常。与对照组相比, 缺血预处理组Gαp/11含量升77.8%(P<0.05), Giα2含量无明显改变。内皮素-1预处理组Gαq/11含量升高110.6%(P<0.01), Giα2含量下降31.0% (P<0.05) 。本研究结果提示, 激活Gαq/11蛋白是两种预处理对心肌产生保护作用的共同信号转导通路, 而Giα2蛋白在两种预处理中的作用方式有所不同。
, http://www.100md.com
缺血预处理(ischemic preconditioning, IP)是指经短暂缺血-再灌注(ischemia-reperfusion, IR)后心肌对随后较长时间缺血的耐受力增强, 损伤减轻。此现象已在人[1]及多种动物[2]实验中得到证实。但IP保护的机制尚未阐明, 可能涉及受体、G蛋白、蛋白激酶C (protein kinase C, PKC)和离子通道等多个环节。G蛋白作为联接多种细胞膜受体与选择性效应器之间信号转导的重要蛋白质, 是IP保护的信号转导通路之一。我们以前的工作表明, IR时Giα2含量明显升高, 心肌cAMP生成减少, 这是导致IR时腺甘酸环化酶(adenyl cyclase, AC)信号转导通路功能障碍及心功能异常的重要原因[3]。IP时, 通过激活Gαp/11增加磷脂酶C (phospholipase C, PLC)活性, 进而激活PKC, 可减轻缺血性心肌损伤[4]; Giα2不参与IP保护作用[5]。内皮素-1(endothelin-1, ET-1)预处理可显著缩小缺血心肌的损伤面积, 通过激活PKC产生心肌保护作用[6]。但ET-1预处理是否是通过G蛋白介导的信号转导途径而发挥心肌保护作用的有关报道甚少。本实验以ET-1和IP预处理大鼠为模型, 探讨在不同预处理方式中G蛋白依赖性信号转导途径的作用及其差异。
, 百拇医药
1 材料和方法
1.1 动物模型 健康雄性Wistar大鼠(280~350 g), 由首都医科大学动物部提供, 行戊巴比妥钠(45 mg/kg)腹腔麻醉, 肝素抗凝及人工呼吸。分离右侧颈动脉, 逆行插管至左心室, 经RM-6200C型四道生理记录仪持续监测Ⅱ导联心电图并输入计算机以存储、分析。开胸暴露心脏, 用4~0丝线环绕冠状动脉左前降支(LAD)根部以备用。以上步骤完成后, 等待5 min, 动物进入稳态后, 随机分为4组: (1)内皮素-1预处理组(ET-1组): 经颈动脉插管向左心室内缓慢注入0.5 nmol/ml ET-1(2.5 nmol/kg), 20 min后, 夹闭LAD 60 min, 再灌30 min; (2)缺血预处理组(IP组): 夹闭LAD 5 min/再灌5 min×2进行缺血预处理, 然后夹闭LAD 60 min, 再灌30 min; (3)缺血损伤组(IR组): 经颈动脉插管向左心室内缓慢注入与ET-1同体积生理盐水, 20 min后, 夹闭LAD 60 min, 再灌30 min; (4)对照组: 观察90 min。实验结束后取下左心室, 提取心肌细胞膜, 用Lowry 法测定膜蛋白含量后保存待用。计算缺血60 min时室性早博发生次数(ventricular extrasystole, VE), 室性心动过速发生率(ventricular tachycardia rate, VFr)及累计持续时间(ventricular tachycardia time, VTt),室颤发生率(ventricular fibrillation rate, VFr)及累计持续时间(ventricular fibrillation time, VTt)。并参照文献[7]标准, 按下述方法对室性心律失常(ventricular arrhythmias, VA)进行评分: (1)0级: 无室性心律失常或仅发生室性早搏且<5次; (2)1级: 仅发生室性早搏≥5次; (3)2级: 仅发生一阵室性心动过速且<60 s; (4)3级: 发生一阵≥60 s的室性心动过速, 或发生多阵室性心动过速但累积时间<60 s; (5)4级: 发生多阵室性心动过速且累积时间≥60 s; (6)5级: 可发生室颤, 但能够自动恢复; (7)6级: 出现不可恢复的室颤或在观察期内死亡。
, 百拇医药
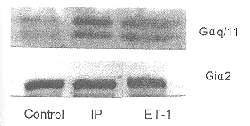
1.2 免疫印迹法测定大鼠心脏G蛋白含量 9% SDS-PAGE分离细胞膜蛋白, 用电转移方式将蛋白转移至硝酸纤维膜, 用含5%脱脂奶粉的PBS进行非特异性封闭, PBS冲洗后, 分别加入抗Gαq/11和Giα2亚单位抗体(购自Santa Cruz公司)4℃过夜。再用 0.1%Tween-PBS冲洗, 加入辣根过氧化物酶标记的二抗孵育, 冲洗后加入化学发光剂(购自Amersham公司)进行曝光。用LEICA-5501IW图像分析系统对所得区带的积分密度进行扫描。
1.3 统计学处理 各组数据均用均数±标准差(x±s)表示, 采用one-way ANOVA程序对组间差异进行统计学处理后用q检验进行两组间比较。P<0.05表示差异有显著性。
2 结果
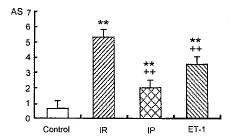
心律失常评分: 图1显示IR组(5.3±0.5)心律失常评分明显高于对照组(P<0.01)。IP组(2.0±0.9)和ET-1组(3.5±0.5)心律失常评分与IR组相比均显著降低 (P<0.01, P<0.01)。
, 百拇医药
心肌Gαq/11含量的变化: 免疫印迹杂交分析显示IR组Gαq/11含量无明显变化[4](结果未显示)。IP组和ET-1组Gαq/11含量较对照组分别增加77.8%(P<0.05)和110.6% (P<0.01)。IP组与ET-1组Gαq/11含量无明显差异(表1, 图2)。
图 1. 大鼠心律失常评分
Fig. 1. Arrhythmia score of rat ventricle (AS) (n=6, mean±SD). ~* * P<0.01 compared with control; ~+ + P<0.01 compared with IR.
心肌Giα2含量的变化: 与对照组相比, IR时Giα2含量显著增加[3](结果未显示), IP组Giα2含量无明显变化。ET-1预处理组Giα2含量下降, 分别比对照组和IP组减少31.0%(P<0.05)和40.1%(P<0.01) (表1, 图2)。
, 百拇医药
表 1. 缺血预处理和内皮素-1预处理大鼠心肌Gαq/11和Giα2蛋白含量变化
Table 1. Alterations of Gαq/11 and Giα2 proteins in rat myo~cardium during IP and ET-1 treatment
Groups
Gαq/11
Giα2
Control
21.54±2.86
41.67±2.90
IP
, 百拇医药
38.30±16.76*
48.40±13.76
ET-1
45.35±13.71* *
28.71±7.38* + +
n=5, mean±SD. ~* P<0.05,~* * P<0.01, compared with control; ~+ + P<0.01, compared with IP.
图 2. 免疫印迹法测定大鼠心脏Gαq/11和Giα2蛋白
, http://www.100md.com Fig. 2. Western blot analysis of Gαq/11 and Giα2 proteins in rat heart
3 讨论 大量的动物实验和临床观察已充分肯定了预处理的保护作用[1,2]。预处理对心脏的保护作用可表现为心肌梗塞范围减小、心律失常的发生率和严重程度降低以及心功能改善等。预处有多种诱导方式, 包括IP、缺氧预处理、热休克预处理和药物预处理等。药物预处理是指运用一些药物给心脏一个微小的外界损伤性刺激, 诱发心肌产生适应性的、内源性的调控保护。常用的药物有腺苷A1受体激动剂、毒蕈碱M2受体激动剂、α-受体激动剂和ET-1等。药物预处理由于处理方法简单易行, 而且便于控制剂量, 在各种预处理心肌保护措施中有着良好的临床应用前景。但预处理保护的机制尚未阐明, 可能是受体、G蛋白、PKC和离子通道等多环节、多途径共同作用的结果。许多研究资料表明, 预处理时PKC表达增加, 应用PKC抑制剂可减弱或消除预处理对心肌的保护作用。这提示PKC活化可能是各种预处理保护的共同机制[6,8,9]。ET-1预处理可模拟IP的保护作用, 其保护机制与激活PKC和KATP通道有关[6]。抑制PKC活性或应用ET受体阻断剂可阻断ET-1预处理对, 图2)。
, 百拇医药
表 1. 缺血预处理和内皮素-1预处理大鼠心肌Gαq/11和Giα2蛋白含量变化
Table 1. Alterations of Gαq/11 and Giα2 proteins in rat myo~cardium during IP and ET-1 treatment
Groups
Gαq/11
Giα2
Control
21.54±2.86
41.67±2.90
IP
, 百拇医药
38.30±16.76*
48.40±13.76
ET-1
45.35±13.71* *
28.71±7.38* + +
n=5, mean±SD. ~* P<0.05,~*
* P<0.01, compared with control; ~+ + P<0.01, compared with IP.
图 2. 免疫印迹法测定大鼠心脏Gαq/11和Giα2蛋白
, http://www.100md.com
Fig. 2. Western blot analysis of Gαq/11 and Giα2 proteins in rat heart
3 讨论 大量的动物实验和临床观察已充分肯定了预处理的保护作用[1,2]。预处理对心脏的保护作用可表现为心肌梗塞范围减小、心律失常的发生率和严重程度降低以及心功能改善等。预处有多种诱导方式, 包括IP、缺氧预处理、热休克预处理和药物预处理等。药物预处理是指运用一些药物给心脏一个微小的外界损伤性刺激, 诱发心肌产生适应性的、内源性的调控保护。常用的药物有腺苷A1受体激动剂、毒蕈碱M2受体激动剂、α-T-1预处理亦不是通过激活Gi介导的信号转导通路而产生心肌保护作用的。但ET-1预处理时Gi表达下降的意义和机制还需进一步探讨。
综上所述, 通过Gαq/11蛋白激活PKC是ET-1预处理和IP两种预处理对心肌产生保护作用的共同机制; 与IP不同的是, Giα2蛋白可能在ET-1预处理时发挥着一定作用。
, 百拇医药
Supported by the foundation of Beijing Municipal Health Bureau
汪香婷,Corresponding author. Tel: 010-62091403;E-mail:wxt@mail.bjmu.edu.cn
汪香婷(北京医科大学病理生理教研室, 北京 100083)
王瑾瑜(北京医科大学病理生理教研室, 北京 100083)
吴立玲(北京医科大学病理生理教研室, 北京 100083)
杨啸林(首都医科大学病理生理教研室, 北京 100054)
芦玲巧(首都医科大学病理生理教研室, 北京 100054)
, http://www.100md.com
张立克(首都医科大学病理生理教研室, 北京 100054)
孙银平(新乡医学院病理生理教研室, 新乡 453003)
参 考 文 献
[1]Yellon DM, Alkhulaifi AM, Pugsley WB. Preconditioning the human myocardium. Lancet, 1993, 342: 276~277.
[2]Okubo S, Xi L, Bernardo NL et al. Myocardial pre~con~di~tioning: basic concepts and potential mechanisms. Mol Cell Biochem, 1999, 196: 3~12.
[3]Wang Y (王 瑶), Wu LL (吴立玲), Ge MZ (葛明珠). Alterations of cardiac Gi protein alpha subunits during ischemia-reperfusion in rats. Acta Physiol Sin (生理学报), 1998, 50 (5): 514~518 (in Chinese with English abstract).
, 百拇医药
[4]Wu LL(吴立玲), Wang Y (王 瑶), Wang YM (王岩眉) et al. The role of Gαq/11 protein during ischemia-re~per~fu~sion and ischemic preconditioning. Natl Med J Chin (中华医学杂志), 1999, 79: 146~147 (in Chinese).
[5]Wang Y (王 瑶), Wu LL (吴立玲), Luo J (罗 婕) et al. Effects of cardiac Giα2 and Giα3 proteins during ischemic preconditioning. J Beijing Med Univ (北京医科大学学报), 1998, 30: 333~334 (in Chinese with English abstract).
[6]Bugge E, Ytrehus K. Endothelin-1 can reduce infarct size through protein kinase C and KATP channels in the isolated rat heart. Cardiovasc Res, 1996, 32: 920~929.
, 百拇医药
[7]Zhang LK (张立克), Wang W (王 雯), Chen RF (陈瑞芬). Effect of cytochrome p450 on myocardial ischemia/reperfusion injury in rats. Chin J Pathophysiol (中国病理生理杂志), 1999, 15 (6): 518~521 (in Chinese with English abstract).
[8]Bugge E, Ytrehus K. Ischaemic preconditioning is protein kinase C dependent but not through stimulation of alpha adrenergic or adenosine receptors in the isolated rat heart. Cardiovasc Res, 1995, 29: 401~406.
[9]Downey JM, Cohen MV, Ytrehus K et al. Cellular mech~a~nisms in ischemic preconditioning: the role of adenosine and protein kinase C. Ann NY Acad Sci, 1994, 723: 82~98.
, 百拇医药
[10]Takigawa M, Sakurai T, Kasuya Y et al. Molecular iden~tifi~cation of guanine-nucleotide-binding regulatory proteins which couple to endothelin receptors. Eur J Biochem, 1995, 228: 102~108.
[11]Johnson MD, Friedmanm E. G protein in cardiovascular func~tion and dysfunction. Biochem Pharmacol, 1993, 45: 2365~2372.
[12]Thornton J, Liu G, Downey J. Pretreatment with pertussis toxin blocks the protective effects of preconditioning: evidence for a G-protein mechanism. J Mol Cell Cardiol, 1993, 25: 311~320.
[13]Lauson CS, Cotart DJ, Hearse DJ. The antiarrhythmic action of ischemic preconditioning in rat hearts does not involve functional Gi proteins. Cardiovasc Res, 1993, 27: 681~687.
Received2000-03-20l;Accepted 2000-06-27, 百拇医药