不同功能位点介导α干扰素的免疫调节和中枢镇痛作用
 |
 |
 |
王云霞;蒋春雷;宋连霞;路长林;邵小燕;由振东;黄爱军(第二军医大学神经生物学教研室、 神经科学研究所; 上海 200433);崔瑞耀(青岛医学院病理生理学教研室; 青岛 266021);刘新垣(中国科学院上海生物化学研究所; 上海 200031) 王云霞;蒋春雷;宋连霞;路长林;邵小燕;由振东;黄爱军;崔瑞耀;刘新垣
关键词:α干扰素;基因定点突变;功能位点;阿片受体;痛阈
摘要:细胞因子α干扰素(IFNα)具有中枢镇痛作用。抗内源性阿片肽血清与IFNα能发生明显的交叉反应, 提示IFNα与内源性阿片肽之间存在着共同的抗原决定基。采用基因定点突变技术, 获得系列IFNα突变体, 并分别测定其免疫学活性和镇痛能力。结果显示, IFNα突变体Y129S-IFNα免疫学活性显著下降, 但仍然保留了很强的镇痛能力, 阿片受体拮抗剂纳洛酮能够阻断Y129S-IFNα的镇痛作用。实验结果表明, IFNα分子存在着相互独立的免疫和镇痛两个功能位点, 分别介导免疫调节作用和中枢镇痛作用。结果还提示, IFNα的免疫调节和中枢镇痛作用可能是由不同的受体途径介导的。
, 百拇医药
10余年来, 愈来愈多的证据表明, 免疫系统与中枢神经系统之间存在着相互联系和相互作用。IFNα不仅是重要的免疫调节因子, 而且具有重要的中枢调节作用[1]。Blalock等的研究提示, IFNα与内啡肽之间存在着结构的同源性和功能的交叉[2]。我们以往的工作表明, IFNα的镇痛作用与阿片受体有关, 而且是由μ阿片受体所介导[3]。本实验旨在利用基因定点突变技术, 有目的地改变IFNα的基因和分子结构, 获得系列IFNα的突变体, 测定其抗病毒活性和中枢镇痛能力, 以期研究IFNα发挥中枢镇痛作用的结构基础及可能的受体机制。
1 材料和方法
1.1 菌种和质粒 重组人IFNα2b基因及表达质粒由中国科学院上海生物化学研究所研制, PUC118、 PUC119购自华美生物工程公司, E. coli DH5α由本室提供。
1.2 试剂 限制性内切酶、 Taq酶和其它工具酶购自Boehringer Mannheim公司,其余均为分析纯试剂。
, 百拇医药
1.3 基因定点突变和表达 基因定点突变参照White的方法[4]进行。以包括拟突变位点在内的突变位点两侧IFNα基因为模板, 采用PCR方法扩增出两个PCR产物, 它们的序列在拟突变位点区相互重叠。两个PCR产物与各自的引物分离后混合, 经过变性、 退火, 各有一条链在3′末端相互发生重叠, 然后以这一异源杂合双链为模板, 进行PCR扩增, 获得IFNα的突变基因。
各突变的IFNα基因经测序后, 与表达质粒连接, 获得的突变质粒转入DH5α菌, 表达后收集菌体, IFNα及其突变体按华新生物高技术有限公司建立的方法(亲和层析)进行纯化。
1.4 IFNα的免疫学(抗病毒)活性测定 采用细胞病变抑制法进行IFNα的活性测定[5], 本实验使用Wish细胞(由中国药品生物制品检定所提供)和VSV病毒, 干扰素标准品用国家标准品9403。
1.5 侧脑室埋管及用药 采用的健康雄性SD大鼠(160~180 g)由上海计划生育科学研究所、 西普尔-必凯公司提供, 每组7~10只。动物麻醉后, 采用平颅头位固定于江湾I-C型脑立体定位仪上, 按B1.0, L1.6, H3.5坐标埋植不锈钢导管(外径0.6 mm)于侧脑室中, 术后3~5 d进行测痛实验。IFNα及其突变体以8 pmol/5 μl剂量, 纳洛酮(Sigma)以200 pmol/5 μl剂量于注射IFNα前10 min给药, 同体积的生理盐水作为阴性对照。
, http://www.100md.com
1.6 痛阈测定 测痛仪购自北京海淀电子仪器厂(WQ-9E型)。采用直接电刺激法(即将电极插入距尾根部2~3 cm处的大鼠尾部皮下)引起甩尾反应为指标, 测定痛阈和基础痛阈, 并计算痛阈变化百分率=(痛阈-基础痛阈)/基础痛阈×100%。
1.7 交叉反应 抗内源性阿片肽(β-内啡肽、 强啡肽A1~13、 亮氨酸-脑啡肽)血清(Peninsula Lab. Inc., USA)与IFNα的交叉反应采用间接ELISA进行[6]。IFNα的包被浓度为4 μg/ml, 设立阴性、 阳性和空白对照。
1.8 统计处理方法 平均数±标准差和t检验为统计处理方法。
2 结果
2.1 IFNα突变体的制备
每一突变体先合成4条引物, 以IFNα基因为模板, 采用PCR方法扩增出两个3′末端相互重叠PCR产物, 经变性、 退火, 再以这一异源杂合双链为模板, 进行PCR扩增后, 进行DNA序列测定, 筛选出Y85S-IFNα、 Y89S-IFNα、 Y129S-IFNα、 Y135S-IFNα 4种IFNα突变基因, 即分别将编码入IFNα2b第85、 89、 129和135位Tyr残基的TAC、 TAC、 TAT和TAC突变为编码Ser的TCC。将突变体基因插入表达载体中, 在E. coli DH5α中获得表达, 并将它们纯化, 纯度达95%以上。
, http://www.100md.com
2.2 IFNα及其突变体的抗病毒活性
将纯化的IFNα及其突变体同时测定抗病毒活性, 并计算其比活性, 结果见表1。
表 1. 天然重组IFNα及其突变体的抗病毒活性
Table 1. The anti-viral activities of wild type IFNα and its mutants
IFNα and its
mutants
Anti-viral activities
(×106 U/mg)
, http://www.100md.com Anti-viral activities
(% of wild type)
IFNα
56.0
100
Y85S-IFNα
22.9
40.9
Y89S-IFNα
30.2
53.9
Y129S-IFNα
, http://www.100md.com
2.7
4.8
Y135S-IFNα
46.6
83.2
2.3 IFNα及其突变体对大鼠痛阈的影响
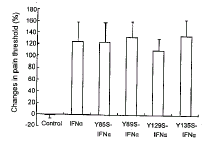
IFNα及其4种突变体Y85S-IFNα、 Y89S-IFNα、 Y129S-IFNα、 Y135S-IFNα侧脑室注射对大鼠痛阈影响的结果见图1 (IFNα注射后20 min)。Y85S-IFNα、 Y89S-IFNα、 Y129S-IFNα、 Y135S-IFNα均能显著提高大鼠的痛阈, 并与天然重组IFNα无显著性差异。
图 1. 天然重组IFNα及其突变体的中枢镇痛作用
, 百拇医药
Fig.1. The analgesic effect of IFNα and its mutants.
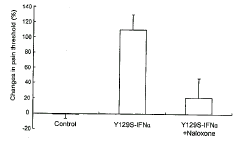
2.4 纳洛酮对IFNα突变体Y129S-IFNα镇痛作用的影响
如图2所示, IFNα注射后20 min, 阿片受体拮抗剂纳洛酮能够有效地阻断Y129S-IFNα提高大鼠痛阈的作用(P<0.01: Y129S-IFNα vs IFNα)。
图 2. 纳洛酮对IFNα突变体Y129S-IFNα镇痛作用的影响
Fig.2. Effect of naloxone on the analgesic effect of IFNα mutant (Y129S-IFNα).
图 3. 抗阿片肽抗血清与IFNα的交叉反应
, 百拇医药
Fig.3. The cross reactivity between IFNα and anti-opioid sera.
2.5 抗阿片肽抗血清与IFNα的交叉反应
用间接ELISA显示(图3), 3种抗阿片肽血清(抗β-内啡肽血清, AEPS; 抗亮啡肽血清, ALEKS; 抗强啡肽血清, ADYNS)与IFNα之间都有明显的交叉反应(P<0.05: ALEKS vs control; P<0.01: AEPS and ADYNS vs control)。
3 讨论
细胞因子在免疫系统和中枢神经系统的双向关系中起重要的调节作用。我们曾报道IFNα具有镇痛作用, 而且IFNα的中枢镇痛作用是由μ阿片受体所介导。
IFNα的4个突变体的免疫学活性均低于野生型, 但其镇痛作用与野生型无明显差别, 尤其是IFNα第129Tyr残基突变为Ser后(129Ser-IFNα), 其免疫学活性只有天然重组IFNα的4.8%, 但仍然保留了很强的镇痛活性。结果表明, IFNα第129Tyr残基是免疫学活性所必须的, 但与中枢镇痛作用无明显关系。这一结果同时还表明, IFNα存在着与免疫调节功能位点相互独立的镇痛功能位点, 它们分别介导免疫(抗病毒)调节作用和中枢镇痛作用, 即α干扰素分子具有介导免疫调节和中枢镇痛作用相互独立的结构基础。
, http://www.100md.com
IFNα突变体Y129S-IFNα的免疫学活性基本丧失, 而其保留的镇痛活性又能被阿片受体拮抗剂纳洛酮所阻断, 这表明IFNα的镇痛作用和免疫调节作用是通过不同的受体途径实现的。我们曾报道, 纳洛酮可以阻断IFNα的镇痛作用, 表明镇痛作用与阿片受体有关, 但这可能是IFNα直接作用于阿片受体, 也可能是IFNα引起内源性阿片肽等的释放, 从而继发地作用于阿片受体, 即通过间接作用途径。纳洛酮可以阻断129Ser-IFNα的镇痛作用, 基本上可以排除这一间接作用途径, 而进一步提示IFNα可能直接作用于阿片受体发挥镇痛作用。这是因为129Ser-IFNα已没有免疫调节作用, 因而可以排除129Ser-IFNα与IFNα受体相结合, 继发性引起内源性阿片肽提高等所致的作用。
内源性阿片肽分子一级结构有一共同的特征, 即其N端为Tyr-χ-χ-Phe结构, 其中Tyr残基是其镇痛活性所必须的。细胞因子白细胞介素-2通过空间折叠, 形成一具有类似于内源性阿片肽N端特征的结构而介导中枢镇痛作用[7, 8]。本实验结果显示, 抗内源性阿片肽血清与IFNα能发生明显的交叉反应, 提示IFNα与阿片肽分子之间存在着共同的抗原决定基。由此推测, IFNα中很可能存在着一个类似于内源性阿片肽样的分子结构, 此结构可介导IFNα的镇痛作用。对IFNα镇痛功能位点的分子结构正在做进一步研究。
, 百拇医药
我们曾提出细胞因子神经调节作用的分子机制和神经系统与免疫系统相互作用分子机制的新假说, 认为生物活性物质的多功能位点是神经与免疫系统相互联系的结构基础之一[7,8], 本研究结果进一步验证了这一假说。
This work was supported by Shanghai Educational Development Foundation (97SG16) and National Natural Science Foundation of China (39570669).
Corresponding author. Department of Neurobiology, Institute of Neuroscience, Second Military Medical University, 800 Xiangyin Road, Shanghai 200433. Tel: 021-25070294×8607; Fax: 21-65492132; E-mail: jiangclk@online.sh.cn
, 百拇医药
王云霞(第二军医大学神经生物学教研室、 神经科学研究所, 上海 200433)(青岛医学院病理生理学教研室, 青岛 266021)
蒋春雷(第二军医大学神经生物学教研室、 神经科学研究所, 上海 200433)
宋连霞(第二军医大学神经生物学教研室、 神经科学研究所, 上海 200433)(青岛医学院病理生理学教研室, 青岛 266021)
路长林(第二军医大学神经生物学教研室、 神经科学研究所, 上海 200433)
邵小燕(中国科学院上海生物化学研究所, 上海 200031)
由振东(第二军医大学神经生物学教研室、 神经科学研究所, 上海 200433)
黄爱军(第二军医大学神经生物学教研室、 神经科学研究所, 上海 200433)
, 百拇医药
崔瑞耀(青岛医学院病理生理学教研室, 青岛 266021)
刘新垣(中国科学院上海生物化学研究所, 上海 200031)
参 考 文 献
[1] Dafny N. Is interferon-alpha a neuromodulator? Brain Res Rev, 1998, 26: 1~15.
[2] Blalock JE, Smith EM. Human leukocyte interferon: Struc~tural and biological relatedness to adrenocorticotropic hormone and endorphins. Proc Natl Acad Sci USA, 1980, 77: 5972~5974.
, 百拇医药
[3] Song LX (宋连霞), Jiang CL (蒋春雷), Lu CL (路长林) et al. The central analgesic effect of interferon-α. Chin J Neurosci (中国神经科学杂志), 1999, 15 (2): 131~133 (in Chinese with English abstract).
[4] White BA. PCR Cloning Protocols. New Jersey: Humana Press, 1997, 141~149.
[5] 侯云德. 干扰素及其临床应用, 第1版. 北京:人民卫生出版社, 1981, 159~165.
[6] 章谷生, 容秉培. 单克隆抗体在医学上的应用, 第1版. 上海: 上海科学技术出版社, 1987, 357~361.
, http://www.100md.com
[7] Jiang CL, Lu CL, Liu XY. Multiple actions of cytokines on the CNS. Trends Neurosci, 1995, 18: 296.
[8] Jiang CL, Lu CL, Liu XY. The molecular basis for bidi~rec~tional communication between the immune and neuro~endocrine systems. Domest Anim Endocrinol, 1998, 15 (5): 363~369.
Received 1999-09-13 Revised 2000-01-21, 百拇医药