bFGF与BDNF对损伤后成年小鼠离体培养嗅觉上皮细胞发育的影响
 |
 |
 |
 |
美国路易斯维尔大学医学院解剖科学和神经生物学系; 美国 张晓东;郭占芳;刘宁;F.J.ROISEN
关键词:嗅觉上皮;碱性成纤维细胞生长因子;脑源神经营养因子;免疫细胞化学
摘要:
在成熟神经系统中
在成熟神经系统中, 嗅觉上皮(OE)很特殊, 它能不断产生新的神经元。本文用细胞培养、 组织化学和免疫细胞化学技术对成年小鼠的OE进行了研究。 实验显示: 双极细胞NF、NSE、MAP2、OMP和tau蛋白免疫染色为阳性, 但keratin免疫染色为阴性, 说明双极细胞是神经元。用不同浓度血清的培养基, 离体培养成年小鼠的OE, 观察碱性成纤维细胞生长因子(bFGF) 和脑源神经营养因子(BDNF)对OE细胞数量和突起发育的影响。结果显示: 将bFGF与BDNF的组合分别加到10%和5%血清的OE培养基(OEM)中, 增加了双极细胞的数量和比例, 刺激了双极细胞突起的发育, 减少了大细胞和梭形细胞。这种组合的效果比bFGF或BDNF单独作用好。在10%血清的OEM中, 神经营养因子的效果比在5%血清的OEM中好。
, http://www.100md.com
在成年神经系统中, 大多数神经元是完全分化的, 一旦损伤便不能再生。而嗅觉上皮(olfactory epithelium, OE)很特殊, 它能够在一生中不断产生新的神经元[5,20]。OE是一种假复层柱状上皮, 包含嗅神经元、 支持细胞和基底细胞。基底细胞能产生嗅神经元和嗅鞘细胞。嗅神经元伸出一根短树突到上皮游离面形成嗅泡, 嗅泡内含有嗅觉受体, 并伸出一根长轴突到嗅球[6] 。
OE细胞增殖速度可以通过手术创伤或化学损伤而改变。研究证明疾病或创伤能影响OE细胞中一些蛋白的表达。例如, Alzheimer病患者OE中的淀粉样蛋白前体的加工过程发生改变[22]; 人类神经疾病能增加OE细胞中神经细丝亚单位的表达[18]。
以前实验显示, 硫酸锌(ZnSO4)创伤能刺激离体和在体的成年小鼠OE基底细胞的分裂活性。培养的OE 包括双极细胞、 窝细胞、 梭形细胞及大细胞[17]。一些研究报道, 胚胎或新生大鼠、 小鼠、 鸡和人的分散的OE细胞[1,4,10,15,16,19], 能成功地离体培养1周[2]到1年[19], 其中的一部分细胞能表达许多神经元抗原, 包括神经细胞粘着分子(neural cell adhesion molecule, N-CAM), 神经元特有微管蛋白(neuron-specific tubulin, NST), 微管相关蛋白-5(microtubule-associated protein-5, MAP5), 神经丝蛋白(neurofilament protein, NF), 生长相关蛋白-43(growth-associated protein 43, GAP-43)和神经元特异烯醇化酶(neuron-specific enolase, NSE)[1,4,14,16,19,20]。只有5%的嗅神经元表达嗅觉标记蛋白(olfactory marker protein, OMP), 这种蛋白仅存于成熟的嗅神经元中[19]。而另一些嗅神经元在离体培养时却表达胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP, 星形胶质细胞标记物)[23], 表明这些细胞并没有完全分化。
, http://www.100md.com
单独应用或组合应用神经营养因子(neurotrophic factors, NTFs)能加强离体和在体生长的OE细胞增殖和分化。例如, 神经生长因子(nerve growth factor, NGF)、 碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、 白介素-1β(interleukin-1β)和白介素-6的组合能刺激离体人的嗅神经元突起生长[20]。有报道, 脑源神经营养因子(brain-derived neurotrophic factor, BDNF)能增强在体和离体神经元的生存; 成纤维细胞生长因子(fibroblast growth factors, FGFs)能刺激离体胚胎OE中嗅神经元前体细胞的分化[7]。
本研究目的在于观察bFGF和BDNF对离体培养OE中各种细胞的数量和双极细胞突起长度的影响。
1 材料和方法
, http://www.100md.com 1.1 ZnSO4 处理和细胞培养 每次实验, 至少有6只2~3月龄、 体重20~24 g的小鼠(Charles River, Wilmington, MA, USA)用ZnSO4处理, 重复3次。处理及细胞培养方法如前所述[17], 作以下改进: (1) 鼻滴时间延长到30 min, 以确保OE充分浸润; (2)当胰酶被OE培养基(OE medium, OEM)失活后, 将分散的细胞液离心, 弃上清液; 加入OEM, 再次离心; (3)将OE细胞分别接种到5%血清OEM和10%血清的OEM上; (4)离体培养1 d后, 1.5 ml OEM加到每个盒内的盖玻片上, 无需去除旧培养基。每5天换1次培养基。
所有培养基成分都购自GIBCO公司(Grand Island, NY, USA)。 在开始的研究中, 对培养的活OE作慢转速摄影后用普通转速放映的录像分析。
1.2 免疫组化研究 方法同前所述[17], 作以下改进: 阻断用2%的牛血清白蛋白 (bovine serum albumin, BSA) (Sigma, USA), 一抗和二抗都稀释在2% BSA中。一抗包括: (1)单克隆抗体: 抗肌动蛋白 (anti-actin,1∶200, Boehringer Monnheim, USA),抗GFAP (1∶4, Soehringer), 抗低亲和力神经生长因子受体 (p75NGFr)(1∶10, Sigma), 抗有丝分裂活化蛋白激酶-2 (MAP2) (1∶250, Boehrunger), 抗微管蛋白(tubulin, 1∶50, Amersham, USA); (2)多克隆抗体: 抗GFAP (1∶20, Dako, USA), 抗角蛋白 keratin (1∶20, Sigma), 抗NF 200 kD (NF200, 1∶100, Sigma), 抗NSE (1∶50, Incstar, Still Water, USA), 抗OMP (Frank Margolis博士自制、 赠送), 抗-tau (1∶100, Chemicon), 抗-tubulin (1∶20, ICN, Costa Mesa, USA)
, http://www.100md.com
1.3 bFGF和BDNF对培养OE的影响 OE离体培养第3天, 将BDNF、 bFGF或bFGF与BDNF的组合分别加到5%血清的OEM及10%血清的OEM中, 并一直保持直到固定用于免疫荧光。所有药剂的浓度(ng/ml): BDNF(Intergen, USA) 100, bFGF (Boehringer) 50。 bFGF与BDNF的组合: bFGF 50 ng/ml, BDNF100 ng/ml。
培养的OE分成8组: (5%)对照组(在5%血清OEM中), (5%)bFGF组(在5%血清OEM中加入bFGF), (5%) BDNF组 (在5%血清OEM中加入BDNF), (5%) bFGF与BDNF组合组(在5%血清OEM中加入bFGF和 BDNF); (10%)对照组(在10%血清OEM中), (10%)bFGF组 (在10%血清OEM中加入bFGF), (10%) BDNF组 (在10%血清OEM中加入BDNF), (10%) bFGF 与 BDNF组合组 (在10%血清OEM中加入bFGF和 BDNF)。
, 百拇医药
培养6、 9、 14 d后, 在每片5个随机视野中计算每种细胞的细胞数并测量双极细胞的长、 短突起长度(用目测微尺和台测微尺), 每组3片, 结果用 ±s表示, 并作t-test分析。
用bFGF 与BDNF组合处理过的培养OE细胞, 先用细胞荧光追踪剂DiI(Molecular Probes, Eugene, Oregon, USA)处理(DiI浓度: 8 μg/ml), 然后移植入大鼠脊髓中, 7 d后对移植处脊髓做冰冻切片并在荧光显微镜下观察。
2 结果
2.1 离体培养的OE
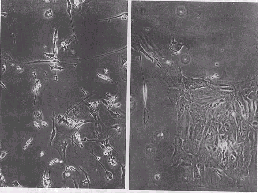
培养的OE由不同形态的细胞所组成。在培养第1~3天, 可观察到大量的细胞碎片、 圆形细胞、 扁多角形细胞及一些成群的上皮细胞。这些成群上皮细胞被称作“窝形”细胞。一些纺锤形细胞先伸出一根突起, 然后再伸出第二根突起, 形成双极细胞。培养5 d后, 双极细胞、 窝形细胞、 大细胞和梭形成细胞可区分开来(图1A~C, 见196页)。对培养的活OE作慢转速摄影后用普通转速放映的录像分析显示, 一些梭形细胞长出突起形成双极细胞, 而大细胞将核、 质移到一边, 最后形成梭形的双极细胞。
, http://www.100md.com
2.2 离体培养OE的免疫组化特征
窝形细胞呈keratin免疫染色阳性, 细胞中围绕核的细丝染色极强, 这表明窝形细胞具有上皮特征。同时, 窝形细胞也呈actin、 tubulin染色阳性;但 对NF200、 GFAP、 OMP及其它神经元特有抗体都呈免疫反应阴性。窝形细胞在培养的OE中一直生长, 成群的细胞数越来越多, 在培养的盖玻片上占很大的区域。这显示窝形细胞的分裂能力极强 (图1D)。
图 1. ZnSO4处理4 d后的离体培养成年小鼠的OE
Fig.1. Mouse adult olfactory epithelia cultured in vitro 4 days after an in situ ZnSO4 treatment. 110×, phase contrast optics. A. Four major cell types: bipolar, nest, fusiform and giant cells in 10% serum OE medium (OEM) with the addition of the combination of bFGF and BDNF, in 6 DIV. B. Showing many more cells in 10% serum OEM with the addition of the combination of bFGF and BDNF, in 9 DIV. C. The bipolar cells that usually exhibit asymmetric process development with a short and a long process in 10% serum OEM with the addition of the combination of bFGF and BDNF, in 14 DIV. D.The nest cell keeping the mitotic activity in 10% serum OEM with the addition of combined bFGF and BDNF, in 14 DIV.
, http://www.100md.com
一些大细胞呈actin、 tubulin免疫染色阳性反应; 另外少量大细胞对GFAP染色为阳性而对神经元特有抗体染色为阴性。
一些双极细胞的核周部及突起可见NF200 免疫染色阳性, 在高分辨共聚焦显微镜下胞质中可见OMP染色阳性的环形结构。同时, 50%以上双极细胞NSE、 MAP2、 tau蛋白免疫染色阳性, 其染色分布同NF200; 而GFAP、 keratin、 p75NGFr染色阴性。
2.3 bFGF和BDNF对离体培养OE细胞数的影响
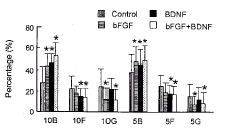
培养6~14 d后, 在(10%)bFGF组、 (10%)BDNF组、 (10%)bFGF与BDNF组合组中, 双极细胞数均比(10%)对照组明显增加(P<0.05)。双极细胞在(10%)bFGF与BDNF组合组中, 从7.1/mm2(对照组)增加到 22.3/mm2 (P<0.05), 它在细胞总数中的比例从对照组的28.1%上升到52.6% (P<0.05)(图3); 其中, (10%)bFGF与BDNF组合组中双极细胞又比(10%)bFGF组或(10%)BDNF组明显增加 (P<0.05) (图2), 而大细胞的比例却从对照组的24.1%减到11.1% (P<0.05)、 梭形细胞从22.1%减到13.7% (P<0.05) (图3)。
, 百拇医药
图 2. 10%血清OEM中培养6~14 d后的细胞数
Fig.2. Number of cells in 10% serum OEM after 6~14 d in vitro (DIV) culture. B: bipolar cell; N: nest cell; F: fusiform cell; G: giant cell; O: other cell; T: total cell. *P<0.05 vs control.
图 3. 10%血清OEM和5%血清OEM中培养6~14 d后细胞的比例
Fig.3. Percentage of cells in 10% serum OEM and 5% serum OEM after 6~14 DIV culture. B: bipolar cell; F: fusiform cell; G: giant cell; 10: in 10% serum OEM; 5: in 5% serum OEM.
, 百拇医药
培养6~14 d后, (5%)bFGF组、 (5%)BDNF组和 (5%) bFGF 与 BDNF组合组的双极细胞数均比(5%)对照组明显增加(P<0.05)。而(5%) bFGF与 BDNF组合组的双极细胞数又比(5%)bFGF组或 (5%)BDNF组明显增加(P<0.05)(图4)。
对比两种不同血清浓度的培养条件, 发现不论单独加bFGF或BDNF, 或加两者的组合, 在10%血清 OEM 中培养的各种细胞数 [除加BDNF时的梭形细胞和(10%)对照组中双极细胞以外]均比在5%血清OEM中培养的明显增多(对比图2和图4)。
图 4. 5%血清OEM中培养6~14 d后的细胞数
Fig.4. Number of cells in 5% serum OEM after 6~14 DIV culture.
用bFGF 与BDNF组合处理过的培养OE细胞, 先用荧光追踪剂DiI处理, 然后移植入大鼠脊髓中, 首次在冰冻切片中找到一些发荧光的OE细胞。
, 百拇医药
2.4 bFGF和BDNF 对离体培养的OE 中双极细胞突起发育的影响
培养6~14 d后, 在含10%血清的OEM中双极细胞, 长、 短突起在(10%)bFGF组中比(10%)对照组增长40.3% (P<0.05); (10%)bFGF与BDNF组合组比(10%)对照组增长38.8% (P<0.05); 而BDNF对双极细胞无明显影响(表1)。双极细胞突起长度在(10%)bFGF组中与在(10%)bFGF与BDNF组合组相比, 无明显差别。
培养6~14 d后, (5%)bFGF组双极细胞短突起长度、 长突起长度比(5%)对照组明显增长(P<0.05)。 双极细胞长、 短突起长度在(5%)bFGF与BDNF组合组中也比(5%)对照组明显增长(P<0.05); 但BDNF对双极细胞突起发育无明显影响(表1)。
对比两种不同血清浓度的培养条件, 发现在10%血清的OEM条件下, 各组双极细胞长突起的长度[除(10%)对照组以外]均比5%血清的OEM条件下相对应的各组明显增长 (P<0.05); 而双极细胞短突起的长度在(10%) bFGF与BDNF组合组中比对应的(5%)bFGF与BDNF组合组明显增长(P<0.05)。
, http://www.100md.com
表 1. 培养6~14 d后双极细胞的突起长度
Table 1. Length of the bipolar cell processes (μm) after 6~14 DIV culture
Short process
Long process
Total length
10%
5%
10%
5%
10%
, http://www.100md.com
5%
Control
20.6±0.6
20.7±0.6
50.5±1.1
46.2±1.0
71.2±1.3
66.9±1.3
bFGF
28.9±1.0*
25.8±0.9*
74.6±1.8*
, 百拇医药
60.3±1.5*
103.5±2.4*
86.1±2.0*
BDNF
21.2±0.6
20.9±0.6
50.2±1.1
45.2±0.9
71.4±1.3
66.2±1.3
bFGF-BDNF
, 百拇医药
28.6±0.8*
24.0±0.8*
71.5±1.6*
56.1±1.3*
100.1±2.0*
80.1±1.9*
Data presented as mean±SD. 10% or 5%: 10% or 5% serum OEM. ~*P<0.05 vs control.
3 讨论
本实验离体培养的OE中, 50%以上双极细胞NF、 NSE、 MAP2、 OMP和tau蛋白免疫染色为阳性, 但keratin免疫染色为阴性。其中NF蛋白被认为是神经元的标志, tau蛋白和MAP2的分布是神经元成熟的指标, 说明这些双极细胞为神经元。然而, 以前研究显示, 少量双极细胞GFAP和p75NGFr免疫染色阳性, 而p75NGFr与嗅觉系统中嗅鞘细胞有关[11]。还有报道嗅鞘细胞是来源于正常OE中的前体细胞[4], 它们和双极细胞形态相似[3,8], 这些研究提示一些双极细胞并非完全分化, 也可能一些双极细胞是嗅鞘细胞。
, http://www.100md.com
已有报道, BDNF能增强神经元的生存能力[9,12,13,21], 而bFGF 能刺激离体神经元突起生长[21]。在我们的研究中, BDNF和bFGF都能使离体培养OE中的双极细胞数增加。其中BDNF对双极细胞突起的生长无明显影响; 而bFGF促使双极细胞突起的生长。因此, BDNF和bFGF是通过不同的途径影响细胞的分化。由于嗅觉对许多脊椎动物生存很重要, 所以嗅神经元的增殖和分化需要有多种机制和许多途径, 才能保证嗅觉系统的正常功能。
bFGF 与BDNF 组合既能使培养OE中双极细胞和总细胞数增加, 又能刺激双极细胞的突起生长, 同时使大细胞和梭形细胞减少。提示bFGF和BDNF可能增强双极细胞生存, 并帮助梭形细胞与大细胞分化成双极细胞。这与我们对培养的活OE作慢转速摄影后用普通转速放映的录像分析结果一致。
bFGF 与BDNF 组合在10%血清的OEM中的效果比单用一种或在5%血清的OEM中明显增强。显示bFGF 和BDNF相辅相成, 而一定浓度的血清对于细胞培养很重要, 因为OE细胞在无血清的培养基中会死亡。bFGF与BDNF组合能使我们培养的OE分化出更多的双极细胞, 而双极细胞为细胞移植时修复受损或生病的中枢神经系统提供了很好的细胞来源。bFGF和BDNF对OE细胞的作用机理还不清楚, 尚需继续研究。
, 百拇医药
感谢LU Cheng-Liang 博士和Alan Dozier博士给予技术帮助, 以及Frank Margolis博士提供OMP抗血清。
Supported by American Alliant Community Trust Fund (No.ACFT-95-21) and the KY Spinal Cord and Head Injury Research Trust Fund (No.KSCHIRT7-17; 9-19A).
Corresponding author. Tel: 0512-5391335; E-mail: zhang02@public1.sz.js.cn
张晓东(苏州大学生物技术中心, 苏州 215151)(美国路易斯维尔大学医学院解剖科学和神经生物学系, 美国)
郭占芳(苏州大学生物技术中心, 苏州 215151)(美国路易斯维尔大学医学院解剖科学和神经生物学系, 美国)
, 百拇医药
刘宁(美国路易斯维尔大学医学院解剖科学和神经生物学系, 美国)
F.J.ROISEN(美国路易斯维尔大学医学院解剖科学和神经生物学系, 美国)
参 考 文 献
[1] Calof AL, Chikaraishi DM. Analysis of neurogenesis in a mammalian neuroepithelium: Proliferation and differentiation of an olfactory neuron precursor in vitro. Neuron, 1989, 3: 115~127.
[2] Calof AL, Langer AD, Chikarish DM. Regulation of neurogenesis and neuronal differentiation in primary and immortalized cells from mouse olfactory epithelium. Ciba Found Symp, 1991, 160: 249~276.
, 百拇医药
[3] Chuah MI, Au C. Cultures of ensheathing cells from neonatal olfactory bulb. Brain Res, 1993, 601: 213~220.
[4] Chuah MI, David S, Blaschuk O. Differentiation and survival of rat olfactory epithelial neurons in dissociated cell culture. Dev Brain Res, 1991, 60: 123~132.
[5] Coon HG, Curcio F, Sakaguchi K et al. Cell cultures of neuroblasts from rat olfactory epithelium that show odorant responses. Proc Natl Acad Sci USA, 1989, 86: 1703~1707.
, http://www.100md.com
[6] DeCarlos JA, López-Mascaraque L, Valverde F. Early olfactory fiber projections and cell migration into the rat telencephalon. J Dev Neurosci, 1996, 14: 853~866.
[7] DeHamer MK, Guevara JL, Hannon K et al. Genesis of olfactory receptor neurons in vitro: regulation of pregenitor cell divisions by fibroblast growth factors. Neuron, 1994, 13: 1083~1097.
[8] Doucette R, Devon R. Elevated intracellular levels of cAMP induce olfactory entheathing cells to express GAL-c and GFAP but not MBP. Glia, 1995, 13: 130~140.
, http://www.100md.com
[9] Ernfors P, Lee KF, Jaenisch R. Mice lacking brain-derived neurotrophic factor develop with sensory deficits. Nature, 1994, 386: 147~150.
[10] Gonzales F, Farbman A, Gesteland R. Cell and explant culture of olfactory chemoreceptor cells. J Neurosci Meth, 1985, 14: 77~90.
[11] Gudi?o-Cabrera G, Nieto-Sampedro M. Ensheathing cells: Large scale purification from adult olfactory bulb, freeze-preservation and migration of transplanted cells in adult brain. Resto Neurol Neurosci, 1996, 10: 25~34.
, 百拇医药
[12] Jones KR, Farinas I, Backus C et al. Targeted disruption of the BDNF gene perturbs brain and sensory neuron development but not motor neuron development. Cell, 1994, 76: 989~999.
[13] Meyer-Franke A, Kaplan MR, Pfrieger FW et al. Char~acterization of signaling interactions that promote the survival and growth of developing retinal ganglion cells in culture. Neuron, 1995, 15 (4): 805~819.
[14] Pixley SK, Pun RY. Cultured rat olfactory neurons are ex~ci~table and respond to odors. Brain Res Dev Brain Res, 1990, 53 (1): 125~130.
, 百拇医药
[15] Pixley SK, Bage M, Miller D et al. Olfactory neurons in vitro show phenotypic orientation in epithelial spheres. NeuroReport, 1994, 5: 543~548.
[16] Ronnett GV, Hester LD, Snyder SH. Primary culture of neonatal rat olfactory neurons. J Neurosci, 1991, 11 (5): 1243~1255.
[17] Sosnowski JS, Gupta M, Reid KH et al. Chemical tr~au~matization of adult mouse olfactory epithelium in situ stimulates growth and differentiation of olfactory neurons in vitro. Brain Res, 1995, 702: 37~48.
, 百拇医药
[18] Trojanowski JQ, Newman PD, Hill WD et al. Human olfac~tory epithelium in normal aging, Alzheimer′s disease, and other neurodegenerative disorders. J Comp Neurol, 1991, 310: 365~376.
[19] Vannelli GB, Ensoli F, Zonefrati R et al. Neuroblast long term cell cultures from human fetal olfactory epithelium respond to odors. J Neurosci, 1995, 15 (6): 4382~4394.
[20] Vawter MP, Basaric-Keys J, Li Y et al. Human olfactory neuroepithelial cells: Tyrosine phosphorylation and process extension are increased by the combination of IL-1β, IL-6, NGF, and bFGF. Exper Neuro, 1996, 142: 179~194.
[21] Vazquez E, Van de Water TR, Del Valle M et al. Pattern of trkB protein-like immunoreactivity in vivo and the in vitro effects of brain-derived neurotrophic factor (BDNF) on developing cochlear and vestibular neurons. Anat Embryol, 1994, 189 (2): 157~167.
Received 1999-08-24 Revised 1999-09-20, http://www.100md.com