膳食锌对小鼠脑组织微管相关蛋白2表达的影响
 |
 |
 |
 |
 |
王福俤;赵法伋第二军医大学海军卫生学教研室;上海;200433;景乃禾;中国科学院上海生物化学研究所;上海;200031) 王福俤;赵法伋;景乃禾
关键词:锌;脑发育;脑功能;微管相关蛋白2
摘要:本工作观察了膳食锌与脑组织微管相关蛋白2 (MAP2)之间的联系, 并探讨了微量元素锌调节微管聚合作用的可能机制。ICR初孕小鼠80只, 在孕期和哺乳期饲喂不同锌水平饲料,随机分为5组 :严重缺锌组、 轻度缺锌组、 适锌组、 高锌对喂组及高锌组, 它们饲料的锌水平分别为1, 5, 30, 100和100 mg/kg。 断奶期(仔鼠20日龄)后各组均改为普通饲料饲喂。检测各实验组动物大脑、 小脑和肝脏组织中MAP2的表达。使用Western blot法。结果表明, MAP2印迹开始出现于E15期, E10期未见有MAP2印迹出现; 高分子量MAP2的MAP2a和MAP2b从E15期出现至成年(70日龄, P70)持续表达, 而低分子量MAP2, 即MAP2c, 表达随日龄增长有下调趋势, 成年时(P70)MAP2c表达消失。 比较各实验组MAP2 (包括MAP2a、 MAP2b和MAP2c)水平, 观察到脑组织(包括大脑及小脑)MAP2表达水平与膳食锌呈正依赖关系, 其中以严重缺锌组表达量最低, 而高锌组最高, 各组MAP2表达量顺序为严重缺锌组<轻度缺锌组<适锌组<高锌对喂组<高锌组。上述结果表明, 缺锌可明显抑制脑组织中MAP2表达, 补充锌即可显著促进MAP2表达; MAP2表达量降低可能是锌缺乏引发微管聚合作用下降的重要机制之一。
, 百拇医药
微管是由两种密切相关的α-微管蛋白及β-微管蛋白形成的原微丝和许多微管相关蛋白(mcrotube-associated proteins, MAPs)组成的多聚体, 是细胞骨架的重要成分之一, 在维持细胞增长、 细胞分裂及细胞骨架稳定等方面具有重要作用[1,2]。目前已发现至少10种不同的MAPs, 而MAPs在α-微管蛋白及β-微管蛋白聚合形成二聚体、 维持微管动力学稳定等方面均发挥重要作用[3,4]。微管相关蛋白2 (MAP2)作为MAPs的主要成员之一, 是一种调节微管蛋白组装及动力学的重要调节因子, 在脑的发育过程中发生明显的组成变化[1]。MAP2有3种结构, 即MAP2a、 MAP2b和MAP2c。MAP2a和MAP2b的分子量均约为280 kD, 而MAP2c分子量约为70 kD。一些研究提示, MAP2是微管组装的启动子, 在神经元极性获得上具有重要作用,并为神经元树突所必需[5]; 所有MAP2亚型在体外都能诱导微管蛋白组装, 并对微管生长具有明显的促进作用[6]。
, 百拇医药
锌离子在维持微管蛋白结构及其聚合作用中具有重要作用, 锌离子可特异地与微管结合, 对大脑微管的组装起促进作用[7,8]。 我们的一项研究发现, 缺锌小鼠中枢神经系统中α及β-微管蛋白表达量下降, 而高锌小鼠却维持在较高水平(待发表)。Oteiza等给发育期(孕期及哺乳期)大鼠喂饲轻度缺锌饲料(10 mg/kg), 检测其20日龄和成年大脑微管聚合作用和微管蛋白量, 发现微管聚合作用明显下降[9]。上述结果提示, 锌缺乏引发的微管聚合作用下降与微管蛋白降低有关。但是微管组装及其动力学变化是一个非常复杂的过程, 它不仅受微管蛋白结构的限制, 而且还要受许多诸如微管相关蛋白等连接蛋白的调节[1]。为此, 我们采用Western blot技术观察了发育期饲喂不同缺锌水平饲料小鼠脑组织中MAP2的表达情况, 为明确锌参与微管聚合的机制提供进一步的理论依据。
1 材料与方法
1.1 主要试剂 抗MAP2单克隆抗体(一抗)为Sigma公司产品; AP-羊抗小鼠IgG(二抗)为Zymed公司产品; 小牛白蛋白(BSA)、 过硫酸胺(ammonium persulfate)、 乙二醇双(2-氨基乙醚)四乙酸(EGTA)、 溴氯吲哚基磷酸(BCIP)、 N,N′-亚甲基硝基蓝四唑(NBT)、 丽春红S及Tween-20均为Sigma公司产品; 正常羊血清(NGS)为Gibco BRL公司产品; 丙烯酰胺(acrylamide)、 双丙烯酰胺(BIS)、 乙二胺四乙酸(EDTA)、 苯*****(PMSF)、 尿素(Urea)、 二硫苏糖醇(DTT)、 抑蛋白酶肽(aprotinin)及Tris均为USB产品; 硝酸纤维素膜为Amersham公司产品; 预染蛋白质分子量标准(分子量范围14300~200000)为Life Technologies公司产品; 其它试剂均为国产或进口分析纯试剂。
, 百拇医药
1.2 实验动物处理 成年ICR小鼠, 体重21~24 g, 由中国科学院实验动物中心提供。在动物房普通饲料喂饲适应1周, 雌雄合笼(雌∶雄=2∶1), 次日晨检查雌鼠,见有阴道栓即确定其已怀孕, 并认为是怀孕第0天(E0), 以后依次为怀孕第1天(E1)、 第2天(E2)。将80只刚怀孕母鼠按体重随机分5组, 分别饲喂不同锌水平饲料, 使其成为严重缺锌组(severely zinc deficient, SZD, 饲料含锌量为1 mg/kg)、 轻度缺锌组(marginally zinc deficient, MZD, 饲料含锌量为5 mg/kg)、 适锌组(zinc adequately supplied, ZA, 饲料含锌量为30 mg/kg)、 高锌组(zinc supplemented supplied, ZS, 饲料含锌量为100 mg/kg)及高锌对喂组(pair-fed, PF, 饲料含锌量亦为100 mg/kg)。PF组和ZS组母鼠喂饲的饲料相同, 含锌量均为100 mg/kg。但控制PF组的喂饲量, 使PF组喂饲量与严重缺锌组(SZD)母鼠的喂饲量相等。因为严重低锌膳食可使动物食欲降低、 摄食减少, 设定PF组是为排除因喂饲量不同而造成的对动物生长发育的干扰, 使实验结果只受锌水平影响[10]。母鼠从E0至仔鼠出生后20 d(P20)分别饲喂含不同锌水平实验饲料, 断奶期(P20)后改为饲喂普通饲料。动物饲养在塑料笼具内, 自由饮用双蒸水, 照明周期为12 h/d, 室温为21~25℃。分别收集各实验组E10(30只)及E15胎鼠(10只)、 P1(出生后第1天)、 P5、 P10、 P20及P70(成年)鼠各6只, 采用Western blot技术对其脑组织及肝组织MAP2水平进行检测。
, 百拇医药
1.3 实验动物饲料 实验饲料为参照美国营养协会报告的AIN-93G配方配制而成的纯合成饲料[11]。配方中酪蛋白经EDTA-Na2漂洗数次, 以清除锌离子。配方不加入锌源为严重缺锌饲料, 饲料含锌量约为1 mg/kg, 其它各组饲料按不同要求加入ZnCO3, 使其分别达到5、30和100 mg/kg。饲料贮存于-20℃备用。
1.4 Western blot (蛋白印迹)检测 Western blot检测采用常规法进行操作[12]。取新鲜实验小鼠组织,按照1:2 (wt/vol)加入组织提取液(mmol/L: EDTA 20, EGTA 10, PMSF 1, Urea 2, DTT 1 和aprotinin 0.2 μg/ml的TBS缓冲液, pH 7.6), 冰浴超声匀浆, 15000 r/min 4℃离心5 min, 取上清液进行乙醇(70%乙醇, 0.13 mol/L醋酸钾)沉淀, Lowry法测定总蛋白量, 每孔加样量为20μg蛋白。然后进行SDS-PAGE(凝胶浓度为8.5%T、 2.7%C)分离, 电转移至硝酸纤维素膜, 室温封闭30 min。第一抗体500倍稀释于封闭液中, 4℃反应过夜。次日以漂洗缓冲液(PBS, 含0.05% Tween, 1% BSA)洗去第一抗体, 第二抗体(AP-羊抗小鼠IgG)500倍稀释于封闭液中, 室温反应1 h后依次以漂洗缓冲液、 PBS洗去多余二抗。 避光显色(显色液为75 mg/ml NBT、 50 mg/ml BCIP、 0.1 mol/L NaCl、 0.05 mol/L MgCl2、 0.1 mol/L Tris-HCl, pH 9.5), 待条带清晰出现后终止反应(终止反应缓冲液为20 mmol/L Tris-HCl、 1 mmol/L EDTA, pH 7.9)。 对MAP2a、 MAP2b 及 MAP2c 蛋白杂交条带进行相对密度扫描并分析。
, http://www.100md.com
2 结果
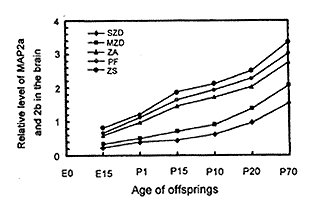
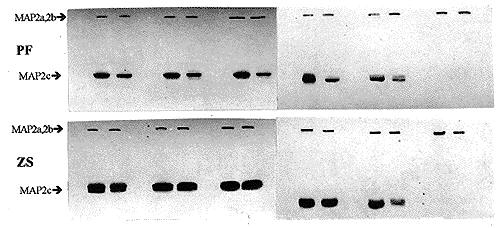
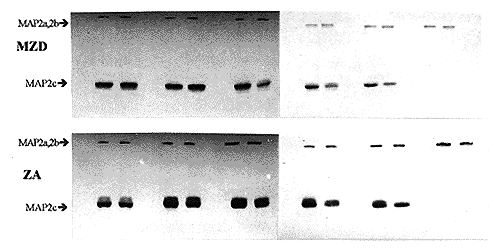
2.1 不同膳食锌水平对实验仔鼠高分子量MAP2 (MAP2a和MAP2b)表达的影响图1(见图版Ⅱ)是各实验组仔鼠各组织MAP2 Western blot检测结果。将各实验组大脑和小脑组织MAP2a和MAP2b蛋白杂交条带相对密度扫描结果绘制成图2。由图1(见图版Ⅱ)及图2可见, E15期脑组织中开始出现MAP2a和MAP2b杂交印迹, 并持续表达至成年(P70)。E10期胚胎头部及各发育时期肝组织中均未见有MAP2杂交印迹。比较各实验组脑组织MAP2a和MAP2b的表达量, 发现缺锌组(SZD及MZD)MAP2a和MAP2b表达量明显低于非缺锌组(ZA、 PF及ZS), MAP2表达量顺序为:严重缺锌组<轻度缺锌组<适锌组<高锌对喂组<高锌组。结果提示, 发育期锌缺乏可明显抑制脑组织中MAP2a和MAP2b表达, 而补充锌可促进MAP2a和MAP2b表达。
图1 Western Blots 对小鼠大脑、小脑及肝组织MAP2表达的检测
, 百拇医药
Fig1 Western blots of different tissues from experimental mice stained weth monoclonal antibody against MAP2 in SZD,MZD,ZA,PF and ZS groups
Samples were prepared from E10 head(Lane 1),E15 cerebrum(Lane2),E15 cerebellum(Lane3),E15 liver(Lane4),P1 cerebrum(Lane5),P1 cerebellum(Lane6),P1 liver(Lane7),P5 cerebrum(Lane8),P5 cerebellum(Lane9),P5 liver(Lane10),P10 cerebrum(Lane11),P10 cerebellum(Lane12),P10 liver(Lane13),P20 cerebrum(Lane14),P20 cerebrum(Lane15),P20 liver(Lane16),P70 cerebrum(Lane17),P70 cerebrum(Lane18),and P70 liver(Lane19).
, 百拇医药
图2 各实验组仔鼠脑组织MAP2a及MAP2b的相对水平
Fig.2 Level of MAP2a and MAP2b in the brain of experimental offsprings
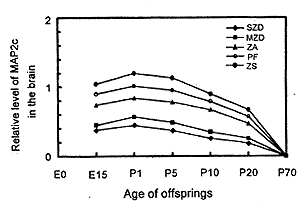
图3 各实验组仔鼠脑组织MAP2c的相对水平
Fig.3 Level of MAP2c in the brain of experimental offsprings
2.2 不同膳食锌水平对实验仔鼠低分子量MAP2 (MAP2c)表达的影响
图3为各实验组仔鼠脑组织(包括大脑和小脑)MAP2c蛋白杂交条带相对密度扫描结果。由图3可见, MAP2c同样是在E15期, 脑组织中检测到表达, 但表达量逐渐下调, P20时还能检测到低浓度的MAP2c, P70时MAP2c表达消失。肝组织中未见有MAP2c表达。脑组织MAP2c的表达量与膳食锌水平呈正依赖关系, 其中以严重缺锌组MAP2c表达量最低, 轻度缺锌组次之, 而高锌组最高。结果提示, 膳食锌水平对脑组织中MAP2c具有明显的促进作用, 锌缺乏抑制MAP2c表达, 而补充锌可促进MAP2c表达。
, 百拇医药
3 讨论
微管在维持神经细胞骨架及有丝分裂等方面具有重要作用, 微管在体内和体外经常处于一种动态的不稳定状态[3]。微管组装及其动态稳定均依赖一些与之相连接的蛋白调节因子调控, MAP2就是其中一种非常重要的调节因子[1]。MAP2在脑的发育过程中发生明显的组成变化, 成年有2个高分子量的MAP2亚型即MAP2a和MAP2b表达, 而新生或出生后不久只有MAP2b和高分子量的MAP2c出现。随着出生后大鼠脑的发育, MAP2c表达量逐渐减少, 至成年完全消失。提示MAP2在脑发育中发挥明显作用[13]。MAP2是微管组装的启动子, 在神经元极性获得以及神经元树突生长中发挥重要作用。一些研究提示, 所有MAP2亚型(MAP2a、 MAP2b及MAP2c)在体外都能诱导微管蛋白组装, 并可能通过提高微管的生长速率与修复频率等途径促进微管生长[6]。Gamblin等通过体外实验发现, MAP2c具有降低微管不稳定性的作用[14]。本研究发现,孕期和哺乳期锌缺乏仔鼠脑组织中MAP2a、 MAP2b及MAP2c的表达均受到明显抑制, 而高锌组脑组织MAP2表达上升。结果表明膳食锌含量与脑组织中MAP2的表达水平呈正依赖关系。锌缺乏引起MAP2(包括MAP2a、 MAP2b及MAP2c)表达下降, 提示其微管的不稳定状态增强、 微管聚合作用下降, 这样必然会影响细胞骨架及细胞有丝分裂的正常进行, 进而损伤脑发育及脑功能; 而补充锌(30 mg/kg及100 mg/kg)可使MAP2表达水平明显升高。即膳食锌在一定的范围内(1~100 mg/kg), 随着膳食锌含量的增加, 其脑组织MAP2的表达明显上升, 而MAP2表达上升提示其微管的不稳定状态下降, 微管生长加速, 并有利于脑的正常发育及脑功能发挥。我们近期的一项研究提示, 这些锌缺乏仔鼠学习能力受损, 海马长时程增强(LTP)诱导下降, 而高锌组仔鼠学习能力较强, 海马LTP亦较高[15]。该结果(学习能力与海马LTP)与本研究的MAP2表达变化呈明显的平行关系。提示锌缺乏引发的MAP2表达下降亦可能是脑功能(学习与记忆能力)损伤的重要机制之一。
, 百拇医药
锌离子在维持微管蛋白结构及其聚合作用中具有重要作用, 锌离子可特异地与微管结合,对大脑微管组装起促进作用[7,8]。我们的另一项研究发现, 缺锌小鼠中枢神经系统中α及β-微管蛋白表达量下降, 而高锌小鼠α及β-微管蛋白却维持在较高水平(待发表)。Oteiza等给发育期(孕期及哺乳期)大鼠喂饲轻度缺锌饲料(10 mg/kg), 其大脑微管聚合作用明显下降[9]。结合以往文献及我们的研究, 提示锌缺乏引发的微管聚合作用下降与微管蛋白及MAPs(包括MAP2a、 MAP2b及MAP2c等)的表达下降有关, 而补充锌可通过提高微管蛋白及MAPs表达水平促进微管聚合作用。因此可以认为, MAP2的表达量降低可能是锌缺乏引发微管聚合作用下降的另一个重要机制所在。
本研究曾得到中国科学院上海生物化学研究所119组边玮实验师、 孔令伟实验师、 高翔及杨靖博士等的大力协助, 特此致谢。
*Supported by grants of the National Natural Science Foundation of China (No.39770643)and the Young Medicine Funds 1995′s of the Army (No.98Q043).
, http://www.100md.com
500
基金项目:国家自然科学基金资助项目 (No.39770643)及全军“九五”医学科研规划第二批青年基金资助项目(No.98Q043)
作者单位:王福俤;赵法伋 第二军医大学海军卫生学教研室, 上海 200433
景乃禾 中国科学院上海生物化学研究所, 上海 200031)
参考文献
[1]Maccioni RB, Veronica CV. Role of microtubule-associated proteins in the control of microtubule as~sembly. Physiol Rev, 1995, 75: 835~864.
, 百拇医药
[2]Matus A. Microtubule-associated proteins: their potential role in determining neuronal morphology. Annu Rev Neurosci, 1988, 11: 29~44.
[3]Ainsztein AM, Purich DL. Stimulation of tubulin polymerization by MAP-2. Control by protein kinase C-mediated phosphorylation at specific sites in the microtubule-binding region. J Biol Chem, 1994, 269 (45): 28465~28471.
[4]Panda D, Goode BL, Feinstein SC, et al. Kinetic stabilization of microtubule dynamics at steady state by tau and microtubule-binding domains of tau. Biochemistry, 1995, 34 (35): 11117~11127.
, 百拇医药
[5]Bernhardt R, Matus A. Light and electron microscope studies on the distribution of microtubule-associated protein 2 in rat brain: a difference between dendritic and axonal cytoskeleton. J Comp Neurol, 1984, 226: 203~221.
[6]Kowalski RJ, Williams RC Jr. Microtubule-associated protein 2 alters the dynamic properties of microtubule assembly and disassembly. J Biol Chem, 1993, 268: 9847~9855.
[7]Gaskin F, Kress Y. Zinc ion-induced assembly of tubulin. J Biol Chem, 1977, 252: 6918~6924.
, 百拇医药
[8]Ray S, Wolf SG, Howard J, et al. Kinesin does not support the motility of zinc-macrotubes. Cell Mot Cytoskel, 1995, 30: 146~152.
[9]Oteiza PI, Hurley LS, Lonnerdal B, et al. Effects of marginal zinc deficiency on microtubule polymerization in the developing rat brain. Biological Trace Element Research, 1990, 24: 13~23.
[10]Golub MS, Keen CL, Gershwin ME, et al. Developmental zinc deficiency and behavior. J Nutr, 1995, 125 (8s): 2263s~2271s.
, 百拇医药
[11]Reeves PG, Nielsen FH, Fahey GC. AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition Ad Hoc Writing Committee on the reformulation of the AIN-76A rodent diet. J Nutr, 1993, 123: 1939~1951.
[12]Sambrook J, Fritsch EF, Maniatis T. Detection and analysis of proteins expressed from cloned genes. In: Sambrook J eds. Molecular CloningA Laboratory Manual, 2nd ed, New York: Cold Spring Harbor Laboratary Press, 1989, 852~904.
, 百拇医药
[13]Riederer B, Matus A. Differential expression of distinct microtubule-associated proteins during brain de~velop~ment. Proc Natr Acad Sci USA, 1985, 82: 6006~6009.
[14]Gamblin TC, Nachmanoff K, Halpain S, et al. Recombinant microtubule-associated protein 2c reduces the dynamic instability of individual microtubules. Biochemistry, 1996, 35: 12576~12586.
[15]Wang FD (王福俤), Zhao FJ (赵法伋 ), Guo JS (郭俊生), et al. Effects of zinc deficiency during pregnancy and lactation of maternal mice on learning ability and hippocampal long-term potentiation of offsprings. Chin J Neurosci(中国神经科学杂志), 1998, 14 (1): 20~23 (in Chinese with English abstract).
收稿1998-11-18
修回1999-01-31, 百拇医药