低频电磁场对兔动脉平滑肌细胞增殖的抑制作用研究
作者:吕安林 高歌 贾国良 王海昌 郭文怡 王小燕 杨省利
单位:第四军医大学西京医院心血管内科 西安市 710032
关键词:磁场;动脉平滑肌细胞;调控作用;冠脉再狭窄
高血压杂志000224
摘要 目的:探讨不同场强、不同作用时间的低频电磁场对兔主动脉平滑肌细胞增殖的调控作用,以观察磁场是否能用于 PTCA支架后冠脉再狭窄的防治。
方法:用含10%小牛血清的RPMI-1640培养液体外培养新西兰白兔的主动脉平滑肌细胞至3~7代,将含5%小牛血清的RPMI-1640培养液与动脉平滑肌细胞的混悬液100 μl加入96孔培养板中培养。按照实验分组,每日磁场作用一次,共二日。用MTT法检测动脉平滑肌细胞的增殖数量。
, 百拇医药
结果:磁场作用时间大于10分钟时,20 mT、40 mT和60 mT磁场对动脉平滑肌细胞的增殖均有显著的抑制作用(P<0.05),其中作用时间为30分钟的40 mT磁场对动脉平滑肌细胞增殖的抑制作用最显著(P<0.001)。
结论:磁场对动脉平滑肌细胞增殖有显著的抑制作用,磁场的这种抑制作用具有强度敏感性、时间依赖性和空间距离性;磁场对PTCA支架后的冠脉再狭窄可能具有防治作用。
中图分类号:R318.03;Q2 文献标识码:A 文章编号:1006-2866(2000)06-0162-03
The Adjusting Effect of Low-frequency Magnetic Field on the
Proliferation of Aortic Smooth Muscle Cells in Rabbits
, 百拇医药
LU An-lin, GAO Ge, JIA Guo-liang, WANG Hai-chang
GUO Wen-yi, WANG Xiao-yan, YANG Sheng-li
(Department of Cardiology, Xijing Hospital
Fourth Military Medical University, Xi'an 710032,China)
ABSTRACT Objective:To investigate the adjusting effect of low-frequency magnetic field (LFMF) of different intensity and time on the proliferation of aortic smooth muscle cells (ASMCs), and observe if LFMF can be used to treat the coronary restenosis after percutaneous transluminal coronary angioplasty (PTCA) and in-stent.
, http://www.100md.com
Methods: New Zealand rabbit ASMCs were cultured in vitro with RPMI-1640 and 10 percent calf plasma. 100 μl mixture of ASMCs and RPMI-1640 5 percent calf plasma was put in cavities of 96-hole plate for culture. ASMCs was exposed under LFMF for two day once per day. The numbers of ASMCs proliferation was monitored by MTT method.
Results:The ASMCs proliferation was significantly inhibited by LFMF when they were exposed under magnetic field more than 10 minutes (P<0.05), and the most obvious inhibitory effect on the ASMCs proliferation was 40 mT LFMF for 30 minutes (P<0.001).
, 百拇医药
Conclusion: LFMF can inhibit the proliferation of ASMCs, and the inhibitory effect on ASMCs was related to the field intensity , time and space distance. The posibility of using magnetic field to prevent and cure the coronary restenosis with PTCA and in-stent is under investigated.
Key words: magnetic field; arterial smooth muscle cells; adjusting effect; coronary restenosis
经皮腔内冠脉成形术(PTCA)及冠脉内支架后冠脉再狭窄(RS)的主要原因是冠脉血管重构和新生内膜增生,血管重构是冠脉血管的修复效应造成的,而新生内膜增生是血管平滑肌细胞的迁移、增生和基质改建形成的[1]。在RS的形成过程中,冠脉新生内膜增生是主要影响因素[2]。
, 百拇医药
目前,有关RS防治研究的文献较多,但所提出的防治措施的疗效均未达到理想的水平,再狭窄率仍然高达15%~20%[1~3],这严重阻碍了PTCA支架术的进一步发展和推广应用。为了提高 PTCA支架术的疗效,降低 RS的发生率,本文研究了低频电磁场对兔主动脉平滑肌细胞(ASMCs)增殖的影响,目的是探讨磁场对RS的防治作用。
材料与方法
1 低频电磁治疗仪:P1K2型(苏州市无线电元件五厂生产)。
2 CO2培养箱:MODEL2300(美国Sheldon制造公司生产)。
3 酶联免疫检测仪:DG3022A型(华东电子管厂生产)。
4 ASMCs的体外培养:
, http://www.100md.com
无菌取出新西兰白兔(体重:1.5±0.5 kg)主动脉段,刮除内膜后,剥脱中膜的平滑肌层,按照 Ross贴片法用含10%小牛血清的RPMI-1640培养液培养ASMCs,在CO2孵箱中静置培养7日后,可见细胞开始从组织块边缘爬出,待细胞生长到一定密度后即传代培养,取其3~7代作为实验用细胞。
5 ASMCs的鉴定:
图1 相差显微镜:ASMCs呈梭形或长梭形,可重叠生长达多层,高低起伏呈"峰""谷"状.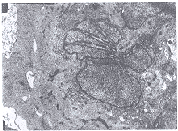
图2 透射电镜:ASMCs的胞浆内有很多与细胞纵轴平行的肌丝及与其相联的致密体,部分细胞周围可见基膜.
, 百拇医药
图3 α-肌动蛋白抗体染色:淡兰色的ASMCs胞核周围有淡棕色的阳性肌丝
6 ASMCs增殖数量的检测: 四唑盐比色法(MTT):将含5%小牛血清的RPMI-1640培养液与ASMCs的混悬液(细胞浓度为1×104/ml)100 μl加入96孔培养板中培养24小时(hr)后,按照实验分组,每日磁场作用一次(电磁板距培养板2 cm),共二日。68 hr时每孔加入MTT溶液(5 mg/ml)20 μl,继续孵育4 hr后终止培养;吸弃上清液,每孔加入50 μl DMSO,振荡10 min,然后在酶联免疫检测仪上(波长:490 mm)测定各孔光吸收值,结果以OD值和变化的百分数来表示。
7 实验分组:对照组,无磁场;20 mT磁场,30 mT磁场,40 mT磁场4组,每组各作用10、20、30 min,以上共10组。
8统计方法:统计数据用均值±标准差(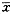 )±s表示,数据处理采用显著性t检验法。
)±s表示,数据处理采用显著性t检验法。
, 百拇医药
结果
1 磁场对ASMCs增殖的影响: 各实验组ASMCs增殖的OD值的统计数据见表 1。以对照组ASMCs增殖的OD值为基数,与其它各磁场实验组比较。由表1知,各磁场实验组ASMCs的增殖均受到不同程度的抑制,统计学检验结果表明:ASMCs增殖的OD值对照组与20 mT 10 min组及60 mT 10 min组无显著性差异外,与其他各组均有显著性差异(P<0.05),其中对照组与40 mT 30 min组比较有极显著性差异(P<0.01)。
表 1 实验组与对照组ASMCs增殖的OD值(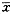 ±s)
±s)
10 min
20 min
30 min
, http://www.100md.com
对照组(n=48)
0.52±0.01
-
-
20 mT(n=48)
0.50±0.01
0.41±0.01*
0.39±0.01*
40 mT(n=48)
0.41±0.01*
0.37±0.01*
, 百拇医药
0.29±0.01**
60 mT(n=48)
0.45±0.01
0.38±0.01*
0.39±0.01*
*:P<0.05;**:P<0.01 vs control
2 磁场对ASMCs增殖的影响程度:根据表 1的实验统计数据进行各实验组间的显著性差异检验,检验结果为:(1)20 mT10 min组及60 mT 10 min组之外的其它各实验组有显著性差异(P<0.05);(2)40 mT 10 min组就开始显示有显著性差异的抑制现象,时间延长组呈顺序地增强抑制;(3)60 mT 20 min组开始表现有较20 mT 20 min组而和40 mT 20 min组相类似的强抑制现象,但30 min则无继续增强的迹象。见 表 1,图 1。
, http://www.100md.com
3 磁场抑制ASMCs增殖的时间变化规律:根据表 1的数据绘制的磁场抑制ASMCs增殖作用的时间变化曲线见图 1。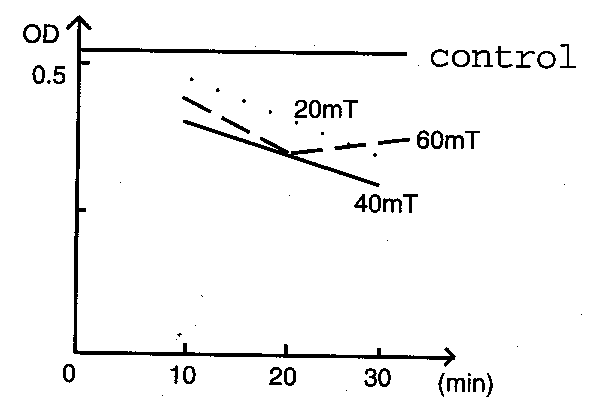
图1 各磁场实验组ASMCs增殖OD值的均值时间变化曲线
由图 1可以看出:磁场对ASMCs增殖的抑制作用随着时间的延长呈逐渐增强趋势,其表现为:40 mT磁场组对ASMCs增殖的抑制作用最强,60 mT磁场组对ASMCs增殖的抑制作用有类似于40 mT磁场组而大于20 mT磁场组,但时间延长并没有更强的作用,而不象40 mT磁场组有时间延长的好处。
讨论
1 近年来,有关磁场促进创伤组织愈合的研究文献较多[4],但磁场调控ASMCs增殖的研究却未见报道。本文采用的实验方法为目前国际上常用的血管平滑肌细胞增殖研究方法,具有很高的可信度[5]。
, 百拇医药
2受磁场作用后,各实验组ASMCs的增殖均受到不同程度的抑制,以40 mT磁场组最显著(P<0.05),10 mT磁场组相对较弱。以往有关磁场对表皮细胞增殖的研究认为磁场作用时间小于10分钟对表皮细胞的增殖起促进作用,而作用时间大于10分钟呈现抑制作用[6]。但在我们的实验中仅发现了磁场对ASMCs增殖的抑制效应,并没有呈现促增值作用。其原因可能与磁场的作用时间因素有关。由于电磁体的磁场强度随着距离的增大而减弱,而且在原始数据的统计过程中也发现越靠近磁场的培养孔,ASMCs增殖的OD值就越小,所以磁场对ASMCs增殖的抑制作用还与组织细胞与磁场的空间距离有关,表现为空间距离性。
3 各磁场实验组中以40 mT磁场作用30分钟组对ASMCs增殖的抑制作用最强(P<0.001),而且20 mT、40 mT和60 mT磁场对ASMCs的抑制作用均为10分钟组弱于20分钟组,20分钟组又弱于30分钟组。这一变化过程提示:磁场对ASMCs增殖的调控作用具有时间依赖性。即随着磁场作用时间的延长,ASMCs增殖受抑制的程度逐渐增加,ASMCs的增殖作用呈逐渐递减的趋势。
, 百拇医药
4 在20 mT、40 mT和60 mT三个磁场实验组中,40 mT磁场组对ASMCs增殖的抑制作用最强,大于或小于40 mT磁场对ASMCs增殖的抑制作用均弱于40 mT磁场。这说明磁场对ASMCs增殖的抑制作用具有场强敏感性。Nossol B等在研究磁场对细胞色素—C氧化酶活性的影响时也发现了同样的现象[7]。
5 磁场抑制ASMCs增殖的作用机理:(1)磁场对细胞新陈代谢的影响:培养液中的荷电离子,如钾、钠、氯、钙、镁、磷等离子,在磁场的作用下,其荷电能力发生改变,影响了这些离子的移动速度和排列形式,使细胞代谢所需酶的活性或功能受到干扰,细胞代谢水平降低,细胞的增殖能力降低[6,7] ;(2)磁场对DNA合成的影响:磁场的能量直接作用于DNA合成的信使转录系统,降低了DNA的合成速度,使ASMCs的增殖受到抑制[8]。
6 已有文献报道适当强度的磁场对心脏的传导和收缩功能无显著影响[9,11],因此体内或体外磁疗可望显著降低PTCA支架后冠脉再狭窄的发生率,但有待于进一步的动物实验和临床试验观察。
, 百拇医药
参考文献
[1] Farb A, Sangiorgi G, Carter AJ, et al Pathology of acute and chronic coronary stenting in humans[J].Circulation 1999,99(l):44-52.
[2]Mgosaki N, Tsurumi Y, Hosoda S. Current approaches to restenosis after coronary interventions[J].Nippon Rinsho1998,56(l):242-248.
[3] Leon MB, Popma JJ, Mintz GS, et al. An overview of US coronary stent trials. [J].Semi Interv Cardiol 1998,1(4):247-254.
, 百拇医药
[4] Darendeliler MA, Darendeliler A, Sinclair PM. effects of static magnetic and pulsed electromagnetic fields on bone healing[J].Orthognath Surg 1997,12(l):43-53.
[5] Pang SC, Venanece SL. Cultured smooth muscle approach in the study of hypertension[J].Can J Physiol Pharmacol 1992,70(4):573-579.
[6] 陈树德,张红锋,陈家森,等.低频电磁场对细胞生物学效应的研究[J].中华物理医学杂志 1998,20(2):78-80.
[7] Nossol B, Buse G, Silny J. Influence of weak static 50 Hz magnetic fields on the redox activity of cytochrome-C[J].Bioelectromagnetics 1993,4(4):361-372.
, 百拇医药
[8] Lai H, Singh NP. Acute exposure to a 60 Hz magnetic field increases DNA strand breaks in rat brain cells[J].Bioelectromagnetics 1997,18(2):156-165.
[9] Grassi Schultheiss PP, Heller F, Dobson J. Analysis of magnetic material in the human heart,spleen and liver[J].Biometals 1997,10(4):351-355.
[10] Mouchawar GA, Bourland TD, Nyenhuis TA. Closed-chest cardiac stimulation with a pulsed magnetic field[J].Med Biol Eng Comput 1992,30(2):162-168.
[11] Kazakova RT, Badakva AM. Effect of isolated and combined effect of a constant magnetic field and antiorthostatic hypokinesia on central hemodynamics in rats[J].Kosm Biol Avikosm Med 1991,25(5):48-49.
收稿日期:1999-08-23, http://www.100md.com
单位:第四军医大学西京医院心血管内科 西安市 710032
关键词:磁场;动脉平滑肌细胞;调控作用;冠脉再狭窄
高血压杂志000224
摘要 目的:探讨不同场强、不同作用时间的低频电磁场对兔主动脉平滑肌细胞增殖的调控作用,以观察磁场是否能用于 PTCA支架后冠脉再狭窄的防治。
方法:用含10%小牛血清的RPMI-1640培养液体外培养新西兰白兔的主动脉平滑肌细胞至3~7代,将含5%小牛血清的RPMI-1640培养液与动脉平滑肌细胞的混悬液100 μl加入96孔培养板中培养。按照实验分组,每日磁场作用一次,共二日。用MTT法检测动脉平滑肌细胞的增殖数量。
, 百拇医药
结果:磁场作用时间大于10分钟时,20 mT、40 mT和60 mT磁场对动脉平滑肌细胞的增殖均有显著的抑制作用(P<0.05),其中作用时间为30分钟的40 mT磁场对动脉平滑肌细胞增殖的抑制作用最显著(P<0.001)。
结论:磁场对动脉平滑肌细胞增殖有显著的抑制作用,磁场的这种抑制作用具有强度敏感性、时间依赖性和空间距离性;磁场对PTCA支架后的冠脉再狭窄可能具有防治作用。
中图分类号:R318.03;Q2 文献标识码:A 文章编号:1006-2866(2000)06-0162-03
The Adjusting Effect of Low-frequency Magnetic Field on the
Proliferation of Aortic Smooth Muscle Cells in Rabbits
, 百拇医药
LU An-lin, GAO Ge, JIA Guo-liang, WANG Hai-chang
GUO Wen-yi, WANG Xiao-yan, YANG Sheng-li
(Department of Cardiology, Xijing Hospital
Fourth Military Medical University, Xi'an 710032,China)
ABSTRACT Objective:To investigate the adjusting effect of low-frequency magnetic field (LFMF) of different intensity and time on the proliferation of aortic smooth muscle cells (ASMCs), and observe if LFMF can be used to treat the coronary restenosis after percutaneous transluminal coronary angioplasty (PTCA) and in-stent.
, http://www.100md.com
Methods: New Zealand rabbit ASMCs were cultured in vitro with RPMI-1640 and 10 percent calf plasma. 100 μl mixture of ASMCs and RPMI-1640 5 percent calf plasma was put in cavities of 96-hole plate for culture. ASMCs was exposed under LFMF for two day once per day. The numbers of ASMCs proliferation was monitored by MTT method.
Results:The ASMCs proliferation was significantly inhibited by LFMF when they were exposed under magnetic field more than 10 minutes (P<0.05), and the most obvious inhibitory effect on the ASMCs proliferation was 40 mT LFMF for 30 minutes (P<0.001).
, 百拇医药
Conclusion: LFMF can inhibit the proliferation of ASMCs, and the inhibitory effect on ASMCs was related to the field intensity , time and space distance. The posibility of using magnetic field to prevent and cure the coronary restenosis with PTCA and in-stent is under investigated.
Key words: magnetic field; arterial smooth muscle cells; adjusting effect; coronary restenosis
经皮腔内冠脉成形术(PTCA)及冠脉内支架后冠脉再狭窄(RS)的主要原因是冠脉血管重构和新生内膜增生,血管重构是冠脉血管的修复效应造成的,而新生内膜增生是血管平滑肌细胞的迁移、增生和基质改建形成的[1]。在RS的形成过程中,冠脉新生内膜增生是主要影响因素[2]。
, 百拇医药
目前,有关RS防治研究的文献较多,但所提出的防治措施的疗效均未达到理想的水平,再狭窄率仍然高达15%~20%[1~3],这严重阻碍了PTCA支架术的进一步发展和推广应用。为了提高 PTCA支架术的疗效,降低 RS的发生率,本文研究了低频电磁场对兔主动脉平滑肌细胞(ASMCs)增殖的影响,目的是探讨磁场对RS的防治作用。
材料与方法
1 低频电磁治疗仪:P1K2型(苏州市无线电元件五厂生产)。
2 CO2培养箱:MODEL2300(美国Sheldon制造公司生产)。
3 酶联免疫检测仪:DG3022A型(华东电子管厂生产)。
4 ASMCs的体外培养:
, http://www.100md.com
无菌取出新西兰白兔(体重:1.5±0.5 kg)主动脉段,刮除内膜后,剥脱中膜的平滑肌层,按照 Ross贴片法用含10%小牛血清的RPMI-1640培养液培养ASMCs,在CO2孵箱中静置培养7日后,可见细胞开始从组织块边缘爬出,待细胞生长到一定密度后即传代培养,取其3~7代作为实验用细胞。
5 ASMCs的鉴定:

图1 相差显微镜:ASMCs呈梭形或长梭形,可重叠生长达多层,高低起伏呈"峰""谷"状.

图2 透射电镜:ASMCs的胞浆内有很多与细胞纵轴平行的肌丝及与其相联的致密体,部分细胞周围可见基膜.

, 百拇医药
图3 α-肌动蛋白抗体染色:淡兰色的ASMCs胞核周围有淡棕色的阳性肌丝
6 ASMCs增殖数量的检测: 四唑盐比色法(MTT):将含5%小牛血清的RPMI-1640培养液与ASMCs的混悬液(细胞浓度为1×104/ml)100 μl加入96孔培养板中培养24小时(hr)后,按照实验分组,每日磁场作用一次(电磁板距培养板2 cm),共二日。68 hr时每孔加入MTT溶液(5 mg/ml)20 μl,继续孵育4 hr后终止培养;吸弃上清液,每孔加入50 μl DMSO,振荡10 min,然后在酶联免疫检测仪上(波长:490 mm)测定各孔光吸收值,结果以OD值和变化的百分数来表示。
7 实验分组:对照组,无磁场;20 mT磁场,30 mT磁场,40 mT磁场4组,每组各作用10、20、30 min,以上共10组。
8统计方法:统计数据用均值±标准差(
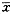 )±s表示,数据处理采用显著性t检验法。
)±s表示,数据处理采用显著性t检验法。, 百拇医药
结果
1 磁场对ASMCs增殖的影响: 各实验组ASMCs增殖的OD值的统计数据见表 1。以对照组ASMCs增殖的OD值为基数,与其它各磁场实验组比较。由表1知,各磁场实验组ASMCs的增殖均受到不同程度的抑制,统计学检验结果表明:ASMCs增殖的OD值对照组与20 mT 10 min组及60 mT 10 min组无显著性差异外,与其他各组均有显著性差异(P<0.05),其中对照组与40 mT 30 min组比较有极显著性差异(P<0.01)。
表 1 实验组与对照组ASMCs增殖的OD值(
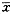 ±s)
±s)10 min
20 min
30 min
, http://www.100md.com
对照组(n=48)
0.52±0.01
-
-
20 mT(n=48)
0.50±0.01
0.41±0.01*
0.39±0.01*
40 mT(n=48)
0.41±0.01*
0.37±0.01*
, 百拇医药
0.29±0.01**
60 mT(n=48)
0.45±0.01
0.38±0.01*
0.39±0.01*
*:P<0.05;**:P<0.01 vs control
2 磁场对ASMCs增殖的影响程度:根据表 1的实验统计数据进行各实验组间的显著性差异检验,检验结果为:(1)20 mT10 min组及60 mT 10 min组之外的其它各实验组有显著性差异(P<0.05);(2)40 mT 10 min组就开始显示有显著性差异的抑制现象,时间延长组呈顺序地增强抑制;(3)60 mT 20 min组开始表现有较20 mT 20 min组而和40 mT 20 min组相类似的强抑制现象,但30 min则无继续增强的迹象。见 表 1,图 1。
, http://www.100md.com
3 磁场抑制ASMCs增殖的时间变化规律:根据表 1的数据绘制的磁场抑制ASMCs增殖作用的时间变化曲线见图 1。

图1 各磁场实验组ASMCs增殖OD值的均值时间变化曲线
由图 1可以看出:磁场对ASMCs增殖的抑制作用随着时间的延长呈逐渐增强趋势,其表现为:40 mT磁场组对ASMCs增殖的抑制作用最强,60 mT磁场组对ASMCs增殖的抑制作用有类似于40 mT磁场组而大于20 mT磁场组,但时间延长并没有更强的作用,而不象40 mT磁场组有时间延长的好处。
讨论
1 近年来,有关磁场促进创伤组织愈合的研究文献较多[4],但磁场调控ASMCs增殖的研究却未见报道。本文采用的实验方法为目前国际上常用的血管平滑肌细胞增殖研究方法,具有很高的可信度[5]。
, 百拇医药
2受磁场作用后,各实验组ASMCs的增殖均受到不同程度的抑制,以40 mT磁场组最显著(P<0.05),10 mT磁场组相对较弱。以往有关磁场对表皮细胞增殖的研究认为磁场作用时间小于10分钟对表皮细胞的增殖起促进作用,而作用时间大于10分钟呈现抑制作用[6]。但在我们的实验中仅发现了磁场对ASMCs增殖的抑制效应,并没有呈现促增值作用。其原因可能与磁场的作用时间因素有关。由于电磁体的磁场强度随着距离的增大而减弱,而且在原始数据的统计过程中也发现越靠近磁场的培养孔,ASMCs增殖的OD值就越小,所以磁场对ASMCs增殖的抑制作用还与组织细胞与磁场的空间距离有关,表现为空间距离性。
3 各磁场实验组中以40 mT磁场作用30分钟组对ASMCs增殖的抑制作用最强(P<0.001),而且20 mT、40 mT和60 mT磁场对ASMCs的抑制作用均为10分钟组弱于20分钟组,20分钟组又弱于30分钟组。这一变化过程提示:磁场对ASMCs增殖的调控作用具有时间依赖性。即随着磁场作用时间的延长,ASMCs增殖受抑制的程度逐渐增加,ASMCs的增殖作用呈逐渐递减的趋势。
, 百拇医药
4 在20 mT、40 mT和60 mT三个磁场实验组中,40 mT磁场组对ASMCs增殖的抑制作用最强,大于或小于40 mT磁场对ASMCs增殖的抑制作用均弱于40 mT磁场。这说明磁场对ASMCs增殖的抑制作用具有场强敏感性。Nossol B等在研究磁场对细胞色素—C氧化酶活性的影响时也发现了同样的现象[7]。
5 磁场抑制ASMCs增殖的作用机理:(1)磁场对细胞新陈代谢的影响:培养液中的荷电离子,如钾、钠、氯、钙、镁、磷等离子,在磁场的作用下,其荷电能力发生改变,影响了这些离子的移动速度和排列形式,使细胞代谢所需酶的活性或功能受到干扰,细胞代谢水平降低,细胞的增殖能力降低[6,7] ;(2)磁场对DNA合成的影响:磁场的能量直接作用于DNA合成的信使转录系统,降低了DNA的合成速度,使ASMCs的增殖受到抑制[8]。
6 已有文献报道适当强度的磁场对心脏的传导和收缩功能无显著影响[9,11],因此体内或体外磁疗可望显著降低PTCA支架后冠脉再狭窄的发生率,但有待于进一步的动物实验和临床试验观察。
, 百拇医药
参考文献
[1] Farb A, Sangiorgi G, Carter AJ, et al Pathology of acute and chronic coronary stenting in humans[J].Circulation 1999,99(l):44-52.
[2]Mgosaki N, Tsurumi Y, Hosoda S. Current approaches to restenosis after coronary interventions[J].Nippon Rinsho1998,56(l):242-248.
[3] Leon MB, Popma JJ, Mintz GS, et al. An overview of US coronary stent trials. [J].Semi Interv Cardiol 1998,1(4):247-254.
, 百拇医药
[4] Darendeliler MA, Darendeliler A, Sinclair PM. effects of static magnetic and pulsed electromagnetic fields on bone healing[J].Orthognath Surg 1997,12(l):43-53.
[5] Pang SC, Venanece SL. Cultured smooth muscle approach in the study of hypertension[J].Can J Physiol Pharmacol 1992,70(4):573-579.
[6] 陈树德,张红锋,陈家森,等.低频电磁场对细胞生物学效应的研究[J].中华物理医学杂志 1998,20(2):78-80.
[7] Nossol B, Buse G, Silny J. Influence of weak static 50 Hz magnetic fields on the redox activity of cytochrome-C[J].Bioelectromagnetics 1993,4(4):361-372.
, 百拇医药
[8] Lai H, Singh NP. Acute exposure to a 60 Hz magnetic field increases DNA strand breaks in rat brain cells[J].Bioelectromagnetics 1997,18(2):156-165.
[9] Grassi Schultheiss PP, Heller F, Dobson J. Analysis of magnetic material in the human heart,spleen and liver[J].Biometals 1997,10(4):351-355.
[10] Mouchawar GA, Bourland TD, Nyenhuis TA. Closed-chest cardiac stimulation with a pulsed magnetic field[J].Med Biol Eng Comput 1992,30(2):162-168.
[11] Kazakova RT, Badakva AM. Effect of isolated and combined effect of a constant magnetic field and antiorthostatic hypokinesia on central hemodynamics in rats[J].Kosm Biol Avikosm Med 1991,25(5):48-49.
收稿日期:1999-08-23, http://www.100md.com