甘蓝细胞溶质超氧化物歧化酶的纯化及性质研究
作者:林元藻 彭少君 刘春
单位:林元藻(广东药学院生物化学教研室,广州510224);彭少君(江西宜春医学专科学校生化教研室,宜春336000);刘 春(湖北医科大学微生物及免疫学教研室,武汉430071)
关键词:超氧化物歧化酶;纯化;性质;甘蓝细胞溶质
摘 要 通过对甘蓝细胞溶质SOD的纯化及性质研究 摘 要 通过对甘蓝细胞溶质SOD的纯化及性质研究,开拓制备SOD的廉价原料来源。经硫酸铵沉淀、SephadexG-100凝胶过滤和DEAE-DE52层析3个步骤,将甘蓝细胞溶质SOD纯化到均一程度。从1000g叶片中得到3.2mg酶,酶的比活力达9700U/mg蛋白。经鉴定该酶是Cu.Zn-SOD。测得其Mr约为32200,亚基Mr约为16000。该酶的N-末端为丙氨酸,其可见光区与紫外光区的最大吸收峰分别在680nm和265nm。氨基酸组成分析表明甘蓝细胞溶液质SOD由266个氨基酸残基组成,而且不含色氨酸。本研究对高等植物细胞溶质SOD的纯化建立了一种行之有效的方法,为高等植物SOD性质的比较研究提供了实验依据。
, http://www.100md.com
Studies on Purification and Properties of Superoxide
Dismutase from Cab bage Plasma
Lin Yuanzao, Peng Shaojun1 , Liu Chun2
(Department of Biochemistry, Guangdong College of Pharmacy, Guangzhou 510224, 1Department of Biochemistry, Yichun Medical School, Yichun 336000, 2Department of Microbiology and immunology , Hubei Medical University, Wuhan 430071)
, http://www.100md.com
Abstract Through a study on purification and properties of superoxide dismuta se (SOD) from cabbage plasma , an approach was developed to explore a cheap ersource of crude material for preparing SOD . The SOD from cabbage plasm a has been purified to homogeneity by ammonium sulfate fractionation, Sephadex G-100 gel filtration and DEAE-DE52 chromatography. The yield of SOD was 3. 2 mg per kilogram cabbage leaves, and the specific activity of this enzyme prep aration was 9700U/mg protein. The purified enzyme was characterized to be a Cu.Zn-SOD. Electrophoretic analysis indicated that the enzyme contains two hom og enous subunits with molecular weight of 16000. The N-terminal of the enzyme is alanine ,and (max in the visible and ultraviolet spectra were at 680 nm. and 26 5 nm, respectively. Amino acid component quantitative analysis revealed that th i s protein was composed of 266 amino acids and lack of tryptophan. This study presented an effective approach for SOD purification in higher plant plasma and pr ovided an experimental basis for the comparative study on the higher plants.
, http://www.100md.com
Key Words Superoxide dismutase, Purification, Properties , Cabbage plasma
超氧化物歧化酶(superoxide dismutase,SOD)是需氧生物中以超氧阴离子为底物的一种酶,广泛存在于各种生物中,其制备原料十分广阔。SOD不仅在生物体内对抗氧化、解毒起重要作用,而且也有延缓机体衰老、抗肿瘤及抗免疫性疾病等功能[1],因而受到医药界的极大关注。邹国林等曾对小白菜、葱等的SOD进行过较系统研究[2-5]。甘蓝是一种种植面极广的蔬菜,其SOD的纯化和性质研究国内外尚未见报道。本文报道甘蓝细胞溶质Cu.Zn-SOD的纯化及其性质。旨在开拓制备SOD的廉价原料来源,为高等植物SOD的比较研究积累素材。
1 材 料
甘蓝(Brassica oleracea var.capitata L.cabbage,俗称苞菜、卷心菜),自备;Sephadex G-100,Pharmacia产品;DEAE-DE52,Whatman产品;甲叉双丙烯酰胺,Fluka产品;SDS-PAGE标准蛋白,上海东风试剂厂产品;其它试剂为国产分析纯或生化试剂。
, 百拇医药
2 方 法
2.1 SOD的分离纯化
取1000g甘蓝叶片,加入1000ml缓冲液I(200mmol/LK2HPO4-KH2PO4,pH7.8,内含1mmol/LNa2-EDTA、1mmol/L巯基乙醇和400mmol/L蔗糖),捣碎,匀浆,过滤。滤液经4℃、15000g离心20min,取上清液(粗酶液)。
在粗酶液中加入固体(NH4)2SO4至55%饱和度,4℃下静置6h,15000g离心20min,取上清液;再加入固体(NH4)2SO4至95%饱和度,4℃下静置6h,15000g离心20min,收集沉淀物。将沉淀物用少量缓冲液Ⅱ(5mmol/LK2HPO4-KH2PO4,pH7.8,内含1mmol/LNa2-EDTA、1mmol/L巯基乙醇)溶解,并用缓冲液Ⅱ透析过夜,再用聚乙二醇(PEG)20000浓缩。浓缩液上已平衡好的SephadexG-100柱(1.5cm×95cm),用缓冲液Ⅱ洗脱,流速1.8ml/10min,以3.6ml/管部分收集。经酶活力与蛋白浓度测定,收集活力峰,再上已平衡好的DEAE-DE52柱(1.0cm×60cm)。用缓冲液Ⅱ淋洗至A280nm≤0.02后,再用5~300mmol/L缓冲液(K2HPO4-KH2PO4,pH7.8,内含1mmol/LNa2-EDTA、1mmol/L巯基乙醇)进行线性梯度洗脱(150ml×2),流速1ml/3min,以3ml/管部分收集。经酶活力与蛋白浓度测定,合并酶活力峰的洗脱液,存冰箱备用。
, 百拇医药
2.2 SOD活力测定
采用黄嘌呤氧化酶法,参考文献[6]进行。
2.3 蛋白质含量测定
按文献[7]进行。
2.4 聚丙烯酰胺凝胶电泳(PAGE)
采用非解离系统的不连续的聚丙烯酰胺凝胶垂直平板电泳。浓缩胶浓度为3%,分离胶浓度为10%,电极缓冲液为pH8.3,Tris-甘氨酸缓冲液。蛋白染色用考马斯亮蓝R-250,酶活性染色参照文献[6]进行。
2.5 SDS-PAGE
按文献[8]进行。
2.6 抑制剂敏感性实验
, 百拇医药
分别测定SOD样品在1mmol/LKCN或1mmol/LH2O2中的剩余活力。
2.7 金属元素含量测定
采用日本岛津AA-650型原子吸收光谱仪测定。
2.8 吸收光谱测定
采用日本岛津UV-240自动记录分光光度计测定。
2.9 氨基酸组成分析
采用日立835-50型氨基酸自动分析仪测定。色氨酸残基分析采用对二甲基氨基苯甲醛(DAB)法
2.10 N-末端氨基酸测定
采用5-二甲氨基萘磺酰氯(DNS)法[8]。
, 百拇医药
3 结果与讨论
3.1 酶的纯化和鉴定
3.1.1 酶的纯化 酶的纯化结果见表1。从1000g甘蓝叶片中可纯化得到3.2mg酶,其比活力约达9700U/mg蛋白。一般认为从粗酶液中将SOD纯化到均一程度,需要经过4步以上的纯化步骤,而本法只用了硫酸铵分级沉淀,SephadexG-100凝胶过滤和DEAE-DE52柱层析3步即将酶纯化到均一程度。
Tab 1 Purification of SOD from cabbage plasma
Procedure
Volume
(ml)
Overall
, 百拇医药
activity
(U×104)
Overall
quantity of
protein(mg)
Specific
activity
(u/mg protein)
Purification
multiple
Enzyme succus
, http://www.100md.com
1032
12.7
1142.4
111.2
1
Precipitation of ammonium sulfate
66
10.3
139.2
739.2
6.7
Sephadex G-100 gel filtration
, http://www.100md.com
90
7.6
46.1
1648.6
14.8
DEAE-DE52 chromatography
21
3.1
3.2
9687.5
87.2
3.1.2 酶的鉴定 酶样品经PAGE后,分别进行蛋白染色和活力染色,结果均呈现一条带,且蛋白带和活性带位置互相对应,表明该酶已纯化到均一程度[9](图1)。由于Cu.Zn-SOD对氰化物和H2O2均敏感;Fe-SOD对氰化物不敏感,而对H2O2敏感;Mn-SOD则对氰化物和H2O2均不敏感;因此可用这2种抑制剂实验将3种SOD区分开。经实验测定,1mmol/LKCN可抑制SOD样品活力达96%,1mmol/LH2O2可抑制SOD样品活力达70%,可见甘蓝细胞溶质SOD对KCN和H2O2都很敏感,因此可判断该酶是Cu.Zn-SOD[1]。该结果与文献报道的高等植物细胞溶质中的SOD均是Cu.Zn-SOD的结论相符。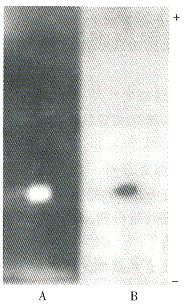
, 百拇医药
A:Activity dyeing of enzyme
B:Dyeing of protein
Fig 1 Polyacrylamide gel electrophoretic patterns of SOD from cabbage plasma
经原子吸收光谱法测定,每1mol酶样品中含1.8mol/LCu、2.0mol/LZn、0.18mol/LFe,而Mn的含量低于检测水平。其Cu∶Zn=0.9∶1,进一步证明甘蓝细胞溶质SOD是一种Cu.Zn-SOD[1]。
3.2 酶的性质
3.2.1 吸收光谱 该酶的紫外吸收峰在265nm,而不在280nm。图2)这是因为它不含色氨酸,只含7个酪氨酸,而含有13个苯丙氨酸之故。不同来源的Cu.Zn-SOD紫外吸收峰均在260nm。附近,而Mn-SOD和Fe-SOD的吸收峰均在280nm附近[10-11]。该酶在可见光区的吸收峰为680nm,而Mn-SOD和Fe-SOD无此特征峰,可见该酶分子中含有铜,此吸收光谱反映了二价铜离子的光谱特性。吸收光谱测定的结果也表明该酶是Cu.Zn-SOD。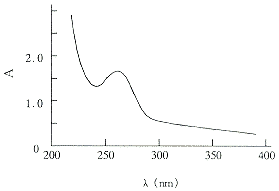
, 百拇医药
Fig 2 Absorption spectrum of SOD from cabbage plasma
3.2.2 Mr与亚基Mr 由于SOD的分子带和亚基分子带在SDS-PAGE中均可同时出现,故可同时用于测定其Mr与亚基Mr。经SDS-PAGE法测定,其Mr约为32200,其亚基Mr约为16000,见图3。根据标准蛋白分子量的对数和其对应的相对迁移率数据计算,得到的直线方程(回归方程)很好,其相关系数γ=0.998。图3表明该酶是由两个相同的亚基组成。小白菜细胞溶质SODMr和亚基Mr分别为32000和16000[2]。本结果与其他文献所报道的一样,证实不同来源的Cu.Zn-SODMr一般均在32000左右,且由两个相同的亚基组成[1]。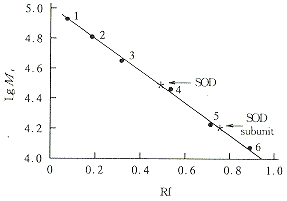
, 百拇医药
The following proteins are used as markers:
1.PhsphrylaseB(94 000) 2.Albumin(67 000)
3.Actin(43 000) 4.Carbonic anhydrase(30 000)
5.TMV(17 500) 6.Cytochrome(12 300)
Fig 3 Molecular weight determination of the subunit of SOD by SDS-PAGE
3.2.3 氨基酸组成 经氨基酸自动分析仪分析,甘蓝细胞溶质SOD的氨 基酸组成如表2所示。
Tab 2 Amino acid analysis of SOD from cabbage plas ma(residue/molecule)
, 百拇医药
Amino acid
Reckoning
value
Integer value
Amino acid
Reckoning
value
Integer value
Asp
26.6
27
Ser
, http://www.100md.com
20.7
21
Gly
33.4
33
Cys
1.4
1
Met
0.6
1
Leu
18.8
, http://www.100md.com 19
Phe
12.8
13
His
5.7
6
Pro
18.9
19
Glu
24.6
25
Thr
, 百拇医药
17.3
17
Val
19.2
19
Ala
22.8
23
Tyr
7.3
7
Ile
10.7
, 百拇医药
11
Arg
8.9
9
Lys
14.7
15
Sum total
266
Trp
0
0
由表2可见,该酶分子约由266个氨基酸残基组成,含17种氨基酸,不含色氨酸。
, 百拇医药
3.2.4 N-末端氨基酸 测得该酶N-末端氨基酸是丙氨酸。样品经聚酰胺薄膜单向和双向层析,均只出现DNS-丙氨酸斑点,未出现其他DNS-氨基酸斑点,这也进一步证明该酶已纯化到均一程度。小白菜细胞溶质和叶绿体的Cu.Zn-SOD的N-末端氨基酸亦是丙基酸[2,3],而线粒体Mn-SOD的N-末端氨基酸是缬氨酸[4]。参考文献
1 林元藻,王凤山,王转花主编.生化制药学.北京:人民卫生出版社,1998.207
2 邹国林,罗时文.一种小白菜叶细胞溶质铜锌超氧化物歧化酶的纯化和性质研究.生物化学杂志,1989,5(2):182
3 邹国林,罗时文,荣俊,等.小白菜叶绿体铜锌超氧化物歧化酶的纯化和某些性质研究.生物化学与生物物理学报,1989,21(1):51
, 百拇医药
4 邹国林,罗时文,裘名宜,等.小白菜线粒体锰超氧化物歧化酶的纯化和性质研究.生物化学与生物物理学报,1992,24(2):180
5 唐双焱,邹国林,金建明.小葱叶胞质中3种Cu,Zn-SOD的纯化及性质研究.中国生物化学与分子生物学报,1998,14(6):796
6 Beauchamp C , Fridovich I. Superoxide dismutase:improved assays and ass ay applicable to acrylamide gels. Anal Biochem , 1971,44:276
7 Bradford M M . A rapid and sensitive method for the quantitation o f microgram quantities of protein utilizing the principle of protein-dye binding. Anal biochem , 1976,72:248
, 百拇医药
8 赵永芳.生物化学技术原理及其应用.武汉:武汉大学出版社,1988.343,6 5
9 邹国林.对SOD研究中若干问题的看法.中国生化药物杂志,1995,16(4):186
10 Baum J A, Scandalios J G. Isolation and characterization of the cytosolic and mitochondriai superoxide dismutase of maize. Arch Biochem Biophys,1981,206:249
11 Salin M L, Bridges S M. Isolation and characterization of an iron-containing superoxide dismutase from a eucaryote, Brassica campestris. Arch Bioche Biophys ,1980, 201:369
收稿日期:199-03-05, 百拇医药
单位:林元藻(广东药学院生物化学教研室,广州510224);彭少君(江西宜春医学专科学校生化教研室,宜春336000);刘 春(湖北医科大学微生物及免疫学教研室,武汉430071)
关键词:超氧化物歧化酶;纯化;性质;甘蓝细胞溶质
摘 要 通过对甘蓝细胞溶质SOD的纯化及性质研究 摘 要 通过对甘蓝细胞溶质SOD的纯化及性质研究,开拓制备SOD的廉价原料来源。经硫酸铵沉淀、SephadexG-100凝胶过滤和DEAE-DE52层析3个步骤,将甘蓝细胞溶质SOD纯化到均一程度。从1000g叶片中得到3.2mg酶,酶的比活力达9700U/mg蛋白。经鉴定该酶是Cu.Zn-SOD。测得其Mr约为32200,亚基Mr约为16000。该酶的N-末端为丙氨酸,其可见光区与紫外光区的最大吸收峰分别在680nm和265nm。氨基酸组成分析表明甘蓝细胞溶液质SOD由266个氨基酸残基组成,而且不含色氨酸。本研究对高等植物细胞溶质SOD的纯化建立了一种行之有效的方法,为高等植物SOD性质的比较研究提供了实验依据。
, http://www.100md.com
Studies on Purification and Properties of Superoxide
Dismutase from Cab bage Plasma
Lin Yuanzao, Peng Shaojun1 , Liu Chun2
(Department of Biochemistry, Guangdong College of Pharmacy, Guangzhou 510224, 1Department of Biochemistry, Yichun Medical School, Yichun 336000, 2Department of Microbiology and immunology , Hubei Medical University, Wuhan 430071)
, http://www.100md.com
Abstract Through a study on purification and properties of superoxide dismuta se (SOD) from cabbage plasma , an approach was developed to explore a cheap ersource of crude material for preparing SOD . The SOD from cabbage plasm a has been purified to homogeneity by ammonium sulfate fractionation, Sephadex G-100 gel filtration and DEAE-DE52 chromatography. The yield of SOD was 3. 2 mg per kilogram cabbage leaves, and the specific activity of this enzyme prep aration was 9700U/mg protein. The purified enzyme was characterized to be a Cu.Zn-SOD. Electrophoretic analysis indicated that the enzyme contains two hom og enous subunits with molecular weight of 16000. The N-terminal of the enzyme is alanine ,and (max in the visible and ultraviolet spectra were at 680 nm. and 26 5 nm, respectively. Amino acid component quantitative analysis revealed that th i s protein was composed of 266 amino acids and lack of tryptophan. This study presented an effective approach for SOD purification in higher plant plasma and pr ovided an experimental basis for the comparative study on the higher plants.
, http://www.100md.com
Key Words Superoxide dismutase, Purification, Properties , Cabbage plasma
超氧化物歧化酶(superoxide dismutase,SOD)是需氧生物中以超氧阴离子为底物的一种酶,广泛存在于各种生物中,其制备原料十分广阔。SOD不仅在生物体内对抗氧化、解毒起重要作用,而且也有延缓机体衰老、抗肿瘤及抗免疫性疾病等功能[1],因而受到医药界的极大关注。邹国林等曾对小白菜、葱等的SOD进行过较系统研究[2-5]。甘蓝是一种种植面极广的蔬菜,其SOD的纯化和性质研究国内外尚未见报道。本文报道甘蓝细胞溶质Cu.Zn-SOD的纯化及其性质。旨在开拓制备SOD的廉价原料来源,为高等植物SOD的比较研究积累素材。
1 材 料
甘蓝(Brassica oleracea var.capitata L.cabbage,俗称苞菜、卷心菜),自备;Sephadex G-100,Pharmacia产品;DEAE-DE52,Whatman产品;甲叉双丙烯酰胺,Fluka产品;SDS-PAGE标准蛋白,上海东风试剂厂产品;其它试剂为国产分析纯或生化试剂。
, 百拇医药
2 方 法
2.1 SOD的分离纯化
取1000g甘蓝叶片,加入1000ml缓冲液I(200mmol/LK2HPO4-KH2PO4,pH7.8,内含1mmol/LNa2-EDTA、1mmol/L巯基乙醇和400mmol/L蔗糖),捣碎,匀浆,过滤。滤液经4℃、15000g离心20min,取上清液(粗酶液)。
在粗酶液中加入固体(NH4)2SO4至55%饱和度,4℃下静置6h,15000g离心20min,取上清液;再加入固体(NH4)2SO4至95%饱和度,4℃下静置6h,15000g离心20min,收集沉淀物。将沉淀物用少量缓冲液Ⅱ(5mmol/LK2HPO4-KH2PO4,pH7.8,内含1mmol/LNa2-EDTA、1mmol/L巯基乙醇)溶解,并用缓冲液Ⅱ透析过夜,再用聚乙二醇(PEG)20000浓缩。浓缩液上已平衡好的SephadexG-100柱(1.5cm×95cm),用缓冲液Ⅱ洗脱,流速1.8ml/10min,以3.6ml/管部分收集。经酶活力与蛋白浓度测定,收集活力峰,再上已平衡好的DEAE-DE52柱(1.0cm×60cm)。用缓冲液Ⅱ淋洗至A280nm≤0.02后,再用5~300mmol/L缓冲液(K2HPO4-KH2PO4,pH7.8,内含1mmol/LNa2-EDTA、1mmol/L巯基乙醇)进行线性梯度洗脱(150ml×2),流速1ml/3min,以3ml/管部分收集。经酶活力与蛋白浓度测定,合并酶活力峰的洗脱液,存冰箱备用。
, 百拇医药
2.2 SOD活力测定
采用黄嘌呤氧化酶法,参考文献[6]进行。
2.3 蛋白质含量测定
按文献[7]进行。
2.4 聚丙烯酰胺凝胶电泳(PAGE)
采用非解离系统的不连续的聚丙烯酰胺凝胶垂直平板电泳。浓缩胶浓度为3%,分离胶浓度为10%,电极缓冲液为pH8.3,Tris-甘氨酸缓冲液。蛋白染色用考马斯亮蓝R-250,酶活性染色参照文献[6]进行。
2.5 SDS-PAGE
按文献[8]进行。
2.6 抑制剂敏感性实验
, 百拇医药
分别测定SOD样品在1mmol/LKCN或1mmol/LH2O2中的剩余活力。
2.7 金属元素含量测定
采用日本岛津AA-650型原子吸收光谱仪测定。
2.8 吸收光谱测定
采用日本岛津UV-240自动记录分光光度计测定。
2.9 氨基酸组成分析
采用日立835-50型氨基酸自动分析仪测定。色氨酸残基分析采用对二甲基氨基苯甲醛(DAB)法
2.10 N-末端氨基酸测定
采用5-二甲氨基萘磺酰氯(DNS)法[8]。
, 百拇医药
3 结果与讨论
3.1 酶的纯化和鉴定
3.1.1 酶的纯化 酶的纯化结果见表1。从1000g甘蓝叶片中可纯化得到3.2mg酶,其比活力约达9700U/mg蛋白。一般认为从粗酶液中将SOD纯化到均一程度,需要经过4步以上的纯化步骤,而本法只用了硫酸铵分级沉淀,SephadexG-100凝胶过滤和DEAE-DE52柱层析3步即将酶纯化到均一程度。
Tab 1 Purification of SOD from cabbage plasma
Procedure
Volume
(ml)
Overall
, 百拇医药
activity
(U×104)
Overall
quantity of
protein(mg)
Specific
activity
(u/mg protein)
Purification
multiple
Enzyme succus
, http://www.100md.com
1032
12.7
1142.4
111.2
1
Precipitation of ammonium sulfate
66
10.3
139.2
739.2
6.7
Sephadex G-100 gel filtration
, http://www.100md.com
90
7.6
46.1
1648.6
14.8
DEAE-DE52 chromatography
21
3.1
3.2
9687.5
87.2
3.1.2 酶的鉴定 酶样品经PAGE后,分别进行蛋白染色和活力染色,结果均呈现一条带,且蛋白带和活性带位置互相对应,表明该酶已纯化到均一程度[9](图1)。由于Cu.Zn-SOD对氰化物和H2O2均敏感;Fe-SOD对氰化物不敏感,而对H2O2敏感;Mn-SOD则对氰化物和H2O2均不敏感;因此可用这2种抑制剂实验将3种SOD区分开。经实验测定,1mmol/LKCN可抑制SOD样品活力达96%,1mmol/LH2O2可抑制SOD样品活力达70%,可见甘蓝细胞溶质SOD对KCN和H2O2都很敏感,因此可判断该酶是Cu.Zn-SOD[1]。该结果与文献报道的高等植物细胞溶质中的SOD均是Cu.Zn-SOD的结论相符。

, 百拇医药
A:Activity dyeing of enzyme
B:Dyeing of protein
Fig 1 Polyacrylamide gel electrophoretic patterns of SOD from cabbage plasma
经原子吸收光谱法测定,每1mol酶样品中含1.8mol/LCu、2.0mol/LZn、0.18mol/LFe,而Mn的含量低于检测水平。其Cu∶Zn=0.9∶1,进一步证明甘蓝细胞溶质SOD是一种Cu.Zn-SOD[1]。
3.2 酶的性质
3.2.1 吸收光谱 该酶的紫外吸收峰在265nm,而不在280nm。图2)这是因为它不含色氨酸,只含7个酪氨酸,而含有13个苯丙氨酸之故。不同来源的Cu.Zn-SOD紫外吸收峰均在260nm。附近,而Mn-SOD和Fe-SOD的吸收峰均在280nm附近[10-11]。该酶在可见光区的吸收峰为680nm,而Mn-SOD和Fe-SOD无此特征峰,可见该酶分子中含有铜,此吸收光谱反映了二价铜离子的光谱特性。吸收光谱测定的结果也表明该酶是Cu.Zn-SOD。

, 百拇医药
Fig 2 Absorption spectrum of SOD from cabbage plasma
3.2.2 Mr与亚基Mr 由于SOD的分子带和亚基分子带在SDS-PAGE中均可同时出现,故可同时用于测定其Mr与亚基Mr。经SDS-PAGE法测定,其Mr约为32200,其亚基Mr约为16000,见图3。根据标准蛋白分子量的对数和其对应的相对迁移率数据计算,得到的直线方程(回归方程)很好,其相关系数γ=0.998。图3表明该酶是由两个相同的亚基组成。小白菜细胞溶质SODMr和亚基Mr分别为32000和16000[2]。本结果与其他文献所报道的一样,证实不同来源的Cu.Zn-SODMr一般均在32000左右,且由两个相同的亚基组成[1]。

, 百拇医药
The following proteins are used as markers:
1.PhsphrylaseB(94 000) 2.Albumin(67 000)
3.Actin(43 000) 4.Carbonic anhydrase(30 000)
5.TMV(17 500) 6.Cytochrome(12 300)
Fig 3 Molecular weight determination of the subunit of SOD by SDS-PAGE
3.2.3 氨基酸组成 经氨基酸自动分析仪分析,甘蓝细胞溶质SOD的氨 基酸组成如表2所示。
Tab 2 Amino acid analysis of SOD from cabbage plas ma(residue/molecule)
, 百拇医药
Amino acid
Reckoning
value
Integer value
Amino acid
Reckoning
value
Integer value
Asp
26.6
27
Ser
, http://www.100md.com
20.7
21
Gly
33.4
33
Cys
1.4
1
Met
0.6
1
Leu
18.8
, http://www.100md.com 19
Phe
12.8
13
His
5.7
6
Pro
18.9
19
Glu
24.6
25
Thr
, 百拇医药
17.3
17
Val
19.2
19
Ala
22.8
23
Tyr
7.3
7
Ile
10.7
, 百拇医药
11
Arg
8.9
9
Lys
14.7
15
Sum total
266
Trp
0
0
由表2可见,该酶分子约由266个氨基酸残基组成,含17种氨基酸,不含色氨酸。
, 百拇医药
3.2.4 N-末端氨基酸 测得该酶N-末端氨基酸是丙氨酸。样品经聚酰胺薄膜单向和双向层析,均只出现DNS-丙氨酸斑点,未出现其他DNS-氨基酸斑点,这也进一步证明该酶已纯化到均一程度。小白菜细胞溶质和叶绿体的Cu.Zn-SOD的N-末端氨基酸亦是丙基酸[2,3],而线粒体Mn-SOD的N-末端氨基酸是缬氨酸[4]。参考文献
1 林元藻,王凤山,王转花主编.生化制药学.北京:人民卫生出版社,1998.207
2 邹国林,罗时文.一种小白菜叶细胞溶质铜锌超氧化物歧化酶的纯化和性质研究.生物化学杂志,1989,5(2):182
3 邹国林,罗时文,荣俊,等.小白菜叶绿体铜锌超氧化物歧化酶的纯化和某些性质研究.生物化学与生物物理学报,1989,21(1):51
, 百拇医药
4 邹国林,罗时文,裘名宜,等.小白菜线粒体锰超氧化物歧化酶的纯化和性质研究.生物化学与生物物理学报,1992,24(2):180
5 唐双焱,邹国林,金建明.小葱叶胞质中3种Cu,Zn-SOD的纯化及性质研究.中国生物化学与分子生物学报,1998,14(6):796
6 Beauchamp C , Fridovich I. Superoxide dismutase:improved assays and ass ay applicable to acrylamide gels. Anal Biochem , 1971,44:276
7 Bradford M M . A rapid and sensitive method for the quantitation o f microgram quantities of protein utilizing the principle of protein-dye binding. Anal biochem , 1976,72:248
, 百拇医药
8 赵永芳.生物化学技术原理及其应用.武汉:武汉大学出版社,1988.343,6 5
9 邹国林.对SOD研究中若干问题的看法.中国生化药物杂志,1995,16(4):186
10 Baum J A, Scandalios J G. Isolation and characterization of the cytosolic and mitochondriai superoxide dismutase of maize. Arch Biochem Biophys,1981,206:249
11 Salin M L, Bridges S M. Isolation and characterization of an iron-containing superoxide dismutase from a eucaryote, Brassica campestris. Arch Bioche Biophys ,1980, 201:369
收稿日期:199-03-05, 百拇医药