Wilson’s病8号外显子突变研究
作者:徐评议 梁秀龄 马少春
单位:徐评议 梁秀龄 马少春(510080广州,中山医科大学附属第一医院神经内科)
关键词:Wilsons病;基因突变;核酸序列分析
Wilson 【摘要】 目的 对中国人WD基因8号外显子进行突变分析。方法 对中国人Wilson's病(Wilson's disease,WD)45例患者以及20例正常人的ATP7B基因8号外显子进行SSCP分析,对有异常者进行测序,根据突变点序列设计合适的内切酶对所有患者进行酶切分析。结果 正常组未见异常。患者组发现exon 8有泳动异常,序列分析证实G2273T置换,即Arg778Leu突变。用限制性内切酶Msp Ⅰ对45例患者以及20例正常对照进行该位点酶切分析,表明正常组未见异常,患者组有2例突变纯合子,占患者总数4.4%,11例杂合子,占12.2%。外显子8的Arg778Leu突变率占WD突变基因的16.67%。检测了2个突变家系。结论 8号外显子突变可能是中国人WD发病的较重要原因。
, http://www.100md.com
Study on mutation of exon 8 of Wilson's disease gene
XU Pingyi*, LIANG Xiuling, MA Shaochun
*Department of Neurology, First Affiliated Hospital,Sun Yat-sen University of Medical Sciences, Guangzhou, 510080 P.R.China
【Abstract】 Objective To analyze the frequency of mutation in exon 8 of Wilson's disease(WD) gene in Chinese people.Methods Screening for ATP7B gene mutation was conducted in 45 WD patients. Mobility shift of exon 8 was analyzed by SSCP. Nucleotide sequence of exon 8 was analyzed, and the PCR products were cut by enzyme Msp Ⅰ. The authors found G2273T mutation at codon 778, and according to this mutation sequence, made an analysis of enzyme cut by Msp Ⅰ in all patients. 2 WD families were analyzed.Results No abnormality was found in 20 controls. In 45 patients, 2 were homozygous (4.4%) and 11 heterozygous(12.2%). The positive rate of mutation was 16.67%. The Arg778Leu mutation was validated by this study.Conclusion The mutation in exon 8 of WD gene may play an important role in pathogenesis of Wilson's disease in Chinese.
, 百拇医药
【Key words】 Wilson's disease Gene mutation Nucleotide sequence analysis
肝豆状核变性又称Wilson's病(Wilson's dis-ease, WD),是一种常染色体隐性遗传性疾病,以铜代谢障碍为特征,主要表现为肝和神经系统病变。该病基因定位于13q14.3区[1],基因含有21个外显子,编码1 411个氨基酸。其蛋白产物为一铜转运ATP酶。自1993年起多位学者对其基因突变位点等进行了深入的研究[2-4],目前已有将近95种突变类型被发现[5,6],但对中国人的WD基因突变类型和高频突变点的报道甚少。为了探讨中国人WD患者的突变特点,我们对45个WD患者进行PCR-SSCP分析,异常泳动者进行DNA测序,并设计了基因突变点的酶切检测,其结果报告如下。
, http://www.100md.com 1 材料与方法
1.1 DNA标本收集 收集20例无亲缘关系正常个体及45名来自全国各地已确诊为WD患者及2个WD完整家系成员外周抗凝全血10ml,经酚-氯仿抽提法提取白细胞DNA。正常个体标本由中山医科大学附一院血库提供。WD患者经本科确诊,具有典型锥体外系症状和体征,角膜K-F环阳性以及血清铜蓝蛋白水平低下,24小时尿铜含量升高等生化特征。
1.2 基因突变筛查的PCR-SSCP法 8号外显子扩增设计参照文献[5]。25μlPCR反应体系中,含1μl DNA样品,20pmol引物,1×PCR缓冲液,0.2mmol dNTP,1U Taq酶(PE公司);97℃变性10分钟后,94℃ 30秒,退火50秒,72℃每分钟循环35次,最后72℃延伸10分钟,扩增产物经1%普通琼酯糖电泳鉴定后,按文献[7]方法稍作改良进行SSCP分析。PCR产物8μl加8μl甲酰胺变性剂(95%去离子甲酰胺、0.03%溴酚蓝、0.02%二甲苯晴),97℃变性5分钟,-20℃立即上样至6%或8%的聚丙酰凝胶(Acr∶Bis=49∶1)中,以0.5× TEB为电泳缓冲液,4℃ 200V电泳4~5小时,取胶后用银染法[8]观察结果。
, 百拇医药
1.3 PCR双链模板的直接测序 按参考文献[9]进行。25~50μl PCR产物经透析袋法纯化后,用超纯水溶解后测浓度。将此双链模板与测序引物以1∶20浓度混合,按美国USB公司的Sequenase Ver.2测序盒说明和北京亚辉生物医学工程公司的α-32P-dATP37TBq/L(10Ci/L)进行标记和延伸反应。以每孔3.5μl上样于含7mol/L尿素的6%聚丙烯酰胺变性凝胶中1200V电泳4小时,放射性自显影12~24小时。
1.4 PCR产物酶切检测 PCR产物4μl加入20μl MspⅠ(Biolabs公司),12μl反应体积,37℃酶切6~8小时。酶切后产物经8%的非变性丙烯酰胺进行电泳,缓冲液0.5×TBE。Marker采用pGEM-7ZF(+)/Hae Ⅲ标记(华美公司)。25℃ 100V电泳2小时。电泳后EB染色2分钟,紫外透射灯下观察结果。
2 结果
, 百拇医药
2.1 PCR-SSCP结果 在对45例患者和20例正常对照的8号外显子进行SSCP筛选时,正常对照组均未见异常,患者组有3个泳动异常,家系分析发现有两个为多态现象,另一例家系分析表明,患者的祖母、外祖父、外祖母、母亲、妹妹均显示正常,患者的单链位置明显与家人不同,而患者的父亲、祖父则出现4条带,其中两条与正常的位置表现相同,另外两条则与患者的两条位置相同。
2.2 基因突变的序列分析 将上述异常表现的患者和其父亲及1例正常人的exon 8 PCR产物纯化后测序,两次独立进行的实验结果并与Genebank中的ATP7B基因序列对比发现,患者在WD基因8号外显子778密码2273位点发现纯合的G→T突变,是CGG变成CTG,使之编码的亲水的Arg被疏水的Leu置换,引起该基因表达产物的变化,很可能引起功能缺失。其父亲的序列分析发现在2273位点存在杂合状态,G及T碱基同时存在同一位置。
2.3 酶切结果 见图1。由于8号外显子突变点778密码子CGG→CTG,Msp Ⅰ酶切位点消失,故正常标本酶切片段为256bp、30bp两个片段,而在患者中,发现2例纯合子,酶切时因发生突变而导致酶切位点消失,故其PCR产物没有发生变化,占患者总数4.4%。发现11例杂合子,酶切后出现两条片段约为296bp和256bp(理论上应该为3条,但其中最短的1条约30bp已跑出胶),两条的颜色深浅相近,占患者总数12.2%。检出阳性率占患者总数16.7%。其余患者均表现为酶切完全,个别在原PCR产物位置也有一条颜色极浅的带,可能是酶切不完全所致。在20例正常人对照组中,均见安全酶切的256bp和30bp两个片段,即表明无异常。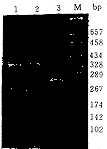
, http://www.100md.com
图1 WD基因exon 8 PCR-MspⅠ酶切分析 M:酶切电泳带,1:纯合子,2:杂合子,3:正常对照
Fig 1 The analysis of exon 8 PCR product of Wilson's disease gene digested by MspⅠ.M:Marker,1:Homozygous, 2:Heterozygous, 3:Normal control
2.4 家系分析 见图2。本研究中2个家系资料比较完整,酶切结果发现:家系1,患者男性,纯合子,祖父及父亲为杂合子,母亲及妹妹为正常。家系2,患者女性,纯合子,父母及姐、妹均为杂合子,其夫及子为正常。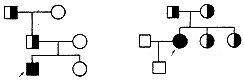
图2 WD基因exon 8 PCR-MspⅠ 2个家系分析 箭头所示为先证者
, http://www.100md.com
Fig 2 The analysis of exon 8 PCR product of Wilson's disease gene digested by MspⅠ in two families Arrow shows the proband
3 讨论
3.1 Wilson's病基因的高频突变点 1995年Thomas[5]报道在欧洲人中exon 14突变率为28%,主要发生His1070Gln突变,exon 18突变率为10%,主要发生Gly1367Lys突变,其余各外显子的突变频率均在1%~2%。我们通过对45例患者WD基因8号外显子扩增产物进行酶切检测,发现13例存在异常,酶切阳性率为16.7%,DNA测序证实为8号外显子2273位点G→T错义突变,导致778号密码子Arg778Leu突变。其结果与Thomas[5]、Lee-Ming Chung[10]等检测的结果一致,与欧洲人明显不同。
, http://www.100md.com
另外,我们研究发现45名WD患者WD基因8号外显子扩增产物经MspⅠ酶切后,纯合子占患者总数的4.4%,杂合子11例占患者总数的12.2%,检出阳性率占患者总数28.8%。在20例正常人中却无一例异常,表明778密码子的酶切异常不是一个多态性表现,而是一个病理性改变。可以认为,WD基因8号外显子778密码子错义突变可能为中国人Wilson's病基因突变的一种方式。
3.2 Arg778Leu改变与疾病的关系 已有的研究表明,WD患者基因突变一般涉及的是ATP酶切功能区,而不是金属离子结合区[3]。在欧洲患者中,exon 14突变率最高,而该外显子在ATP7B基因中处于磷酸化区(phosphorylation domain)和ATP结合区(ATP-binding domain)[2-4]。本研究结果提示exon 8突变频率为16.7%,在中国患者中频率较高,而exon 8在整个ATP7B基因中处于跨膜功能区(transmembrane domain,Tm4)[2-4],该位点发生突变,可能导致该蛋白质的一级、二级结构发生改变,使其功能丧失,导致铜转运在细胞膜上的停滞,最终导致患者致病。国内其他学者的研究以及我们的研究中(另文发表)发现在中国患者exon 14无异常,提示中国患者和欧洲患者在发病的分子遗传学基础上有差异,但临床方面的差异尚无肯定的研究报道。
, http://www.100md.com
3.3 PCR-MspⅠ酶切家系分析 目前,Wilson's病的诊断依据临床症状、体征及铜生化检测结果,对早期诊断尤其是症状前诊断存在困难,而RFLP及微卫星DNA标记对WD基因进行间接连锁分析,其结果又存在局限性,因此,利用WD基因高频突变点对其进行PCR酶切分析则方便快速。我们对2个WD家系开展的PCR-Msp Ⅰ分析,其结果是较准确地检出了2名异常纯合子、6名杂合子及4名正常人,诊断信息为100%。说明WD基因8号外显子高频突变点的发现,对开展中国人群中WD基因筛查具有较重要意义。
本课题由国家自然科学基金(39670270)和广东省自然科学基金(95434)资助
参考文献
[1] 徐评议,梁秀龄,刘焯霖,等.中国人D13S31位点多态性及与肝豆状核变性的连锁关系.中山医科大学学报,1995,16(1)∶17-21.
, http://www.100md.com
[2] Bull PC, Thomas GR, Rommens JM, et al.The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene.Nature Genet,1993,5(12)∶327-337.
[3] Tanzi RE, Petrukhin K, Chernov I, et al.The Wilson disease gene is a copper transporting ATPase with homology to the Menkes disease gene. Nature Genet, 1993,5(12)∶344-350.
[4] Petrukhin K, Fischer SG, Pirastu M, et al.Mapping, cloning and genetic characterization of the region containing the Wilson disease gene. Nature Genet, 1993,5(12)∶338-342.
, 百拇医药
[5] Thomas GR, John RF, Cox DW, et al. The Wilson's disease gene:spectrum of mutations and their consequences. Nature Genet, 1995,9(1)∶210.
[6] Shimizu K, Kawase C, Nakazono H, et al.A novel RNA splicing mutation in Japanese patients with Wilson's disease. Bioch Biophys Res Commun, 1995,217(113)∶16-220.
[7] Kenshi H, Saiki R, Gelfand DH, et al. PCR-SSCP:a method for detection of mutations. Science, 1988,239(13)∶487.
, 百拇医药
[8] Budo WB, Chak RR, Audren EB, et al.Analysis of the VNTR locus Dis 80 by the PCR followed by high-resolution PAGE. Am J Hum Genet, 1991,48(6)∶137.
[9] Reishe V. A rapid protocol for DNA extraction and primer annealing for PCR sequencing. Biotech, 1994,17(5)∶842.
[10] Chuand LM,Wu HP, Jang MH, et al.High frequency of two mutations in codon 778 in exon 8 of the ATP7B gene in Taiwanese families with Wilson's disease. J Med Genet, 1996,33(9)∶521-523.
(收稿:1998-04-03 修回:1998-10-23), http://www.100md.com
单位:徐评议 梁秀龄 马少春(510080广州,中山医科大学附属第一医院神经内科)
关键词:Wilsons病;基因突变;核酸序列分析
Wilson 【摘要】 目的 对中国人WD基因8号外显子进行突变分析。方法 对中国人Wilson's病(Wilson's disease,WD)45例患者以及20例正常人的ATP7B基因8号外显子进行SSCP分析,对有异常者进行测序,根据突变点序列设计合适的内切酶对所有患者进行酶切分析。结果 正常组未见异常。患者组发现exon 8有泳动异常,序列分析证实G2273T置换,即Arg778Leu突变。用限制性内切酶Msp Ⅰ对45例患者以及20例正常对照进行该位点酶切分析,表明正常组未见异常,患者组有2例突变纯合子,占患者总数4.4%,11例杂合子,占12.2%。外显子8的Arg778Leu突变率占WD突变基因的16.67%。检测了2个突变家系。结论 8号外显子突变可能是中国人WD发病的较重要原因。
, http://www.100md.com
Study on mutation of exon 8 of Wilson's disease gene
XU Pingyi*, LIANG Xiuling, MA Shaochun
*Department of Neurology, First Affiliated Hospital,Sun Yat-sen University of Medical Sciences, Guangzhou, 510080 P.R.China
【Abstract】 Objective To analyze the frequency of mutation in exon 8 of Wilson's disease(WD) gene in Chinese people.Methods Screening for ATP7B gene mutation was conducted in 45 WD patients. Mobility shift of exon 8 was analyzed by SSCP. Nucleotide sequence of exon 8 was analyzed, and the PCR products were cut by enzyme Msp Ⅰ. The authors found G2273T mutation at codon 778, and according to this mutation sequence, made an analysis of enzyme cut by Msp Ⅰ in all patients. 2 WD families were analyzed.Results No abnormality was found in 20 controls. In 45 patients, 2 were homozygous (4.4%) and 11 heterozygous(12.2%). The positive rate of mutation was 16.67%. The Arg778Leu mutation was validated by this study.Conclusion The mutation in exon 8 of WD gene may play an important role in pathogenesis of Wilson's disease in Chinese.
, 百拇医药
【Key words】 Wilson's disease Gene mutation Nucleotide sequence analysis
肝豆状核变性又称Wilson's病(Wilson's dis-ease, WD),是一种常染色体隐性遗传性疾病,以铜代谢障碍为特征,主要表现为肝和神经系统病变。该病基因定位于13q14.3区[1],基因含有21个外显子,编码1 411个氨基酸。其蛋白产物为一铜转运ATP酶。自1993年起多位学者对其基因突变位点等进行了深入的研究[2-4],目前已有将近95种突变类型被发现[5,6],但对中国人的WD基因突变类型和高频突变点的报道甚少。为了探讨中国人WD患者的突变特点,我们对45个WD患者进行PCR-SSCP分析,异常泳动者进行DNA测序,并设计了基因突变点的酶切检测,其结果报告如下。
, http://www.100md.com 1 材料与方法
1.1 DNA标本收集 收集20例无亲缘关系正常个体及45名来自全国各地已确诊为WD患者及2个WD完整家系成员外周抗凝全血10ml,经酚-氯仿抽提法提取白细胞DNA。正常个体标本由中山医科大学附一院血库提供。WD患者经本科确诊,具有典型锥体外系症状和体征,角膜K-F环阳性以及血清铜蓝蛋白水平低下,24小时尿铜含量升高等生化特征。
1.2 基因突变筛查的PCR-SSCP法 8号外显子扩增设计参照文献[5]。25μlPCR反应体系中,含1μl DNA样品,20pmol引物,1×PCR缓冲液,0.2mmol dNTP,1U Taq酶(PE公司);97℃变性10分钟后,94℃ 30秒,退火50秒,72℃每分钟循环35次,最后72℃延伸10分钟,扩增产物经1%普通琼酯糖电泳鉴定后,按文献[7]方法稍作改良进行SSCP分析。PCR产物8μl加8μl甲酰胺变性剂(95%去离子甲酰胺、0.03%溴酚蓝、0.02%二甲苯晴),97℃变性5分钟,-20℃立即上样至6%或8%的聚丙酰凝胶(Acr∶Bis=49∶1)中,以0.5× TEB为电泳缓冲液,4℃ 200V电泳4~5小时,取胶后用银染法[8]观察结果。
, 百拇医药
1.3 PCR双链模板的直接测序 按参考文献[9]进行。25~50μl PCR产物经透析袋法纯化后,用超纯水溶解后测浓度。将此双链模板与测序引物以1∶20浓度混合,按美国USB公司的Sequenase Ver.2测序盒说明和北京亚辉生物医学工程公司的α-32P-dATP37TBq/L(10Ci/L)进行标记和延伸反应。以每孔3.5μl上样于含7mol/L尿素的6%聚丙烯酰胺变性凝胶中1200V电泳4小时,放射性自显影12~24小时。
1.4 PCR产物酶切检测 PCR产物4μl加入20μl MspⅠ(Biolabs公司),12μl反应体积,37℃酶切6~8小时。酶切后产物经8%的非变性丙烯酰胺进行电泳,缓冲液0.5×TBE。Marker采用pGEM-7ZF(+)/Hae Ⅲ标记(华美公司)。25℃ 100V电泳2小时。电泳后EB染色2分钟,紫外透射灯下观察结果。
2 结果
, 百拇医药
2.1 PCR-SSCP结果 在对45例患者和20例正常对照的8号外显子进行SSCP筛选时,正常对照组均未见异常,患者组有3个泳动异常,家系分析发现有两个为多态现象,另一例家系分析表明,患者的祖母、外祖父、外祖母、母亲、妹妹均显示正常,患者的单链位置明显与家人不同,而患者的父亲、祖父则出现4条带,其中两条与正常的位置表现相同,另外两条则与患者的两条位置相同。
2.2 基因突变的序列分析 将上述异常表现的患者和其父亲及1例正常人的exon 8 PCR产物纯化后测序,两次独立进行的实验结果并与Genebank中的ATP7B基因序列对比发现,患者在WD基因8号外显子778密码2273位点发现纯合的G→T突变,是CGG变成CTG,使之编码的亲水的Arg被疏水的Leu置换,引起该基因表达产物的变化,很可能引起功能缺失。其父亲的序列分析发现在2273位点存在杂合状态,G及T碱基同时存在同一位置。
2.3 酶切结果 见图1。由于8号外显子突变点778密码子CGG→CTG,Msp Ⅰ酶切位点消失,故正常标本酶切片段为256bp、30bp两个片段,而在患者中,发现2例纯合子,酶切时因发生突变而导致酶切位点消失,故其PCR产物没有发生变化,占患者总数4.4%。发现11例杂合子,酶切后出现两条片段约为296bp和256bp(理论上应该为3条,但其中最短的1条约30bp已跑出胶),两条的颜色深浅相近,占患者总数12.2%。检出阳性率占患者总数16.7%。其余患者均表现为酶切完全,个别在原PCR产物位置也有一条颜色极浅的带,可能是酶切不完全所致。在20例正常人对照组中,均见安全酶切的256bp和30bp两个片段,即表明无异常。

, http://www.100md.com
图1 WD基因exon 8 PCR-MspⅠ酶切分析 M:酶切电泳带,1:纯合子,2:杂合子,3:正常对照
Fig 1 The analysis of exon 8 PCR product of Wilson's disease gene digested by MspⅠ.M:Marker,1:Homozygous, 2:Heterozygous, 3:Normal control
2.4 家系分析 见图2。本研究中2个家系资料比较完整,酶切结果发现:家系1,患者男性,纯合子,祖父及父亲为杂合子,母亲及妹妹为正常。家系2,患者女性,纯合子,父母及姐、妹均为杂合子,其夫及子为正常。
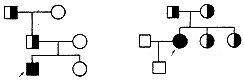
图2 WD基因exon 8 PCR-MspⅠ 2个家系分析 箭头所示为先证者
, http://www.100md.com
Fig 2 The analysis of exon 8 PCR product of Wilson's disease gene digested by MspⅠ in two families Arrow shows the proband
3 讨论
3.1 Wilson's病基因的高频突变点 1995年Thomas[5]报道在欧洲人中exon 14突变率为28%,主要发生His1070Gln突变,exon 18突变率为10%,主要发生Gly1367Lys突变,其余各外显子的突变频率均在1%~2%。我们通过对45例患者WD基因8号外显子扩增产物进行酶切检测,发现13例存在异常,酶切阳性率为16.7%,DNA测序证实为8号外显子2273位点G→T错义突变,导致778号密码子Arg778Leu突变。其结果与Thomas[5]、Lee-Ming Chung[10]等检测的结果一致,与欧洲人明显不同。
, http://www.100md.com
另外,我们研究发现45名WD患者WD基因8号外显子扩增产物经MspⅠ酶切后,纯合子占患者总数的4.4%,杂合子11例占患者总数的12.2%,检出阳性率占患者总数28.8%。在20例正常人中却无一例异常,表明778密码子的酶切异常不是一个多态性表现,而是一个病理性改变。可以认为,WD基因8号外显子778密码子错义突变可能为中国人Wilson's病基因突变的一种方式。
3.2 Arg778Leu改变与疾病的关系 已有的研究表明,WD患者基因突变一般涉及的是ATP酶切功能区,而不是金属离子结合区[3]。在欧洲患者中,exon 14突变率最高,而该外显子在ATP7B基因中处于磷酸化区(phosphorylation domain)和ATP结合区(ATP-binding domain)[2-4]。本研究结果提示exon 8突变频率为16.7%,在中国患者中频率较高,而exon 8在整个ATP7B基因中处于跨膜功能区(transmembrane domain,Tm4)[2-4],该位点发生突变,可能导致该蛋白质的一级、二级结构发生改变,使其功能丧失,导致铜转运在细胞膜上的停滞,最终导致患者致病。国内其他学者的研究以及我们的研究中(另文发表)发现在中国患者exon 14无异常,提示中国患者和欧洲患者在发病的分子遗传学基础上有差异,但临床方面的差异尚无肯定的研究报道。
, http://www.100md.com
3.3 PCR-MspⅠ酶切家系分析 目前,Wilson's病的诊断依据临床症状、体征及铜生化检测结果,对早期诊断尤其是症状前诊断存在困难,而RFLP及微卫星DNA标记对WD基因进行间接连锁分析,其结果又存在局限性,因此,利用WD基因高频突变点对其进行PCR酶切分析则方便快速。我们对2个WD家系开展的PCR-Msp Ⅰ分析,其结果是较准确地检出了2名异常纯合子、6名杂合子及4名正常人,诊断信息为100%。说明WD基因8号外显子高频突变点的发现,对开展中国人群中WD基因筛查具有较重要意义。
本课题由国家自然科学基金(39670270)和广东省自然科学基金(95434)资助
参考文献
[1] 徐评议,梁秀龄,刘焯霖,等.中国人D13S31位点多态性及与肝豆状核变性的连锁关系.中山医科大学学报,1995,16(1)∶17-21.
, http://www.100md.com
[2] Bull PC, Thomas GR, Rommens JM, et al.The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene.Nature Genet,1993,5(12)∶327-337.
[3] Tanzi RE, Petrukhin K, Chernov I, et al.The Wilson disease gene is a copper transporting ATPase with homology to the Menkes disease gene. Nature Genet, 1993,5(12)∶344-350.
[4] Petrukhin K, Fischer SG, Pirastu M, et al.Mapping, cloning and genetic characterization of the region containing the Wilson disease gene. Nature Genet, 1993,5(12)∶338-342.
, 百拇医药
[5] Thomas GR, John RF, Cox DW, et al. The Wilson's disease gene:spectrum of mutations and their consequences. Nature Genet, 1995,9(1)∶210.
[6] Shimizu K, Kawase C, Nakazono H, et al.A novel RNA splicing mutation in Japanese patients with Wilson's disease. Bioch Biophys Res Commun, 1995,217(113)∶16-220.
[7] Kenshi H, Saiki R, Gelfand DH, et al. PCR-SSCP:a method for detection of mutations. Science, 1988,239(13)∶487.
, 百拇医药
[8] Budo WB, Chak RR, Audren EB, et al.Analysis of the VNTR locus Dis 80 by the PCR followed by high-resolution PAGE. Am J Hum Genet, 1991,48(6)∶137.
[9] Reishe V. A rapid protocol for DNA extraction and primer annealing for PCR sequencing. Biotech, 1994,17(5)∶842.
[10] Chuand LM,Wu HP, Jang MH, et al.High frequency of two mutations in codon 778 in exon 8 of the ATP7B gene in Taiwanese families with Wilson's disease. J Med Genet, 1996,33(9)∶521-523.
(收稿:1998-04-03 修回:1998-10-23), http://www.100md.com