神经酰胺介导粒细胞凋亡机理初探①
作者:
单位:辛宏 颜光涛 郝秀华 王录焕 李英丽(解放军总医院基础所生化研究室,北京 100853)
关键词:细胞凋亡;神经酰胺;bcl-2基因;c-myc基因
中国免疫学杂志/990514 摘 要 目的:观察神经酰胺对HL-60及中性粒细胞(PMN)凋亡产生的影响,探讨其在粒细胞发生过程中可能的调节作用。方法:采用DNA凝胶电泳,流式细胞术,光镜及RT-PCR等技术对细胞进行凋亡鉴定及相关基因bcl-2, c-myc mRNA表达分析。结果:神经酰胺(C2 -ceramide), 肿瘤坏死因子(TNFα)及长春新碱(Vincristine)均可不同程度地诱导HL-60及成熟PMN产生凋亡, CPK激活剂PMA, Diacylglycerol无诱凋作用, 并对TNFα,C2-ceramide及Vincristine诱导的凋亡有不同程度的抑制;上述药物刺激后bcl-2, c-myc mRNA表达在HL-60细胞中呈明显下调趋势, c-myc mRNA表达在PMN中也呈轻度下调。结论: 神经酰胺可作为HL-60、PMN胞内介质参与凋亡信号的传导,且与CPK途径及bcl-2,c-myc基因表达相关。
, http://www.100md.com
中国图书分类号 R392.12
Induction of apoptosis by ceramide in human promyelocytic cells and its mechanism
XIN Hong, YAN Guang-Tao, HAO Xiu-Hua et al.
Laboratory of Biochemistry, Basic Medical Center, General Hospital of PLA, Beijing 100853
Abstract Objective: To determine the effects of ceramide on apoptosis and regulation in granulocytes differentiation processes. Methods: DNA fragmentation, FACS , light microscope and RT-PCR were employed to determine the apoptosis and bcl-2,c-myc mRNA levels of granulocytes. Results: C2-ceramide, TNFα and Vincristine all resulted in a time and dose-dependent apoptosis of PMN and HL-60 cells.They also induced down-regulation of bcl-2,c-myc mRNA expressions in HL-60 cells and a light down-regulation of c-myc mRNA expression in PMN. A proper dose of phorbol ester (PMA) and diacylglycerol could not induce cell growth suppression but inhibite apoptosis induced by the drugs above. Conclusion: Ceramide was a mediator of apoptosis in PMN and HL-60 cell. The transduction of apoptotic signal was correlated with the CPK pathway,the down-regulation of bcl-2 and c-myc mRNA expression.
, 百拇医药
Key words Apoptosis Ceramide bcl-2 c-myc gene
细胞凋亡(Apoptosis)是细胞生理性死亡过程,在维持机体内环境稳定,减少自身免疫及炎症反应中有重要作用。中性粒细胞(PMN)是炎症反应的重要标志, 在炎症的发生、发展和转归中起至关重要的作用。PMN的清除机制仍未明确,但近年来认为通过凋亡方式在膜完整状态下被巨噬细胞识别和清除[1],是维持机体正常数量PMN,进而限制细胞损伤,促进炎症吸收的重要机制。
神经酰胺,即N-脂酰鞘氨醇(Ceramide)是神经鞘磷脂(SM)主要的水解产物, 作为一个新的第二信使分子参与调节细胞的生长,分化,特别是在介导细胞凋亡中的意义已引起人们的关注[2]。HL-60细胞是人早幼白血病细胞,但适当因子刺激(如PMA)可发生成熟性分化[3],且具有较高强度的自发生成氧的活性,使其具有一定的原始粒细胞特点,因此我们拟用HL-60细胞及成熟中性粒细胞为模型,观察加入外源神经酰胺及胞内神经酰胺诱导剂的情况下,对其凋亡产生的影响,探讨其在粒细胞发生过程中可能的调节作用,以新的角度认识炎症的发生和调控机制。
, http://www.100md.com
1 材料与方法
1.1 主要试剂和器材 C2-ceramide(N-acetyl sphingosine), 1,2-Diacylglycerol,佛波脂(PMA), 长春新碱(Vincristine)及碘化丙啶(PI)均购于Sigma公司; TNFα为邦定公司产品,AMV逆转录酶,DNA聚合酶为芬兰Finnzymes公司产品, bcl-2 cDNA克隆质粒pSBC2(阳性对照)由德国Dr.W.Dirks惠赠。流式细胞仪为美国B-D公司FACS Calibur,基因扩增仪为Biotechs公司HS-97型。
1.2 人外周血PMA分离 取健康献血者抗凝血, 按常规方法立即进行PMA分离。
1.3 细胞培养 1×106 ml-1 HL-60细胞及分离的人外周血PMA,基础培养条件为RPMI 1640培养液中含10%新生牛血清,青链霉素各100 U/ml,37℃含5% CO2 孵箱培养。
, 百拇医药
1.4 细胞基因组DNA提取及电泳 1×106 ml-1细胞按常规方法提取基因组DNA,电泳条件为1.8%琼脂糖凝胶,80 V电泳3 h, EB染色, 紫外透射下观察,拍照。
1.5 细胞总RNA提取 采用Chomozyrski异硫氰酸胍-酚-氯仿一步法[4] 。简言之, 准确计数细胞, 按5×105 ml-1加入变性液(异硫氰酸胍4 mol/L, 柠檬酸钠25 mmol/L, Sarkosyl 0.5%, β-巯基乙醇0.1 mol/L pH7.0)水饱合酚, 氯仿/异戊醇49:1, NaAc 2 mol/L pH4.0, 冰浴, 离心, 异丙醇沉淀, 真空干燥, 加10 μl DEPC*H2O溶解待用。
1.6 半定量RT-PCR测定bcl-2, c-myc mRNA表达 Oligod T18为引物, AMV作用下合成cDNA,反转录体系为20.0 μl, 含10×反转录缓冲液2.0 μl, Oligod T 18 1.0 μl(50 pmol), 4×dNTP 4.0 μl(2.5 mmol) RNasin 0.5 μl, RNA 5.0 μl, 逆转录酶4 U,42℃孵育60 min, 98℃ 3 min后, 取5.0 μl进行PCR。
, http://www.100md.com
分别合成bcl-2扩增引物 P1 5′GGACAACATCGCCCTGTG3′, P2 5′AGTCTTCAGAGAACAGCCA-
GGA3′, c-myc扩增引物P3 5′CAAGAGGCGAACACACAACGTCT3′, P4 5′AACTGTTCTCGTCGTTTCCGC-
AA3′,内参照β-action扩增引物P5 5′GCGGGAAATCGTGCGTGACATT3′;P6 5′GATGGAGTTGAGGTAGTTTCGTG3′[5,6],扩增片段分别为137,218,234 bp,50 μl扩增体系中含10×扩增缓冲液, 上下游引物各50 pmol, 4×dNTP(400 μmol),耐热DNA聚合酶0.5 U。93℃ 变性3 min后,按93℃ 35 s、55℃ 50 s、72℃ 55 s 32个循环, 72℃延伸5~10 min。10 μl PCR产物以2%琼脂糖凝胶(含溴化乙锭0.4 μg),100 V电泳20 min。紫外灯下鉴定结果。
, http://www.100md.com
1.7 流式细胞仪测定细胞凋亡 离心收集细胞(2×106 ml-1), 70%乙醇处理18 h, 离心弃上清, 少量PBS溶解细胞沉淀,加RNase(100 μg/ml), 37℃ 30 min,室温下PI(50 μg/ml)染色30 min, 流式细胞仪检测, 通过观察细胞周期变化及亚二倍体峰的出现来确认细胞凋亡及比例。
1.8 细胞形态学检查 细胞离心洗涤后, 常规制片。姬姆萨染色, 油镜观察。细胞膜完整但胞体缩小, 染色质浓缩成块或核碎裂, 判为凋亡细胞。
2 结果
2.1 体外培养PMA的自然凋亡 人外周血PMA在体外常规培养, 随时间的延长,凋亡比例增加。流式细胞分析显示12 h后出现明显的GI峰前特有的亚二倍体峰(AP峰),见图1。体外培养48 h DNA电泳出现明显的梯形降解。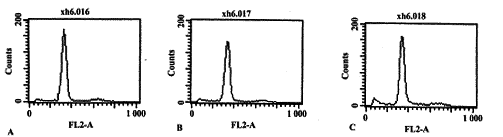
, http://www.100md.com
图1 体外培养PMN的流式细胞分析
Fig.1 Confirmation of apoptotic changes in PMN with FACS caliburNote:A.0 h; B.6 h; C.12 h
2.2 C2 -ceramide, TNFα,Vincristine对PMN及HL-60细胞的凋亡诱导
2.2.1 PMN C2 -ceramide 5 μmol/ml,TNFα 200 ng/ml, Vincristine 1 μg/ml处理8 h后,流式细胞分析可见凋亡细胞比例高于自然凋亡率(对照组: 8.09%, C2 -ceramide组: 12.82%, TNFα组: 17.90%, Vincristine组: 13.58%), DNA电泳可以发现降解明显增加。
, http://www.100md.com
2.2.2 HL-60细胞 用上述药物处理HL-60细胞24 h后, DNA电泳已可见明显梯形降解,以Vincristine 更为显著(图2)。光镜下也观察到明显凋亡改变。
图2 不同药物处理HL-60细胞24 h的DNA电泳分析
Fig.2 Agarose gel electrophoresis of genomic DNA of HL-60 cells following treatment with ceramides for 24 h
Note:1. λDNA/EcoR Ⅰ+HindⅢ; 2. 24 h normal control; 3. C2-ceramide 50 μmol/ml; 4. C2-ceramide 50 μmol/ml+PMA 400 pmol/ml; 5. C2-ceramide 50 μmol/ml+diacylglycerol 200 μmol/ml; 6. TNFα 200 ng/ml; 7. TNFα 200 ng/ml+PMA 400 pmol/ml; 8.TNFα200 ng/ml+diacylglycerol 200 μmol/ml; 9. Vincristine 1 μmol/L; 10.Vincristine 1 μg/ml+PMA 400 pmol/ml; 11. Vincristine 1 μg/ml+ diacylglycerol 200 μmol/ml
, 百拇医药
2.3 PCK激活剂Diacylglycerol及PMA对PMN及HL-60细胞凋亡的影响 Diacylglycerol 100 μmol/ml , PMA 8 pmol/ml与PMN共同培养8,18,24,48 h,可明显阻断PMN的自然凋亡。但低浓度Diacylglycerol(10 μmol/ml)无明显抑制PMN自然凋亡作用(图3)。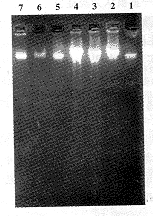
图3 Diacylglycerol, PMA处理PMN 24 h的DNA电泳分析
Fig.3 Agarose gel eletrophoresis of genomic DNA of PMN following treatment with diacylglycerol, PMA of 24 h
Note:1. λDNA/EcoR Ⅰ+HindⅢ,2. 0 h control, 3. 24 h control, 4. diacylglycerol 10 μmol/ml, 5. diacylglycerol 100 μmol/ml, 6. PMA 40 pmol/ml, 7. PMA 400 pmol/ml
, http://www.100md.com
2.4 PKC激活剂Diacylglycerol和PMA对神经酰胺类药物诱导凋亡的影响 在PMN及HL-60细胞中, Diacylglycerol(100~500 μmol/ml), PMA(40~400 pmol/ml)均可不同程度地抑制由C2-ceramide, TNFα, Vincristine所诱导的DNA降解(分别见图2,4)。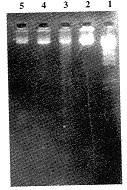
图4 C2-ceramide, diacylglycerol,PMA处理PMN 6 h的DNA电泳分析
Fig.4 Agarose gel electrophoresis of genomic DNA of PMN following treatmant with C2-caramide, diacylglycerol, PMN for 6 h
, http://www.100md.com
Note:1. λDNA/EcoR Ⅰ+HindⅢ, 2.6 h control , 3. C2-ceramide 5 μmol/ml, 4. C2-ceramide 5 μmol/ml+diacylglycerol 100 μmol/ml, 5. c2-ceramide 5 μmol/ml+PMA 40 pmol/ml
2.5 神经酰胺类药物诱导PMN及HL-60细胞凋亡过程中bcl-2, c-myc mRNA表达的改变
2.5.1 PMN 正常人外周血PMN有中等程度的c-myc mRNA表达 C2-ceramide, TNFα及Vincristine刺激后,c-myc mRNA有不同程度下调,Diacylglycerol, PMA刺激后, 观察至18 h, 未见c-myc mRNA表达有明显改变。图5显示了Diacylglycerol及PMA刺激后c-myc mRNA表达的情况。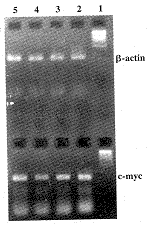
, 百拇医药
图5 Diacylglycerol, PMA处理 PMN后 c-myc mRNA表达的RT-PCR分析
Fig.5 Detection of c-myc mRNA expression with RT-PCR, following treatment PMN with diacylglycerol and PMA
Note:1. 100 bp ladder; 2. diacylglycerol 100 μmol/ml 0 h; 3. diacylglycerol 100 μmol/ml 18 h; 4. PMA 40 pmol/ml 0 h; 5. PMA 40 pmol/ml 18 h
2.5.2 HL-60细胞 在内参照扩增强度一致的情况下, bcl-2基因扩增随着C2 -ceramide,TNFα及Vincristine浓度增加及作用时间延长明显下降,以Vincristine更为明显,c-myc mRNA表达呈轻度下调。图6显示了C2 -ceramide作用后的结果。
, 百拇医药
图6 C2-ceramide处理HL-60细胞后bcl-2 mRNA表达的RT-PCR分析
Fig.6 Detection of bcl-2 mRNA expression with RT-PCR following treatment HL-60 cells with C2-ceramide
Note:1. 100 bp ladder; 2. positive control; 3. c2-ceramide 50 μmol/ml 0 h; 4. c2-ceramide 50 μmol/ml 12 h; 5. c2-ceramide 50 μmol/ml 24 h; 6. c2-ceramide 50 μmol/ml 48 h
3 讨论
, 百拇医药
炎症反应是机体对伤害刺激正常防御反应的一部分,炎症反应的启动和放大已有较多研究和解释,而对炎症的吸收机制还缺乏深入研究。中性粒细胞(PMN)是炎症反应的重要标志, 因此炎症灶内PMN的转归对炎症的发生发展至关重要。Chapes等的实验研究已发现,炎症灶内的PMN是在膜完整的状态下被巨噬细胞吞噬,认为通过凋亡方式清除炎症灶内PMN是维持炎症反应平衡的重要因素[7]。我们也发现,PMN在体外培养中可发生自发性凋亡,说明凋亡过程在PMN代谢中是非常重要的环节。
PMN凋亡是一种自身稳定性的生理性死亡,启动机制并不清楚。涉及因素很多,如Fas家族抗原表达增加, CPK途径的调解及神经酰胺诱导NFκ-B表达增高等[8]。神经酰胺是近年来引起人们极大兴趣的信号分子, 它参与细胞增殖、分化及凋亡等多个过程,被认为是细胞生长抑制和细胞程序死亡的诱导剂。国外报道以及我们前期工作已经发现神经酰胺可诱导多种细胞产生凋亡,同时由于神经酰胺的代谢途径与炎症反应所涉及的酶和细胞因子,如PLA2 、TNFα、PGE2 等密切相关[9]。因此,我们希望了解在粒细胞凋亡过程中,神经酰胺是否具有特异性的调节作用。之所以选择HL-60细胞为研究模型,一是因为文献报道在适当因子刺激下(如PMA)其可发生成熟性分化,二是因为我们前期工作已发现在PMA作用下HL-60细胞的自发活性氧生成能力很高,这在其它白血病细胞系中是没有的, 说明HL-60细胞在一定程度上具有原始粒细胞的特点。实验发现,PMN在体外培养时,加入5 μmol/L外源性、细胞渗透性神经酰胺C2-ceramide,6 h后流式细胞分析已经出现了明显的AP峰,说明PMN的凋亡可能在早期即被C2-ceramide诱导。同样,在HL-60细胞中C2 -ceramide也可诱导凋亡产生。由C2 -ceramide诱导的凋亡作用可部分程度地被一定剂量Diacylglycerol和PMA所抑制。Diacylglycerol和PMA单独刺激,在成熟PMN及原始粒细胞HL-60中,凋亡现象都有所减轻。
, 百拇医药
PMA, Diacylglycerol是CPK的激活剂,关于PKC途径在细胞凋亡中具有双重调节作用已有报道,如PMA在胸腺细胞中可促进凋亡,同时在B淋巴细胞系中则抑制凋亡。本实验中神经酰胺诱导的细胞核DNA断裂可被PKC激活物抑制,说明此时神经酰胺诱导的凋亡是特异性的,并非细胞毒性作用,同时神经酰胺诱导凋亡是与CPK途径活化密切相关。我们的结果与Jarvis等认为CPK途径可能与SM水解途径相拮抗的结论一致[10]。
TNFα一直被认为炎症发生的正性调控因子,可直接激活PMN,但同时近来资料也显示它可引起多种细胞发生凋亡,并被证明是通过促进胞内神经酰胺升高而实现此过程[11] 。我们实验中也看到,它与C2 -ceramide诱导的凋亡表现极为相似,都可被CPK激活剂所抑制,间接提示TNFα可通过升高胞内神经酰胺水平而介导凋亡发生。
Vincristine是抗肿瘤药物和胞内神经酰胺诱导剂,国外学者报道,胞内神经酰胺水平在加入Vincristine后8 h明显升高,12 h可达高峰[12] ,但这种变化与TNFα IL-1等诱导的胞内神经酰胺上升并不完全一致。实验发现Vincristine可使HL-60细胞产生更快、更强的凋亡,而在PMN中这种诱凋作用并未明显强于C2-ceramide和TNFα, 可能提示Vincristine诱导的细胞凋亡途径与前二者并不完全相同。
, 百拇医药
Bcl-2为凋亡抑制基因,在HL-60细胞中有中等程度的表达。TNFα、Vicristine及C2 -ceramide作用后,bcl-2 mRNA的表达呈显著下调,说明神经酰胺类药物诱导的HL-60细胞凋亡与bcl-2基因的抑制有明确关系,可能通过最终抑制bcl-2基因表达来实现其促凋作用。
c-myc原癌基因不仅参与细胞增殖,也在细胞凋亡过程中起作用。外源导入c-myc或抑制c-myc表达均有诱导凋亡的报道。HL-60细胞及PMN均有中等程度的c-myc mRNA表达,神经酰胺类药物的刺激, 使c-myc的表达均下调,在PMN中更为明显。CPK激活剂刺激后c-myc无明显下调改变。提示胞内神经酰胺诱导的粒细胞凋亡,与c-myc水平的降低有关。
总之,我们初步的工作表明神经酰胺在粒细胞凋亡过程中,有明确的调节作用。不仅可直接诱导原始粒细胞产生凋亡,在终末粒细胞的自然凋亡中也起促进作用。同时通过对胞内神经酰胺诱导剂TNFα及Vincristine促进凋亡的研究,间接提示神经酰胺可作为HL-60及PMN胞内介质参与凋亡的信号传导,胞内信号还涉及CPK途径的调节,并最终改变与凋亡密切相关的bcl-2, c-myc 基因表达而引起凋亡。
, http://www.100md.com
①本课题为国家自然科学基金资助项目(39770716)
作者简介:辛 宏,女,36岁,助理研究员,主要从事细胞凋亡研究;
颜光涛,男, 38岁,研究员,硕士生导师,主要从事炎症分子机理研究
4 参考文献
[1] Haslett C. Resolution of acute inflammation and the role of apoptosis in the tissue fate of granulocytes. Clin Sci,1992;83:639
[2] Leslie R B, Stanley J F, Edward F et al. Ceramide signalling and the immune response. Biochim Biophys Acta,1996;1301:273
, http://www.100md.com
[3] Adalbeoto B, Didier G, Gabrid N et al. Regulation and function of bcl-2 duing differentiation induced cell death in HL-60 promyelocytic cells. American J Patho, 1995;146;481
[4] Chomcaynski P, Sacchi N .Single-step method of RNA isolation by acid Guanidium thiocyanate-phenol-chloroform extraction. Anal Biochem,1987;162:156
[5] Alessandro Q, Laura P, Valeria S et al. Quantilation of bcl-2 oncogene in cultured lymphoma/leukemia cell lines and in primary leukemia B-cells by a highly sensitive RT-PCR method. Heamatologica,1995;80:495
, 百拇医药
[6] Howard Wong, Willian D A, Ting C et al. Monitoring mRNA expression by polymerase chain reaction, the primer-dropping method. Anacytical Biochemistry,1994;223:251
[7] Chapes S K, Haskill S. Eviolence of granulocyte-mediated macrophage activation after C parvum immunization. Cell Immunol,1983;75:367
[8] Mariva P, Lina M O, Hannun Y A. Ceramide: an endogenous regulator of apoptosis and growth suppression. Immnotogy Today,1995;16:294
, 百拇医药
[9] Jaattela M, Benedict M, Tewari et al. Bcl-x and Bcl-2 inhibit TNF and fas-induced apoptosis and activation of phospholipase A2 in breast carcinoma cells. Oncogen,1995;10:2297
[10] Jarvis W D,Fornar F A, Browning J L et al. Attenuation of ceramide-induced apoptosis by diglyceride in human myeloid leukmia cells. J Biol Chen,1994;269:31685
[11] Obeid L M, Linardic C M, Karolak L A et al. Programmed cell death induced by ceramide. Science,1993;259:1769
[12] Jiandiz S, Nejemie A, Johe C et al. Bcl-2 interrupts the ceramide-mediated pathway of cell death. Proc Natl Acad Sci ZZUSA,1996;93:5325
〔收稿1998-09-29 修回1998-11-20〕, 百拇医药
单位:辛宏 颜光涛 郝秀华 王录焕 李英丽(解放军总医院基础所生化研究室,北京 100853)
关键词:细胞凋亡;神经酰胺;bcl-2基因;c-myc基因
中国免疫学杂志/990514 摘 要 目的:观察神经酰胺对HL-60及中性粒细胞(PMN)凋亡产生的影响,探讨其在粒细胞发生过程中可能的调节作用。方法:采用DNA凝胶电泳,流式细胞术,光镜及RT-PCR等技术对细胞进行凋亡鉴定及相关基因bcl-2, c-myc mRNA表达分析。结果:神经酰胺(C2 -ceramide), 肿瘤坏死因子(TNFα)及长春新碱(Vincristine)均可不同程度地诱导HL-60及成熟PMN产生凋亡, CPK激活剂PMA, Diacylglycerol无诱凋作用, 并对TNFα,C2-ceramide及Vincristine诱导的凋亡有不同程度的抑制;上述药物刺激后bcl-2, c-myc mRNA表达在HL-60细胞中呈明显下调趋势, c-myc mRNA表达在PMN中也呈轻度下调。结论: 神经酰胺可作为HL-60、PMN胞内介质参与凋亡信号的传导,且与CPK途径及bcl-2,c-myc基因表达相关。
, http://www.100md.com
中国图书分类号 R392.12
Induction of apoptosis by ceramide in human promyelocytic cells and its mechanism
XIN Hong, YAN Guang-Tao, HAO Xiu-Hua et al.
Laboratory of Biochemistry, Basic Medical Center, General Hospital of PLA, Beijing 100853
Abstract Objective: To determine the effects of ceramide on apoptosis and regulation in granulocytes differentiation processes. Methods: DNA fragmentation, FACS , light microscope and RT-PCR were employed to determine the apoptosis and bcl-2,c-myc mRNA levels of granulocytes. Results: C2-ceramide, TNFα and Vincristine all resulted in a time and dose-dependent apoptosis of PMN and HL-60 cells.They also induced down-regulation of bcl-2,c-myc mRNA expressions in HL-60 cells and a light down-regulation of c-myc mRNA expression in PMN. A proper dose of phorbol ester (PMA) and diacylglycerol could not induce cell growth suppression but inhibite apoptosis induced by the drugs above. Conclusion: Ceramide was a mediator of apoptosis in PMN and HL-60 cell. The transduction of apoptotic signal was correlated with the CPK pathway,the down-regulation of bcl-2 and c-myc mRNA expression.
, 百拇医药
Key words Apoptosis Ceramide bcl-2 c-myc gene
细胞凋亡(Apoptosis)是细胞生理性死亡过程,在维持机体内环境稳定,减少自身免疫及炎症反应中有重要作用。中性粒细胞(PMN)是炎症反应的重要标志, 在炎症的发生、发展和转归中起至关重要的作用。PMN的清除机制仍未明确,但近年来认为通过凋亡方式在膜完整状态下被巨噬细胞识别和清除[1],是维持机体正常数量PMN,进而限制细胞损伤,促进炎症吸收的重要机制。
神经酰胺,即N-脂酰鞘氨醇(Ceramide)是神经鞘磷脂(SM)主要的水解产物, 作为一个新的第二信使分子参与调节细胞的生长,分化,特别是在介导细胞凋亡中的意义已引起人们的关注[2]。HL-60细胞是人早幼白血病细胞,但适当因子刺激(如PMA)可发生成熟性分化[3],且具有较高强度的自发生成氧的活性,使其具有一定的原始粒细胞特点,因此我们拟用HL-60细胞及成熟中性粒细胞为模型,观察加入外源神经酰胺及胞内神经酰胺诱导剂的情况下,对其凋亡产生的影响,探讨其在粒细胞发生过程中可能的调节作用,以新的角度认识炎症的发生和调控机制。
, http://www.100md.com
1 材料与方法
1.1 主要试剂和器材 C2-ceramide(N-acetyl sphingosine), 1,2-Diacylglycerol,佛波脂(PMA), 长春新碱(Vincristine)及碘化丙啶(PI)均购于Sigma公司; TNFα为邦定公司产品,AMV逆转录酶,DNA聚合酶为芬兰Finnzymes公司产品, bcl-2 cDNA克隆质粒pSBC2(阳性对照)由德国Dr.W.Dirks惠赠。流式细胞仪为美国B-D公司FACS Calibur,基因扩增仪为Biotechs公司HS-97型。
1.2 人外周血PMA分离 取健康献血者抗凝血, 按常规方法立即进行PMA分离。
1.3 细胞培养 1×106 ml-1 HL-60细胞及分离的人外周血PMA,基础培养条件为RPMI 1640培养液中含10%新生牛血清,青链霉素各100 U/ml,37℃含5% CO2 孵箱培养。
, 百拇医药
1.4 细胞基因组DNA提取及电泳 1×106 ml-1细胞按常规方法提取基因组DNA,电泳条件为1.8%琼脂糖凝胶,80 V电泳3 h, EB染色, 紫外透射下观察,拍照。
1.5 细胞总RNA提取 采用Chomozyrski异硫氰酸胍-酚-氯仿一步法[4] 。简言之, 准确计数细胞, 按5×105 ml-1加入变性液(异硫氰酸胍4 mol/L, 柠檬酸钠25 mmol/L, Sarkosyl 0.5%, β-巯基乙醇0.1 mol/L pH7.0)水饱合酚, 氯仿/异戊醇49:1, NaAc 2 mol/L pH4.0, 冰浴, 离心, 异丙醇沉淀, 真空干燥, 加10 μl DEPC*H2O溶解待用。
1.6 半定量RT-PCR测定bcl-2, c-myc mRNA表达 Oligod T18为引物, AMV作用下合成cDNA,反转录体系为20.0 μl, 含10×反转录缓冲液2.0 μl, Oligod T 18 1.0 μl(50 pmol), 4×dNTP 4.0 μl(2.5 mmol) RNasin 0.5 μl, RNA 5.0 μl, 逆转录酶4 U,42℃孵育60 min, 98℃ 3 min后, 取5.0 μl进行PCR。
, http://www.100md.com
分别合成bcl-2扩增引物 P1 5′GGACAACATCGCCCTGTG3′, P2 5′AGTCTTCAGAGAACAGCCA-
GGA3′, c-myc扩增引物P3 5′CAAGAGGCGAACACACAACGTCT3′, P4 5′AACTGTTCTCGTCGTTTCCGC-
AA3′,内参照β-action扩增引物P5 5′GCGGGAAATCGTGCGTGACATT3′;P6 5′GATGGAGTTGAGGTAGTTTCGTG3′[5,6],扩增片段分别为137,218,234 bp,50 μl扩增体系中含10×扩增缓冲液, 上下游引物各50 pmol, 4×dNTP(400 μmol),耐热DNA聚合酶0.5 U。93℃ 变性3 min后,按93℃ 35 s、55℃ 50 s、72℃ 55 s 32个循环, 72℃延伸5~10 min。10 μl PCR产物以2%琼脂糖凝胶(含溴化乙锭0.4 μg),100 V电泳20 min。紫外灯下鉴定结果。
, http://www.100md.com
1.7 流式细胞仪测定细胞凋亡 离心收集细胞(2×106 ml-1), 70%乙醇处理18 h, 离心弃上清, 少量PBS溶解细胞沉淀,加RNase(100 μg/ml), 37℃ 30 min,室温下PI(50 μg/ml)染色30 min, 流式细胞仪检测, 通过观察细胞周期变化及亚二倍体峰的出现来确认细胞凋亡及比例。
1.8 细胞形态学检查 细胞离心洗涤后, 常规制片。姬姆萨染色, 油镜观察。细胞膜完整但胞体缩小, 染色质浓缩成块或核碎裂, 判为凋亡细胞。
2 结果
2.1 体外培养PMA的自然凋亡 人外周血PMA在体外常规培养, 随时间的延长,凋亡比例增加。流式细胞分析显示12 h后出现明显的GI峰前特有的亚二倍体峰(AP峰),见图1。体外培养48 h DNA电泳出现明显的梯形降解。

, http://www.100md.com
图1 体外培养PMN的流式细胞分析
Fig.1 Confirmation of apoptotic changes in PMN with FACS caliburNote:A.0 h; B.6 h; C.12 h
2.2 C2 -ceramide, TNFα,Vincristine对PMN及HL-60细胞的凋亡诱导
2.2.1 PMN C2 -ceramide 5 μmol/ml,TNFα 200 ng/ml, Vincristine 1 μg/ml处理8 h后,流式细胞分析可见凋亡细胞比例高于自然凋亡率(对照组: 8.09%, C2 -ceramide组: 12.82%, TNFα组: 17.90%, Vincristine组: 13.58%), DNA电泳可以发现降解明显增加。
, http://www.100md.com
2.2.2 HL-60细胞 用上述药物处理HL-60细胞24 h后, DNA电泳已可见明显梯形降解,以Vincristine 更为显著(图2)。光镜下也观察到明显凋亡改变。

图2 不同药物处理HL-60细胞24 h的DNA电泳分析
Fig.2 Agarose gel electrophoresis of genomic DNA of HL-60 cells following treatment with ceramides for 24 h
Note:1. λDNA/EcoR Ⅰ+HindⅢ; 2. 24 h normal control; 3. C2-ceramide 50 μmol/ml; 4. C2-ceramide 50 μmol/ml+PMA 400 pmol/ml; 5. C2-ceramide 50 μmol/ml+diacylglycerol 200 μmol/ml; 6. TNFα 200 ng/ml; 7. TNFα 200 ng/ml+PMA 400 pmol/ml; 8.TNFα200 ng/ml+diacylglycerol 200 μmol/ml; 9. Vincristine 1 μmol/L; 10.Vincristine 1 μg/ml+PMA 400 pmol/ml; 11. Vincristine 1 μg/ml+ diacylglycerol 200 μmol/ml
, 百拇医药
2.3 PCK激活剂Diacylglycerol及PMA对PMN及HL-60细胞凋亡的影响 Diacylglycerol 100 μmol/ml , PMA 8 pmol/ml与PMN共同培养8,18,24,48 h,可明显阻断PMN的自然凋亡。但低浓度Diacylglycerol(10 μmol/ml)无明显抑制PMN自然凋亡作用(图3)。

图3 Diacylglycerol, PMA处理PMN 24 h的DNA电泳分析
Fig.3 Agarose gel eletrophoresis of genomic DNA of PMN following treatment with diacylglycerol, PMA of 24 h
Note:1. λDNA/EcoR Ⅰ+HindⅢ,2. 0 h control, 3. 24 h control, 4. diacylglycerol 10 μmol/ml, 5. diacylglycerol 100 μmol/ml, 6. PMA 40 pmol/ml, 7. PMA 400 pmol/ml
, http://www.100md.com
2.4 PKC激活剂Diacylglycerol和PMA对神经酰胺类药物诱导凋亡的影响 在PMN及HL-60细胞中, Diacylglycerol(100~500 μmol/ml), PMA(40~400 pmol/ml)均可不同程度地抑制由C2-ceramide, TNFα, Vincristine所诱导的DNA降解(分别见图2,4)。

图4 C2-ceramide, diacylglycerol,PMA处理PMN 6 h的DNA电泳分析
Fig.4 Agarose gel electrophoresis of genomic DNA of PMN following treatmant with C2-caramide, diacylglycerol, PMN for 6 h
, http://www.100md.com
Note:1. λDNA/EcoR Ⅰ+HindⅢ, 2.6 h control , 3. C2-ceramide 5 μmol/ml, 4. C2-ceramide 5 μmol/ml+diacylglycerol 100 μmol/ml, 5. c2-ceramide 5 μmol/ml+PMA 40 pmol/ml
2.5 神经酰胺类药物诱导PMN及HL-60细胞凋亡过程中bcl-2, c-myc mRNA表达的改变
2.5.1 PMN 正常人外周血PMN有中等程度的c-myc mRNA表达 C2-ceramide, TNFα及Vincristine刺激后,c-myc mRNA有不同程度下调,Diacylglycerol, PMA刺激后, 观察至18 h, 未见c-myc mRNA表达有明显改变。图5显示了Diacylglycerol及PMA刺激后c-myc mRNA表达的情况。

, 百拇医药
图5 Diacylglycerol, PMA处理 PMN后 c-myc mRNA表达的RT-PCR分析
Fig.5 Detection of c-myc mRNA expression with RT-PCR, following treatment PMN with diacylglycerol and PMA
Note:1. 100 bp ladder; 2. diacylglycerol 100 μmol/ml 0 h; 3. diacylglycerol 100 μmol/ml 18 h; 4. PMA 40 pmol/ml 0 h; 5. PMA 40 pmol/ml 18 h
2.5.2 HL-60细胞 在内参照扩增强度一致的情况下, bcl-2基因扩增随着C2 -ceramide,TNFα及Vincristine浓度增加及作用时间延长明显下降,以Vincristine更为明显,c-myc mRNA表达呈轻度下调。图6显示了C2 -ceramide作用后的结果。

, 百拇医药
图6 C2-ceramide处理HL-60细胞后bcl-2 mRNA表达的RT-PCR分析
Fig.6 Detection of bcl-2 mRNA expression with RT-PCR following treatment HL-60 cells with C2-ceramide
Note:1. 100 bp ladder; 2. positive control; 3. c2-ceramide 50 μmol/ml 0 h; 4. c2-ceramide 50 μmol/ml 12 h; 5. c2-ceramide 50 μmol/ml 24 h; 6. c2-ceramide 50 μmol/ml 48 h
3 讨论
, 百拇医药
炎症反应是机体对伤害刺激正常防御反应的一部分,炎症反应的启动和放大已有较多研究和解释,而对炎症的吸收机制还缺乏深入研究。中性粒细胞(PMN)是炎症反应的重要标志, 因此炎症灶内PMN的转归对炎症的发生发展至关重要。Chapes等的实验研究已发现,炎症灶内的PMN是在膜完整的状态下被巨噬细胞吞噬,认为通过凋亡方式清除炎症灶内PMN是维持炎症反应平衡的重要因素[7]。我们也发现,PMN在体外培养中可发生自发性凋亡,说明凋亡过程在PMN代谢中是非常重要的环节。
PMN凋亡是一种自身稳定性的生理性死亡,启动机制并不清楚。涉及因素很多,如Fas家族抗原表达增加, CPK途径的调解及神经酰胺诱导NFκ-B表达增高等[8]。神经酰胺是近年来引起人们极大兴趣的信号分子, 它参与细胞增殖、分化及凋亡等多个过程,被认为是细胞生长抑制和细胞程序死亡的诱导剂。国外报道以及我们前期工作已经发现神经酰胺可诱导多种细胞产生凋亡,同时由于神经酰胺的代谢途径与炎症反应所涉及的酶和细胞因子,如PLA2 、TNFα、PGE2 等密切相关[9]。因此,我们希望了解在粒细胞凋亡过程中,神经酰胺是否具有特异性的调节作用。之所以选择HL-60细胞为研究模型,一是因为文献报道在适当因子刺激下(如PMA)其可发生成熟性分化,二是因为我们前期工作已发现在PMA作用下HL-60细胞的自发活性氧生成能力很高,这在其它白血病细胞系中是没有的, 说明HL-60细胞在一定程度上具有原始粒细胞的特点。实验发现,PMN在体外培养时,加入5 μmol/L外源性、细胞渗透性神经酰胺C2-ceramide,6 h后流式细胞分析已经出现了明显的AP峰,说明PMN的凋亡可能在早期即被C2-ceramide诱导。同样,在HL-60细胞中C2 -ceramide也可诱导凋亡产生。由C2 -ceramide诱导的凋亡作用可部分程度地被一定剂量Diacylglycerol和PMA所抑制。Diacylglycerol和PMA单独刺激,在成熟PMN及原始粒细胞HL-60中,凋亡现象都有所减轻。
, 百拇医药
PMA, Diacylglycerol是CPK的激活剂,关于PKC途径在细胞凋亡中具有双重调节作用已有报道,如PMA在胸腺细胞中可促进凋亡,同时在B淋巴细胞系中则抑制凋亡。本实验中神经酰胺诱导的细胞核DNA断裂可被PKC激活物抑制,说明此时神经酰胺诱导的凋亡是特异性的,并非细胞毒性作用,同时神经酰胺诱导凋亡是与CPK途径活化密切相关。我们的结果与Jarvis等认为CPK途径可能与SM水解途径相拮抗的结论一致[10]。
TNFα一直被认为炎症发生的正性调控因子,可直接激活PMN,但同时近来资料也显示它可引起多种细胞发生凋亡,并被证明是通过促进胞内神经酰胺升高而实现此过程[11] 。我们实验中也看到,它与C2 -ceramide诱导的凋亡表现极为相似,都可被CPK激活剂所抑制,间接提示TNFα可通过升高胞内神经酰胺水平而介导凋亡发生。
Vincristine是抗肿瘤药物和胞内神经酰胺诱导剂,国外学者报道,胞内神经酰胺水平在加入Vincristine后8 h明显升高,12 h可达高峰[12] ,但这种变化与TNFα IL-1等诱导的胞内神经酰胺上升并不完全一致。实验发现Vincristine可使HL-60细胞产生更快、更强的凋亡,而在PMN中这种诱凋作用并未明显强于C2-ceramide和TNFα, 可能提示Vincristine诱导的细胞凋亡途径与前二者并不完全相同。
, 百拇医药
Bcl-2为凋亡抑制基因,在HL-60细胞中有中等程度的表达。TNFα、Vicristine及C2 -ceramide作用后,bcl-2 mRNA的表达呈显著下调,说明神经酰胺类药物诱导的HL-60细胞凋亡与bcl-2基因的抑制有明确关系,可能通过最终抑制bcl-2基因表达来实现其促凋作用。
c-myc原癌基因不仅参与细胞增殖,也在细胞凋亡过程中起作用。外源导入c-myc或抑制c-myc表达均有诱导凋亡的报道。HL-60细胞及PMN均有中等程度的c-myc mRNA表达,神经酰胺类药物的刺激, 使c-myc的表达均下调,在PMN中更为明显。CPK激活剂刺激后c-myc无明显下调改变。提示胞内神经酰胺诱导的粒细胞凋亡,与c-myc水平的降低有关。
总之,我们初步的工作表明神经酰胺在粒细胞凋亡过程中,有明确的调节作用。不仅可直接诱导原始粒细胞产生凋亡,在终末粒细胞的自然凋亡中也起促进作用。同时通过对胞内神经酰胺诱导剂TNFα及Vincristine促进凋亡的研究,间接提示神经酰胺可作为HL-60及PMN胞内介质参与凋亡的信号传导,胞内信号还涉及CPK途径的调节,并最终改变与凋亡密切相关的bcl-2, c-myc 基因表达而引起凋亡。
, http://www.100md.com
①本课题为国家自然科学基金资助项目(39770716)
作者简介:辛 宏,女,36岁,助理研究员,主要从事细胞凋亡研究;
颜光涛,男, 38岁,研究员,硕士生导师,主要从事炎症分子机理研究
4 参考文献
[1] Haslett C. Resolution of acute inflammation and the role of apoptosis in the tissue fate of granulocytes. Clin Sci,1992;83:639
[2] Leslie R B, Stanley J F, Edward F et al. Ceramide signalling and the immune response. Biochim Biophys Acta,1996;1301:273
, http://www.100md.com
[3] Adalbeoto B, Didier G, Gabrid N et al. Regulation and function of bcl-2 duing differentiation induced cell death in HL-60 promyelocytic cells. American J Patho, 1995;146;481
[4] Chomcaynski P, Sacchi N .Single-step method of RNA isolation by acid Guanidium thiocyanate-phenol-chloroform extraction. Anal Biochem,1987;162:156
[5] Alessandro Q, Laura P, Valeria S et al. Quantilation of bcl-2 oncogene in cultured lymphoma/leukemia cell lines and in primary leukemia B-cells by a highly sensitive RT-PCR method. Heamatologica,1995;80:495
, 百拇医药
[6] Howard Wong, Willian D A, Ting C et al. Monitoring mRNA expression by polymerase chain reaction, the primer-dropping method. Anacytical Biochemistry,1994;223:251
[7] Chapes S K, Haskill S. Eviolence of granulocyte-mediated macrophage activation after C parvum immunization. Cell Immunol,1983;75:367
[8] Mariva P, Lina M O, Hannun Y A. Ceramide: an endogenous regulator of apoptosis and growth suppression. Immnotogy Today,1995;16:294
, 百拇医药
[9] Jaattela M, Benedict M, Tewari et al. Bcl-x and Bcl-2 inhibit TNF and fas-induced apoptosis and activation of phospholipase A2 in breast carcinoma cells. Oncogen,1995;10:2297
[10] Jarvis W D,Fornar F A, Browning J L et al. Attenuation of ceramide-induced apoptosis by diglyceride in human myeloid leukmia cells. J Biol Chen,1994;269:31685
[11] Obeid L M, Linardic C M, Karolak L A et al. Programmed cell death induced by ceramide. Science,1993;259:1769
[12] Jiandiz S, Nejemie A, Johe C et al. Bcl-2 interrupts the ceramide-mediated pathway of cell death. Proc Natl Acad Sci ZZUSA,1996;93:5325
〔收稿1998-09-29 修回1998-11-20〕, 百拇医药