微囊化猪胰岛对特异性抗体的免疫隔离作用的研究
作者:张苏河 程栋 李鹏诺 李凤良 栗夏莲 田晨光 李青菊 欧阳安
单位:河南医科大学第二附属医院内分泌科,郑州450003
关键词:海藻酸钠微囊;新鲜免疫血清;猪ICC;胰岛素释放
中国免疫学杂志990813 摘 要 目的:为了探讨一步成囊法制备的海藻酸钠微囊对猪胰岛样细胞团(Islet-like cell cluster, ICC)的保护作用。方法:本研究把经猪ICC免疫的小鼠新鲜血清,与微囊化ICC或游离ICC共同孵育后,观察各组ICC的胰岛素释放试验。结果:微囊ICC组的基础及刺激后的胰岛素值分别为93.49±16.21 ,275.00±35.19 mU/L,与对照组比较差异无显著性(P>0.05);游离ICC组的基础及刺激后胰岛素值分别为66.83±10.24 ,92.41±25.32 mU/L,明显低于微囊ICC组及对照组(P<0.01)。结论:表明免疫血清对游离ICC有明显损害,而海藻酸钠微囊对特异性抗体有免疫隔离作用,能够保护ICC免遭抗体攻击。
, 百拇医药
中国图书分类号 R392.4
Study on the immunoisolation of microencapsulated porcine islet-like cell clusters from special antibodies
ZHANG Su-He, CHENG Dong, LI Peng-Nuo et al. Department of Endocrinology, Second Affiliated Hospital, Henan Medical University, Zhengzhou 450003
Abstract Objective:In order to study the protective effect of alginate microcapsules by one-step encapsulated method to porcine islet-like cell clusters (ICC). Methods:Microencapsulated ICC (McICC) and free ICC (FICC) were incubated with fresh sera of immunized mice by porcine ICC, then the changes of insulin release of McICC and FICC were observed. Results: The results indicated that the insulin concentrations of basal and stimulated McICC group were 93.49±16.21 , 275.00±35.19 mU/L respectively, there was no difference between McICC and control ICC (P>0.05), and that the concentrations of basal and stimulated insulin of FICC were 66.83±10.24 , 92.41±25.32 mU/L respectively, which were significantly lower than those of McICC and control ICC (P<0.01). Conclusion:It was suggested that immunized sera could injure FICC seriously and that alginate microcapsules had the efficient effect of immunoisolation, which could prevent ICC from the destruction of special antibodies.
, 百拇医药
Key words Alginate microcapsules Fresh immunized sera Porcine ICC Insulin release
微囊化胰岛移植是为解决同种、异种胰岛移植后发生免疫排斥而采用的方法之一。微囊作为一种半透膜,应具有良好的生物相容性,且允许小分子营养物质、胰岛素自由通过,但阻挡大分子的免疫细胞、抗体及补体的透入。本实验用自行纯化的海藻酸钠,经一步成囊法将新生猪胰岛样细胞团(Islet-like cell clusters, ICC)微囊化。然后把微囊化ICC(Microencapsulated ICC, McICC)和游离ICC(Free ICC, FICC)与经猪ICC免疫的小鼠新鲜血清共同孵育,再观察McICC和FICC的胰岛素释放的变化,以探讨海藻酸钠微囊对血清中特异性抗体的免疫隔离作用。
1 材料与方法
1.1 实验材料 海藻酸钠、氯化钡、茶碱均为上海化学制剂厂产品。胰岛素放免试剂盒为中国原子能科学研究院同位素研究所产品。
, 百拇医药
1.2 方法
1.2.1 猪ICC的分离纯化及微囊化胰岛的制备 足月分娩出生1~4 d的新生猪,乙醚麻醉,无菌条件下取出胰腺,参照姜枫勤等人报道的方法稍加改进进行分离、纯化,获得ICC,置37℃、5%CO2的细胞培养箱中备用[1]。经双硫腙及台盼蓝染色,纯度90%以上,活细胞率90%以上。
将培养3~4 d的ICC分成2份,1份为FICC,1份参照Zekorn及姜枫勤等的方法进行微囊化[1,2]。每1 000个ICC加入15 g/L的精制海藻酸钠溶液1 ml,混匀后由自制微囊发生器喷入30 mmol/L的氯化钡溶液中使其成囊。倒置显微镜下见微囊外形完整,大小均匀,直径约400~600 μm。每个微囊含1~3 个胰岛,见图1。

, 百拇医药
图1 微囊化猪ICC(10×20)
Fig.1 Microcapsulated porcine ICC(10×20)
Note:diameter about 0.6 mm
1.2.2 小鼠免疫血清制备 出生50 d左右昆明种小鼠(山东医科大学动物中心提供),体重28~30 g。取1×104 ml-1 ICC悬液,每只小鼠腹腔内注射0.2 ml。此后于10、20、30 d重复注射0.2 ml/只。50 d后于左、右眼眶内取血,分离血清,分成新鲜血清(2 h 内用于实验)及灭活血清(56℃、40 min灭活后用于实验),同时留取正常小鼠血清。
把FICC分别与免疫小鼠的新鲜血清(未稀释及稀释一倍)、灭活血清、正常小鼠的新鲜血清及RPMI 1640培养液孵育24 h后,倒置显微镜下观察各组ICC形态,见未稀释免疫小鼠新鲜血清孵育后的FICC边缘模糊,细胞团发暗,一些形态不完整。同期RPMI 1640培养液中生长的FICC,边缘清晰完整,桔黄色,半透明。其余各组FICC的形态亦未见明显变化。
, 百拇医药
1.2.3 分组及步骤 分组McICC对照组:RPMI 1640液100 μl+McICC 100个。FICC对照组:RPMI 1640液100 μl+FICC 100个。免疫小鼠新鲜血清-McICC组:免疫新鲜血清100 μl+McICC 100个。免疫小鼠新鲜血清-FICC组:免疫小鼠新鲜血清100 μl+FICC 100个。免疫小鼠灭活血清-FICC组:免疫小鼠灭活血清100 μl+FICC 100个。正常小鼠新鲜血清-FICC组:正常小鼠新鲜血清100 μl+FICC 100个。
步骤:按上述分组加样于96孔细胞培养板,每个样本设3个复孔,于37℃、5%CO2培养箱内培养24 h,而后弃去上清液,用RPMI 1640液洗后,再做胰岛素释放试验。
1.2.4 胰岛素释放试验 各组分别加葡萄糖浓度为5.1 mmol/L的Tc199培养液200 μl/孔。置CO2培养箱内培养2 h,然后留取上清液待测胰岛素(为基础胰岛素);再加葡萄糖浓度为16.7 mmol/L、茶碱浓度为10 mmol/L的Tc199培养液200 μl/孔温育2 h,留取上清液待测胰岛素(为刺激后胰岛素)。标本置-20℃冰箱内保存。
, 百拇医药
1.2.5 胰岛素放免测定 按照放免药盒说明进行胰岛素放免测定。每个样本3个复孔的平均值为该样本的胰岛素测定值。
1.3 统计学处理 实验数据以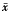 ±s表示。采用多个样本均数两两比较的方差分析法,用SPSS统计软件包进行统计学处理。
±s表示。采用多个样本均数两两比较的方差分析法,用SPSS统计软件包进行统计学处理。
2 结果
2.1 ICC对照组的胰岛素释放结果 见表1,McICC对照组与FICC对照组的基础胰岛素值对比,差异无显著性(P>0.05);两组的刺激后胰岛素值之间差异无显著性(P>0.05)。
2.2 小鼠血清对ICC胰岛素释放的影响 见表1。免疫小鼠新鲜血清-McICC组的基础及刺激后胰岛素值与对照组比较,差异无显著性(P>0.05);而免疫小鼠新鲜血清-FICC组的基础及刺激后胰岛素值均明显降低,与免疫新鲜血清-McICC组及对照组比较,差异均有显著性(P<0.01)。免疫小鼠灭活血清-FICC组及正常小鼠新鲜血清-FICC组的基础和刺激后胰岛素浓度与对照组比较,差异无显著性(P>0.05)。
, 百拇医药
3 讨论
动物实验显示,微囊化胰岛移植可有效逆转糖尿病动物的高血糖,并使移植物的存活期明显延长[3,4]。一步法制备微囊,步骤简化,操作时间短,减少了制囊过程中对胰岛细胞活性的影响,在动物移植实验中取得良好结果[2,5]。本研究参考这一新技术,微囊化猪ICC后,经胰岛素释放试验,结果显示:RPMI 1640培养液中的McICC,其基础及刺激后胰岛素水平与FICC相似,说明该方法制成的微囊,对葡萄糖、胰岛素具有良好的通透性,囊内ICC具有生物活性。我们也证实了该种微囊的免疫原性很低(另文报道)。
表1 小鼠血清-ICC各组胰岛素释放结果比较(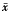 ±s,n=6)
±s,n=6)
Tab.1 The results of insulin releasing in mice sera-ICC groups (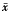 ±s,n=6) Groups
±s,n=6) Groups
, 百拇医药
Basal insulin (mU/L)
Stimulized insulin (mU/L)
McICC control group
95.00±14.11
268.06±54.49
FICC control group
100.54±11.51
285.33±30.83
Immunized mice's fresh sera-McICC group
93.49±16.21
, http://www.100md.com
275.00±35.19
Immunized mice's fresh sera-FICC group
66.83±10.241)2)
92.41±25.321)2)
Immunized mice's inactive sera-FICC group
93.78±17.77
265.56±23.33
Normal mice's fresh sera-FICC group
90.06±17.16
, http://www.100md.com
287.78±30.31
Note:compared with FICC control group, 1)P<0.01; compared with immunized mice's fresh sera-McICC group, 2)P<0.01 体外测定微囊对抗体或免疫活性细胞的隔离作用,是一种评价微囊功能的方法,国内少见报道。本文侧重研究了钡-海藻酸钠微囊膜对免疫小鼠血清特异性抗体的隔离作用。免疫后的小鼠血清对异种胰岛的胰岛素分泌有较强的抑制作用[6]。本研究用经猪ICC免疫过的小鼠新鲜血清、灭活血清,分别与McICC、FICC共同孵育后,各组ICC的胰岛素释放试验显示:与新鲜免疫血清共同孵育后的FICC组,其基础及刺激后的胰岛素释放明显受到抑制;而免疫新鲜血清-McICC组、免疫灭活血清-FICC组的基础及刺激后胰岛素释放值与对照组比较无明显差异,提示免疫血清对FICC有明显损害,其中补体的参与非常重要;本研究中的钡-海藻酸钠微囊对特异性抗体有免疫隔离作用,能够保护ICC免遭抗体攻击。还可推测,微囊膜对I型糖尿病自身抗胰岛细胞毒性抗体亦有隔离作用。
, 百拇医药
致谢:承蒙山东省医学科学院基础研究所刘金生副研究员、姜枫勤副研究员对本研究给予热情的指导和帮助。
本课题受河南省科委自然科学基金资助(No.974024100)
焦作市第一人民医院内分泌科,焦作454150
河南医科大学第一附属医院内分泌科,郑州450052
作者简介:张苏河,女,42岁,硕士,副教授,主要从事内分泌疾病的免疫研究;
李凤良,男,59岁,教授,硕士生导师,主要研究胰岛移植及临床内分泌疾病
4 参考文献
1 姜枫勤,唐天华,刘风云 et al.微囊新生猪胰岛体外培养的研究.中华器官移植杂志,1995;16(1):31
, 百拇医药
2 Zekor?n T, Horcher A, Schnettler R et al. Barium-cross-linked alginate bead: a simple one-step method for successful immunoisolated transplantation of islets of langerhans. Acta Diabetol, 1992;29:99
3 Fam M Y, Lum Z P, Fu X W et al. Reversal of diabetes in BB, rat by transplantation of encapsulated pancreatic islets. Diabetes, 1990;39:519
4 Tatarkiewicz K, Sitarek E, Sabat M et al. Multilayer coating of islets of langerhans: in vitro studies on a new method for immunoisolation. Transplant Proc, 1995;27:617
, 百拇医药
5 Horcher A, Zekorn T, Siebers U et al. Transplantation of microencapsulated islets in rats: evidence for induction of fibrotic overgrowth by islet alloaitigens released from microcapsules. Transplant Proc, 1994;26:784
6 Bitotard C, Say P, Debray-sachs M et al. Anti-pancreatic immunity, in vitro studies of cellulars and humoral immune reactions directed toward panceatic islets. Clin Exp Immunol, 1983;55:571
〔收稿1998-07-06 二次修回1999-01-20〕, 百拇医药
单位:河南医科大学第二附属医院内分泌科,郑州450003
关键词:海藻酸钠微囊;新鲜免疫血清;猪ICC;胰岛素释放
中国免疫学杂志990813 摘 要 目的:为了探讨一步成囊法制备的海藻酸钠微囊对猪胰岛样细胞团(Islet-like cell cluster, ICC)的保护作用。方法:本研究把经猪ICC免疫的小鼠新鲜血清,与微囊化ICC或游离ICC共同孵育后,观察各组ICC的胰岛素释放试验。结果:微囊ICC组的基础及刺激后的胰岛素值分别为93.49±16.21 ,275.00±35.19 mU/L,与对照组比较差异无显著性(P>0.05);游离ICC组的基础及刺激后胰岛素值分别为66.83±10.24 ,92.41±25.32 mU/L,明显低于微囊ICC组及对照组(P<0.01)。结论:表明免疫血清对游离ICC有明显损害,而海藻酸钠微囊对特异性抗体有免疫隔离作用,能够保护ICC免遭抗体攻击。
, 百拇医药
中国图书分类号 R392.4
Study on the immunoisolation of microencapsulated porcine islet-like cell clusters from special antibodies
ZHANG Su-He, CHENG Dong, LI Peng-Nuo et al. Department of Endocrinology, Second Affiliated Hospital, Henan Medical University, Zhengzhou 450003
Abstract Objective:In order to study the protective effect of alginate microcapsules by one-step encapsulated method to porcine islet-like cell clusters (ICC). Methods:Microencapsulated ICC (McICC) and free ICC (FICC) were incubated with fresh sera of immunized mice by porcine ICC, then the changes of insulin release of McICC and FICC were observed. Results: The results indicated that the insulin concentrations of basal and stimulated McICC group were 93.49±16.21 , 275.00±35.19 mU/L respectively, there was no difference between McICC and control ICC (P>0.05), and that the concentrations of basal and stimulated insulin of FICC were 66.83±10.24 , 92.41±25.32 mU/L respectively, which were significantly lower than those of McICC and control ICC (P<0.01). Conclusion:It was suggested that immunized sera could injure FICC seriously and that alginate microcapsules had the efficient effect of immunoisolation, which could prevent ICC from the destruction of special antibodies.
, 百拇医药
Key words Alginate microcapsules Fresh immunized sera Porcine ICC Insulin release
微囊化胰岛移植是为解决同种、异种胰岛移植后发生免疫排斥而采用的方法之一。微囊作为一种半透膜,应具有良好的生物相容性,且允许小分子营养物质、胰岛素自由通过,但阻挡大分子的免疫细胞、抗体及补体的透入。本实验用自行纯化的海藻酸钠,经一步成囊法将新生猪胰岛样细胞团(Islet-like cell clusters, ICC)微囊化。然后把微囊化ICC(Microencapsulated ICC, McICC)和游离ICC(Free ICC, FICC)与经猪ICC免疫的小鼠新鲜血清共同孵育,再观察McICC和FICC的胰岛素释放的变化,以探讨海藻酸钠微囊对血清中特异性抗体的免疫隔离作用。
1 材料与方法
1.1 实验材料 海藻酸钠、氯化钡、茶碱均为上海化学制剂厂产品。胰岛素放免试剂盒为中国原子能科学研究院同位素研究所产品。
, 百拇医药
1.2 方法
1.2.1 猪ICC的分离纯化及微囊化胰岛的制备 足月分娩出生1~4 d的新生猪,乙醚麻醉,无菌条件下取出胰腺,参照姜枫勤等人报道的方法稍加改进进行分离、纯化,获得ICC,置37℃、5%CO2的细胞培养箱中备用[1]。经双硫腙及台盼蓝染色,纯度90%以上,活细胞率90%以上。
将培养3~4 d的ICC分成2份,1份为FICC,1份参照Zekorn及姜枫勤等的方法进行微囊化[1,2]。每1 000个ICC加入15 g/L的精制海藻酸钠溶液1 ml,混匀后由自制微囊发生器喷入30 mmol/L的氯化钡溶液中使其成囊。倒置显微镜下见微囊外形完整,大小均匀,直径约400~600 μm。每个微囊含1~3 个胰岛,见图1。


, 百拇医药
图1 微囊化猪ICC(10×20)
Fig.1 Microcapsulated porcine ICC(10×20)
Note:diameter about 0.6 mm
1.2.2 小鼠免疫血清制备 出生50 d左右昆明种小鼠(山东医科大学动物中心提供),体重28~30 g。取1×104 ml-1 ICC悬液,每只小鼠腹腔内注射0.2 ml。此后于10、20、30 d重复注射0.2 ml/只。50 d后于左、右眼眶内取血,分离血清,分成新鲜血清(2 h 内用于实验)及灭活血清(56℃、40 min灭活后用于实验),同时留取正常小鼠血清。
把FICC分别与免疫小鼠的新鲜血清(未稀释及稀释一倍)、灭活血清、正常小鼠的新鲜血清及RPMI 1640培养液孵育24 h后,倒置显微镜下观察各组ICC形态,见未稀释免疫小鼠新鲜血清孵育后的FICC边缘模糊,细胞团发暗,一些形态不完整。同期RPMI 1640培养液中生长的FICC,边缘清晰完整,桔黄色,半透明。其余各组FICC的形态亦未见明显变化。
, 百拇医药
1.2.3 分组及步骤 分组McICC对照组:RPMI 1640液100 μl+McICC 100个。FICC对照组:RPMI 1640液100 μl+FICC 100个。免疫小鼠新鲜血清-McICC组:免疫新鲜血清100 μl+McICC 100个。免疫小鼠新鲜血清-FICC组:免疫小鼠新鲜血清100 μl+FICC 100个。免疫小鼠灭活血清-FICC组:免疫小鼠灭活血清100 μl+FICC 100个。正常小鼠新鲜血清-FICC组:正常小鼠新鲜血清100 μl+FICC 100个。
步骤:按上述分组加样于96孔细胞培养板,每个样本设3个复孔,于37℃、5%CO2培养箱内培养24 h,而后弃去上清液,用RPMI 1640液洗后,再做胰岛素释放试验。
1.2.4 胰岛素释放试验 各组分别加葡萄糖浓度为5.1 mmol/L的Tc199培养液200 μl/孔。置CO2培养箱内培养2 h,然后留取上清液待测胰岛素(为基础胰岛素);再加葡萄糖浓度为16.7 mmol/L、茶碱浓度为10 mmol/L的Tc199培养液200 μl/孔温育2 h,留取上清液待测胰岛素(为刺激后胰岛素)。标本置-20℃冰箱内保存。
, 百拇医药
1.2.5 胰岛素放免测定 按照放免药盒说明进行胰岛素放免测定。每个样本3个复孔的平均值为该样本的胰岛素测定值。
1.3 统计学处理 实验数据以
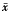 ±s表示。采用多个样本均数两两比较的方差分析法,用SPSS统计软件包进行统计学处理。
±s表示。采用多个样本均数两两比较的方差分析法,用SPSS统计软件包进行统计学处理。2 结果
2.1 ICC对照组的胰岛素释放结果 见表1,McICC对照组与FICC对照组的基础胰岛素值对比,差异无显著性(P>0.05);两组的刺激后胰岛素值之间差异无显著性(P>0.05)。
2.2 小鼠血清对ICC胰岛素释放的影响 见表1。免疫小鼠新鲜血清-McICC组的基础及刺激后胰岛素值与对照组比较,差异无显著性(P>0.05);而免疫小鼠新鲜血清-FICC组的基础及刺激后胰岛素值均明显降低,与免疫新鲜血清-McICC组及对照组比较,差异均有显著性(P<0.01)。免疫小鼠灭活血清-FICC组及正常小鼠新鲜血清-FICC组的基础和刺激后胰岛素浓度与对照组比较,差异无显著性(P>0.05)。
, 百拇医药
3 讨论
动物实验显示,微囊化胰岛移植可有效逆转糖尿病动物的高血糖,并使移植物的存活期明显延长[3,4]。一步法制备微囊,步骤简化,操作时间短,减少了制囊过程中对胰岛细胞活性的影响,在动物移植实验中取得良好结果[2,5]。本研究参考这一新技术,微囊化猪ICC后,经胰岛素释放试验,结果显示:RPMI 1640培养液中的McICC,其基础及刺激后胰岛素水平与FICC相似,说明该方法制成的微囊,对葡萄糖、胰岛素具有良好的通透性,囊内ICC具有生物活性。我们也证实了该种微囊的免疫原性很低(另文报道)。
表1 小鼠血清-ICC各组胰岛素释放结果比较(
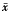 ±s,n=6)
±s,n=6)Tab.1 The results of insulin releasing in mice sera-ICC groups (
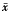 ±s,n=6) Groups
±s,n=6) Groups, 百拇医药
Basal insulin (mU/L)
Stimulized insulin (mU/L)
McICC control group
95.00±14.11
268.06±54.49
FICC control group
100.54±11.51
285.33±30.83
Immunized mice's fresh sera-McICC group
93.49±16.21
, http://www.100md.com
275.00±35.19
Immunized mice's fresh sera-FICC group
66.83±10.241)2)
92.41±25.321)2)
Immunized mice's inactive sera-FICC group
93.78±17.77
265.56±23.33
Normal mice's fresh sera-FICC group
90.06±17.16
, http://www.100md.com
287.78±30.31
Note:compared with FICC control group, 1)P<0.01; compared with immunized mice's fresh sera-McICC group, 2)P<0.01 体外测定微囊对抗体或免疫活性细胞的隔离作用,是一种评价微囊功能的方法,国内少见报道。本文侧重研究了钡-海藻酸钠微囊膜对免疫小鼠血清特异性抗体的隔离作用。免疫后的小鼠血清对异种胰岛的胰岛素分泌有较强的抑制作用[6]。本研究用经猪ICC免疫过的小鼠新鲜血清、灭活血清,分别与McICC、FICC共同孵育后,各组ICC的胰岛素释放试验显示:与新鲜免疫血清共同孵育后的FICC组,其基础及刺激后的胰岛素释放明显受到抑制;而免疫新鲜血清-McICC组、免疫灭活血清-FICC组的基础及刺激后胰岛素释放值与对照组比较无明显差异,提示免疫血清对FICC有明显损害,其中补体的参与非常重要;本研究中的钡-海藻酸钠微囊对特异性抗体有免疫隔离作用,能够保护ICC免遭抗体攻击。还可推测,微囊膜对I型糖尿病自身抗胰岛细胞毒性抗体亦有隔离作用。
, 百拇医药
致谢:承蒙山东省医学科学院基础研究所刘金生副研究员、姜枫勤副研究员对本研究给予热情的指导和帮助。
本课题受河南省科委自然科学基金资助(No.974024100)
焦作市第一人民医院内分泌科,焦作454150
河南医科大学第一附属医院内分泌科,郑州450052
作者简介:张苏河,女,42岁,硕士,副教授,主要从事内分泌疾病的免疫研究;
李凤良,男,59岁,教授,硕士生导师,主要研究胰岛移植及临床内分泌疾病
4 参考文献
1 姜枫勤,唐天华,刘风云 et al.微囊新生猪胰岛体外培养的研究.中华器官移植杂志,1995;16(1):31
, 百拇医药
2 Zekor?n T, Horcher A, Schnettler R et al. Barium-cross-linked alginate bead: a simple one-step method for successful immunoisolated transplantation of islets of langerhans. Acta Diabetol, 1992;29:99
3 Fam M Y, Lum Z P, Fu X W et al. Reversal of diabetes in BB, rat by transplantation of encapsulated pancreatic islets. Diabetes, 1990;39:519
4 Tatarkiewicz K, Sitarek E, Sabat M et al. Multilayer coating of islets of langerhans: in vitro studies on a new method for immunoisolation. Transplant Proc, 1995;27:617
, 百拇医药
5 Horcher A, Zekorn T, Siebers U et al. Transplantation of microencapsulated islets in rats: evidence for induction of fibrotic overgrowth by islet alloaitigens released from microcapsules. Transplant Proc, 1994;26:784
6 Bitotard C, Say P, Debray-sachs M et al. Anti-pancreatic immunity, in vitro studies of cellulars and humoral immune reactions directed toward panceatic islets. Clin Exp Immunol, 1983;55:571
〔收稿1998-07-06 二次修回1999-01-20〕, 百拇医药