脂多糖增强小鼠腹腔巨噬细胞14.2 kD蛋白质磷酸化①
作者:刘彦 王寅 崔肇春
单位:王寅 辽宁师范大学化学系应化教研室,大连 116029 刘彦 崔肇春 大连医科大学生化教研室,大连116027
关键词:脂多糖;巨噬细胞;蛋白质磷酸化
中国免疫学杂志991006 摘 要 目的:探索LPS对小鼠腹腔巨噬细胞小分子蛋白质磷酸化的影响。方法:利用同位素掺入、SDS-PAGE、放射自显影和蛋白质印迹(Western blot)、结合蛋白激酶抑制剂与激活剂的使用,研究LPS对巨噬细胞处理后小分子蛋白质磷酸化及其相关蛋白激酶对此磷酸化的影响。结果:14.2 kD蛋白质磷酸化被LPS强烈地促进;MAPK的表达量未见明显变化;TPK抑制剂三羟异黄酮(genistein)明显抑制上述磷酸化;PKA激活剂佛斯可林(forskolin)和Gi蛋白抑制剂百日咳毒素对上述磷酸化无明显影响。结论:LPS能促进14.2 kD蛋白质的磷酸化,此磷酸化可能依赖酪氨酸蛋白激酶(TPK)。
, 百拇医药
中国图书分类号 R392.11
Lipopolysaccharide enhances a 14.2 kD protein phosphorylation
of murine peritoneal macrophages
LIU Yan,WANG Yin,CUI Zhao-Chun.
Department of Biochemistry,Dalian Medical University,Dalian 116027
Abstract Objective:This study is aimed at exploring the influence of LPS on the phosphorylation of small MW proteins in mouse peritoneal macrophages.Methods:Radioisotope incorporation,SDS-PAGE,autoradiography,Western blot and protein kinase inhibitor and activator were used.Results:LPS strongly enhanced the phosphorylation of a 14.2 kD protein; MAPK expression was not significantly influenced by LPS;the TPK inhibitor genistein significantly inhibited this phosphorylation;the PKA activator forskolin and Gi protein inhibitor pertussis toxin did not show influence on the 14.2 kD protein phosphorylation.Conclusion:LPS enhanced the phosphorylation of a 14.2 kD protein and this phosphorylation might be TPK-dependent.
, 百拇医药
Key words Lipopolysaccharide Macrophage Protein phosphorylation
来自细菌胞壁的脂多糖(LPS)是巨噬细胞(Mφ)激活表达多种功能的强激活剂,它能激活Mφ表达诱导型一氧化氮合酶mRNA(iNOS-mRNA)和肿瘤坏死因子mRNA(TNF-mRNA),并释放大量一氧化氮(NO)及TNF,后二者不仅是Mφ杀伤病原微生物及肿瘤细胞的主要效应分子[1],而且也是Mφ过度激活损伤组织细胞的主要致病分子[2]。现已发现蛋白激酶C(PKC)、酪氨酸蛋白激酶(TPK)及蛋白磷酸酶是Mφ表达iNOS-mRNA或TNF-mRNA信息传递通路中的重要组分[3,4],因此研究蛋白质磷酸化是探索它们作用的靶蛋白的直接方式之一。文献曾报道LPS对完整Mφ蛋白质磷酸化的影响[5],也表明LPS增强完整Mφ蛋白质磷酸化(如38、45、67、103 kD等)。完整细胞蛋白磷酸化能反映细胞蛋白磷酸化的动态水平,但大量[32P]Pi易遮盖电泳前沿小分子蛋白的磷酸化情况。本文重点观察Mφ溶解液中小分子蛋白质的磷酸化,发现LPS能增强14.2 kD蛋白磷酸化,该蛋白分子可能是LPS激活Mφ信息传递中的一个重要的调节分子。
, http://www.100md.com
1 材料与方法
1.1 材料
1.1.1 试剂 LPS、genistein、forskolin、百日咳毒素、佛波酯(PMA)及蛋白标准品皆购于Sigma;[γ-32P]ATP(1 mCi/ml),北京亚辉生物工程公司;[32P]Pi(10 mCi/ml),北京中国原子能研究所;新生小牛血清(NCS),大连旅顺生物制品厂;RPMI 1640培基,GIBCO公司;多克隆MAPK-2(Mitogen-activated protein kinase-2,也称ERK-2)抗体由加拿大UBC大学Steven Pelech教授赠送;ABC药盒为美国Vector Lab.Inc.;其它试剂均为国产分析纯。
1.1.2 动物 纯系昆明种小白鼠,23~25 g,雌雄不限,本校实验动物室提供。
, http://www.100md.com 1.2 方法
1.2.1 Mφ的培养、鉴定及激活[6] 小白鼠腹腔注射4%巯基乙醇(TG)培基,1.5 ml/只,4 d后用含4%NCS的无Ca2+、Mg2+的Hank’s液灌洗,收集小鼠腹腔渗出细胞(PEC)。PEC用RPMI 1640全培基(含20%NCS,4 mmol/L L-谷氨酰胺,4 mmol/L Hepes,0.25%NaHCO3,100 μg/ml青霉素,140 μg/ml链霉素)调成悬液,计数,按5×106细胞/孔分配于6孔塑料培养板中,经贴壁培养得贴壁细胞,后者经Mφ酸性磷酸酶和非特异性酯酶鉴定,98%以上为Mφ。Mφ在受LPS不同时间(15,30,60 min)刺激后或分别用蛋白激酶特异抑制剂、激动剂及百日咳毒素预处理1 h后再受LPS刺激。各种Mφ处理完毕,用PBS洗3遍,然后加入细胞溶解液(0.5%TritonX-100,80 mmol/L β-磷酸甘油,20 mmol/L EGTA,14 mmol/L MgCl2,1 mmol/L Na3VO3,10 mmol/L NaF,1 mmol/L PMSF,pH7.6)溶解细胞,11 000 r/min离心,收集上清,以考马氏亮蓝测定蛋白质含量,然后进行蛋白质磷酸化实验。
, http://www.100md.com
1.2.2 Mφ细胞溶解液蛋白质磷酸化 取50 μl细胞溶解液,加入蛋白质磷酸化缓冲液(100 mmol/L Tris-HCl,40 mmol/L MgCl2,3.5 mmol/L ATP)及4~5 μCi [γ-32P]ATP,终体积为65 μl,于37℃保温使磷酸化30 min,然后加入15 μl电泳样品缓冲液,放100℃水浴3 min 终止反应。以13%凝胶浓度进行SDS-PAGE,蛋白上样量为100 μg。电泳完毕,用考马氏亮蓝R250于50℃染色30 min,脱色1 h,观察电泳结果,然后滤纸吸干胶板再进行放射自显影。显影后的胶板可重新染色、脱色,以标准蛋白定蛋白质分子量。
1.2.3 完整Mφ蛋白质磷酸化和Western blot鉴定MAPK-2[5,7] 二者的测定完全按文献进行。
2 结果
2.1 LPS增强Mφ的14.2 kD蛋白质磷酸化 小鼠腹腔Mφ受LPS刺激或先用genistein等试剂预处理后再受LPS刺激,各组Mφ溶解液蛋白质磷酸化结果见图1。从图1中可知,LPS单独处理的Mφ溶解液中14.2 kD的蛋白质磷酸化比对照组显著地增强(Lane 5或Lane 1比较),LPS的这种效应受TPK抑制剂genistein的抑制(Lane 5与Lane 4比较),但不受PKA激动剂forskolin及Gi效应剂百日咳毒素的影响(Lane 5与Lane 2,3比较)。14.2 kD蛋白质密度扫描值与上述结论相一致。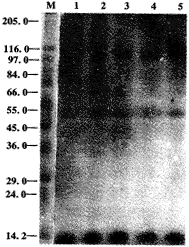
, 百拇医药
图1 LPS增强Mφ的14.2 kD蛋白质磷酸化
Fig.1 LPS enhanced the phosphorylation of a 14.2 kD protein of Mφ
Note: TG-elicited Mφs were treated for 30 min with medium(lane 1) or with 1 μg/ml LPS(lane 5) or (with 1 μg/ml LPS after 1 h of pretreatment with 25 μmol/L of forskolin (lane 2),125 ng/ml pertussis toxin(lane 3),30 μmol/L of genistein (lane 4).The treated cells were washed and lysed.TritonX-100-soluble protein was prepared for protein phosphorylation as described in materials and methods.Fig.1 is a representative autoradigram of three experiments
, 百拇医药
2.2 LPS增强Mφ的14.2 kD蛋白质磷酸化的时间过程 Mφ受LPS不同时间刺激,然后测定LPS增强14.2 kD蛋白质磷酸化的最佳时间,结果见图2。图2显示LPS刺激Mφ 30 min,14.2 kD蛋白质的磷酸化强度最大,与相应对照组差别最大。LPS刺激Mφ1 h,14.2 kD蛋白质磷酸化与对照组相比无显著性。14.2 kD蛋白质密度扫描值支持上述结论。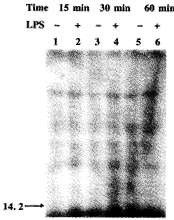
图2 LPS增强Mφ的14.2 kD蛋白质磷酸化的时间过程
Fig.2 The time course of LPS-enhanced phosphorylation of a 14.2 kD protein of Mφ
Note:TG-elicited Mφs were treated with medium(lane 1,3,5) or with 1 μg/ml of LPS(lane 2,4,6)for various times.The steps that follow were as described in materials and methods.The fig is a representative autoradigram of three experiments
, http://www.100md.com
2.3 LPS增强完整Mφ蛋白质磷酸化 文献曾报道,LPS能激活Mφ的有丝分裂原激活的蛋白激酶(MAPK)。MAPK家族分子量在38.0~45.0 kD,其中MAPK-2的分子量为42.0 kD。LPS激活MAPK的最佳时间为15 min,MAPK被磷酸化后而激活,然后再磷酸化其靶蛋白而将信息下传[7,8]。LPS增强14.2 kD蛋白质磷酸化的时间进程恰好处于MAPK激活状态之下,14.2 kD磷酸化是否是MAPK激活的结果呢?通过测定完整Mφ蛋白质磷酸化可观察到LPS增强38.0~45.0 kD蛋白质磷酸化,说明MAPK被激活,但14.2 kD蛋白质磷酸化情况被前沿32P遮盖住了。用MAPK-2多克隆抗体也检测到MAPK-2的存在,但酶蛋白的表达量未有显著变化,表明14.2 kD磷酸化的增强可能不是MAPK作用的结果。
3 讨论
LPS能激活Mφ非受体型Src家族的TPK,后者以TPK→Raf→MAPK kinase→MAPK途径激活MAPK[9]。MAPK的激活是其酶蛋白特定部位Tyr/Thr同时双重磷酸化导致的,但在Mφ中,MAPK的表达量不变[7,8]。本文用MAPK-2多克隆抗体证明Mφ中存在MAPK-2,其酶表达量也不变。通过完整Mφ蛋白磷酸化(结果略)也观察到MAPK家族蛋白磷酸化较对照增加,即酶活性增加,这一点与文献[7,8]相符合。通过LPS激活Mφ的MAPK最佳剂量与时间刺激Mφ[8],则观察到LPS增强Mφ溶解液中14.2 kD蛋白质磷酸化,且14.2 kD蛋白质磷酸化受TPK抑制剂genistein抑制,而又受PKA和Gi的影响。文献[8]报道LPS对Mφ的MAPK的激活也受genistein抑制,因TPK是MAPK上游一个重要传递站,从14.2 kD蛋白质磷酸化和MAPK激活都受TPK控制及LPS激活MAPK的最佳时间(15 min)与激活14.2 kD蛋白质磷酸化最佳时间(30 min)有一定先后次序相关联上看,14.2 kD蛋白质磷酸化可能与MAPK激活有关,但这里未能确定二者的关系,需做进一步实验来证实。TPK是LPS激活Mφ信息传递中的一个重要传递站,LPS增强14.2 kD蛋白质磷酸化受TPK所控制,说明14.2 kD可能作为一种因子或信使参与LPS激活Mφ的信息传递,对14.2 kD蛋白的深入研究有重要的意义。
, 百拇医药
资金项目:国家自然科学基金(39500134)及大连市科委基金资助课题
作者简介:刘彦,主要从事免疫学研究
参考文献
1 刘 彦,崔肇春.巨噬细胞激活与其信息传递.国外医学*免疫学分册,1996;19(4):214
2 Wu G Y,Wu. The activation of the arginine-citrulline cycle in macrophage from the spontaneously diabetic BB rat.Biochem J,1993;294:113
3 Paul A,Pendreigh R H,PLevin R.Protein kinase C and tyrosine kinase pathways regulate lipopolysaccharide-induced nitric oxide synthase activity in Raw 264.7 murine macrophages.Brit J Pharmacol,1995;114:482
, 百拇医药
4 Pan J M,Burgher K L,Sjcjepanik A M et al.Tyrosine phosphorylation of inducible nitric oxide synthase:implications for potential post-translational regulation.Biochem J,1996;314:889
5 Weiel J E,Hamilton T A,Adams D O.LPS induces altered phosphate labeling of proteins in murine peritoneal macrophages.J Immunol,1986;136:3012
6 Pennline K J.In:Heppner G H,Futton A M eds.Macrophages and Cancer,Boca Rotn,Florida:CRC Press Inc,1988:63-68
, 百拇医药
7 Weinstein S L,Sanghera J S,Lemke K et al.Bacterial lipopolysaccharide induces tyrosine phosphorylation and activation of mitogen-activated protein dinases in macrophages.J Biol Chem,1992;267(21);14955
8 Dong Z Y,Qi X X,Fidder I J.Tyrosine phosphorylation of mitogen-activated protein kinases is necessary for activation of murine macrophages by natural and synthetic bacterial products.J Exp Med,1993;177:1071
9 Reimann T,Buscher D,Hipskind R A et al.Lipopolysaccharide induces activation of the Raf-1/MAP kinase pathway.J Immunol,1994;153:5740
收稿:1997-10-05 修回:1998-06-26
, http://www.100md.com
单位:王寅 辽宁师范大学化学系应化教研室,大连 116029 刘彦 崔肇春 大连医科大学生化教研室,大连116027
关键词:脂多糖;巨噬细胞;蛋白质磷酸化
中国免疫学杂志991006 摘 要 目的:探索LPS对小鼠腹腔巨噬细胞小分子蛋白质磷酸化的影响。方法:利用同位素掺入、SDS-PAGE、放射自显影和蛋白质印迹(Western blot)、结合蛋白激酶抑制剂与激活剂的使用,研究LPS对巨噬细胞处理后小分子蛋白质磷酸化及其相关蛋白激酶对此磷酸化的影响。结果:14.2 kD蛋白质磷酸化被LPS强烈地促进;MAPK的表达量未见明显变化;TPK抑制剂三羟异黄酮(genistein)明显抑制上述磷酸化;PKA激活剂佛斯可林(forskolin)和Gi蛋白抑制剂百日咳毒素对上述磷酸化无明显影响。结论:LPS能促进14.2 kD蛋白质的磷酸化,此磷酸化可能依赖酪氨酸蛋白激酶(TPK)。
, 百拇医药
中国图书分类号 R392.11
Lipopolysaccharide enhances a 14.2 kD protein phosphorylation
of murine peritoneal macrophages
LIU Yan,WANG Yin,CUI Zhao-Chun.
Department of Biochemistry,Dalian Medical University,Dalian 116027
Abstract Objective:This study is aimed at exploring the influence of LPS on the phosphorylation of small MW proteins in mouse peritoneal macrophages.Methods:Radioisotope incorporation,SDS-PAGE,autoradiography,Western blot and protein kinase inhibitor and activator were used.Results:LPS strongly enhanced the phosphorylation of a 14.2 kD protein; MAPK expression was not significantly influenced by LPS;the TPK inhibitor genistein significantly inhibited this phosphorylation;the PKA activator forskolin and Gi protein inhibitor pertussis toxin did not show influence on the 14.2 kD protein phosphorylation.Conclusion:LPS enhanced the phosphorylation of a 14.2 kD protein and this phosphorylation might be TPK-dependent.
, 百拇医药
Key words Lipopolysaccharide Macrophage Protein phosphorylation
来自细菌胞壁的脂多糖(LPS)是巨噬细胞(Mφ)激活表达多种功能的强激活剂,它能激活Mφ表达诱导型一氧化氮合酶mRNA(iNOS-mRNA)和肿瘤坏死因子mRNA(TNF-mRNA),并释放大量一氧化氮(NO)及TNF,后二者不仅是Mφ杀伤病原微生物及肿瘤细胞的主要效应分子[1],而且也是Mφ过度激活损伤组织细胞的主要致病分子[2]。现已发现蛋白激酶C(PKC)、酪氨酸蛋白激酶(TPK)及蛋白磷酸酶是Mφ表达iNOS-mRNA或TNF-mRNA信息传递通路中的重要组分[3,4],因此研究蛋白质磷酸化是探索它们作用的靶蛋白的直接方式之一。文献曾报道LPS对完整Mφ蛋白质磷酸化的影响[5],也表明LPS增强完整Mφ蛋白质磷酸化(如38、45、67、103 kD等)。完整细胞蛋白磷酸化能反映细胞蛋白磷酸化的动态水平,但大量[32P]Pi易遮盖电泳前沿小分子蛋白的磷酸化情况。本文重点观察Mφ溶解液中小分子蛋白质的磷酸化,发现LPS能增强14.2 kD蛋白磷酸化,该蛋白分子可能是LPS激活Mφ信息传递中的一个重要的调节分子。
, http://www.100md.com
1 材料与方法
1.1 材料
1.1.1 试剂 LPS、genistein、forskolin、百日咳毒素、佛波酯(PMA)及蛋白标准品皆购于Sigma;[γ-32P]ATP(1 mCi/ml),北京亚辉生物工程公司;[32P]Pi(10 mCi/ml),北京中国原子能研究所;新生小牛血清(NCS),大连旅顺生物制品厂;RPMI 1640培基,GIBCO公司;多克隆MAPK-2(Mitogen-activated protein kinase-2,也称ERK-2)抗体由加拿大UBC大学Steven Pelech教授赠送;ABC药盒为美国Vector Lab.Inc.;其它试剂均为国产分析纯。
1.1.2 动物 纯系昆明种小白鼠,23~25 g,雌雄不限,本校实验动物室提供。
, http://www.100md.com 1.2 方法
1.2.1 Mφ的培养、鉴定及激活[6] 小白鼠腹腔注射4%巯基乙醇(TG)培基,1.5 ml/只,4 d后用含4%NCS的无Ca2+、Mg2+的Hank’s液灌洗,收集小鼠腹腔渗出细胞(PEC)。PEC用RPMI 1640全培基(含20%NCS,4 mmol/L L-谷氨酰胺,4 mmol/L Hepes,0.25%NaHCO3,100 μg/ml青霉素,140 μg/ml链霉素)调成悬液,计数,按5×106细胞/孔分配于6孔塑料培养板中,经贴壁培养得贴壁细胞,后者经Mφ酸性磷酸酶和非特异性酯酶鉴定,98%以上为Mφ。Mφ在受LPS不同时间(15,30,60 min)刺激后或分别用蛋白激酶特异抑制剂、激动剂及百日咳毒素预处理1 h后再受LPS刺激。各种Mφ处理完毕,用PBS洗3遍,然后加入细胞溶解液(0.5%TritonX-100,80 mmol/L β-磷酸甘油,20 mmol/L EGTA,14 mmol/L MgCl2,1 mmol/L Na3VO3,10 mmol/L NaF,1 mmol/L PMSF,pH7.6)溶解细胞,11 000 r/min离心,收集上清,以考马氏亮蓝测定蛋白质含量,然后进行蛋白质磷酸化实验。
, http://www.100md.com
1.2.2 Mφ细胞溶解液蛋白质磷酸化 取50 μl细胞溶解液,加入蛋白质磷酸化缓冲液(100 mmol/L Tris-HCl,40 mmol/L MgCl2,3.5 mmol/L ATP)及4~5 μCi [γ-32P]ATP,终体积为65 μl,于37℃保温使磷酸化30 min,然后加入15 μl电泳样品缓冲液,放100℃水浴3 min 终止反应。以13%凝胶浓度进行SDS-PAGE,蛋白上样量为100 μg。电泳完毕,用考马氏亮蓝R250于50℃染色30 min,脱色1 h,观察电泳结果,然后滤纸吸干胶板再进行放射自显影。显影后的胶板可重新染色、脱色,以标准蛋白定蛋白质分子量。
1.2.3 完整Mφ蛋白质磷酸化和Western blot鉴定MAPK-2[5,7] 二者的测定完全按文献进行。
2 结果
2.1 LPS增强Mφ的14.2 kD蛋白质磷酸化 小鼠腹腔Mφ受LPS刺激或先用genistein等试剂预处理后再受LPS刺激,各组Mφ溶解液蛋白质磷酸化结果见图1。从图1中可知,LPS单独处理的Mφ溶解液中14.2 kD的蛋白质磷酸化比对照组显著地增强(Lane 5或Lane 1比较),LPS的这种效应受TPK抑制剂genistein的抑制(Lane 5与Lane 4比较),但不受PKA激动剂forskolin及Gi效应剂百日咳毒素的影响(Lane 5与Lane 2,3比较)。14.2 kD蛋白质密度扫描值与上述结论相一致。

, 百拇医药
图1 LPS增强Mφ的14.2 kD蛋白质磷酸化
Fig.1 LPS enhanced the phosphorylation of a 14.2 kD protein of Mφ
Note: TG-elicited Mφs were treated for 30 min with medium(lane 1) or with 1 μg/ml LPS(lane 5) or (with 1 μg/ml LPS after 1 h of pretreatment with 25 μmol/L of forskolin (lane 2),125 ng/ml pertussis toxin(lane 3),30 μmol/L of genistein (lane 4).The treated cells were washed and lysed.TritonX-100-soluble protein was prepared for protein phosphorylation as described in materials and methods.Fig.1 is a representative autoradigram of three experiments
, 百拇医药
2.2 LPS增强Mφ的14.2 kD蛋白质磷酸化的时间过程 Mφ受LPS不同时间刺激,然后测定LPS增强14.2 kD蛋白质磷酸化的最佳时间,结果见图2。图2显示LPS刺激Mφ 30 min,14.2 kD蛋白质的磷酸化强度最大,与相应对照组差别最大。LPS刺激Mφ1 h,14.2 kD蛋白质磷酸化与对照组相比无显著性。14.2 kD蛋白质密度扫描值支持上述结论。

图2 LPS增强Mφ的14.2 kD蛋白质磷酸化的时间过程
Fig.2 The time course of LPS-enhanced phosphorylation of a 14.2 kD protein of Mφ
Note:TG-elicited Mφs were treated with medium(lane 1,3,5) or with 1 μg/ml of LPS(lane 2,4,6)for various times.The steps that follow were as described in materials and methods.The fig is a representative autoradigram of three experiments
, http://www.100md.com
2.3 LPS增强完整Mφ蛋白质磷酸化 文献曾报道,LPS能激活Mφ的有丝分裂原激活的蛋白激酶(MAPK)。MAPK家族分子量在38.0~45.0 kD,其中MAPK-2的分子量为42.0 kD。LPS激活MAPK的最佳时间为15 min,MAPK被磷酸化后而激活,然后再磷酸化其靶蛋白而将信息下传[7,8]。LPS增强14.2 kD蛋白质磷酸化的时间进程恰好处于MAPK激活状态之下,14.2 kD磷酸化是否是MAPK激活的结果呢?通过测定完整Mφ蛋白质磷酸化可观察到LPS增强38.0~45.0 kD蛋白质磷酸化,说明MAPK被激活,但14.2 kD蛋白质磷酸化情况被前沿32P遮盖住了。用MAPK-2多克隆抗体也检测到MAPK-2的存在,但酶蛋白的表达量未有显著变化,表明14.2 kD磷酸化的增强可能不是MAPK作用的结果。
3 讨论
LPS能激活Mφ非受体型Src家族的TPK,后者以TPK→Raf→MAPK kinase→MAPK途径激活MAPK[9]。MAPK的激活是其酶蛋白特定部位Tyr/Thr同时双重磷酸化导致的,但在Mφ中,MAPK的表达量不变[7,8]。本文用MAPK-2多克隆抗体证明Mφ中存在MAPK-2,其酶表达量也不变。通过完整Mφ蛋白磷酸化(结果略)也观察到MAPK家族蛋白磷酸化较对照增加,即酶活性增加,这一点与文献[7,8]相符合。通过LPS激活Mφ的MAPK最佳剂量与时间刺激Mφ[8],则观察到LPS增强Mφ溶解液中14.2 kD蛋白质磷酸化,且14.2 kD蛋白质磷酸化受TPK抑制剂genistein抑制,而又受PKA和Gi的影响。文献[8]报道LPS对Mφ的MAPK的激活也受genistein抑制,因TPK是MAPK上游一个重要传递站,从14.2 kD蛋白质磷酸化和MAPK激活都受TPK控制及LPS激活MAPK的最佳时间(15 min)与激活14.2 kD蛋白质磷酸化最佳时间(30 min)有一定先后次序相关联上看,14.2 kD蛋白质磷酸化可能与MAPK激活有关,但这里未能确定二者的关系,需做进一步实验来证实。TPK是LPS激活Mφ信息传递中的一个重要传递站,LPS增强14.2 kD蛋白质磷酸化受TPK所控制,说明14.2 kD可能作为一种因子或信使参与LPS激活Mφ的信息传递,对14.2 kD蛋白的深入研究有重要的意义。
, 百拇医药
资金项目:国家自然科学基金(39500134)及大连市科委基金资助课题
作者简介:刘彦,主要从事免疫学研究
参考文献
1 刘 彦,崔肇春.巨噬细胞激活与其信息传递.国外医学*免疫学分册,1996;19(4):214
2 Wu G Y,Wu. The activation of the arginine-citrulline cycle in macrophage from the spontaneously diabetic BB rat.Biochem J,1993;294:113
3 Paul A,Pendreigh R H,PLevin R.Protein kinase C and tyrosine kinase pathways regulate lipopolysaccharide-induced nitric oxide synthase activity in Raw 264.7 murine macrophages.Brit J Pharmacol,1995;114:482
, 百拇医药
4 Pan J M,Burgher K L,Sjcjepanik A M et al.Tyrosine phosphorylation of inducible nitric oxide synthase:implications for potential post-translational regulation.Biochem J,1996;314:889
5 Weiel J E,Hamilton T A,Adams D O.LPS induces altered phosphate labeling of proteins in murine peritoneal macrophages.J Immunol,1986;136:3012
6 Pennline K J.In:Heppner G H,Futton A M eds.Macrophages and Cancer,Boca Rotn,Florida:CRC Press Inc,1988:63-68
, 百拇医药
7 Weinstein S L,Sanghera J S,Lemke K et al.Bacterial lipopolysaccharide induces tyrosine phosphorylation and activation of mitogen-activated protein dinases in macrophages.J Biol Chem,1992;267(21);14955
8 Dong Z Y,Qi X X,Fidder I J.Tyrosine phosphorylation of mitogen-activated protein kinases is necessary for activation of murine macrophages by natural and synthetic bacterial products.J Exp Med,1993;177:1071
9 Reimann T,Buscher D,Hipskind R A et al.Lipopolysaccharide induces activation of the Raf-1/MAP kinase pathway.J Immunol,1994;153:5740
收稿:1997-10-05 修回:1998-06-26
, http://www.100md.com