外源性IL-4基因表达对K562 细胞增殖及死亡的影响
作者:赵晓东 李成荣 杨锡强 李欣 黄贵清 蒋利萍
单位:赵晓东(重庆医科大学儿童医院,重庆400014);李成荣(重庆医科大学儿童医院,重庆400014);杨锡强(重庆医科大学儿童医院,重庆400014);李欣(重庆医科大学儿童医院,重庆400014)
关键词:IL-4;基因治疗;白血病
中国免疫学杂志000413 摘 要 目的:观察外源性 IL-4对 K562增殖及死亡的影响。 方法:用逆转录病毒载体将IL-4 cDNA导入K562细胞,检测其增殖 反 应,用流式细胞仪及 DNA片段凝胶电泳检测细胞增殖周期及凋亡情况,用台盼蓝排除法计 数死亡细胞。结果:高表达 IL-4的 K562细胞增殖反应 明显低于低表达株、亲代 K562株;前者培养过程中死亡细胞百分率明显升高且可被IL-4 单克隆抗体阻断,但其自发凋亡细胞数及增殖周期均无明显改变。 结论:外源性 IL-4基因表达产物可诱导K562细胞死亡,但并非凋 亡机制介导。
, 百拇医药
中国图书分类号 R725.5
The effect of exogenous IL-4 gene expression on cell death of K562 cells
ZHAO Xiao-Dong LI Cheng-Rong YANG Xi-Qiang
(Children's Hospital,Chongqin g University of Medical Sciences,Chongqing 400014)
Abstract Objective: To observe the effec t of exogenous IL-4 gene expression on cell death of K562 cells.Methods: IL-4 gene was transduced into K562 ce ll via retroviral vector-mediated gene transfer method.Trypan blue stain,gel el ec trophoresis and flow cytometry were employed to determine cell death of K562 cel l. Results:Proliferation of high IL-4-producing K562 clones was significantly lower than that of low IL-4-producing clones,pa rental K562 cells and K562 cells co-cultured with recombinant IL-4.C ell death o f high IL-4-producing K562 cells was enhanced dramatically and this effect co uld be blocked by IL-4 McAb,but its cell cycle no ever changed.There was no apoptosis determined.Conclusion: IL-4 expressed by IL-4 gene-m odified K562 cells could induce cell death of K562 cell by means of necrosis,whi ch is benefitial for growth inhibition of leukemic cell.
, http://www.100md.com
Key words IL-4 Gene therapy Leukemia
人白细胞介素4(hIL-4)是一种具有多种生物学功能的细胞因子,诸多研究已显示其在抗 实 体瘤免疫治疗方面有广阔的应用前景。近年又发现 IL-4促进急性 B淋巴细胞性白血病细 胞凋亡[1,2]。肿瘤细胞本身产生的细胞因子可能较精确地模拟生理状况下的作用 模式,因而本文 将IL-4基因导入人红白血病细胞系-K562,观察其表达对细胞存活特性的影响,并初步探 讨其机制。
1 材料与方法
1.1 IL-4基因修饰K562细胞株的获得 作者采用逆转录病毒载体将人IL-4基因导入K562细胞并获得持续高表达IL-4的K562株,具体 方法见文献[3]。
1.2 K562细胞体外增殖反应 采用3H-TdR掺入法检测IL-4基因 修饰K562细胞(K-IL-41-4)、空载体修饰K562细胞(K-neo)和亲代K562细胞体 外增殖反应。
, http://www.100md.com
1.3 K562细胞增殖周期 采用流式细胞仪检测。复苏K-IL-41细 胞 株,体外反复换液培养l w,待细胞数量扩增3~5倍时取 1×107接种于6孔板,总体积为 3 ml 。另分别接种野生型K562及rIL-4对照组(培养初始加入rIL-4 0.2 ng/ml),37℃,5%CO2及95%湿度条件下培养48 h。培养结束后离心去除上清,PBS洗涤后碘化丙啶(PI)染色 20 min,用流式细胞仪分析各增殖周期的细胞构成比。
1.4 台盼蓝拒染法观察K562 细胞死亡情况 细胞悬液浓度调至2×10 8~5×108 ml-1并加入等体积0.2%台盼蓝染液,3 min内滴入细胞计数池内 计数200个细胞,着色者为死细胞。按下式计算死 亡细胞所占百分率: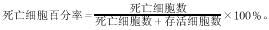
, http://www.100md.com
1.5 K562细胞凋亡检测 结合DNA凝胶电泳和流式细胞仪观察。 分别接种K-IL-41、野生型K562 3×106于6孔板, 设以下6组:亲代K562组;亲代K562+重组IL-4 0.2 ng/ml;K-IL-41组;K5 62+放线菌酮;PBMC +放线菌酮(阳性对照);PBMC+Anti-CD3(阳性对照)。
37℃,5%CO2及95%湿度条件下培养48 h,结束后取2×106细胞提取片段DNA 凝胶电泳 观察。另取1×106细胞用PBS洗涤后PI染色20 min,流式细胞仪观察亚二倍体细胞。
2 结果
2.1 K562细胞表达IL-4水平及增殖反应 K-IL-41表达IL-4的水平可达106.6 pg/(106cell.d),而野生型K562和K562-neo均无IL-4 表达 。高表达IL-4的K562株增殖反应明显降低,rIL-4亦可抑制K562细胞的增殖反应(表1)。
, http://www.100md.com
表1 K562细胞IL-4表达水平及其体外增殖反应
Tab.1 IL-4 expression and proliferation of K562 Parental K562
0
6 065
-
4 673
K562-neo
0
5 826
-
4 350
, http://www.100md.com
K-IL-41
106.6
3 723
5 320
-
K-IL-42
85.3
4 356
5 755
-
K-IL-43
47.6
, 百拇医药
4 756
6 090
-
K-IL-44
38.1
5 012
5 988
-
2.2 IL-4基因修饰对K562细胞增殖周期的影响 加入rIL-4共培养 或IL-4基因修饰的K562细胞各增殖周期所占百分率与亲代K562无显著差别。加入放线菌 酮的K562细胞增殖周期发生明显改变。K-IL-41细胞培养过程中产生的细胞碎片亦 明显增多(表2)。表2 各增殖周期K562及细胞碎片百分率(%)
, 百拇医药
Tab.2 Percentage of dead cells of cultured K562(%) Cell line
3rd
6th
8th
10th(d)
K-IL-41
25
28
32
29
K-IL-41+IL-4 McAb
, 百拇医药
8
15
26
30
K562+rIL-4
16
8
5
4
K562
2
3
1
1
, 百拇医药
K562-neo
2
5
4
6
2.3 K562细胞培养过程中死亡细胞所占百分率 用台盼蓝拒染法动态 观察细胞存活状态,发现K-IL-41及加入rIL-4的K562培养过程中死亡细胞所占百分率高于野生型K562细胞(表3)。表3 K562细胞培养过程中死亡细胞百分率动态观察(%)
Tab.3 Percentage of K562 in G0-G1,G2-M and S phage
and cell debris(%) Group
, 百拇医药
G0-G1
G2-M
S
Cell debris
K562
30.71
17.59
51.59
3.08
K-IL-41
33.02
15.01
, 百拇医药 51.97
12.13
K562+rIL-4
32.45
19.57
47.97
8.22
K562+CHO
42.87
0.00
57.16
10.94
2.4 K562细胞凋亡观察 凝胶电泳观察发现 K-IL-41 及加入 rIL-4共育的K562组并无片段DNA出现,加入Anti-CD3和放线菌酮的PBMC阳性对照组则出现 明显的片段DNA, K562放线菌酮组出现少量片段DNA。用流式细胞仪观察发现阳性对照出现 明显的亚二倍体峰,K-IL-41和rIL-4对照组有无此峰不能肯定,见图1、2。
, http://www.100md.com
图1 K562 细胞凋亡片段DNA凝胶电泳图
Fig.1 DNA fragmentation of K562 cell
Note:1.marker;2.K562;3.K562+rIL-4;4.K-IL-41;
5.K562+mytocin;6.PBMC+Anti-CD3;7.PBMC+mytocin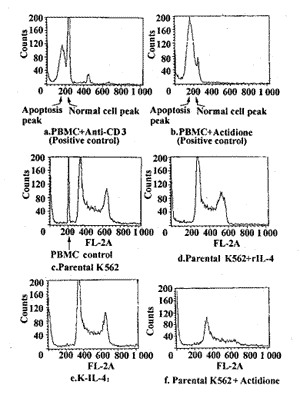
图2 流式细胞术检测K562细胞凋亡
Fig.2 Apoptosis of K562 detected by flow cytometry
3 讨论
, http://www.100md.com
肿瘤细胞丧失正常细胞所具有的死亡机制是肿瘤恶性扩增并致死的关键因素;肿瘤细胞死 亡过程亦有益于机体抗肿瘤免疫反应的建立,因而通过适当手段促进肿瘤细胞死亡既可直接 抑制瘤细胞生长,又能有效刺激机体建立抗肿瘤免疫应答[4]。已证实 某些细胞因子能启动 肿瘤细胞的死亡机制,近年又发现IL-4可诱导耐药B淋巴细胞白血病细胞凋亡,但尚未见将 IL-4基因转导入白血病细胞后对其死亡过程影响的报道。本文发现通过逆转录病毒载体介导转染入K562细胞的IL-4 cDNA可高水平表达,K562细胞表 达IL-4水平与其自身增殖反应负相关。肿瘤细胞自分泌或加入培养系统的rIL-4均有效抑 制 其增殖反应,此种效应可被IL-4单克隆抗体阻断。进一步观察发现,IL-4基因修饰或在培 养 系统中加入rIL-4明显促进K562细胞死亡,但无论肿瘤细胞自分泌或外源性给予IL-4均对K 562增殖周期无明显影响,证实IL-4诱导的K562细胞死亡是其增殖反应减弱的重要原因。坏死与凋亡为细胞死亡的两种形式,二者均可能出现于肿瘤细胞的体内死亡过程[5]。肿瘤细胞不同类型、局部浸润细胞成分及其分泌的细胞因子等因素可影响瘤细胞的死亡机制[6]。 本文未发现K562细胞凋亡的依据,故IL-4诱导的K562细胞体外死亡过程可能并非凋亡机制 介导。K562细胞自分泌的IL-4可能在生物活性、局部浓度及维持时间等方面优于rIL-4, 故 培养过程中K-IL-41株死亡细胞百分率明显高于加有外源性rIL-4的K562株,有理由推 测IL-4基因修饰的K562疫苗具有比直接使用rIL-4更优良的抗瘤效果。
, http://www.100md.com
本文受国家自然科学基金资助(No.39470733)
作者简介:赵晓东,男,28岁,儿科学博士生;
李成荣 指导教师,男,教授 ,硕士生导师,研究方向为小儿临床免疫学;
杨锡强 指导教师,男,教授,博士生导师,研究方向为小儿临床免疫学
黄贵清(重庆医科大学儿童医院,重庆400014)
蒋利萍(重庆医科大学儿童医院,重庆400014)
4 参考文献
1,Manade A,Coustan S E,Kumagai M et al. In terleukin-4 induces programmed cell death(apoptosis)in cases of high-risk acut e lymphoblastic leukemia.Blood,1994;83:1731
, 百拇医药
2,Defrance T,Fluckiger A C,Rossi J F et al.Antiproliferative effe cts of interleukin-4 on freshly isolated non-Hodgkin malignant B-lymphoma cel ls.Blood,1992;79(4):990
3,赵晓东,李成荣,杨锡强et al.人IL-4逆转录病毒载体的构建及在人 肿瘤细胞中的表达.重庆医科大学学报,1998;23(1):1
4,Bosco M C,Giovarelli M,Forni G et al. Low doses of IL-4 inject e d perilymphatically in tumor-bearing mice inhibit the growth of poorly and
appa rently nonimmunogenic tumors and induce a tumor-specific immune memory.J Immuno l,1990;145:3136
, 百拇医药
5,Musiani P,Modesti A,Giovarelli G et al.Cytokines,tumor cell dea th and
immunogenicity:a question of choice.Immunol Today, 1997;18:32
6,Witmer-Pack M D,Oliver W,Valinsky J et al.Granulocyte/macropha
gecolony-stimulating factor is essential for the viability and function of cultured
murine epidermal langerhans cells.J Exp Med,1987;166:1484
[收稿1998-06-10 修回1998-10-20], 百拇医药
单位:赵晓东(重庆医科大学儿童医院,重庆400014);李成荣(重庆医科大学儿童医院,重庆400014);杨锡强(重庆医科大学儿童医院,重庆400014);李欣(重庆医科大学儿童医院,重庆400014)
关键词:IL-4;基因治疗;白血病
中国免疫学杂志000413 摘 要 目的:观察外源性 IL-4对 K562增殖及死亡的影响。 方法:用逆转录病毒载体将IL-4 cDNA导入K562细胞,检测其增殖 反 应,用流式细胞仪及 DNA片段凝胶电泳检测细胞增殖周期及凋亡情况,用台盼蓝排除法计 数死亡细胞。结果:高表达 IL-4的 K562细胞增殖反应 明显低于低表达株、亲代 K562株;前者培养过程中死亡细胞百分率明显升高且可被IL-4 单克隆抗体阻断,但其自发凋亡细胞数及增殖周期均无明显改变。 结论:外源性 IL-4基因表达产物可诱导K562细胞死亡,但并非凋 亡机制介导。
, 百拇医药
中国图书分类号 R725.5
The effect of exogenous IL-4 gene expression on cell death of K562 cells
ZHAO Xiao-Dong LI Cheng-Rong YANG Xi-Qiang
(Children's Hospital,Chongqin g University of Medical Sciences,Chongqing 400014)
Abstract Objective: To observe the effec t of exogenous IL-4 gene expression on cell death of K562 cells.Methods: IL-4 gene was transduced into K562 ce ll via retroviral vector-mediated gene transfer method.Trypan blue stain,gel el ec trophoresis and flow cytometry were employed to determine cell death of K562 cel l. Results:Proliferation of high IL-4-producing K562 clones was significantly lower than that of low IL-4-producing clones,pa rental K562 cells and K562 cells co-cultured with recombinant IL-4.C ell death o f high IL-4-producing K562 cells was enhanced dramatically and this effect co uld be blocked by IL-4 McAb,but its cell cycle no ever changed.There was no apoptosis determined.Conclusion: IL-4 expressed by IL-4 gene-m odified K562 cells could induce cell death of K562 cell by means of necrosis,whi ch is benefitial for growth inhibition of leukemic cell.
, http://www.100md.com
Key words IL-4 Gene therapy Leukemia
人白细胞介素4(hIL-4)是一种具有多种生物学功能的细胞因子,诸多研究已显示其在抗 实 体瘤免疫治疗方面有广阔的应用前景。近年又发现 IL-4促进急性 B淋巴细胞性白血病细 胞凋亡[1,2]。肿瘤细胞本身产生的细胞因子可能较精确地模拟生理状况下的作用 模式,因而本文 将IL-4基因导入人红白血病细胞系-K562,观察其表达对细胞存活特性的影响,并初步探 讨其机制。
1 材料与方法
1.1 IL-4基因修饰K562细胞株的获得 作者采用逆转录病毒载体将人IL-4基因导入K562细胞并获得持续高表达IL-4的K562株,具体 方法见文献[3]。
1.2 K562细胞体外增殖反应 采用3H-TdR掺入法检测IL-4基因 修饰K562细胞(K-IL-41-4)、空载体修饰K562细胞(K-neo)和亲代K562细胞体 外增殖反应。
, http://www.100md.com
1.3 K562细胞增殖周期 采用流式细胞仪检测。复苏K-IL-41细 胞 株,体外反复换液培养l w,待细胞数量扩增3~5倍时取 1×107接种于6孔板,总体积为 3 ml 。另分别接种野生型K562及rIL-4对照组(培养初始加入rIL-4 0.2 ng/ml),37℃,5%CO2及95%湿度条件下培养48 h。培养结束后离心去除上清,PBS洗涤后碘化丙啶(PI)染色 20 min,用流式细胞仪分析各增殖周期的细胞构成比。
1.4 台盼蓝拒染法观察K562 细胞死亡情况 细胞悬液浓度调至2×10 8~5×108 ml-1并加入等体积0.2%台盼蓝染液,3 min内滴入细胞计数池内 计数200个细胞,着色者为死细胞。按下式计算死 亡细胞所占百分率:
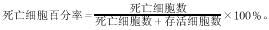
, http://www.100md.com
1.5 K562细胞凋亡检测 结合DNA凝胶电泳和流式细胞仪观察。 分别接种K-IL-41、野生型K562 3×106于6孔板, 设以下6组:亲代K562组;亲代K562+重组IL-4 0.2 ng/ml;K-IL-41组;K5 62+放线菌酮;PBMC +放线菌酮(阳性对照);PBMC+Anti-CD3(阳性对照)。
37℃,5%CO2及95%湿度条件下培养48 h,结束后取2×106细胞提取片段DNA 凝胶电泳 观察。另取1×106细胞用PBS洗涤后PI染色20 min,流式细胞仪观察亚二倍体细胞。
2 结果
2.1 K562细胞表达IL-4水平及增殖反应 K-IL-41表达IL-4的水平可达106.6 pg/(106cell.d),而野生型K562和K562-neo均无IL-4 表达 。高表达IL-4的K562株增殖反应明显降低,rIL-4亦可抑制K562细胞的增殖反应(表1)。
, http://www.100md.com
表1 K562细胞IL-4表达水平及其体外增殖反应
Tab.1 IL-4 expression and proliferation of K562 Parental K562
0
6 065
-
4 673
K562-neo
0
5 826
-
4 350
, http://www.100md.com
K-IL-41
106.6
3 723
5 320
-
K-IL-42
85.3
4 356
5 755
-
K-IL-43
47.6
, 百拇医药
4 756
6 090
-
K-IL-44
38.1
5 012
5 988
-
2.2 IL-4基因修饰对K562细胞增殖周期的影响 加入rIL-4共培养 或IL-4基因修饰的K562细胞各增殖周期所占百分率与亲代K562无显著差别。加入放线菌 酮的K562细胞增殖周期发生明显改变。K-IL-41细胞培养过程中产生的细胞碎片亦 明显增多(表2)。表2 各增殖周期K562及细胞碎片百分率(%)
, 百拇医药
Tab.2 Percentage of dead cells of cultured K562(%) Cell line
3rd
6th
8th
10th(d)
K-IL-41
25
28
32
29
K-IL-41+IL-4 McAb
, 百拇医药
8
15
26
30
K562+rIL-4
16
8
5
4
K562
2
3
1
1
, 百拇医药
K562-neo
2
5
4
6
2.3 K562细胞培养过程中死亡细胞所占百分率 用台盼蓝拒染法动态 观察细胞存活状态,发现K-IL-41及加入rIL-4的K562培养过程中死亡细胞所占百分率高于野生型K562细胞(表3)。表3 K562细胞培养过程中死亡细胞百分率动态观察(%)
Tab.3 Percentage of K562 in G0-G1,G2-M and S phage
and cell debris(%) Group
, 百拇医药
G0-G1
G2-M
S
Cell debris
K562
30.71
17.59
51.59
3.08
K-IL-41
33.02
15.01
, 百拇医药 51.97
12.13
K562+rIL-4
32.45
19.57
47.97
8.22
K562+CHO
42.87
0.00
57.16
10.94
2.4 K562细胞凋亡观察 凝胶电泳观察发现 K-IL-41 及加入 rIL-4共育的K562组并无片段DNA出现,加入Anti-CD3和放线菌酮的PBMC阳性对照组则出现 明显的片段DNA, K562放线菌酮组出现少量片段DNA。用流式细胞仪观察发现阳性对照出现 明显的亚二倍体峰,K-IL-41和rIL-4对照组有无此峰不能肯定,见图1、2。

, http://www.100md.com
图1 K562 细胞凋亡片段DNA凝胶电泳图
Fig.1 DNA fragmentation of K562 cell
Note:1.marker;2.K562;3.K562+rIL-4;4.K-IL-41;
5.K562+mytocin;6.PBMC+Anti-CD3;7.PBMC+mytocin

图2 流式细胞术检测K562细胞凋亡
Fig.2 Apoptosis of K562 detected by flow cytometry
3 讨论
, http://www.100md.com
肿瘤细胞丧失正常细胞所具有的死亡机制是肿瘤恶性扩增并致死的关键因素;肿瘤细胞死 亡过程亦有益于机体抗肿瘤免疫反应的建立,因而通过适当手段促进肿瘤细胞死亡既可直接 抑制瘤细胞生长,又能有效刺激机体建立抗肿瘤免疫应答[4]。已证实 某些细胞因子能启动 肿瘤细胞的死亡机制,近年又发现IL-4可诱导耐药B淋巴细胞白血病细胞凋亡,但尚未见将 IL-4基因转导入白血病细胞后对其死亡过程影响的报道。本文发现通过逆转录病毒载体介导转染入K562细胞的IL-4 cDNA可高水平表达,K562细胞表 达IL-4水平与其自身增殖反应负相关。肿瘤细胞自分泌或加入培养系统的rIL-4均有效抑 制 其增殖反应,此种效应可被IL-4单克隆抗体阻断。进一步观察发现,IL-4基因修饰或在培 养 系统中加入rIL-4明显促进K562细胞死亡,但无论肿瘤细胞自分泌或外源性给予IL-4均对K 562增殖周期无明显影响,证实IL-4诱导的K562细胞死亡是其增殖反应减弱的重要原因。坏死与凋亡为细胞死亡的两种形式,二者均可能出现于肿瘤细胞的体内死亡过程[5]。肿瘤细胞不同类型、局部浸润细胞成分及其分泌的细胞因子等因素可影响瘤细胞的死亡机制[6]。 本文未发现K562细胞凋亡的依据,故IL-4诱导的K562细胞体外死亡过程可能并非凋亡机制 介导。K562细胞自分泌的IL-4可能在生物活性、局部浓度及维持时间等方面优于rIL-4, 故 培养过程中K-IL-41株死亡细胞百分率明显高于加有外源性rIL-4的K562株,有理由推 测IL-4基因修饰的K562疫苗具有比直接使用rIL-4更优良的抗瘤效果。
, http://www.100md.com
本文受国家自然科学基金资助(No.39470733)
作者简介:赵晓东,男,28岁,儿科学博士生;
李成荣 指导教师,男,教授 ,硕士生导师,研究方向为小儿临床免疫学;
杨锡强 指导教师,男,教授,博士生导师,研究方向为小儿临床免疫学
黄贵清(重庆医科大学儿童医院,重庆400014)
蒋利萍(重庆医科大学儿童医院,重庆400014)
4 参考文献
1,Manade A,Coustan S E,Kumagai M et al. In terleukin-4 induces programmed cell death(apoptosis)in cases of high-risk acut e lymphoblastic leukemia.Blood,1994;83:1731
, 百拇医药
2,Defrance T,Fluckiger A C,Rossi J F et al.Antiproliferative effe cts of interleukin-4 on freshly isolated non-Hodgkin malignant B-lymphoma cel ls.Blood,1992;79(4):990
3,赵晓东,李成荣,杨锡强et al.人IL-4逆转录病毒载体的构建及在人 肿瘤细胞中的表达.重庆医科大学学报,1998;23(1):1
4,Bosco M C,Giovarelli M,Forni G et al. Low doses of IL-4 inject e d perilymphatically in tumor-bearing mice inhibit the growth of poorly and
appa rently nonimmunogenic tumors and induce a tumor-specific immune memory.J Immuno l,1990;145:3136
, 百拇医药
5,Musiani P,Modesti A,Giovarelli G et al.Cytokines,tumor cell dea th and
immunogenicity:a question of choice.Immunol Today, 1997;18:32
6,Witmer-Pack M D,Oliver W,Valinsky J et al.Granulocyte/macropha
gecolony-stimulating factor is essential for the viability and function of cultured
murine epidermal langerhans cells.J Exp Med,1987;166:1484
[收稿1998-06-10 修回1998-10-20], 百拇医药