用生物传感器测定重组人α2a-干扰素单克隆抗体的亲和力及抗原识别表位
作者:朱勇 金伯泉 刘雪松
单位:朱勇(第四军医大学免疫学教研室,西安 710032);金伯泉(第四军医大学免疫学教研室,西安 710032);刘雪松(第四军医大学免疫学教研室,西安 710032)
关键词:生物传感器;单克隆抗体;动力学分析;表位测定
中国免疫学杂志000613 摘 要 目的:测定抗重组人α2a-干扰素单克隆抗体的抗原识别表位及其亲和常数。方法:借助于生物传感器技术进行抗原抗体相互作用的动力学分析。结果:抗体的亲和常数介于10-5~10-7之间,5株抗体识别干扰素分子上4种不同的抗原表位。结论:生物传感器在研究抗原抗体相互作用中确为一个理想的工具,适合于抗原抗体结合与解离的动力学分析及预测表位的构像关系。
中国图书分类号 R392.11
, 百拇医药
Determination of affinity and antigenic epitopes of recombinant human interferon-α2a with monoclonal antibodies by biosensor
ZHU Yong,JIN Bo-Quan,LIU Xue-Song
(Department of Immunology,Fourth Military Medical University,Xi'an 710032)
Abstract Objective:To determine the affinity of 5 monoclonal antibodies specific for recombinant human interferon-α2a and antigenic epitopes of interferon.Methods:The affinity constants were measured by means of kinetic analysis,and the antigenic epitopes were determined subsequently,via the biosensor technique.Results:It was shown that the affinity constants of the antibodies ranged from 10-5 to 10-7 and the antigenic epitopes could be categorized into 4 groups.Conclusion:Based on the results obtained,it was concluded that the bisensor is a very ideal and powerful tool to facilitate the kinetic analysis of interaction between antigen and antibody and for prediction of conformational distribution of antigenic epitopes.
, 百拇医药
Key words Biosensor Monoclonal antibody Kinetic analysis Epitope mapping
生物传感器(biosensor)是一种实时监测生物大分子之间相互作用的新技术和新设备。借助于这一技术,可以动态观察抗原抗体之间结合与解离的平衡关系,较为准确地测定抗体的亲和力及识别抗原表位,帮助人们了解单克隆抗体特性,从而有目的地筛选各种具有最佳应用潜力的单抗,而且较常规方法省时、省力,结果也更为客观可信,它在国外生物医学研究方面已有较广泛的应用,但在我国才刚刚起步。最近我们采用Affinity Sensors公司生产的生物传感器IAsys Plus对本室制备的5株抗重组人α2a-干扰素(recombinant human interferon-α2a,rHuIFN-α2a)单克隆抗体的抗原识别表位及其亲和常数进行了测定。结果表明生物传感器在抗原抗体结合的动力学分析方面确有其独到之处。
1 材料与方法
, 百拇医药
1.1 rHuIFN-α2a及其单克隆抗体的制备 抗rHuIFN-α2a单克隆抗体杂交瘤由本室制备[1]。常规制备单抗腹水,经40%硫酸铵盐析和DEAE-FPLC纯化,纯度达90%。rHuIFN-α2a粗品由海南新大洲药业有限公司提供,采用本室研制的亲和层析柱[2]进一步纯化,纯度为90%以上。
1.2 rHuIFN-α2a包被样品池(cuvette) 羧甲基葡聚糖(carboxymethyl dextran,CMD)预处理的样品池由Affinity System 公司惠赠,按照产品手册及提供的NHS/EDC kit活化CMD上的羧基后,分别在两个样品池中加入rHuIFN-α2a(50 μg/ml)和牛血清白蛋白(BAS,100 μg/ml)各50 μl,5 min后用乙醇胺封闭空余羧基3 min。然后用1 mol/L甲酸洗去游离及非特异结合之蛋白分子。
1.3 生物传感器工作的原理和基本过程 简言之,生物传感器的工作原理是利用表面等离子共振(surface plasmon resonance)现象监测传感片表面介质的折射率变化所引发的共振角改变,而这一改变与传感片表面结合的生物大分子的量成正比,溶液中游离的分子不影响共振角的大小,因此非常特异、敏感。用生物传感器检测任何生物大分子间的相互作用都要经过这样几个步骤:结合-解离-再生(图1)。以本实验中rHuIFN-α2a与单抗相互作用为例,首先将包被好rHuIFN-α2a的样品池放入生物传感器,平衡10 min,①基线(baseline):加入 pH7.2,0.01 mol/L PBS 50 μl,等待5 min,作一平稳基线。②结合(association):吸去PBS,加入45 μl PBS和5 μl单抗,待单抗结合至饱和时吸去单抗液。③解离(dissociation):换50 μl PBS,待单抗结合与解离达到平衡。④再生(regeneration):换20 mmol/L HCl 50 μl作用2 min以完全洗脱结合的单抗。⑤回复基线:换PBS,再次回到基线,即可开始下1个循环。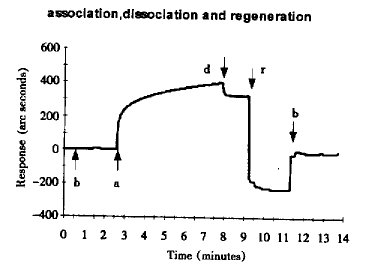
, 百拇医药
图1 生物传感器检测生物大分子间相互作用的基本过程
Fig.1 Typical working cycle of a biosensor
Note:b.baseline a.association d.dissociation r.regeneration
1.4 抗原抗体结合的动力学分析 如1.3所述,将每种单抗用PBS稀释为5个不同浓度,依次分别测定各浓度单抗与包被抗原结合、解离速率,并通过随机附送之专用软件FASTfit计算各株单抗的亲和常数。
1.5 抗原识别表位测定 在抗原抗体结合动力学分析的基础上,将每株单抗均稀释为中等饱和结合浓度,两两配对,首先在平衡好的样品池中加入Ab1,经结合、解离后,换Ab2,继续结合、解离过程。再生后进行下1个循环,将Ab1和Ab2作用顺序调换,重复进行上述步骤。
, 百拇医药
2 结果
2.1 pH5.0条件下rHuIFN-α2a包被量最大 经试用pH3.0~6.0四种不同pH值、10 mmol/L的乙酸钠缓冲液进行预包被,发现pH5.0包被缓冲液最利于rHuIFN-α2a与CMD样品池的偶联。生物传感器测定值为379.45 acr seconds,相当于样品池每mm2表面包被了1.90 ng rHuIFN-α2a。
2.2 5株单克隆抗体的亲和力及其结合、解离特点 图2显示了单抗3F1在5种不同浓度(2.88×10-7、2.88×10-6、1.15×10-5、5.75×10-7和1.15×10-6 mol/L)时结合与解离的动态变化。从所得动态曲线采集数据,经FASTfit分析计算,5株单抗的亲和常数分别为1B8:1.76×105 mol/L、2B6:4.88×106 mol/L、3F1:6.95×106 mol/L、4G5:1.15×105 mol/L、5G10:4.64×106 mol/L。同时结果显示5株单抗均不与BSA结合,表明该系统特异性良好,结果可靠。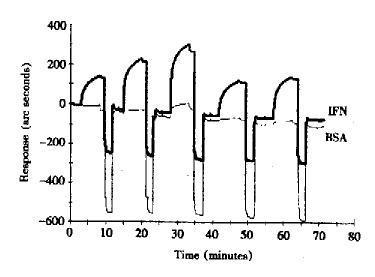
, 百拇医药
图2 单克隆抗体3F1与rHuIFN-α2a相互作用的动力学分析
Fig.2 Kinetic analysis of interaction between rHuIFN-α2a
and monoclonal antibody 3F1
Note:peridium IFN-α2a peridium BSA
2.3 rHuIFN-α2a分子上抗原表位至少有4种 图3显示了单抗1B8、2B6和3F1两两配对时,用生物传感器测定它们识别rHuIFN-α2a抗原表位的情形。图4为5株单抗两两配对时的相互拮抗关系,0表示第二抗体的结合完全被阻断,提示第一和第二抗体识别表位相同或相近;+表示第二抗体仍可结合,提示第一和第二抗体识别表位不同。值得注意的是,有一些抗体两两配对时的结合顺序不同,出现的结果也不同。如单抗2B6不能阻断单抗5G10与抗原的结合;而反过来5G10可完全阻断2B6与抗原的结合。这种情形提示这两株单抗识别的抗原表位不同,但相距较近。在构像关系上,2B6识别表位可能位于抗原分子折叠的凹陷处,5G10识别表位位于其上方。根据Venndiagram作图,得到图5所示的抗原表位识别图谱。可以清楚地看出,5株单抗识别rHuIFN-α2a分子上至少4种表位,其中1B8和2B6为一组,3F1、4G5和5G10各自独立为一组。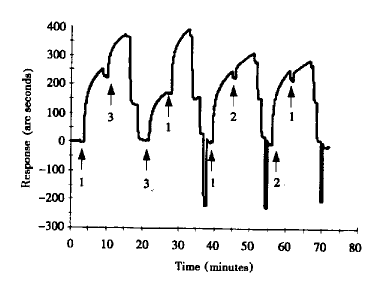
, 百拇医药
图3 rHuIFN-α2a分子上抗原识别表位的测定
Fig.3 Antigenic epitope mapping of rHuIFN-α2a
Note:1.mAb-1B8 2.mAb-2B6 3.mAb-3F1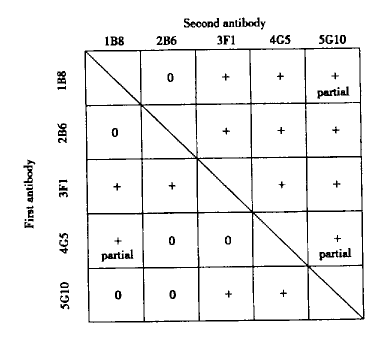
图4 生物传感器对单抗识别rHuIFN-α2a表位配对测定
Fig.4 Pairwise antigenic epitope mapping of rHuIFN-α2a by biosensor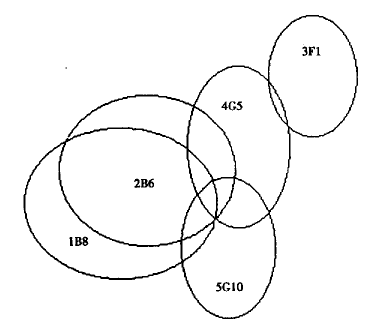
图5 rHuIFN-α2a分子上抗原表位图谱
, 百拇医药
Fig.5 Venn diagram representing antigenic epitope map of rHuIFN-α2a
3 讨论
生物传感器的应用范围十分广泛,除了抗原-抗体以外,还可以进行配体-受体[3]、核酸-核酸、核酸-蛋白[4]、细胞[5]、噬菌体[6]甚至碳水化合物和脂类分子等的相互作用研究。与常规技术相比,它具有以下几个主要特点:①实时(real-time)性。生物分子之间的相互作用可以在实验的全过程中观察,仪器每秒种可以采集3次信号。②高效性。检测一对生物大分子的相互作用只需15 min左右。③客观性。实验结果受人为因素影响较小。④敏感性。最低可检测浓度为10-12mol/L的分子。⑤简易性。检测中的任何分子无需标记。其中实时性是该技术不可替代的优势。以往我们采用常规方法,如ELISA、RIA等分析抗原-抗体结合情况,只能在实验结束后方可判定结果,做出“是”或“否”的结论,但抗原-抗体相互作用的中间过程不得而知,当实验出了差错或得出意外结果时,也很难一下找出问题所在环节。而生物传感器技术则可一目了然地全过程跟踪、观察,及时发现问题。
, 百拇医药
准确地测定抗体的亲和常数一直是比较棘手的事情,常规方法不仅需要大量抗原,而且耗时费力。生物传感器配合其专用软件则可在1 h内测定1株抗体的亲和常数。而且同时测定多株抗体的亲和常数误差小,更具可比性。此外,其独到之处还在于生物传感器技术不仅可对一组抗体的亲和力进行比较,更能直观反映一组抗体与相应抗原结合与解离的速率,这个特性对于筛选不同应用目的的抗体、优化组合非常有用,比如,用于检测、诊断的抗体的亲和力越高越好,同时与抗原的结合要快、解离则要慢和少。而用于抗原分子亲和层析纯化的抗体除了要有高的亲和力,其解离也要求比较容易。在亲和层析技术中应用生物传感器还能帮助选择合适的洗脱条件。确定一组单抗所识别抗原表位多采用竞争ELISA方法,需要酶标每株抗体,工作量很大,通常10株单抗的表位鉴定至少需要1 w时间。而应用生物传感器则可在24 h内完成。从图4和图5结果与我们以前用竞争ELISA测定表位结果[1]的比较可以看出,用生物传感器测定表位更为精确,甚至可以帮助我们初步了解几个表位在抗原分子上的空间构像关系。在选择用于夹心ELISA的最佳抗体组合上也具有很大的实际价值。
, 百拇医药
致谢:感谢Affinity Sensors公司Andrew Au先生给予的技术指导。
作者简介:朱勇,男,36岁,博士,讲师,Email:immu-804@ fmmu.edu.cn
参考文献
1,朱 勇,金伯泉,安献禄 et al.重组人α2a型干扰素单克隆抗体的研制、特性鉴定及初步应用.中国免疫学杂志,1992;8(4):219
2,朱 勇,金伯泉,赵 宁 et al.用单克隆抗体3F1亲和层析纯化rHuIFN-α2a的研究.细胞与分子免疫学杂志,1998;14(2):117
3,Ozbek S,Grotzinger J,Krebs B et al.The membrane proximal cytokine receptor domain of the human interleukin-6 receptor is sufficient for ligand binding but not for gp130 association.J Biol Chem,1998;27(33):21374
, http://www.100md.com
4,Yang W P,Wu H,Barbas C F.Surface plasmon resonance based kinetic studies of zinc finger-DNA interactions.J Immunol Methods,1995;183(1):175
5,Inoue K,Arai T,Aoyagi M.Real-time observation of binding of herpes simplex virus type 1(HSV-1)to vero cells and neutralization of hSV-1 by sulfonated human immunoglobulin.J Biochem,1997;121:633
6,Krebs B,Griffin H,Winter G et al.Recombinant human single chain Fv antibodies recognizing human interleukin-6.Specific targeting of cytokine-secreting cells.J Biol Chem,1998;273(5):2858
1999-04-29, http://www.100md.com
单位:朱勇(第四军医大学免疫学教研室,西安 710032);金伯泉(第四军医大学免疫学教研室,西安 710032);刘雪松(第四军医大学免疫学教研室,西安 710032)
关键词:生物传感器;单克隆抗体;动力学分析;表位测定
中国免疫学杂志000613 摘 要 目的:测定抗重组人α2a-干扰素单克隆抗体的抗原识别表位及其亲和常数。方法:借助于生物传感器技术进行抗原抗体相互作用的动力学分析。结果:抗体的亲和常数介于10-5~10-7之间,5株抗体识别干扰素分子上4种不同的抗原表位。结论:生物传感器在研究抗原抗体相互作用中确为一个理想的工具,适合于抗原抗体结合与解离的动力学分析及预测表位的构像关系。
中国图书分类号 R392.11
, 百拇医药
Determination of affinity and antigenic epitopes of recombinant human interferon-α2a with monoclonal antibodies by biosensor
ZHU Yong,JIN Bo-Quan,LIU Xue-Song
(Department of Immunology,Fourth Military Medical University,Xi'an 710032)
Abstract Objective:To determine the affinity of 5 monoclonal antibodies specific for recombinant human interferon-α2a and antigenic epitopes of interferon.Methods:The affinity constants were measured by means of kinetic analysis,and the antigenic epitopes were determined subsequently,via the biosensor technique.Results:It was shown that the affinity constants of the antibodies ranged from 10-5 to 10-7 and the antigenic epitopes could be categorized into 4 groups.Conclusion:Based on the results obtained,it was concluded that the bisensor is a very ideal and powerful tool to facilitate the kinetic analysis of interaction between antigen and antibody and for prediction of conformational distribution of antigenic epitopes.
, 百拇医药
Key words Biosensor Monoclonal antibody Kinetic analysis Epitope mapping
生物传感器(biosensor)是一种实时监测生物大分子之间相互作用的新技术和新设备。借助于这一技术,可以动态观察抗原抗体之间结合与解离的平衡关系,较为准确地测定抗体的亲和力及识别抗原表位,帮助人们了解单克隆抗体特性,从而有目的地筛选各种具有最佳应用潜力的单抗,而且较常规方法省时、省力,结果也更为客观可信,它在国外生物医学研究方面已有较广泛的应用,但在我国才刚刚起步。最近我们采用Affinity Sensors公司生产的生物传感器IAsys Plus对本室制备的5株抗重组人α2a-干扰素(recombinant human interferon-α2a,rHuIFN-α2a)单克隆抗体的抗原识别表位及其亲和常数进行了测定。结果表明生物传感器在抗原抗体结合的动力学分析方面确有其独到之处。
1 材料与方法
, 百拇医药
1.1 rHuIFN-α2a及其单克隆抗体的制备 抗rHuIFN-α2a单克隆抗体杂交瘤由本室制备[1]。常规制备单抗腹水,经40%硫酸铵盐析和DEAE-FPLC纯化,纯度达90%。rHuIFN-α2a粗品由海南新大洲药业有限公司提供,采用本室研制的亲和层析柱[2]进一步纯化,纯度为90%以上。
1.2 rHuIFN-α2a包被样品池(cuvette) 羧甲基葡聚糖(carboxymethyl dextran,CMD)预处理的样品池由Affinity System 公司惠赠,按照产品手册及提供的NHS/EDC kit活化CMD上的羧基后,分别在两个样品池中加入rHuIFN-α2a(50 μg/ml)和牛血清白蛋白(BAS,100 μg/ml)各50 μl,5 min后用乙醇胺封闭空余羧基3 min。然后用1 mol/L甲酸洗去游离及非特异结合之蛋白分子。
1.3 生物传感器工作的原理和基本过程 简言之,生物传感器的工作原理是利用表面等离子共振(surface plasmon resonance)现象监测传感片表面介质的折射率变化所引发的共振角改变,而这一改变与传感片表面结合的生物大分子的量成正比,溶液中游离的分子不影响共振角的大小,因此非常特异、敏感。用生物传感器检测任何生物大分子间的相互作用都要经过这样几个步骤:结合-解离-再生(图1)。以本实验中rHuIFN-α2a与单抗相互作用为例,首先将包被好rHuIFN-α2a的样品池放入生物传感器,平衡10 min,①基线(baseline):加入 pH7.2,0.01 mol/L PBS 50 μl,等待5 min,作一平稳基线。②结合(association):吸去PBS,加入45 μl PBS和5 μl单抗,待单抗结合至饱和时吸去单抗液。③解离(dissociation):换50 μl PBS,待单抗结合与解离达到平衡。④再生(regeneration):换20 mmol/L HCl 50 μl作用2 min以完全洗脱结合的单抗。⑤回复基线:换PBS,再次回到基线,即可开始下1个循环。

, 百拇医药
图1 生物传感器检测生物大分子间相互作用的基本过程
Fig.1 Typical working cycle of a biosensor
Note:b.baseline a.association d.dissociation r.regeneration
1.4 抗原抗体结合的动力学分析 如1.3所述,将每种单抗用PBS稀释为5个不同浓度,依次分别测定各浓度单抗与包被抗原结合、解离速率,并通过随机附送之专用软件FASTfit计算各株单抗的亲和常数。
1.5 抗原识别表位测定 在抗原抗体结合动力学分析的基础上,将每株单抗均稀释为中等饱和结合浓度,两两配对,首先在平衡好的样品池中加入Ab1,经结合、解离后,换Ab2,继续结合、解离过程。再生后进行下1个循环,将Ab1和Ab2作用顺序调换,重复进行上述步骤。
, 百拇医药
2 结果
2.1 pH5.0条件下rHuIFN-α2a包被量最大 经试用pH3.0~6.0四种不同pH值、10 mmol/L的乙酸钠缓冲液进行预包被,发现pH5.0包被缓冲液最利于rHuIFN-α2a与CMD样品池的偶联。生物传感器测定值为379.45 acr seconds,相当于样品池每mm2表面包被了1.90 ng rHuIFN-α2a。
2.2 5株单克隆抗体的亲和力及其结合、解离特点 图2显示了单抗3F1在5种不同浓度(2.88×10-7、2.88×10-6、1.15×10-5、5.75×10-7和1.15×10-6 mol/L)时结合与解离的动态变化。从所得动态曲线采集数据,经FASTfit分析计算,5株单抗的亲和常数分别为1B8:1.76×105 mol/L、2B6:4.88×106 mol/L、3F1:6.95×106 mol/L、4G5:1.15×105 mol/L、5G10:4.64×106 mol/L。同时结果显示5株单抗均不与BSA结合,表明该系统特异性良好,结果可靠。

, 百拇医药
图2 单克隆抗体3F1与rHuIFN-α2a相互作用的动力学分析
Fig.2 Kinetic analysis of interaction between rHuIFN-α2a
and monoclonal antibody 3F1
Note:peridium IFN-α2a peridium BSA
2.3 rHuIFN-α2a分子上抗原表位至少有4种 图3显示了单抗1B8、2B6和3F1两两配对时,用生物传感器测定它们识别rHuIFN-α2a抗原表位的情形。图4为5株单抗两两配对时的相互拮抗关系,0表示第二抗体的结合完全被阻断,提示第一和第二抗体识别表位相同或相近;+表示第二抗体仍可结合,提示第一和第二抗体识别表位不同。值得注意的是,有一些抗体两两配对时的结合顺序不同,出现的结果也不同。如单抗2B6不能阻断单抗5G10与抗原的结合;而反过来5G10可完全阻断2B6与抗原的结合。这种情形提示这两株单抗识别的抗原表位不同,但相距较近。在构像关系上,2B6识别表位可能位于抗原分子折叠的凹陷处,5G10识别表位位于其上方。根据Venndiagram作图,得到图5所示的抗原表位识别图谱。可以清楚地看出,5株单抗识别rHuIFN-α2a分子上至少4种表位,其中1B8和2B6为一组,3F1、4G5和5G10各自独立为一组。

, 百拇医药
图3 rHuIFN-α2a分子上抗原识别表位的测定
Fig.3 Antigenic epitope mapping of rHuIFN-α2a
Note:1.mAb-1B8 2.mAb-2B6 3.mAb-3F1

图4 生物传感器对单抗识别rHuIFN-α2a表位配对测定
Fig.4 Pairwise antigenic epitope mapping of rHuIFN-α2a by biosensor

图5 rHuIFN-α2a分子上抗原表位图谱
, 百拇医药
Fig.5 Venn diagram representing antigenic epitope map of rHuIFN-α2a
3 讨论
生物传感器的应用范围十分广泛,除了抗原-抗体以外,还可以进行配体-受体[3]、核酸-核酸、核酸-蛋白[4]、细胞[5]、噬菌体[6]甚至碳水化合物和脂类分子等的相互作用研究。与常规技术相比,它具有以下几个主要特点:①实时(real-time)性。生物分子之间的相互作用可以在实验的全过程中观察,仪器每秒种可以采集3次信号。②高效性。检测一对生物大分子的相互作用只需15 min左右。③客观性。实验结果受人为因素影响较小。④敏感性。最低可检测浓度为10-12mol/L的分子。⑤简易性。检测中的任何分子无需标记。其中实时性是该技术不可替代的优势。以往我们采用常规方法,如ELISA、RIA等分析抗原-抗体结合情况,只能在实验结束后方可判定结果,做出“是”或“否”的结论,但抗原-抗体相互作用的中间过程不得而知,当实验出了差错或得出意外结果时,也很难一下找出问题所在环节。而生物传感器技术则可一目了然地全过程跟踪、观察,及时发现问题。
, 百拇医药
准确地测定抗体的亲和常数一直是比较棘手的事情,常规方法不仅需要大量抗原,而且耗时费力。生物传感器配合其专用软件则可在1 h内测定1株抗体的亲和常数。而且同时测定多株抗体的亲和常数误差小,更具可比性。此外,其独到之处还在于生物传感器技术不仅可对一组抗体的亲和力进行比较,更能直观反映一组抗体与相应抗原结合与解离的速率,这个特性对于筛选不同应用目的的抗体、优化组合非常有用,比如,用于检测、诊断的抗体的亲和力越高越好,同时与抗原的结合要快、解离则要慢和少。而用于抗原分子亲和层析纯化的抗体除了要有高的亲和力,其解离也要求比较容易。在亲和层析技术中应用生物传感器还能帮助选择合适的洗脱条件。确定一组单抗所识别抗原表位多采用竞争ELISA方法,需要酶标每株抗体,工作量很大,通常10株单抗的表位鉴定至少需要1 w时间。而应用生物传感器则可在24 h内完成。从图4和图5结果与我们以前用竞争ELISA测定表位结果[1]的比较可以看出,用生物传感器测定表位更为精确,甚至可以帮助我们初步了解几个表位在抗原分子上的空间构像关系。在选择用于夹心ELISA的最佳抗体组合上也具有很大的实际价值。
, 百拇医药
致谢:感谢Affinity Sensors公司Andrew Au先生给予的技术指导。
作者简介:朱勇,男,36岁,博士,讲师,Email:immu-804@ fmmu.edu.cn
参考文献
1,朱 勇,金伯泉,安献禄 et al.重组人α2a型干扰素单克隆抗体的研制、特性鉴定及初步应用.中国免疫学杂志,1992;8(4):219
2,朱 勇,金伯泉,赵 宁 et al.用单克隆抗体3F1亲和层析纯化rHuIFN-α2a的研究.细胞与分子免疫学杂志,1998;14(2):117
3,Ozbek S,Grotzinger J,Krebs B et al.The membrane proximal cytokine receptor domain of the human interleukin-6 receptor is sufficient for ligand binding but not for gp130 association.J Biol Chem,1998;27(33):21374
, http://www.100md.com
4,Yang W P,Wu H,Barbas C F.Surface plasmon resonance based kinetic studies of zinc finger-DNA interactions.J Immunol Methods,1995;183(1):175
5,Inoue K,Arai T,Aoyagi M.Real-time observation of binding of herpes simplex virus type 1(HSV-1)to vero cells and neutralization of hSV-1 by sulfonated human immunoglobulin.J Biochem,1997;121:633
6,Krebs B,Griffin H,Winter G et al.Recombinant human single chain Fv antibodies recognizing human interleukin-6.Specific targeting of cytokine-secreting cells.J Biol Chem,1998;273(5):2858
1999-04-29, http://www.100md.com